الکل

در شیمی به هر ترکیب شیمیایی که یک گروهِ هیدرکسیل (-OH) متصل به کربن یک آلکیل داشتهباشد، الکل گویند. فرمول کلی یک الکل سادهٔ غیر حلقهای CnH2n+1OH است. در شیمی الکلها در شمار گروه مهمی از ترکیبهای شیمیایی هستند و در واکنشهای گستردهای شرکت میکنند و بسیاری از ترکیبهای شیمیایی از آنها به دست میآیند، بهطوری در کتاب شیمی آلی موریسن و بوید آمدهاست که اگر به شیمیدانی بگویند او را با ده ترکیب شیمیایی در یک جزیره تنها خواهند گذاشت الکل یکی از آنها خواهدبود. بیشتر خانوادههای الکل پسوند (ول) میگیرند مانند بوتانول، اتانول
بهطور کلی، زمانی که نام الکل به تنهایی به کار میرود، معمولاً منظور اتانول است که همان الکل گرفتهشده از جو یا عرق یا همان مشروبات الکلی میباشد. اتانول مایعی بیرنگ و فرار وبا بویی بسیار تند است که از تخمیر شکرها به دست میآید. همچنین گاه به هر گونه نوشیدنی که الکل داشتهباشد، الکل میگویند. هزاران سال است که معمولاً الکل به عنوان یکی از عاملهای اعتیادآور بهشمار میآید.
الکلهای دیگر بیشتر با صفتهای مشخصکنندهٔ ویژهٔ خود میآیند مانند الکل چوب (که همان متانول است) یا ایزوپروپیل الکل. پسوند «ول» نیز در پایان نام شیمیایی همهٔ الکلها میآید. با فرمول شیمیایی C2H5OH
تاریخچه
[ویرایش]احتمالاً تقطیر الکل از ۲۰۰۰ سال قبل از میلاد در تمدن دوره سند آغاز شده. مردم هند از نوعی نوشیدنی الکلی به نام سورا استفاده میکردند.[نیازمند منبع]
تقطیر الکل از اوایل قرن هشتم برای شیمی دانان اسلامی شناخته شده بود. شیمیدان عرب، الکندی، به روشنی تقطیر شراب را در رساله ای با عنوان «کتاب شیمی عطر و تقطیر» توصیف کرد.الکندی زبان یونانی و پهلوی(پارسی میانه ساسانی) میدانست و از دانش ایرانیان و یونانیان نیز بهره برده بود.[نیازمند منبع]
الکل را زکریای رازی پزشک ایرانی به عنوان یک ترکیب شیمیایی کشف کرد. کشف این ماده دستاوردی بزرگ بود و به پیشرفت در صنعت بسیار کمک کرد. فرانسویها بعداً این ماده را "دو لَلکول" (De l'alcool) نامیدند. انگلیسیها نیز در ابتدا به این ماده آلکوهیل (Alcohil) نامیدند که بعدها به صورت الکوهول رسمیت پیدا کرد (Alcohol).[۱][۲][۳]
در نامگذاری الکل تردید بسیار بزرگی وجود دارد. چرا دانشمندی ایرانی باید دستاورد خود را به زبان دیگری نامگذاری نماید؛ آنهم نامی بیپایه و اساس از آنچه یافته است. در این نامگذاری از واژه الکحل که آنرا سرمه کشیدن ترجمه کردهاند استفاده شده است حال نام درست آنرا با این ترجمه مقایسه نمایید:
الوکوهل این نامی است که بی تردید دانشمند بزرگ ایرانی برای یافته خود انتخاب کرده است. با بخش بندی این واژه(واژهها) به می(شراب یا آب سرخ) تصفیه و پالایش شده خواهیم رسید. بخش بندی آنرا ببینیم.
ئرُد[۱] = ال = قرمز و اَوه[۲] = آو = آب
از ترکیب دو واژه بالا به الاو = الو= alu[۳] = سرخ آب = می (شراب) می رسیم که این واژه درست به همین شکل وارد زبان ژرمنی گردیده است.
کو = ku[۴] = کاتار = تصفیه شدن
هل = هشتن[۵] = حل = HARZ اوستایی = HISHTAN = به پهلوی پالایش[۶] یا از صافی گذراندن از میان شکلها و حالتهایی که این واژه میتواند برساند خواهیم رسید که با آنچه کشف این دانشمند بزرگ است برابر بوده و نامی ایرانی است.
ساختار و دستهبندی
[ویرایش]الکلها بسته به نوع کربن[۴] که به گروه OH- پیوند دارد، به سه دسته نوع اول، نوع دوم یا نوع سوم طبقهبندی میشوند:
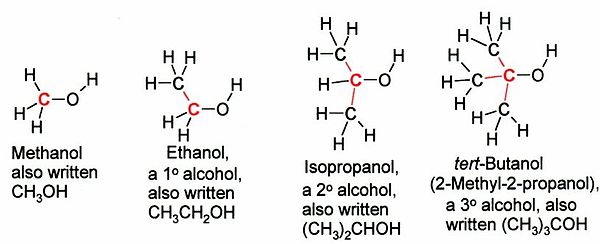
نمایش کلی انواع الکل
[ویرایش]- الکل نوع اول CR(H)۲-OH.
- الکل نوع دوم C(R)۲H-OH.
- الکل نوع سومC(R)۳-OH.
خواص فیزیکی الکلها
[ویرایش]نقطه جوش و انجماد
[ویرایش]الکلها در میان هیدروکربنهای هم وزن خود دمای جوش بالاتری دارند که آن را میتوان به پیوند هیدروژنی الکلها دانست.[نیازمند منبع]
حلالیت
[ویرایش]با توجه به این که پیوند بین الکلها مانند آب، پیوند هیدروژنی است به هر اندازهای در آب حل میشود. همچنین با توجه به این که الکلها از یک سو بخشی آلی داشته و از سوی دیگر گروه هیدروکسیل دارند بسیاری از مواد آلی را نیز حل میکنند. دومین حلال بعد از آب است که برخی از مواد شیمیایی در آن حل میکنند.
محلول ید در محلول آب و الکل را تنتور ید میگویند و برای گندزدایی به کار میروند.
سمشناسی
[ویرایش]الکلها بیشتر بویی تند و زننده دارند و اتانول از دوران پیش از تاریخ به دلیلهای گوناگون بهداشتی، رژیمی، مذهبی و تفریحی به عنوان نوشیدنی الکلی به کار میرفتهاست. اندازههای بیشتر آن سبب مستی شده و در مقدارهای بیشتر میتواند به اختلالات تنفسی و حتی مرگ نیز بینجامد.[۱]
الکلهای دیگر سمیتر از اتانول هستند، که این نیز بیشتر به دلیل نیاز به زمان بیشتر برای تغییر در فرایند سوخت و ساز است و حتی گاه در فرایندهای دگرگشت (متابولیسم) مادههایی سمی میسازند. برای نمونه متانول، که همان الکل چوب است، به وسیلهٔ آنزیمها در جگر اکسایش مییابد و مادهٔ سمی فرمالدهید تولید میکند که میتواند سبب کوری یا مرگ شود.
یکی از راههای کارا در پیشگیری از سمیت فرمالدهید، فراهم آوردن اتانول در کنار آن است چون آنزیمهای هیدروژنزدایی که از متانول فرمالدهید میدهند بر اتانول اثر بیشتری دارند، بدین گونه از پیوند و عمل بر روی متانول پیشگیری میکند. در این زمان متانول باقیمانده وقت دفع از راه کلیهها را پیدا کرده و فرمالدهید باقیمانده نیز به فرمیک اسید تبدیل میشود.
نامگذاری
[ویرایش]در نامگذاری الکلها به روش آیوپاک، تنها در آخر نام آلکان یک «ول» افزوده میشود و زمانی که نیاز ذکر شمارهٔ کربنی که عامل الکلی بر روی آن قرار دارد باشیم، عدد بین نام آلکان و پسوند «ول» قرار میگیرد. مانند «پروپان-۱-ول» برای CH3CH2CH2OH و «پروپان-۲-ول» برای CH3CH(OH)CH3.
روشهای فرآوری صنعتی الکلها
[ویرایش]از میان روشهای صنعتی الکل میتوان راههای زیر را نام برد:
- آبدارکردن آلکنهای بدست آمده از کراکینگ نفت.
- فرایند السک از آلکنها، مونوکسید کربن و هیدروژن.
- تخمیر کربوهیدراتها.
علاوه بر این سه روش اصلی، روشهای دیگری نیز با کاربرد محدود وجود دارند. بهعنوان مثال، متانول از هیدروژندار کردن کاتالیزوری مونوکسید کربن بدست میآید. مخلوط هیدروژن و مونوکسید کربن با نسبت ضروری، از واکنش آب با متان، آلکانهای دیگر، یا زغال سنگ در دمای بالا بدست میآید.
کاربردها
[ویرایش]برخی از کاربردهای الکل:
- سوخت خودرو
- کاربردهای پزشکی و گندزدایی (به دلیل نفوذ فوقالعاده به داخل منافذ و حفرهها و از بین بری باکتریهای گرم مثبت و منفی و باکتریهای مقاوم به اسید با غلظت ۷۰ تا ۸۰ درصد)
- ...
واکنشها
[ویرایش]پروتونزدایی
[ویرایش]الکلها نمیتوانند در حضور بازهای بسیار قوی به سان یک اسید عمل کنند و تشکیل یون کوکوکسی دهند. برای نمونه در واکنش سدیم هیدروکسید و اتانول، سدیم هیدروژنِ مثبت (پروتون) الکل شده و سدیم به دست میدهد.
هیدروژنزدایی
[ویرایش]از راه هیدروژنزدایی الکلها میتوان الکن به دست آورد.
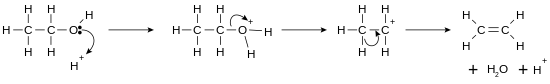
واکنشهای هستهدوستی
[ویرایش]گروه هیدروکسیل الکل یک گروه ترککنندهٔ خوب است و سبب میشود که الکلها بتوانند در واکنشهای هستهدوستی شرکت جویند.
استری شدن
[ویرایش]الکل با اسیدهای آلی در محیط اسیدی به آهستگی تشکیل استر میدهد. مفهوم استری شدن (Esterification) واکنش یک الکل با اسید کربوکسیلیک (اسید آلی) را که منجر به تولید ترکیبی به نام استر میشود، استری شدن مینامند. واکنش استری شدن، واکنشی است تعادلی که در حضور مقادیر کم اسیدهای معدنی انجام میشود و با تولید آب همراه است. خواص استرها استرها ترکیبهایی با فرمول کلیR-CO-OR میباشند. استر، بمعنی اتر اسید است که گاهی به جای آن واژه اتوسل بمعنی نمک فرار را بکار میبرند. استرها غالباً فرار و معطرند و بوی خوشایند بسیاری از گلها و میوهها، بعلت وجود استر در آنهاست؛ مثلاً استات ایزوپنتیل، بوی موز و والرات ایزوپنتیل، بوی سیب دارد. بوی بد کره فاسد (کره ترش شده) بعلت وجود اسیدبوتیریک در آن است. از واکنش این اسید با اتیل الکل، استر بوتانات اتیل بدست میآید که دارای مزه و طعم خوشایند آناناس است.
اکسایش
[ویرایش]الکلهای نوع اول میتوانند در واکنشهای اکسایش تبدیل به آلدهید و پس از آن تبدیل به کربوکسیلیک اسید شوند هرچند که الکلهای نوع دوم در واکنشهای اکسایش تنها تبدیل به کتون میشوند ولی الکلهای نوع سوم در واکنشهای اکسایش شرکت نمیکنند.
الکلهای نوع اول میتوانند بدون واسطه نیز به روشهای زیر به کربوکسیلیک اسیدها تبدیل شوند:
- با حضور پتاسیم پرمنگنات (KMnO4).
- PDC در DMF.
- اکسایش جونز
- اکسایش هنس
- روتنیوم تتراکسید (RuO4).
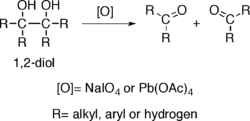
یک الکل با دو عامل مجاور میتواند در مجاورت سدیم پراکسید(NaIO4) یا سرب تترااستات (Pb(OAc)4) پیوند کربنش گسستهشده و به دو کربوکسیلیک اسید تبدیل شود.
الکلها و فنولها
[ویرایش]اگر گروه هیدروکسیل الکل به کربنی که روی یک حلقهٔ آروماتیک است، متصل باشد آنگاه به آن فنول گویند که در دستهٔ دیگری از ترکیبها دستهبندی میشود و ویژگیهای متفاوتی از الکلها دارد. فرمول مولکولی سادهترین فنول C6H5)OH) میباشد.
جستارهای وابسته
[ویرایش]پانویس
[ویرایش]- ↑ Hitti, Philip K. (1977). History of the Arabs from the earliest times to the present (10th ed. ed.). London: Macmillan. p. 365. ISBN 978-0-333-09871-4.
The most notable medical authors who followed the epoch of the great translators were Persian in nationality but Arab in language: 'Ali al-Tabari, al-Razi, 'Ali ibn-al-'Abbas al-Majusi and ibn-Sina.
{{cite book}}:|access-date=requires|url=(help);|edition=has extra text (help) - ↑ Robinson, Victor (1944), The story of medicine, New York: New Home Library
- ↑ Porter, Dorothy (2005), Health, civilization, and the state: a history of public health from ancient to modern times, New York: Routledge (published 1999), p. 25, ISBN 0-415-20036-9
- ↑ به کربنی که به کربن دیگر متصل نباشد، کربن نوع صفرم و به کربنی که تنها به یک کربن دیگر متصل باشد، کربن نوع اول میگویند. کربن نوع دوم و نوع سوم نیز بر همین اساس نامگذاری میشود.
منابع
[ویرایش]۵-شیمی عمومی ۱ و ۲ تألیف چارلز مورتیمر
- موریسن، و بوید (۱۳۷۵)، شیمی آلی، ترجمهٔ سید احمد شکرایی و عیسی یاوری، تهران: مرکز نشر دانشگاهی، شابک ۹۶۴-۰۱-۰۷۷۸-۶
- ویکیپدیای انگلیسی
منابع نامگذاری واژه ایرانی الکل
۱- رویه ۱۵۳۱ فرهنگ واژه های ایران کهن کریستیان بارتولومه
۲- رویه ۱۷۸ فرهنگ واژه های ایران کهن
۳- رویه ۳ از
altenglischen etymologisches wortenbuch f.holthausen
رویه ۱۶ از
A Handbook of Germanic Ethomology vladimir orel
۴- رویه ۴۷۲ فرهنگ واژههای ایران کهن کریستیان بارتولومه
۵- رویه ۵۲۱ فرهنگ واژههای سانسکریت زبان فارسی
۶- رویه ۱۷۹۲ فرهنگ واژههای ایران کهن کریستیان بارتولومه