پروتئین کیناز اختصاصی سرین/ترئونین
| پروتئین کیناز اختصاصی سرین/ترئونین | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| شناساگرها | |||||||||
| شمارهٔ ایسی | ۲٫۷٫۱۱٫۱ | ||||||||
| شمارهٔ سیایاس | ۹۰۲۶-۴۳-۱ | ||||||||
| پایگاههای داده | |||||||||
| اینتنز | نمایش اینتنز | ||||||||
| برندا | مدخل برندا | ||||||||
| اکسپسی | نمایش NiceZyme | ||||||||
| کیایجیجی | مدخل کیایجیجی | ||||||||
| متاسایک | گذرگاه سوختوساز | ||||||||
| پریام | نمایه | ||||||||
| ساختارهای پیدیبی | RCSB PDB PDBe پیدیبیسام | ||||||||
| هستیشناسی ژن | AmiGO / QuickGO | ||||||||
| |||||||||

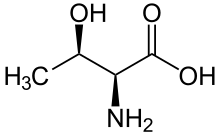
پروتئین کیناز اختصاصی سرین/ترئونین (انگلیسی: Serine/threonine-specific protein kinase) یک آنزیم کیناز است که گروه OH در اسید آمینههای سرین و ترئونین را فسفریله میکند. این آنزیمها از خانوادهٔ ترانسفراز است.
دستکم ۱۲۵ مورد از مجموعِ بیش از ۵۰۰ پروتئین کینازِ انسانی، از نوعِ پروتئین کیناز اختصاصی سرین/ترئونین (STK) است.[۲]
فسفریلاسیون پروتئین در بسیاری از فرایندهای سلولی نقش دارد و اهمیت فراوانی در پیرایش پسارونویسی دارد.[۳][۴][۵][۶][۷][۸][۹]
واکنش شیمیایی که توسط این آنزیم کاتالیز میشود به شرح زیر است:
- ATP + a protein ADP + a phosphoprotein
همانطور که مشاهده میشود، سوبسترای این آنزیم آدنوزین تریفسفات و پروتئین است و محصول نهایی آدنوزین دیفسفات و فسفوپروتئین است.
بیان ژنی و ساخت این آنزیم در بسیاری از انواع سرطان تغییر میکند.[۲]
بافت چربی نقش اصلی در هموستاز انرژی و متابولیسم لیپیدها و غیره دارد. همچنین به عنوان یک عضو غدد درون ریز برای تنظیم ترشح طیف گستردهای از عواملی مانند لپتین، آدیپونکتین، فاکتور نکروز تومور گاما و سایتوکاینهای مختلفی عمل میکند، که برخی از آنها تنظیم کننده اصلی هموستاز انرژی هستند. رده سلولی 3T3-L1 معمولاً به عنوان یک سیستم مدل تمایز چربی برای بررسی مکانیسمهای مولکولی تنظیم چربی استفاده میشود که در این رده سلولی بعد از افزودن انسولین، گلوکوکورتیکوئیدها و تقویت کننده cAMP یک آبشار نظارتی رونویسی را آغاز میکند که منجر به بیان ژنهای مختص چربی میشود. چندین فاکتور مهم رونویسی در سنتز چربی عبارتند از جمله CCAAT / تقویت پروتئینهای اتصال دهنده(C / EBP) بتا، سیگما و آلفا و گیرنده پراکسیزوم فعال شده گاما (گاما PPAR). محرکهای اگزوژن باعث بیان C / EBP بتا و سیگما در سلولهای پیش از چربی میشوند و اینها به نوبه خود سبب القاء گاما PPAR و C / EBP آلفا میشوند و در ادامه این دو ژن القا شده، ژنهای مهم چربی مورد نیاز برای عملکرد چربی را فعال میکنند. در چربیها، تصور میشود ژن مورد هدف راپامایسین در پستانداران (mTOR) سنتز پروتئین، مورفوژنز بافت چربی و سنتز / ترشح لپتین را تنظیم میکند. mTOR یک سرین و ترئونین کیناز حفظ شده میباشد که رشد سلولی و پیشرفت چرخه سلولی از طریق مسیر فسفوتیدیل ۳ کیناز (PI3K) و پروتئین کینازB تنظیم میکند. عامل تضعیفکننده سیستم ایمنی و ضد تکثیر و راپامایسین از طریق مهارmTOR سیگنالهای لازم برای پیشرفت چرخه سلولی، رشد سلولی، تکثیر سلولی و رگ سازی را مهار مینماید. گرچه راپامایسین به خصوص در سرطانها نقش تقویتکننده آپوپتوز را دارد، شواهدی هم مبنی بر اینکه راپامایسین میتواند خواص ضد آپوپتوزی از طریق عملکردش در تنظیم مرگ سلولی بسته به نوع سلول و سطح فعالیت و همچنین تنظیم اهداف مولکولهای ضد آپوپتوز نظیر p35و پروتئینهای Bcl-2 ایفا نماید وجود دارد. گزارش شدهاست که راپامایسین باعث تمایز تمایز سلولهای 3T3-L1 میشود که دلالت بر نقش mTOR در چربی زایی دارد. دو کمپلکس پروتئین چندگانه مجزا mTORC1 و mTORC2، چندین رویداد سلولی از جمله رشد و تکثیر سلول را هدایت میکنند. mTORC1 شامل رپتور، و mLST8 / GbL و PRAS40 است، در حالی که mTORC2 شامل رپتور،sin1، protor و mLST8 / GbL بوده و نسبت به راپامایسین حساس نمیباشد. سیگنالینگ mTORC1 به منظور کنترل رشد، تکثیر و بقا سلولی توسط محرکهای متنوعی مانند فاکتورهای رشد، مواد مغذی و محرکهای انرژی فعال میشود. mTORC1 نسبت به راپامایسین حساس بوده و سبب مهار فاکتور شروع یوکاریوتی اتصال پروتئین (4E-BP) و فعالسازی ریبوزوم S6 کیناز1 (S6K1) که در ترجمه mRNA نقش دارند میشود. S6K1 باعث فعالسازی eIF4E میشود که eIF4E نیز عامل فعالسازی و القاء گاما PPAR و بیان C / EBP آلفا شده و از طریق مکانیسم ناشناختهای سبب فعالسازی C / EBP بتا و سیگما در سلولهای پیش از چربی میشوند. C / EBP بتا، سیگما و آلفا میتوانند وارد هسته شوند و همگی به C / EBP آلفا تبدیل میشوند و در مرحله بعد نوع آلفا به PPAR گاما تبدیل شده و در ادامه سبب بیوسنتز لیپیدهایی که برای حفظ هموستاز سلولی ضروری هستند میشود. همچنینmTORC1 باعث تمایز چربی، افزایش تنفس میتوکندری و سرکوب لیپولیز میشود. نقص در سنتز یا پردازش چربی در ایجاد بسیاری از بیماریها از جمله چاقی، مقاومت به انسولین، دیابت نوع ۲ و سرطان نقش دارد. در نتیجه با توجه به اینکه سیگنالیگ پایین دست mTOR، مسیرهای آنابولیکی هستند که انرژِی زیادی جهت سنتز (برای مثال سنتز پروتئین و لیپید) مصرف میکنند، اگردرعوامل بالا دستmTOR جهش با اختلالاتی صورت گیرد، که باعث افزایش بیان و فعالیت mTORC1 شود، سبب اختلالات سلولی و بیماری میشوند. بهترین راهکار، استفاده از داروی راپامایسین است، زیرا مهار mTORC1 با راپامایسین میتواند از القای بیوژنز ریبوزوم، تمایز و تجمع لیپیدها، مقاومت به انسولین و بروز سرطان جلوگیری کند.[۱۰]
منابع[ویرایش]
- ↑ Nowakowski, J.; Cronin, C. N.; McRee, D. E.; Knuth, M. W.; Nelson, C. G.; Pavletich, N. P.; Rogers, J.; Sang, B. C.; Scheibe, D. N.; Swanson, R. V.; Thompson, D. A. (2002). "Structures of the cancer-related Aurora-A, FAK, and EphA2 protein kinases from nanovolume crystallography". Structure. 10 (12): 1659–1667. doi:10.1016/S0969-2126(02)00907-3. PMID 12467573.
- ↑ ۲٫۰ ۲٫۱ http://cancerres.aacrjournals.org/cgi/content/full/66/16/8147 "Frequent Alterations in the Expression of Serine/Threonine Kinases in Human Cancers" Capra et al. Cancer Research. 2006
- ↑ Damuni Z, Reed LJ (1988). "Purification and properties of a protamine kinase and a type II casein kinase from bovine kidney mitochondria". Arch. Biochem. Biophys. 262 (2): 574–84. doi:10.1016/0003-9861(88)90408-0. PMID 2835010.
- ↑ Baggio B, Pinna LA, Moret V, Siliprandi N (1970). "A simple procedure for the purification of rat liver phosvitin kinase". Biochim. Biophys. Acta. 212 (3): 515–7. doi:10.1016/0005-2744(70)90261-5. PMID 5456997.
- ↑ Jergil B, Dixon GH (1970). "Protamine kinase from rainbow trout testis. Partial purification and characterization". J. Biol. Chem. 245 (2): 425–34. PMID 4312674.
- ↑ Langan TA (1969). "Action of adenosine 3',5'-monophosphate-dependent histone kinase in vivo". J. Biol. Chem. 244 (20): 5763–5. PMID 4310608.
- ↑ Takeuchi M, Yanagida M (1993). "A mitotic role for a novel fission yeast protein kinase dsk1 with cell cycle stage dependent phosphorylation and localization". Mol. Biol. Cell. 4 (3): 247–60. doi:10.1091/mbc.4.3.247. PMC 300923. PMID 8485317.
- ↑ NF; Lützelberger, M; Weigmann, H; Klingenhoff, A; Shenoy, S; Käufer, NF (1997). "Functional analysis of the fission yeast Prp4 protein kinase involved in pre-mRNA splicing and isolation of a putative mammalian homologue". Nucleic Acids Res. 25 (5): 1028–35. doi:10.1093/nar/25.5.1028. PMC 146536. PMID 9102632.
- ↑ Wang Y, Hofmann TG, Runkel L, Haaf T, Schaller H, Debatin K, Hug H (2001). "Isolation and characterization of cDNAs for the protein kinase HIPK2". Biochim. Biophys. Acta. 1518 (1–2): 168–72. doi:10.1016/S0167-4781(00)00308-0. PMID 11267674.
- ↑ Chakrabarti, P., & Kandror, K. V. (2015). "The role of mTOR in lipid homeostasis and diabetes progression. Current Opinion in Endocrinology & Diabetes and Obesity,". Biochim. Biophys. Acta. 1518 (1–2): 1340–346. doi:10.1097/MED.0000000000000187. PMID 11267674.
{{cite journal}}: Vancouver style error: non-Latin character in name 2 (help)
- مشارکتکنندگان ویکیپدیا. «Serine/threonine-specific protein kinase». در دانشنامهٔ ویکیپدیای انگلیسی.
پیوند به بیرون[ویرایش]
- protein-serine-threonine kinases در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا

