آلدئید
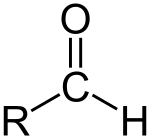

آلدهید (به انگلیسی: Aldehyde) ترکیبی آلی است که یک گروه کربونیل در یک سر خود دارد. (پیوند دوگانه کربن اکسیژن (C=O) که در برخی ترکیبهای آلی همچون آلدهید، کتون، اسیدکربوکسیلیک، آمید و … یافت میشود، گروه کربونیل نامیده میشود. این گروه عاملی دارای کربنی است که از یک سو با پیوند دوگانه به اکسیژن و از سوی دیگر یک اتم هیدروژن پیوند دارد و دارای فرمول عمومی RCHO میباشند. فرمول شیمیایی این بخش از ماده را (-CHO) مینویسند. از آلدئیدهای زبانزد میتوان اتانال، متانال و بنزآلدهید را نام برد. ترکیبهای کربونیلدار اهمیت ویژهای در شیمی آلی دارند زیرا قابلیت تبدیل شدن به سایر ترکیبهای آلی از طریق سنتز را دارا میباشند. آلدئیدها و کتونها مواد شیمیایی بسیار ارزشمندی هستند و در صنعت بهعنوان حلال یا مواد اولیه مصرف میشوند و بعضیها مانند تستسترون به عنوان هورمون دارای اثرات دارویی و بیولوژیکی میباشند یا بهطور مثال داروی هیدروکورتیزون که برای درمان جایگزینی در نارسایی غده فوق کلیوی استفاده میشود یا پریدوکسال فسفات که شکل فعال ویتامین B6 میباشد و نقش کوفاکتر را در مسیر ساخت NAD+ دارد، هر دو دارای گروه عاملی کربونیل هستند.
ریشه واژه آلدئید
[ویرایش]واژه آلدهید (Aldehyde) از دو واژه الکل (Alcohal) و هیدروژنگیری (dehydrogenation) گرفته شدهاست. هرگاه از الکل نوع اول هیدروژنگیری شود، در آن صورت، مادهای تولید میگردد که آلدئید نامیده میشود.[۱]
ساختار الکترونی
[ویرایش]پیوند کربونیل (C=O) شباهت زیادی به پیوند دوگانه آلکنها دارد. هر دو دارای هیبریداسیون sp2 هستند و لذا در یک صفحه قرار دارند. کربن کربونیل مسطح و زاوای پیوندی آن ۱۲۰ درجه میباشد. به کربنی که به کربن گروه کربونیل چسبیده کربن آلفا (α) و به هیدروژنی که به این کربن چسبیده هیدروژن آلفا (α) میگویند. اکسیژن به علت الکترونگاتیویته بیشتر نسبت به کربن تراکم الکترون را بیشتر بر روی خود خواهد داشت و بار جزئی منفی پیدا میکند و کربن دارای با جزئی مثبت میشود. همچنین به علت الکترونگاتیویته بیشتر اکسیژن نسبت به کربن، طول پیوند در C=O نسبت به پیوند C=C آلکنها کوتاهتر و از لحاظ قدرت پیوندی قویتر میباشد. ممان دو قطبی این پیوند همیشه به طرف اکسیژن متمایل است. از جمله دیگر تفاوتهای بین گروه کربونیلی و باند دوگانه C=C حضور جفت الکترون تنها بر روی اتکم اکسیژن در ساختار گروههای کربونیلی است.
نامگذاری آلدهیدها
[ویرایش]در نامگذاری قدیمی، نام آلدهید از نام اسید آلی مربوطه گرفته میشد؛ مثلاً آلدهید فرمیک از اسید فرمیک، آلدهید استیک از اسید استیک و آلدئید پروپیونیک از اسید پروپیونیک. در نامگذاری جدید برای نامگذاری آلدهیدها، ابتدا طولانیترین زنجیر حاوی عامل آلدهیدی را انتخاب کرده و سپس شمارهگذاری اتمهای کربن از جهتی که گروه آلدهیدی قرار گرفتهاست، انجام میگیرد. برای نامگذاری، ابتدا شماره و نام شاخههای فرعی را نوشته، در پایان، اسم هیدروکربن را بهطور کامل ذکر و پسوند آل (al) بر آخر آن افزوده میشود. البته میتوان از حروف آلفا (α) و بتا (β) و گاما (γ) و دلتا (δ) برای شماره گذاری هم استفاده کرد. به این ترتیب که کربن متصل به گروه کربونیل را کربن آلفا (α) کربن بعدی را بتا (β) و . . . مینامیم. اگر در ترکیبی هم گروه آلدهیدی و هم کتونی وجود داشته باشد، گروه آلدهیدی بر کتونی مقدم خواهد بود. در نامگذاری، اگر گروههای آلدهیدی و کتونی خود به صورت استخلاف به کار برده شوند، برای عامل کربونیل پیشوند (اُکسو) و برای آلدهیدها پیشوند (فُرمیل) استفاده میشود.
خواص فیزیکی آلدهیدها
[ویرایش]آلدهیدها به علت داشتن ساختار دو قطبی – دو قطبی و در نتیجه وجود نیروهای قویتر بین مولکولی در این ترکیبها نسبت به آلکانها و اترهای دارای وزن ملکولی یکسان، نقطه جوش بالاتری دارند، اما در مقایسه با الکلها نقطه جوش پائینتری دارند. علت این امر آن است که آلدهیدها و کتونها هیدروژن فعال (هیدروژن که دارای خاصیت اسیدی باشد) ندارند، قابلیت تشکیل پیوند هیدروژنی با ترکیبهای کربونیلدار را ندارند. اما اکسیژن کربونیل به علت دارا بودن جفت الکترونهای غیرپیوندی، میتواند با ترکیبهایی که هیدروژن اسیدی دارند پیوند هیدروژنی تشکیل دهد (گیرنده پیوند هیدروژنی باشند). با بزرگتر و شاخهدار شدن گروههای آلکیل متصل به آلدهیدها و کتونها، همانند الکلها، حلالیت کاهش مییابد. آلدهیدها و کتونهای کوچک مانند فرمآلدهید، استالدهید یا استون با آب کاملاً قابل امتزاج میباشند.
طرز تهیه آلدهیدها
[ویرایش]اُکسایش الکلهای نوع اول
[ویرایش]از معمولترین روشهای آزمایشگاهی برای تهیهٔ آلدهیدها، اکسایش الکلهای نوع اول است. واکنش اکسایش الکلها توسط واکنشگرهای کرم (VI) ترکیبهای کربونیلدار تولید میکند. اکسایش گزینشی الکلهای نوع اول توسط معرف پیریدینیوم کلروکرومات (PCC)، منجر به تولید آلدهیدها میشود، که معمولاً بازده این واکنشها بالاست.
اکسایش آلکنها
[ویرایش]از اُزونولیز آلکنها، آلدهید یا کتون تولید میشود.
هیدرولیز آلکینها توسط نمکهای جیوه
[ویرایش]برای تهیه آلدهید از آلکینها نیاز به حضور واکنشگرهای انتخابی بوران مانند بیسیکلوهگزیل بوران میباشد. در حضور این ترکیبها آبدهی در کربن سرزنجیر که ممانعت فضایی کمتری دارد رخ میدهد.
آسیلدار کردن فریدل-کرافتس
[ویرایش]در طی این واکنش که به واکنش گاترمن-کوچ معروف است، از واکنش منوکسیدکربن تحت فشار و HCl در حضور اسیدلوئیس یک گروه فرمیل CHO به حلقه بنزن اضافه میگردد.
کاهش آسیل کلریدها
[ویرایش]با کاهش آسیل کلریدها یا استرها (مشتقهای اسیدهای کربوکسیلیک) توسط معرفهای احیاءکنندهٔ قوی مانند لیتیم آلومینیوم تری بوتوکسی هیدرید LiHAl(t-BuO)3با نام اختصاری (LABH) میتوان این ترکیبها را به آلدهیدها تبدیل کرد. همچنین از واکنشگر دیایزوبوتیل آلومینیوم هیدرید AlH 2(CH3)2CHCH2)) به عنوان یک کاهنده، میتوان برای تبدیل استرها یا آسیلها به آلدهیدها استفاده کرد. علاوه بر واکنشگرهای اشاره شده در بالا، به وسیله کاتالیزوری مانند پالادیم و باریم سولفات نیز میتوان آسیلکلریدها را کاهش داد و به آلدهید تبدیل کرد.
واکنشهای آلدهیدها – واکنشهای هسته دوستی
[ویرایش]پیوند کربونیلی در آلدهیدها و کتونها مهمترین مرکز واکنش بهشمار میرود. به علت وجود پیوند π بین کربن و اکسیژن (C=O) و با توجه به قطبی بودن گروه کربنیل (اکسیژن الکترونگاتیو و وجود بارمثبت روی اتم کربن) یک گونه هستهدوست میتواند به عامل کربونیل حمله کند. با توجه به مسطح بودن کربونیل (هیبریدsp2) هستهدوست به راحتی میتواند از هر دو طرف به پیوند دوگانه حمله کند. دراین واکنش هیبرید کربن از sp2به sp3 تغییر مییابد. ممانعت فضایی در شدت واکنشگری آلدهیدها و کتونها دخالت دارد. با بزرگتر شدن گروههای آلکیل متصل به گروه کربنیل یعنی با افزایش ممانعت فضائی، نزدیک شدن هستهدوست به کربن گروه کربنیل مشکلتر خواهد شد (استخلاف بیشتر فعالیت کمتر). همچنین گروههای الکتروندهنده فعالیت عامل کربونیل را کمتر میکند و گروههای الکترون کشنده فعالیت عامل کربونیل را زیادتر میکنند. واکنشهای هستهدوستی بر روی عامل کربوتیل هم در محیط اسیدی و هم در محیط بازی امکانپذیر است. در هر دو محیط واکنشها به صورت تعادلی خواهد بود.
واکنش با آب
[ویرایش]آب این امکان را دارد که به عنوا یک هستهدوست با آلدهیدها و کتونها در شرایط اسیدی یا بازی وارد واکنش شود. واکنش در هر دو حالت در تمامی مراحل تعادلی است. آب هستهدوست ضعیفی است و در واکنش کاتالیز شده توسط اسید، ابتدا گروه کربنیل در اثر پروتونه شدن اکسیژن فعال میگردد. در این صورت تراکم بار مثبت روی کربن کربنیل افزایش مییابد تا آب به عنوان هستهدوست ضعیف بتواند به راحتی به آن اضافه شود. یون هیدروکسید (OH-) یک هستهدوست خوب میباشد و در واکنش کاتالیز شده توسط باز به سرعت به گروه کربنیل اضافه میشود. با قرار گرفتن گروههای الکترونکشنده (مانند هالوژنها) در کربن آلفا، به علت افزایش قطبیت پیوند کربونیلی و افزایش بار مثبت بر روی کربن امکان حمله هستهدوست به کربن گروه کربونیلی افزایش مییابد و در نتیجه تعادل بیشتر به سمت تشکیل محصول آبدار (هیدراته) پیش خواهد رفت.
واکنش با الکلها
[ویرایش]همچنین مشابه با آب، الکلها نیز با آلدئیدها واکنش داده، همیاَستالها و اَستالها را به وجود میآورند. از واکنش کتونها با الکلها، همیکِتالها و کِتالها حاصل میگردند (کِتال و همیکِتال به نوعی نامهای متداول و قدیمی محسوب میشوند، امروزه از نام اَستال برای مشتقهای کتونی نیز استفاده میشود). این واکنشها در محیط اسیدی کاتالیز میشوند. همانند واکنش با آب، واکنش در تمامی مراحل تعادلی است و معمولاً تعادل به سمت تشکیل ترکیب کربونیلی میباشد. واکنش برگشت نیز در حضور اسید به عنوان کاتالیست و مقدار اضافی آب انجام میشود. بعد از اضافه شدن اولین گروه الکلی به ساختار اولیه آلدهید و قبل از حذف گروه هیدروکسیل از آن، ترکیبی حاصل میگردد که حالوی یک گروه هیدرکسیل و یک عامل اتری بر روی یک کربن میباشد که به آن همیاَستال میگویند. همیاستال به نوعی هم الکل است و هم اتر. این ترکیبها بهطور کلی بسیار ناپایدار بوده و قابل جداسازی از محسط واکنش نمیباشند. مشابه همین اتفاق در کتونها رخ میدهد و ساختار همیکِتالها حاصل میگردد. برای جلوگیری از برخی از واکنشهای مزاحم و ناخواسته واکنشدهندههایی مانند ترکیبهای آلی فلزی (RLi , RMgBr) و همچنین با توجه به تعادلی بودن تشکیل استالها وکتالها میتوان از این واکنش برای محافظت گروه کربنیل استفاده کرد.
واکنش با واکنشگر گرینیارد و اُرگانولیتیم
[ویرایش]واکنشگر گرینیارد (RMgX) و اُرگانولیتیمها (RLi) شدیداً قطبی است (کربن در این ترکیبها شدیداً هستهدوست است) و در اثر واکنش آن با فرمالدئید و آلدئیدها به ترتیب الکلهای نوع اول و نوع دوم حاصل میگردند. باید به این نکته توجه داشت که تنها از واکنش فرمآلدهید (اولین عضو از خانواده آلدهیدها) با واکنشگرهای آلی فلزی مانند گرینیارد امکان تشکیل الکل نوع اول وجود دارد و در صورت استفاده از سایر آلدهیدها در این واکنش، الکل نوع دوم حاصل خواهد شد. در اثر افزایش واکنشگر گرینیارد و اُرگانولیتیمها به ترکیبهای کربونیلی، گروه آلی به کربن و منیزیم یا لیتیم به اکسیژن متصل میگردد و نمک منیزیم یا لیتیم الکی حاصل میگردد که خصلت اسیدی ضعیفی دارد و بر اثر افزایش آب و اسید به الکل و نمک محلول منیزیم یا لیتیم تبدیل میگردد.
افزایش هیدروژن سیانید
[ویرایش]هیدروژن سیانید (HCN) نیز میتواند همانند سایر هستهدوستها به گروه کربونیل در آلدهیدها یا کتونها حمله کند. جزء فعال که به گروه کربونیل اضافه میگردد یون سانید (CN-) است که هسته دوست خوبی محسوب میشود. محصول تولید شده را سیانوهیدرین مینامند. مشکل اصلی این روش سمیت بسیار زیاد HCNاست که برای غلبه بر آن معمولاً از نمکسیانید در حضور یک اسید استفاده میشود. سیانوهیدرین را میتوان در محیط اسیدی گرم هیدرولیز کردکه در نتیجه آن محصول نهایی یک اسیدکربوکسیلیک خواهد بود یا توسط یک کاهنده مثل (LiAlH4) احیاء کرد که در این صورت محصول نهایی یک آمین خواهد بود.
واکنش با آمونیاک و مشتقهای آن
[ویرایش]مشابه واکنش الکلها با آلدهیدها و کتونها، آمونیاک، آمینهای نوع اول و دوم به عنوان یک هستهدوست با آلدهیدها و کتونها واکنش میدهند. این واکنش در محیط اسیدی ملایم رخ میدهد. آمونیاک با آلدهیدها و کتونها واکنش داده و ترکیبهایی به نام ایمین تولید میکند. ایمینها دارای گروه عاملی C=N هستندو در شناسائی ترکیبهای کربونیلدار بسیار پرکاربرد و مهم میباشند. آمونیاک و آمینهای نوع اول با آلدهیدها یا کتونها ایمین پایدارتری تولید میکنند. آمینهای نوع دوم نیز با آلدهیدها یا کتونها واکنش داده و تولیدترکیبهایی به نام اِنامین میکنند. اِنامینها در ساختار خود گروهC=C-N دارند. واکنش تشکیل ایمین و اِنامین برگشتپذیر است و در حضور آب اسیدی به سادگی عمل هیدرولیز رخ میدهد.
احیاء آلدهیدها
[ویرایش]به وسیله برخی ترکیبها احیاءکننده مانند سدیم بوروهیدرید (NaBH4) و لیتیمآلومینیم هیدرید (LiAlH4) یا هیدروژن به همراه کاتالیزور (پلاتین، پلادیم و…) میتوان آلدهیدها را کاهش داد و به الکل مربوطه تبدیل کرد. ترکیبهای احیاءکننده همچون (NaBH4) و (LiAlH4) به معرفهای هیدریددهنده (H-) معروفند. علاوه بر معرفهای کاهنده ذکر شده در بالا، گروه کربونیلی در آلدهیدها و کتونها را به وسیله گاز هیدروژن و کاتالیزورهای فلزی میتوان کاهش داد. در اثر کاهش گروه کربونیل، آلدهیدها به الکلهای نوع اول تبدیل میگردند. در صورتی در مولکول هم پیوند غیراشباع کربنی و هم گروه کربونیل وجود داشته باشد و هدف کاهش گزینشی گروه کربونیل باشد استفاده از کاهندههای بوران نتیجه مطلوبتری در پی خواهد داشت. همانگونه که در واکنش بالا نیز مشخص گردیده، استفاده از گاز هیدروژن وکاتالیزور فلزی منجر به کاهش هر دو پیوند غیراشباع میگردد.
واکنش آلدهیدها در موقعیت هیدروژن آلفا
[ویرایش]علاوه بر موقعیت کربونیلی به عنوان محل اصلی و مهم برای انجام واکنش در آلدهیدها و کتونها، کربن و هیدروژن مجاور گروه کربونیل که موقعیت آلفا (α) نامیده میشوند نیز محلی برای انجام انواع واکنشهای سنتزی میباشد. هیدروژن موجود بر روی کربن آلفا به علت گروه الکترونکشنده بودن گروه کربونیل خاصیت اسیدی دارد. این قدرت اسیدی باعث ایجاد تعادلی بین هیدروژن آلفا و اکسیژن میشود. در نتیجه ترکیبهای کربونیلدارد و حالت تعادلی (نه رزنانسی) دارند که به این فرمها توتومر (یا تاتومر) گویند. در یکی از این دو فرم، که معمولاً فرم ناپایدارتر است، یک گروه هیدرکسیل به کربن دارای باند دوگانه متصل است که به آن فرم اِنول میگویند. تعادل بسته به نوع حلال ممکن است به سمت تشکیل فرم اِنول یا کتو متغیر باشد. ثابت تعادل کتو به فرم اِنول در مورد آلدهیدها و کتونهای ساده، بسیار کوچک است و فقط مقدار کمی اِنول تشکیل میشود. البته ایجاد این تعادل معمولاً مستلزم وجود محیط اسیدی یا بازی میباشد. خاصیت اسیدی هیدروژن آلفا (Hα) باعث میشود که این هیدروژن توسط بازها جذب گردد و کربانیون (یون اِنولات) تولید شود (شرایط بازی). یون اِنولات دارای دو فرم رزنانسی است و بهطور کلی هرچه بتوان آنیون تولید شده را پایدارتر کرد، قدرت اسیدی هیدروژن بیشتر خواهد شد و جداکردن آن آسانتر خواهد بود. برای جداکردن هیدروژن آلفا (Hα) معمولاً به بازهای قوی همچون (NaNH2)، (R-O-Na+) یا لیتیمدیایزوپروپیلآمید (LDA) نیاز است. اِنولات حاصل توانایی حمله به ترکیبهای الکتروندوست به عنوان یک هسته دوست را دارد. معمولاً واکنش از طریق کربن اِنولات که حامل بار منفی خواهد بود، رخ میدهد. بهطور مثال در حضور یک گروه آلکیلی با گروه ترککننده مناسب و بدون ممانعت فضایی کربن حاوی بار منفی به عنوان هستهدوست به آلکیل حمله میکند. در حضور هالوژنها نیز واکنش مشابهی رخ میدهد و امکان هالوژندار شدن در کربن آلفا وجود دارد. این واکنش هم در محیط اسیدی و هم در محیط بازی رخ میدهد. واکنش در محیط اسیدی قابل کنترل است و میتوان محصولی با یک هالوژن یا بیشتر در کربن آلفا بدست آورد. در حضور اسید، هالوژندار شدن معمولاً بعد از ورود اولین هالوژن، متوقف میشود. علت آن است که برای تکرار هالوژندار کردن، ترکیب هالوکربونیل دوباره باید انولیزه شود ولی قدرات الکترونگاتیویتهٔ هالوژن، اولین مرحله انولیزاسیون، یعنی پروتوندار شدن را مشکلتر از ترکیب کربونیلدار میسازد. در این واکنش سرعت هالوژندار شدن مستقل از غلظت هالوژن است ولی به غلظت کتون و اسید بستگی دارد. در صورت استفاده از آلدهید در شرایط اسیدی، به جای جانشینی هالوژن در موقعیت آلفا، واکنش اکسایش رخ میدهدو الدهید به کربوکسیلیک اسید تبدیل میشود. در شرایط بازی این امکان وجود دارد که تمام هیدروژنهای آلفا توسط هالوژن جایگزین شوند. این واکنش به خصوص وقتی گروه متیل در کنار گروه کربونیلی قرار دارد بسیار ارزشمند است. در این شرایط اگز از ید به استفاده کنیم امکان تشکیل ترییدومتان (یدوفرم) وجود دارد که با حذف از کربونیل اولیه به صورت رسوب زرد رنگ در محیط تهنشین خواهد شد و شاهد خوبی برای اثبات ساختار متیلکربونیل خواهد بود.
عطر
[ویرایش]آلدئیدها به خصوص آلدئیدهای چرب بوی خوشایندی دارند و برای ساخت عطر، صمغهای مصنوعی، رنگدانهها، طعم دهندههای غذایی و سایر ترکیبات شیمیایی استفاده میشوند.[۲]
نقش آلدهیدها در بروز سرطان
[ویرایش]خوردن یا استنشاق آلدهیدها، حتی به مقدار کم احتمال بیماریهای قلبی و سرطان را افزایش میدهد.[۳]
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ «آلدئید». دانشنامه رشد. بایگانیشده از اصلی در ۲۸ اوت ۲۰۱۶. دریافتشده در ۵ شهریور ۱۳۹۵.
- ↑ http://www.fragrantica.com/notes/Aldehydes-165.html
- ↑ «بهترین روغن برای پختوپز چه روغنی است». وبسایت خبری بیبیسی فارسی. ۱۱ مرداد ۱۳۹۴. دریافتشده در ۵ شهریور ۱۳۹۵.
- مشارکتکنندگان ویکیپدیا. «Aldehyde». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۷ آگوست ۲۰۱۶.
