زوال عقل با اجسام لویی
| زوال عقل با اجسام لویی | |
|---|---|
| نامهای دیگر | بیماری ایجاد شده از اجسام لویی، زوال عقل مرتبط با اجسام لویی |
 | |
| میکروگرافی از جسم لویی (سر پیکان) نورونی در توده سیاه موجود در میان مغز. نوار مقیاس = ۲۰ میکرون (۰٫۰۲ میلیمتر) | |
| تخصص | عصبشناسی، روانپزشکی |
| نشانهها | دمانس، اختلال رفتاری حرکت سریع چشم در خواب، نوسانات هوشیاری، توهم و پارکینسونیسم[۱] |
| دورهٔ معمول آغاز | بعد از ۵۰[۲] و بهطور میانگین ۷۶ سالگی[۳] |
| دورهٔ بیماری | بلند مدت[۴] |
| علت | ناشناخته[۴] |
| روش تشخیص | بر اساس علائم و نشانگرهای زیستی[۱] |
| تشخیص افتراقی | بیماری آلزایمر، زوال عقلی بیماری پارکینسون، بیماری روانی خاص، زوال عقل عروقی[۵] |
| مدیریت | استفاده از هشدارهای حساسیت دارویی،[۶] بهبود ایمنی اتاق خواب،[۷] فیزیوتراپی،[۸] اجتناب از مصرف الکل[۹] |
| دارو | دونپزیل، ریواستیگمین، ممانتین[۱۰] ملاتونین[۱۱] |
| پیشآگهی | میانگین زنده ماندن، ۴ سال از زمان تشخیص[۱۲] |
| فراوانی | حدود ۰٫۴ درصد از افراد بالای ۶۵ سال[۱۳] |
| طبقهبندی و منابع بیرونی | |
زوال عقل با اجسام لویی یا دمانس با اجسام لویی (به انگلیسی: Dementia with Lewy bodies)، به اختصار DLB، نوعی زوال عقل است که با تغییر در خواب، رفتار، شناخت، حرکت و تنظیم عملکردهای خودکار بدن مشخص میشود و از دست دادن حافظه همیشه علامت اولیه آن نیست. این بیماری همانند دیگر زوال عقلهای پیشرونده (مانند آلزایمر) با گذشت زمان وخیمتر شده و معمولاً زمانی مورد بررسی قرار میگیرد که اختلالات شناختی (نقص در توجه و حافظه و غیره) در عملکرد طبیعی روزانه تداخل ایجاد کنند. DLB در کنار زوال عقلِ پارکینسون، یکی از دو دمانس اجسام لویی است. این بیماری شکل رایج از زوال عقل بوده، اما شیوع آن بهطور دقیق مشخص نیست و بسیاری از ابتلاها تشخیص داده نمیشوند. زوال عقل با اجسام لویی اولین بار توسط کنجی کوساکا در سال ۱۹۷۶ کشف و توصیف و نامگذاری شد.
اختلال رفتاری خوابِ REM، به اختصار RBD، یکی از علامتهای ابتلا به زوال عقل با اجسام لویی است. در این اختلال، افراد به دلیل از دست دادن فلج عضلانی که بهطور معمول در طول خواب REM اتفاق میافتد، طیف وسیعی از آزادیهای رفتاری هنگام خواب، مانند حرکت و تکلم، را به دست میآورند. RBD ممکن است سالها یا دههها قبل از علائم دیگر ظاهر شود. علائم اصلی دیگر شامل توهم بصری، نوسانات مشخص در توجه یا هوشیاری، و پارکینسونیسم (کندی حرکت، مشکل در راه رفتن، یا سفتی ماهیچهها) است. اگر چند نشانه و بیومارکر از بیماری، مانند علائم یا نتایج مشخصی از آزمایش خون، آزمایشهای عصبی-روانشناختی، تصویربرداری و مطالعات خواب وجود داشته باشد، میتوان تشخیصی احتمالی برای وقوع DLB داد؛ تشخیص قطعی معمولاً نیاز به کالبد شکافی و بررسی فیزیکی مغز دارد.
اگرچه گاهی DLB به صورت خانوادگی نیز وجود دارد، اکثر افراد مبتلا به زوال عقل با اجسام لویی اعضای خانواده مبتلا ندارند. علت دقیق این بیماری ناشناخته است، اما احتمال میرود به دلیل تشکیل تودههای غیرطبیعی پروتئین در نورونهای سراسر مغز ایجاد شده باشد. این تودهها که به صورت اجسام لویی (که در سال ۱۹۱۲ توسط فردریک لویی کشف شد) و نوریتهای لویی ظاهر میشوند، بر سیستم عصبی مرکزی و سیستم عصبی خودمختار تأثیر میگذارند. عملکرد قلب و هر سطح از عملکرد دستگاه گوارش، از جویدن تا مدفوع، میتواند تحت تأثیر این بیماری قرار گیرد، برای مثال یبوست و افت فشار خون هنگام ایستادن یکی از شایعترین علائم DLB است. زوال عقل با اجسام لویی معمولاً باعث بروز نشانههای روانی مانند تغییر در رفتار، افسردگی یا بیتفاوتی میشود.
DLB بهطور معمول پس از پنجاه سالگی آغاز میگردد و افراد مبتلا تنها در حدود چهار سال پس از تشخیص، امید به زندگی دارند. هیچ درمان کامل یا دارویی برای جلوگیری از پیشرفت بیماری وجود ندارد و هدف از روشهای درمانی موجود، کاهش برخی از علائم و نشانههای بیماری است. داروهایی مانند دونپزیل و ریواستیگمین میتوانند بهطور موقت مهارتهای شناختی و عملکرد کلی بدن را بهبود بخشند. ملاتونین نیز گاهی برای کاهش اختلالات مرتبط با خواب استفاده میشود. از تجویز داروهای ضد روان پریشی، حتی در صورت وقوع توهم در فرد بیمار، اجتناب میکنند؛ زیرا تقریباً در نیمی از مبتلایان به DLB واکنشهای شدیدی به این داروها رخ میدهد و استفاده از آنها میتواند به مرگ منجر شود. مدیریت بسیاری از علائم بیماری چالشبرانگیز است، زیرا درک آنها نیازمند تخصصهای متعدد پزشکی بوده و تشخیصهای افتراقی، همپوشانی بسیاری دارند. افرادی که در مراحل آخر DLB هستند ممکن است توانایی خود مراقبتی را از دست بدهند و برای انجام فعالیتهای اولیه خود مانند تغذیه، استحمام و خواب به مراقب احتیاج داشته باشند.
طبقهبندی
[ویرایش]زوال عقل با اجسام لویی (DLB) نوعی زوال عقل و جزء بیماریهای زوالدهنده و پیشرونده عصبی به حساب میآید؛ که با انحطاط سیستم عصبی مرکزی مشخص و با گذشت زمان وخیمتر میشود.[۱۴]
زوال عقل با اجسام لویی را میتوان به روشهای دیگری نیز طبقهبندی کرد؛ به عنوان نمونه این بیماری یکی از دو نوع زوال عقل اجسام لویی (دومین مورد زوال عقل بیماری پارکینسون است) به حساب میآید.[۱۵] چندین بیماری زوال عصبی ممکن است همراه با پارکینسون ظاهر شوند و گاهی به آنها «پارکینسونیسم غیرمعمول» یا «پارکینسون پلاس» گفته میشود،[۱۶][توضیح ۱] زوال عقل با اجسام لویی یک سینوکلئینوپاتی[ت] است، به این معنی که با رسوب غیرطبیعی پروتئین آلفا-سینوکلئین در مغز ایجاد میگردد. سینوکلئینوپاتیها خود نوعی تقسیمبندی از اختلالات عصبی محسوب میشوند که شامل بیماری پارکینسون، آتروفی سیستم چندگانه و سایر شرایط نادرتر هستند.[۱۹]
واژگان مرتبط با آسیبشناسی اجسام لویی اغلب باعث سردرگمی افراد میشوند.[۲۰] زوال عقل اجسام لویی (اصطلاح جامعی که شامل تشخیصهای بالینی زوال عقل با اجسام لویی و زوال عقل بیماری پارکینسون میشود) با بیماری اجسام لویی (اصطلاحی که برای توصیف یافتههای پاتولوژیکی اجسام لویی در کالبد شکافی استفاده میشود) متفاوت است.[۲۰] از آنجا که برای تشخیص قطعی بیماریهای تحلیلبرنده عصبی، مغز را کالبدشکافی میکنند، در مبتلایان به DLB در کنار زوال عقل، اجسام لویی نیز مشاهده میشود به همین علت اصطلاح «زوال عقل با اجسام لویی» را برای آن بکار میبرند. DLB به عنوان زوال عقلی مرتبط با بیماری آلزایمر به حساب میآید با این حال اصطلاح اجسام لوییِ بیماری آلزایمر در جوامع علمی استفاده نمیشود زیرا هر چند اجسام لویی اختلالاتی برای افراد مبتلا به آلزایمر ایجاد میکنند، آسیبشناسی غالب این افراد از خود بیماری آلزایمر سرچشمه میگیرد و وجود اجسام لویی ویژگی اساسی این بیماری نیست.[۲۰]
برخی از محققان بر این باورند که به کارگیری اصطلاح «بیماری اجسام لویی» ممکن است ماهیت واقعی این گروه از بیماریها را توصیف نکند و یک ترتیب ژنتیکی خاص (اپیژن) میتواند افراد را مستعد ابتلا به چند بیماری با اجسام لویی (چند ابتلایی اجسام لویی یا بیماری منتشر لویی) کند. از این رو بحثهای نامگذاری این بیماری همچنان ادامه دارد.[۲۱]
علائم و نشانهها
[ویرایش]محققان بر این باورند، DLB زوال عقلی بوده که با ترکیبی از نوسانات شناخت، توهمات مکرر، پارکینسونیسم و اختلال رفتاری خواب REM (به اختصار RBD)، که همزمان یا پس از تشخیص زوال عقل شناسایی میشوند، همراه است.[۲۲] DLB علائم بسیار متفاوتی دارد و از بسیاری از زوال عقلهای دیگر پیچیدهتر است.[۲۳][۲۴] در این بیمار چندین ناحیه از سیستم عصبی (مانند سیستم عصبی خودمختار و مناطق متعددی از مغز) میتوانند تحت تأثیر رسوبات آلفا سینوکلئین آسیب ببینند[توضیح ۲] و انواع اختلال و نقصهای عصبی مربوط را ایجاد کنند.[۲۶]

در DLB، مجموعهای قابل شناسایی از علائم و نشانههای اولیه وجود دارد. به این مرحله، پرودروم یا پیش زوال میگویند.[۲۸][۲۹] این علائم و نشانههای اولیه میتوانند ۱۵ سال یا بیشتر، قبل از ایجاد زوال عقل ظاهر شوند.[۲۸] اولین علائم معمولاً یبوست، سرگیجه ناشی از اختلال دیساتونومی، هیپوسمی (کاهش توانایی بویایی)، توهمات بینایی و RBD است.[۳۰][۲۹] RBD میتواند سالها یا دههها قبل از علائم دیگر ظاهر شود.[۱۱] از دست دادن حافظه همیشه نشانهای برای ابتلا به DLB نیست و میتواند نشانهای از وقوع یک بیماری دیگر مانند آلزایمر (AD) باشد.[۳۱]
خصوصیات ابتلا به DLB را میتوان به ویژگیهای ضروری، اصلی و حمایتی تقسیم کرد.[۱] برای مثال وجود زوال عقل یک ویژگی ضروری بوده و برای تشخیص وقوع بیماری مورد نیاز است؛ اما ویژگیهای حمایتی، علائم و نشانههای دیگری هستند که برای حمایت از تشخیص مورد ارزیابی قرار میگیرند. (به معیارهای تشخیصی مراجعه کنید).[۳۲]
ویژگیهای ضروری
[ویرایش]غالباً تشخیص زوال عقل زمانی صورت میگیرد که اختلالات شناختی ناشی از زوال، در فعالیتهای روزانه و شغلی خلل ایجاد کنند.[۳۲] در حالی که زوال عقل یکی از ویژگیهای ضروری DLB است، همیشه در اوایل ابتلا ظاهر نمیشود و اکثر اوقات با پیشرفت بیماری، نشانه و علائم آن آشکار میگردد.[۳۲][۳۳]
ویژگیهای اصلی
[ویرایش]در حالی که ویژگیهای اصلی ممکن است متفاوت باشند، در اغلب موارد شامل نوسانات شناختی، هوشیاری یا توجه هستند. اختلال رفتاری خواب REM نیز اگر به دلیل مصرف دارو، سکته مغزی و توهمات بصری مکرر نباشد، یکی از علائم مشابه پارکینسونیسم و زوال عقل با اجسام لویی بهشمار میآید.[۱]
چهارمین گزارش اجماع کنسرسیوم DLB در سال ۲۰۱۷، علائم و نشانههای این بیماری را بر اساس شواهد و آزمایشهای با کیفیت و علمی تعیین نمود تا با دیگر بیماریهای مرتبط با اجسام لویی اشتباه گرفته نشود.[۳۲]
نوسان شناخت و هوشیاری
[ویرایش]نوسانات در عملکرد شناختی، بارز و شایعترین علائم زوال عقل با اجسام لویی است.[۳۴][۳۵] این نوسانات اغلب با نوسانات همزمان توجه و هوشیاری، که توسط کنستانتینوس تساماکیس[ث] و کریستوفر مولر[ج] به عنوان «تغییرات خود به خودی تواناییهای شناختی، هوشیاری یا برانگیختگی» توصیف شدهاست،[۳۶] از سایر زوال عقلها قابل تشخیص هستند.[۳۷] طبق گفته مک کیث[چ] این نوسانات شناختی غالبا با «نوسانات مشخص بین بیشترین و کمترین عملکرد شناختی» قابل تشخیص هستند و در شدت، میزان و مدت زمان متفاوت اند.[۳۸] هر کدام از دورههای اختلال میتوانند از چند ثانیه تا چند هفته طول بکشند و بین دورههایی با عملکرد طبیعیتر قرار بگیرند.[۳۵][۳۶] زمانی که دورههای وقوع اختلال با بررسی پزشکی همزمان شوند، آزمایش شناختی ممکن است شدت بیماری را بهطور نادرستی ارزیابی کند،[۳۶] به همین علت ارزیابیهای بیشتری صورت میپذیرد تا میزان بهبود، نسبت به آزمایشهای اولیه نشان داده شود.[۳۹]
برخلاف نقصهای حافظه و برخی مؤلفهها که مشخص کننده بیماری آلزایمر است،[۳۲] اختلالات متمایزی در مهارتهای شناختی هنگام ابتلا به DLB دیده میشود که بیشتر در سه حوزه است:[۴۰][۴۱]
اختلالات و نوسانات فوق، غالب اوقات، در اوایل بیماری بروز میکنند.[۳۲] ذهن افراد مبتلا به DLB ممکن است به راحتی منحرف شود؛ این افراد زمان زیادی را برای تمرکز کردن بر روی کارهایشان صرف میکنند[۴۲] و ممکناست هنگام هوشیاری دچار هذیان، سردرگمی، عدم تمرکز یا گفتار نامنسجم و نامفهوم (فراموشی هنگام سخن گفتن)[۴۳] و در مواردی نیز دچار نوسان در توانایی سازماندهی افکارشان در طول روز شوند.[۵][۳۲]
عملکرد اجرایی به مجموعه فعالیتهای توجهی و رفتاری، حافظه و انعطافپذیری شناختی گفته میشود که به حل مسئله و برنامهریزی کمک میکند.[۴۴] مشکلات عملکرد اجرایی غالباً در فعالیتهایی که نیاز به تحلیل و سازماندهی دارند، نمود مییابد،[۱۳] این اختلالات میتوانند در عملکرد شغلی، ناتوانی در پیگیری مکالمات، مشکل در انجام چند کار یا اشتباهات رانندگی مانند قضاوت نادرست مسافت یا گم شدن ظاهر شوند.[۴۵]
فرد مبتلا به DLB ممکن است اختلالاتی را هنگام بیداری یا خواب تجربه کند (علاوه بر اختلال رفتاری خواب REM) که میتواند شدید باشد.[۱۱] این اختلالات شامل خوابآلودگی روزانه، چرت زدن بیش از دو ساعت در روز، بیخوابی، اختلال دورهای حرکت اندام، سندرم پای بیقرار و آپنه خواب است.[۱۱]
اختلال رفتاری خواب REM
[ویرایش]و زوال عقل با اجسام لویی
«اختلال رفتار خواب REM مرتبط با DLB بهطور کامل مورد مطالعه قرار گرفتهاست و اکنون به عنوان یک ویژگی اصلی برای این بیماری در نظر گرفته میشود.»
—بی. طوسی (۲۰۱۷)، «تشخیص و مدیریت تغییرات شناختی و رفتاری در دمانس با اجسام لویی»[۴۶]
اختلال رفتاری خواب REM نوعی پاراسومنیا است که افراد مبتلا، فلج عضلانی (آتونی[ح]) را که در طول خواب REM وجود دارد از دست میدهند و پاسخهای رفتاری به رویاهای خود، مانند حرکات و صداهای غیرطبیعی، نشان داده و دربارهٔ رؤیاهای خود سخن میگویند.[۴۷] حدود ۸۰ درصد از مبتلایان به DLB دارای این اختلال هستند.[۴۸] رفتارهای غیرطبیعی خواب ممکن است قبل از مشاهده زوال شناختی شروع و گاهی چندین دهه قبل از هر گونه علائم دیگری ظاهر شوند.[۴۹] اختلالات رفتاری خواب REM اغلب به عنوان اولین نشانه بالینی DLB و نشانه اولیه سینوکلئینوپاتیهای مختلف نیز به حساب میآیند.[۳۲] در کالبد شکافی از افراد مبتلا به RBD که به وسیله آزمایش چندگانه خواب تأیید شدهاند، ۹۴ تا ۹۸ درصد وجود سینوکلئینوپاتی تشخیص داده شد، از بین افراد دارای این اختلال سهم مبتلایان به DLB و پارکینسون به یک اندازه[۵۰] و بیشتر از دیگر بیماریهای عصبی بود.[۵۱][۵۲] بیش از سه نفر از هر چهار نفر مبتلا به RBD در عرض ده سال مبتلا به بیماری زوال عصبی تشخیص داده میشوند،[۵۳] اما تشخیصهای فرعی زوال عصبی ممکن است تا ۵۰ سال پس از تشخیص این اختلال خواب صورت نگیرد.[۵۲] RBD میتواند در طول زمان فروکش کند.[۳۲]
افراد مبتلا به RBD ممکن است از بیماری خود آگاه نباشند.[۵۴] رفتارهای RBD میتواند شامل فریاد زدن، جیغ زدن، خندیدن، گریه کردن، صحبتهای نامفهوم، تکان دادن اندامهای بدن، مشت زدن، لگد زدن، خفه کردن یا خراشیدن خود در هنگام خواب باشد.[۵۵][۵۶] رفتارهای صورت گرفته در خواب، اغلب خشونت آمیز بوده[۵۷] و شامل حمله به دیگران نیز میشوند.[۵۱] برخی افراد مبتلا به RBD از رختخواب بیرون میافتند و به خود یا همسرشان آسیب میرسانند؛[۳۲][۵۱][۵۶] این آسیبها میتواند در غالب کبودی، شکستگی یا هماتوم سابدورال بروز کند.[۵۸] از آنجایی که افراد به احتمال زیاد رؤیاها و رفتارهای خشونتآمیز خود هنگام خواب را گزارش میدهند، در صورت بروز آسیب به متخصص ارجاع داده میشوند. سوگیری خود انتخابی[خ] و سوگیری یادآوری[د] میتواند دلیل خشونت صورت گرفته در RBD را توضیح دهد.[۵۹]
پارکینسونیسم
[ویرایش]پارکینسونیسم یک سندرم بالینی است که با کندی حرکت (به نام برادیکینزی[ذ])، سفتی، اختلال تعادل و لرزش اندامها مشخص میشود[۶۰][۶۱] (لرزش در حالت استراحت کمتر شایع است[۸]). این سندرم در DLB و بسیاری از بیماریهای دیگر مانند بیماری پارکینسون، زوال عقلیِ بیماری پارکینسون و موارد دیگر یافت میشود.[۶۱] پارکینسونیسم در بیش از ۸۵ درصد از افراد مبتلا به DLB رخ میدهد که ممکن است یک یا چند مورد از نشانههای اصلی این بیماری را داشته باشند.[۳۲] علائم حرکتی شامل ناتوانی در راه رفتن، مشکلات تعادل، زمینخوردن، گفتار نامفهوم، کندی در سخن گفتن و صدایِ کمِ گفتار یا هیپوفونی است.[۲] ظهور علائم حرکتی متغیر، اما معمولاً متقارن هستند و در دو طرف بدن ظاهر میشوند.[۶۲] مبتلایان پارکینسونیسم ممکن است کمتر از افراد مبتلا به پارکینسون علامت ابتلا به بیماری از خود نشان دهند[۶۳] و گاهی تنها یکی از علائم مرتبط با پارکینسون را دارا هستند.[۱]
توهمات بصری
[ویرایش]در حدود ۸۰ درصد از افراد مبتلا به DLB، معمولاً در اوایل دوره بیماری، توهمات بصری دارند.[۳۲][۶۴] این توهمات میتواند به صورت مکرر رخ دهد. در برخی موارد این تصاویرِ ذهنی، بسیار وسیع و دقیق هستند[۶۵] و شامل ادراکات متحرک از حیوانات یا افراد، از جمله کودکان و اعضای خانواده، نیز میشوند.[۵] دامنه توهمات بصری از «کوتولههای که خیلی عادی در خانه راه میروند»، «ارواح والدین مردهای که آرام کنار تخت نشستهاند» تا «دوچرخههایی که از درختهای حیاط پشتی آویزان هستند» متفاوت است.[۶۶]
این توهمات میتواند باعث ترس فرد بیمار شود، اما بهطور معمول این تصورات خنثی و عادی هستند.[۵] در برخی شرایط نیز مبتلایان به DLB متوجه واقعی نبودن توهمات خود میشوند.[۶۷] در افرادی که اختلالات شناختی شدت بیشتری دارد، تصاویر رویت شده پیچیدهتر بوده و این افراد کمتر از واقعی نبودن توهمات خود، آگاه هستند.[۶۸] ادراک نادرست بصری یا توهم نیز در DLB رایج است و از ادراکات با توهمات بصری متفاوت اند. توهمات بصری هنگامی رخ میدهد که محرکها واقعی نباشند، در حالی که ادراک نادرست زمانی که محرکهای واقعی به اشتباه درک شود به وجود میآیند؛[۶۸] برای مثال، یک فرد مبتلا به DLB، خصوصیات یک مجسمه را برای شخص دیگری به اشتباه تفسیر میکند.[۵]
ویژگیهای حمایتی
[ویرایش]ویژگیهای حمایتی DLB، وزن تشخیصی کمتری دارند، اما شواهدی برای پشتیبانی از دیگر ویژگیهی بیماری ارائه میدهند.[۳۲] ویژگیهای حمایتی ممکن است در اوایل پیشرفت بیماری به وجود بیایند و بعد از مدتها نیز باقی بمانند. این علائم و نشانهها، شیوع بسیار گستردهای دارند اما برای تشخیص کافی و خاص نیستند و میتوانند علائم بیماری دیگری باشند. ویژگیهای حمایتی عبارتند از:
- حساسیت مشخص به داروهای ضدروانپریشی (نورولپتیکها)؛[۱]
- دیساُتونومی مشخص (اختلال خودکار) که در آن سیستم عصبی خودمختار به درستی کار نمیکند؛[۱]
- توهم در حواس به غیر از بینایی[۱] (شنوایی، لامسه، چشایی، و بویایی)؛[۶۹]
- پرخوابی (خوابآلودگی بیش از حد)؛[۱]
- هیپوسمی (کاهش توانایی بویایی)؛[۱]
- باورها و توهمات نادرست که حول یک موضوع مشترک سازماندهی شدهاند؛[۱]
- بیثباتی وضعیتی، از دست دادن هوشیاری، و زمینخوردنهای مکرر؛[۱][۷۰]
- بیتفاوتی، اضطراب یا افسردگی.[۱][۷۰]
به دلیل از دست دادن سلولهایی که انتقالدهنده عصبی دوپامین را آزاد میکنند، افراد مبتلا به DLB ممکن است به سندرم بدخیم نورولپتیک، اختلال در شناخت یا هوشیاری، تشدید غیرقابل بازگشت پارکینسونیسم از جمله سفتی شدید[۵۷] و دیساتونومی ناشی از استفاده از داروهای ضد روان پریشی مبتلا شوند.[۷۱]

دیساُتونومی (اختلال سیستم عصبی خودمختار) زمانی رخ میدهد که آسیب ناشی از اجسام لویی بر سیستم عصبی خودمختار محیطی (اعصابی که با عملکرد ناخودآگاه اندامهایی مانند روده، قلب و دستگاه ادراری سر و کار دارند) تأثیر میگذارد.[۲۶] اولین نشانههای اختلال عملکردی اُتونومیک اغلب کوچک هستند.[۵۹] نشانههای آن شامل مشکلات فشار خون مانند افت فشارخون ارتواستاتیک[ر] (کاهش قابل توجه فشار خون در هنگام ایستادن)، افت فشار هنگام به پشت خوابیدن،[۷۳] یبوست،[۷۴] مشکلات ادراری،[۷۵] اختلال عملکرد جنسی،[۷۶] تعریق و ترشح بزاق بیش از حد،[۷۷] از دست دادن یا کاهش توانایی بویایی[۵۹][۷۷] و مشکلات بلع (دیسفاژی) است.[۷۸]
رسوبات آلفا-سینوکلئین میتواند بر ماهیچه قلب و عروق خونی تأثیر بگذارد.[۲۷] بر اساس نتایج به دست آمده تخریب اعصاب سمپاتیک قلبی یک ویژگی نوروپاتولوژیک در زوال عقل با اجسام لویی است.[۷۹] تقریباً همه افراد مبتلا به سینوکلئینوپاتی اختلال عملکرد قلبی عروقی دارند، اگرچه اکثر آنها بدون علامت هستند.[۸۰] بین ۵۰ تا ۶۰ درصد از افراد مبتلا به DLB به دلیل کاهش جریان خون، افت فشار خون ارتواستاتیک دارند که میتواند منجر به سبکی سر، احساس ضعف و تاری دید شود.[۲۷]
رسوبات آلفا سینوکلئین بر هر سطحی از عملکرد دستگاه گوارش، از جویدن تا دفع، تأثیر میگذارد.[۹][۸۱] تقریباً همه افراد مبتلا به DLB دارای اختلال عملکرد دستگاه گوارش فوقانی (مانند گاستروپارزی[ز] و تأخیر در تخلیه معده) یا اختلال عملکرد دستگاه گوارش تحتانی (مانند یبوست و طولانی شدن زمان انتقال مدفوع) هستند.[۸۱] افراد مبتلا به زوال عقل با اجسام لویی بهطور کلی حالت تهوع، احتباس معده، نفخ و اتساع شکم را به دلیل تأخیر در تخلیه معده تجربه میکنند.[۸۱] مشکلات مربوط به عملکرد دستگاه گوارش میتواند بر جذب دارو نیز تأثیر بگذارد.[۹] یبوست یکی از شایعترین علائم برای افراد مبتلا به زوال عقلِ اجسام لویی است[۹] و میتواند یک دهه قبل از تشخیص بیماری ظاهر شود.[۸۲] دیسفاژی در DLB خفیفتر از سایر سینوکلئینوپاتیها است و دیرتر ظاهر میشود.[۸۳] مشکلات ادراری (احتباس ادرار، بیدار شدن در شب برای ادرار کردن، افزایش تکرر و فوریت ادرار و مثانه پرکار یا کمکار) معمولاً دیرتر ظاهر میشوند و ممکن است خفیف یا متوسط باشند.[۸۴] اختلالات عملکرد جنسی معمولاً در اوایل سینوکلئینوپاتی ظاهر میشود و ممکن است شامل اختلال نعوظ و مشکل در رسیدن به ارگاسم یا انزال باشد.[۷۶]
در میان سایر ویژگیهای حمایتی، نشانههای روانی اغلب زمانی بروز میکند که فرد برای اولین بار مورد توجه بالینی قرار میگیرد و بیماریش تشخیص داده میشود. در مقایسه با بیماری آلزایمر، احتمال ایجاد اختلالات روانی در مبتلایان به DLB، بیشتر تشخیص داده شدهاست.[۸۵] حدود یک سوم از افراد مبتلا به زوال عقل با اجسام لویی، افسردگی دارند و اغلب دارای اضطراب نیز هستند.[۸۶] اضطراب منجر به افزایش خطر زمینخوردن میشود[۸۷] و بیتفاوتی ممکن است باعث کم شدن تعامل اجتماعی شود.[۲]
آشفتگی، اختلالات رفتاری[۸۸] و هذیان معمولاً در مراحل بعدی بیماری ظاهر میشوند.[۵] هذیانها میتوانند موضوعیتی پارانوئیدی داشته باشند و تفکراتی نظیر تخریب شدن تدریجی خانه، خیانت[۵] یا رها شدن توسط دیگران را شامل میشوند.[۶۹] افراد مبتلا به DLB که وسایل خود را به اشتباه جا میگذارند ممکن است وسایلشان را سرقت شده بدانند.[۵] هنگام تشدید نشانههای بیماری، سندرم کاپگراس نیز رخ میدهد که در آن فرد مبتلا به DLB، شناخت خود از همسر، خانواده و یا توانایی خودمراقبتی را از دست داده[۸۹] و در مواردی فکر میکند آن اطرافیانش به دروغ خود را به عنوان خویشاوندش معرفی کردهاند.[۵] توهم در سایر مسائل نیز وجود دارد، اما کمتر دیده شدهاست.[۶۹]
اختلالات خواب (اختلال در چرخه خواب، آپنه خواب و برانگیختگیِ ناشی از اختلال حرکتی متناوب اندام) در DLB رایج است و گاهی منجر به پرخوابی میشود.[۹۰] همچنین از دست دادن حس بویایی میتواند چندین سال قبل از علائم و نشانههای دیگر رخ دهد.[۳۰]
علل بیماری
[ویرایش]
مانند سایر سینوکلئینوپاتیها، علت دقیق DLB ناشناخته است[۹۲][۹۳] و هیچ محرکی برای ایجاد رسوب آلفا سینوکلئین در سیستم عصبی مرکزی بهطور قطعی شناسایی نشدهاست.[۹۴] تحقیقات نشان داده، بیشتر سینوکلئینوپاتیها معمولاً در اثر تعاملات ژنتیکی و تأثیرات محیطی (اپیژنیک) ایجاد میشوند.[۹۲] البته انتظار میرود علل عفونی نیز در ایجاد بیماری نقش داشته باشند، اما شواهد آزمایشی بحثبرانگیز بوده و نیاز به شواهد باکیفیتی است.[۹۵] اکثر افراد مبتلا به DLB اعضای خانواده مبتلا ندارند، اگرچه وجود DLB به صورت خانوادگی نیز گزارش شدهاست[۴] و تصور میشود که وراثت پذیری آن حدود ۳۰٪ باشد (یعنی حدود ۷۰٪ از صفات مرتبط با DLB به عوامل خارجی و غیر ارثی وابسته است).[۹۶]
در عوامل ژنتیکی بیماریزا برای DLB، بیماری آلزایمر (AD)، پارکینسون و زوال عقل بیماری پارکینسون همپوشانی وجود دارد.[۹۱][۹۷] ژن APOE دارای سه واریانت مختلف است. APOE ε۴، یک عامل خطر برای DLB و بیماری آلزایمر است، در حالی که APOE ε۲ میتواند عاملی برای جلوگیری از ابتلا به این بیماریها باشد.[۹۱][۹۸] جهش در گلوکوسربروزیداز، ژنی برای یک آنزیم لیزوزومی، نیز با DLB و بیماری پارکینسون مرتبط است.[۹۹] به ندرت، جهش در SNCA، ژن آلفا سینوکلئین، یا LRRK2، ژنی برای آنزیم کیناز، میتواند باعث ایجاد هر یک از بیماریهای DLB، آلزایمر، پارکینسون یا زوال عقلِ پارکینسون شود؛[۹۱] این مسئله نشان میدهد که برخی از آسیبهای ژنتیکیِ مشترک ممکن است زمینهساز هر چهار بیماری باشد.[۹۱]
بیشترین خطر ابتلا به DLB در سن بالای ۵۰ سال است. داشتن اختلال رفتاری خواب REM یا بیماری پارکینسون خطر بیشتری برای ابتلا به DLB ایجاد میکند. مبتلا شدن به DLB با هیچ عامل خاص در سبک زندگی، مرتبط تشخیص نداده شدهاست.[۲] عواملی که در کنار اختلال رفتاری خواب REM به سینوکلئینوپاتی اشاره داشته باشند، شامل اختلال در دیدِ رنگی یا توانایی بویایی، اختلال شناختی خفیف و ترشح غیرطبیعی دوپامینرژیک (تشخیص با استفاده از تصویربرداری) میشوند.[۱۰۰]
پاتوفیزیولوژی
[ویرایش]
DLB با ایجاد مجموعههای غیرطبیعی از پروتئین آلفا سینوکلئین در نورونهای مغزیِ بیمار مشخص میگردد که به صورت اجسام لویی یا نوریتهای لویی ظاهر میشوند.[۹۱] هنگامی که این تودههای پروتئین به وجود بیایند، نورونها عملکرد مطلوب کمتری دارند و در نهایت میمیرند.[۲۴] از دست دادن نورون در DLB منجر به اختلال عملکرد عمیق دوپامین[۱۰۱] و آسیب کولینرژیکی میشود؛[۱۰۲] انتقال دهندههای عصبی دیگر نیز ممکن است تحت تأثیر قرار گیرند، اما بررسی کمتری روی آنها صورت گرفتهاست.[۱۰۳] آسیب در مغز گسترده بوده و بسیاری از حوزههای عملکردی را تحت تأثیر قرار میدهد.[۲۴][توضیح ۲] گمان میرود، از دست دادن نورونهای تولیدکننده استیل کولین عامل انحطاط در حافظه و یادگیری و مرگ نورونهای تولیدکننده دوپامین، عامل انحطاط رفتاری، شناختی، خلق و خو، حرکت، انگیزه و خواب باشد.[۲] میزان آسیب عصبی ایجاد شده به وسیله اجسام لویی، یک عامل کلیدی و تعیینکننده در اختلالات زوال عقل با اجسام لویی بهشمار میآید.[۱۰۴][۱۰۵]
مکانیسمهای دقیقی که در DLB مؤثر اند به خوبی درک نشده و بین آن اختلاف نظر وجود دارد.[۹۴][۱۰۶] نقش رسوبات آلفا سینوکلئین در این بیماری نامشخص است، زیرا افرادی که هیچ نشانهای از DLB نداشتند بعد از انجام کالبد شکافی، دارای آسیب عصبی پیشرفته به واسطهٔ آلفا سینوکلئینها تشخیص داده شدند.[۹۱] رابطه بین اختلالات عصبی ایجاد شده توسط اجسام لویی و مرگ سلولی گسترده مغزی، همچنان مورد اختلاف بوده[۱۰۶] و مشخص نیست، بیماری در اثر آسیبِ بین سلولی، گسترش مییابد یا از الگوی متفاوتی پیروی میکند.[۱۰۷] مکانیسمهایی که به مرگ سلولی کمک میکنند، چگونگی پیشرفت بیماری از طریق سلولهای مغز و زمانبندی زوال شناختی، هیچکدام به درستی درک نشدهاند و هیچ مدلی برای نشان دادن نورونها و نواحی خاص مغزی که تحت تأثیر قرار میگیرند، وجود ندارد.[۱۰۶]
مطالعات کالبد شکافی و تصویربرداریِ آمیلوئید با استفاده از ترکیب پیتزبورگ بی (PiB) نشان داد،[۱۰۸] آسیبشناسی پروتئین تاو و پلاکهای آمیلوئیدی،[۱۰۹] که از نشانههای بیماری آلزایمر محسوب میشوند،[۱۱۰] در DLB نیز رایج هستند[۱۱۱] و نسبت به زوال عقل بیماری پارکینسون شایعتر اند.[۱۱۲] رسوبات آمیلوئید بتا (Aβ) در تائوپاتی ها[ژ] نیز یافت میشوند (بیماریهای نورودِژِنِراتیو که با تودههای نوروفیبریلار پروتئین تاوِ فسفریله قابل تشخیص اند)،[۱۱۰][۱۱۳][۱۱۴] اما مکانیسم اساسی زوال عقل اغلب مختلف است و Aβ تنها یکی از عوامل ایجاد DLB بهشمار میآید.[۱۱۵]
یک بررسی آسیبشناختی برای RBD، نورونهایی را که در تشکیل شبکهٔ تنظیم خواب REM نقش دارند، مؤثر میداند. RBD ممکن است چندین دهه زودتر از سایر نشانهها در زوال عقل اجسام لویی ظاهر شود زیرا نورونهای بخشهای مختلف مغز، قبل از همه گیر شدن آسیب اجسام لویی، تحت تأثیر برهم خوردن کارکرد نورونهای دیگر نواحی مغز قرار میگیرند.[۵۵]
تشخیص
[ویرایش]زوال عقل با اجسام لویی را تنها میتوان بهطور قطعی پس از مرگ با کالبد شکافی مغز (یا در موارد نادر خانوادگی، از طریق آزمایش ژنتیکی) تشخیص داد،[۲] بنابراین تشخیص یک فرد زنده به صورت «محتمل» یا «ممکن» در نظر گرفته میشود.[۳۲]
تشخیص DLB میتواند چالشبرانگیز باشد زیرا طیف گستردهای از علائم و نشانهها با سطوح مختلفِ شدت در هر فرد وجود دارد.[۳] DLB اغلب اشتباه تشخیص داده شده[۱۱۶] یا در مراحل اولیه، با بیماری آلزایمر (AD) اشتباه گرفته میشود.[۱۱۷] اکثر افراد مبتلا به زوال عقل با اجسام لویی (مانند مبتلایان به آلزایمر، پارکینسونیسم و سایر زوال عقلها) تشخیص اولیه نادرستی را دریافت میکنند که گاهی برای چندین سال منجر به کاهش حمایت اجتماعی، افزایش ترس و عدم اطمینان به پزشک میشود.[۱۱۸] مقایسه میزان تشخیص DLB در مطالعات کالبد شکافی با موارد تشخیص داده شده در حین مراقبت بالینی نشان میدهد که از هر سه تشخیص DLB، ممکن است یک مورد نادیده گرفته شود.[۱۱۹][۱۲۰] مسئلهٔ دیگر که سبب پیچیده بودن تشخیص DLB میشود، همراهی این بیماری با آلزایمر است. کالبد شکافیها صورت گرفته نشان میدهد، نیمی از افراد مبتلا به DLB دارای سطوحی از تغییرات مربوط به آلزایمر در مغزشان هستند که طیف گستردهای از علائم و مشکلات تشخیصی را ایجاد میکند.[۳][۱۲۱][۱۲۲]
زندگی کردن با تشخیص و پیشآگهی نامشخص، نگرانیای است که از زبان افراد مبتلا به DLB و مراقبان آنها بیان میشود و مشکل در دستیابی به تشخیص واحد بین متخصصان مراقبتهای بهداشتی، از تجربیات رایج بیماران است.[۱۲۳] هنگامی که زوالعقل تشخیص داده شود نیز مشکلاتی برای یافتن پزشک متخصص برای درمان و مدیریت DLB وجود دارد.[۱۲۳] علیرغم دشواریهای موجود، تشخیص سریع به دلیل خطرات جدی حساسیت به داروهای ضد روان پریشی و اهمیتِ آگاهی فرد مبتلا و مراقبان فرد در مورد عوارض جانبی این داروها، مهم است.[۶][۱۲۴] مدیریت DLB در مقایسه با بسیاری از بیماریهای زوال عصبی دیگر دشوارتر است، بنابراین تشخیص دقیق اهمیت بالایی دارد.[۲۳]
معیارها
[ویرایش]
چهارمین گزارش کنسرسیوم زوال عقل با اجسم لویی که در سال ۲۰۱۷ برگزار شد؛[۱۲۵] معیارهای تشخیصی را برای DLB احتمالی مشخص نمود و پیشرفتهای تشخیصی و معیارهای جدیدی را نسبت به کنسرسیوم سوم (در سال ۲۰۰۵) تعیین کرد.[توضیح ۳] معیارهای مشخص شده در سال ۲۰۱۷ بر اساس ویژگیهای بالینی ضروری، اصلی، حمایتی و نشانگرهای زیستی-تشخیصی تنظیم شدهاست.[۱]
ویژگی اساسی DLB، زوال عقل است. زوال عقل باید آنقدر شدید باشد که در عملکرد اجتماعی یا شغلی تداخل ایجاد کند.[۳۲]
چهار ویژگی اصلی بالینی بیماری (در بخش علائم و نشانهها توضیح داده شد) نوسان شناختی، توهمات بینایی، اختلال رفتار خواب REM و علائم پارکینسونیسم و ویژگیهای بالینیِ حمایتی نیز شامل حساسیت مشخص به داروهای ضد روان پریشی، اختلال عملکرد اتونومی، توهمات غیر بصری، پرخوابی (خواب آلودگی بیش از حد)، هیپوسمی (کاهش توانایی بویایی)، باورها و توهمات نادرست که حول یک موضوع مشترک سازماندهی شدهاند، بیثباتی وضعیتی، از دست دادن هوشیاری و زمینخوردن مکرر، بیتفاوتی، اضطراب و افسردگی است.[۱][۷۰]
نشانگرهای زیستی قابل اندازهگیریِ مستقیم در آزمایشگاه، برای تشخیص DLB شناخته شده نیستند، اما چندین روش غیرمستقیم میتواند شواهد بیشتری برای تشخیص ارائه دهند. بیومارکرهای تشخیصی عبارتند از:[۳۲]
- کاهش جذب ناقل دوپامین در عقدههای قاعدهای که با استفاده از تصویربرداری PET و SPECT مشخص میشود.
- جذب کم آیودین123-متایودوبنزیل-گوانیدین (123I-MIBG)[س] هنگام تهیهٔ سینتیگرافی از میوکارد
- از دست دادن آتونی (انقباض عضلات کل بدن) در طول خواب REM که به وسیله پلی سومنوگرافی تشخیص داده میشود.
بیومارکرهای تشخیصی حمایتی (از مطالعات تصویربرداری مغزی PET, SPECT, CT ,MRI یا مانیتورینگِ EEG[۱۲۷]) نیز شامل عدم آسیب در لوب گیجگاهی داخلی (در آلزایمر احتمال آسیبِ بیشتر وجود دارد[۱۱۹])، کاهش فعالیت لوب پسسری و افزایش فعالیت مغز در خواب SWS (هنگام تصویر برداری با نوار مغزی) میشود.[۳۲]
DLB را زمانی میتوان تشخیص داد که زوال عقل و حداقل دو ویژگی اصلی یا یک ویژگی اصلی و حداقل یک بیومارکر زیستی-تشخیصی با یکدیگر همراه باشند. زوالعقل با اجسام لوییِ احتمالی نیز زمانی تشخیص داده میشود که زوال عقل و فقط یک ویژگی اصلی یا در صورت نبود هیچ ویژگی اصلی، حداقل یک بیومارکر زیستی-تشخیصی که در بالا ذکر گردید، وجود داشته باشد.[۳۲][۱۲۸]
زوال عقل با اجسام لویی بر اساس بازه زمانی که در آن علائم زوال عقل نسبت به علائم پارکینسون ظاهر میشود، از زوال عقلِ پارکینسون تمایز مییابد. DLB معمولاً زمانی تشخیص داده میشود که نشانههای اختلالات شناختی قبل یا همزمان با علائم حرکتی پارکینسون آغاز گردد؛ اما زوال عقل بیماری پارکینسون زمانی تشخیص داده میشود که بیماری پارکینسون قبل از وقوع زوال عقل به خوبی مشخص شده باشد (شروع زوال عقل بیش از یک سال پس از شروع علائم پارکینسون).[۱] این تمایز که به صورت قراردادی «قانون یک ساله» شناخته میشود، همپوشانی بین شرایط را به همراه تفاوتهای کلیدی آشکار مینماید، امکان تغییر در درمان و پیش آگهی را فراهم میکند و چارچوب تحقیقات مختلف، حول بیماری را شکل میدهد.[۲۰]
DLB در کتابچه راهنمای تشخیصی و آماری اختلالات روانی، ویرایش پنجم (DSM-5) به عنوان اختلال عصبی-شناختی عمده یا خفیف با اجسام لویی فهرست شدهاست.[۹۱] تفاوتهای بین معیارهای تشخیصی کنسرسیوم DSM و DLB عبارتند از:[۷۸]
- DSM جذب ناقل دوپامین کم را به عنوان یک ویژگی حمایتی ارزیابی نمیکند.
- وزن تشخیصی مشخصی برای بیومارکرهای زیستی در DSM در نظر گرفته نشدهاست.
همچنین زوال عقل با اجسام لویی توسط سازمان بهداشت جهانی ویرایش ICD-11 در طبقهبندی بینالمللی آماری بیماریها، فصل ششم، به عنوان اختلالات عصبی رشدی، کد ۶D۸۲ طبقهبندی شدهاست.[۱۲۹]
بررسی بالینی و آزمایشگاهی
[ویرایش]تستهای تشخیصی را میتوان برای تعیین برخی از ویژگیهای این بیماری و تمایز آنها از نشانههای سایر شرایط، استفاده کرد. تشخیص ممکن است شامل گرفتن سابقه پزشکی فرد، معاینه فیزیکی و ارزیابی عملکرد عصبی باشد.[۲] آزمایشهایی مانند تصویربرداری مغزی، آزمایش عصبی-روانشناختی[ش] برای رد شرایطی که ممکن است علائم مشابه ایجاد کنند، ارزیابی عملکرد مهارتهای شناختی، مطالعات خواب و میوکارد قلب با استفاده از سینتیگرافی نیز صورت میپذیرد.[۳۲][۱۳۰] پزشکان با استفاده از نتایج آزمایشگاهی سایر شرایطی که میتوانند نشانههایی مشابه زوال عقل داشته باشند، مانند عملکرد غیرطبیعی تیروئید، سیفلیس، HIV و کمبود ویتامین را تا حد امکان رد میکنند.[۱۳۰][۱۳۱]

آزمونهایی نیز جهت غربالگری زوال عقل، مورد استفاده قرار میگیرند، از این آزمونها میتوان به آزمون کوتاه وضعیت ذهنی (MMSE) و ارزیابی شناختی مونترال (MoCA) اشاره کرد.[۴۰] الگوی اختلالات شناختی در DLB از سایر زوال عقلها، مانند آلزایمر، متمایز است. MMSE عمدتاً برای اختلالات حافظه و زبان، که معمولاً در زوالعقلهای دیگر دیده میشود، مورد استفاده قرار میگیرد اما برای ارزیابی شناختی در زوالعقلهای مرتبط با اجسام لویی که تنها عملکرد بینایی، فضایی و اجرایی قابل بررسی بوده، کمتر مناسب است.[۱۳۲] تست مونترال میتواند برای ارزیابی عملکرد شناختی در DLB مناسبتر باشد[۱۳۲] و در کنار مقیاس ارزیابی بالینی نوسانات[ص] و امتیاز ترکیبی نوسانات مایو[ض] به درک زوال شناختی مرتبط با DLB کمک کند.[۱۳۳] از آزمونهای بررسی توجه مانند بازه ارقام (حفظ یک دنباله عددی)،[ط] دنباله هفتایی و محدوده فضایی[ظ] نیز برای غربالگری اولیه استفاده میشود؛ همچنین خردهآزمونِ دنباله رقمی اصلاح شده در تست هوش بزرگسالان وکسلر، برای تشخیص نقص توجه در DLB بهکار میرود.[۱۳۴] برای ارزیابی عملکرد اجرایی نیز از تست ارزیابی لوب پیشانی،[ع] تست استروپ و تست مرتبسازی کارت ویسکانسین[غ] و بسیاری از ابزارهای و تستهای دیگر غربالگری استفاده میکنند.[۱۳۵]
اگر زمانی که پارکینسونیسم و زوال عقل تنها ویژگیهای ارائه دهنده مشکوک به DLB باشند، تصویربرداری PET یا SPECT میتواند کاهش ترشح ناقل دوپامین را در مغز نشان دهد. اگر بتوان سایر شرایط که منجر به کاهش جذب ناقل دوپامین میشود را رد کرد، DLB ممکن است محتملترین بیماری برای تشخیص باشد.[۳۲]
RBD با ثبت چرخه خواب به وسیله آزمایش چندگانه خواب یا زمانی که مطالعات خواب انجام نمیگیرد،[۳۲] با سابقه پزشکی و پرسشنامههای معتبر تشخیص داده میشود.[۵۸][توضیح ۴] در افراد مبتلا به زوال عقل با سابقه RBD، تشخیص احتمالی DLB را میتوان حتی بدون هیچ ویژگی اصلی یا نشانگر زیستی دیگری بر اساس مطالعه خواب که خواب REM را بدون آتونی نشان دهد، توجیه کرد زیرا اختلال رفتاری خواب REM یکی از پیشبینیکنندهترین علائم DLB است.[۳۲] البته شرایط مشابه RBD، مانند آپنه خواب شدید و اختلال حرکتی دورهای اندام، برای تصمیمگیری در رابطه با ابتلا، باید رد شود.[۳۲] ارزیابی و درمان سریع RBD زمانی اهمیت مییابد که سابقه قبلی خشونت یا آسیب در خواب وجود داشته باشد، زیرا میتواند احتمال رفتارهای خشونتآمیز در پاسخ به رویاهای آتی را افزایش دهد.[۵۶] افراد مبتلا به RBD ممکن است نتوانند سابقهای از رفتارهایی که هنگام خواب انجام میدهند، ارائه دهند، بنابراین برای بررسی رفتارهای صورت گرفته، با خانواده فرد نیز مشورت میشود.[۳۲][۵۹] تک سؤال اختلال رفتاری خواب REM[ف]، در زمان نبود شرایط آزمایش پلیسومنوگرافی، ویژگیهای تشخیصی را با یک سؤال بررسی میکند:[۵۸]
«آیا تا به حال به شما گفته شده یا به خودتان مشکوک شدهاید که رفتارهایی هنگام خواب مانند مشت زدن، تکان دادن بازوها در هوا و دویدن را انجام می دهید در حالی که در خواب کامل بوده و از آن بیاطلاع هستید؟»[۱۳۷]
از آنجایی که برخی از افراد مبتلا به RBD زوال عقل با اجسام لویی ندارند، یافتههای طبیعی از مطالعه خواب به تنهایی نمیتواند DLB را رد کند.[۱۳۸]
از سال ۲۰۰۱، جذب کم آیودین123-متایودوبنزیل-گوانیدین (123I-MIBG) هنگام تهیهٔ سینتیگرافی از میوکارد برای تشخیص این بیماری در آسیای شرقی (عمدتا ژاپن)، استفاده میشود؛[۴۶][۱۳۹][۱۴۰] اما در ایالات متحده انجام نمیگیرد.[۱۱۹] همچنین مطالعاتی که استفاده از این روش را در تشخیصهای افتراقی تأیید کند وجود ندارد.[۱۴۱] MIBG توسط پایانههای عصبی سمپاتیک جذب (مانند پایانههایی که قلب را عصب دهی میکنند) و توسط سینتی گرافی با ید123 رادیواکتیو، برچسبگذاری ایزوتوپی میشود.[۱۴۰] اختلال عملکرد اتونومیک ناشی از آسیب به اعصاب قلب در بیماران مبتلا به DLB با جذب کمتر 123I-MIBG از قلب همراه است، به همین علت استفاده از این روش تشخیصی میتواند برای مشخص نمودن ابتلای فرد، مفید باشد.[۱۴۰]
هیچ آزمایش ژنتیکی برای تعیین اینکه یک فرد ممکن است در آینده به DLB مبتلا شود، وجود ندارد[۲][۳۲] و طبق معیارهای انجمن زوال عقل با اجسام لویی، آزمایش ژنتیکی بهطور معمول توصیه نمیشود زیرا فقط موارد نادری از DLB ارثی هستند.[۱۴۲]
تشخیص افتراقی
[ویرایش]بسیاری از بیماریهای تخریبکننده عصبی علائم شناختی و حرکتی مشابه زوال عقل با اجسام لویی دارند. تشخیص افتراقی شامل بیماری آلزایمر، سینوکلئینوپاتیهایی مانند زوال عقل بیماری پارکینسون، بیماری پارکینسون، زوال عقل عروقی، آتروفی سیستم چندگانه، فلج فوق هستهای پیشرونده،[ق] زوالعصبی کورتیکوبازال[ک] و سندرم کورتیکوبازال[گ] است.
علائم DLB میتواند به راحتی با دلیریوم اشتباه گرفته میشود[۱۴۳] یا در مواقع معدودی آن را به عنوان روانپریشی در نظر بگیرند.[۱۱۷] علائم مختلفی برای تشخیص پرودروم DLB با شروع نشانههای شبیه به دلیریوم و حملات روانی پیشنهاد شدهاست.[۲۸] تشخیص نادرست ابتلا به دلیریوم، به دلیل خطراتی که مصرف داروهای ضد روانپریشی برای افراد مبتلا به DLB دارد، یک نگرانی مهم بوده،[۱۴۳] به همین علت بررسی دقیق خصوصیاتی که میتواند مبتلایان DLB را از افراد مبتلا به دلیریوم تفاوت دهد، ضروری است.[۱۴۴] تصویربرداری PET یا SPECT که کاهش جذب ناقل دوپامین را نشان میدهد، میتواند به تشخیص DLB از دلیریوم کمک کننده باشند.[۱۴۳]
آسیبشناسی اجسام لویی نشان دهنده تأثیر بر سیستم عصبی اتونوم محیطی است. اختلال عملکرد اتونومیک کمتر در زوال عقل ایجاد شده در آلزایمر، دمانس فرونتوتمپورال (زوال عقل پیشانی-گیجگاهی) یا دمانس عروقی مشاهده میشود، بنابراین وجود آن میتواند به تمایز این بیماریها از یک دیگر تشخیصها کمک کند؛[۱۴۵] همچنین اسکنهای MRI اکثر مواقع ناهنجاریهایی را در مغز افراد مبتلا به زوال عقل عروقی نشان میدهند که ممکن است بهطور ناگهانی آغاز گردد اما این عارضه در مبتلایان به زوال عقل با اجسام لویی دیده نمیشود.[۱۴۶]
بیماری آلزایمر
[ویرایش]DLB حتی در مرحله پرودرومال از آلزایمر قابل تشخیص است.[۳۰] در اوایل ابتلا به آلزایمر، اختلال حافظه کوتاه مدت دیده میشود که یک ویژگی برجسته در تشخیص افتراقی به حساب میآید؛ همچنین نوسانات توجه، که یکی از علائم اصلی و در اغلب موارد اولین نشانهٔ زوال عقل با اجسام لویی است، کمتر رخ میدهد.[۱۴۷] برخلاف آلزایمر، که در آن هیپوکامپ یکی از اولین ساختارهای مغزی است که تحت تأثیر زوال قرار میگیرد و از دست دادن حافظه اپیزودیک (مربوط به رمزگذاری خاطرات) معمولاً اولین علامت آن است، اختلال حافظه به صورت تدریجی در DLB به وجود میآید.[۴۵][۱۴۸] اختلال شناختی خفیف آمنستیک در افراد (که در آن از دست دادن حافظه علامت اصلی است)، میتواند پیشآگهی ابتلا به آلزایمر باشد، در حالی که افرادی که دارای اختلال شناختی خفیف غیر آمنستیک هستند (اختلالات در حوزههای زبانی و عملکرد دیداری-فضایی برجسته تر است) احتمال ابتلای DLB بیشتری دارند.[۱۴۹] از دست دادن حافظه در DLB، پیشرفت متفاوتی نسبت به آلزایمر دارد زیرا بخشهای پیشانی و اتصال گیجگاهی-آهیانهای[ل] در مغز درگیر میشود. عامل تکفکیک کننده دیگر حافظه کلامی است که در آلزایمر آسیب کمتری میبیند.[۱۵۰]
۷۴٪ از افراد مبتلا به DLB، که توسط کالبد شکافی تأیید شدند، نقص در برنامهریزی و سازماندهی افکار داشتند، در حالی که این مسئله فقط در ۴۵٪ از افراد مبتلا به آلزایمر مشاهده شد.[۱۵۱] نقصهای پردازش دیداری-فضایی که در اکثر افراد مبتلا به DLB وجود دارند،[۶] زودتر از آلزایمر ظاهر میشوند و واضحتر هستند.[۱۵۲] توهمات معمولاً در اوایل دوره ابتلا به DLB رخ میدهد،[۵] اما در مراحل آخر بیماری آلزایمر بروز میکنند.[۸۹] بررسیهای آسیبشناختی آلزایمر نشان داد، سرعت زوال عصبی در این بیماری بیشتر از DLB است. همچنین آزمایش مایع مغزی نخاعی (CSF) «الگوی ابتلایی آلزایمر» را پروتئین تاو بالاتر و آمیلوئید بتای پایین در نورونها، نشان داد.[۱۳۳]
تصویربرداری PET یا SPECT میتواند برای تشخیص کاهش جذب ناقل دوپامین و تشخیص آلزایمر از DLB استفاده شود.[۶۲][۱۵۳] آتروفی (تحلیل) شدید هیپوکامپ در آلزایمر نسبت به DLB بیشتر دیده شدهاست،[۱۵۴] اسکنهای MRI قبل از ایجاد زوال عقل (در طول مرحله اختلال شناختی خفیف)، حجم طبیعی هیپوکامپ را نشان میدهند؛ اما پساز ایجاد زوال عقل، تحلیل بیشتری را در میان افراد مبتلا به آلزایمر ارزیابی میکند و افراد مبتلا به DLB کاهش آهستهترِ حجم مغزی در طول زمان را نسبت به افراد مبتلا به آلزایمر نشان میدهد.[۴۰] همچنین هنگام اسکن مغزی FDG-PET، علامت جزیرهای سینگولیت یکی از مشخصههای ابتلا به DLB بوده و قابل تمایز از بیماری آلزایمر است.[۴۰]
در شرق آسیا، به ویژه ژاپن، 123I-MIBG در تشخیص افتراقی DLB از آلزایمر مورد استفاده قرار میگیرد، زیرا کاهش جذب این ماده در اعصاب قلب تنها در اختلالات مرتبط با اجسام لویی دیده میشود.[۱۱۷][۱۱۷] همچنین سایر نشانگرهای زیستی و حمایتی در تشخیص DLB و آلزایمر (حفظ ساختارهای لوب گیجگاهی، کاهش فعالیت لوب پسسری و افزایش فعالیت مغز در خواب SWS) مفید هستند.[۳۲]
سینوکلئینوپاتیها
[ویرایش]زوال عقل با اجسام لویی، زوال عقلِ پارکینسون و بیماری پارکینسون، پس از بروز زوال عقل، از نظر بالینی مشابه هستند.[۱۵۵] هذیان در زوال عقل بیماری پارکینسون کمتر از DLB مشاهده میشود[۱۵۶] و افراد مبتلا به پارکینسون معمولاً کمتر درگیر توهمات بینایی نسبت به مبتلایان به DLB هستند.[۸۹] بروز لرزش در هنگام استراحت در DLB نسبت به بیماری پارکینسون کمتر است و علائم پارکینسونیسم در DLB متوازنتر نمایان میشود.[۴۸] در آتروفی سیستم چندگانه، اختلال عملکرد اتونومیک زودتر ظاهر میشود، شدیدتر بوده و با حرکات ناهماهنگ همراه است،[۴۵] در حالی که توهمات بینایی و نوسان شناختی کمتر در DLB رخ میدهد.[۱۵۷] همچنین مشکلات ادراری یکی از علائم اولیه همراه با آتروفی سیستم چندگانه بوده و اغلب به صورت شدید بروز میکنند.[۷۵]
زوال عقل پیشانی-گیجگاهی
[ویرایش]سندرم کورتیکوبازال، زوال عصبی کورتیکوبازال، فلج فوق هستهای پیشرونده و زوال عقل پیشانی-گیجگاهی اختلالاتی با ویژگیهای پارکینسونیسم و اختلال در مهارتهای شناختی هستند.[۱۵۸] مشابه DLB، تصویربرداری ممکن است کاهش جذب ناقل دوپامین را در این بیماریها نیز نشان دهد. سندرم و زوال عصبی کورتیکوبازال و فلج فوق هستهای پیشرونده معمولاً با سابقه پزشکی و معاینه از DLB متمایز میشوند. برای مثال یکی از مشخصههای سندرم کورتیکوبازال نامتقارن بودن حرکات بدن هنگام راه رفتن است. در رایجترین انواع فلج فوق هستهای پیشرونده تفاوتهایی در وضعیت، نگاه و حالات صورت وجود دارد و افتادن به سمت عقب نسبت به DLB شایعتر است. توهمات بینایی و نوسانات شناختی که در DLB دیده میشوند، نیز هنگام ابتلا به زوال عصبی کورتیکوبازال و فلج فوق هستهای پیشرونده غیرعادی هستند.[۱۵۸]
مدیریت بیماری
[ویرایش]مراقبتهای تسکینی-درمانی برای بهبود علائم و نشانههای این بیماری ارائه میشود، اما درمان یا روشی در حال حاضر وجود ندارد که بتواند پیشرفت سریع این بیماری را کُند، متوقف یا بهبود بخشد.[۱۵۹][۱۶۰][۱۶۱] اگرچه دونپزیل در ژاپن و فیلیپین برای درمان DLB مجوز دارد.[۱۶۲] هیچ دارویی برای مدیریت DLB، تا سال ۲۰۲۳ توسط سازمان غذا و داروی ایالات متحده (FDA) تأیید نشدهاست،[۱۶۳] بهطور کلی مطالعه کمی در مورد بهترین مدیریت برای علائم غیرحرکتی مانند اختلالات خواب و دیساُتونومی انجام شدهاست؛ همچنین بیشتر اطلاعات دربارهٔ مدیریت اختلال عملکرد اتونومیک، که در DLB نیز دیده میشود، بر اساس مطالعات افراد مبتلا به بیماری پارکینسون صورت پذیرفتهاست.[۱۶۲]
مدیریت DLB میتواند به دلیل نیاز به درمان متعادلِ همهٔ نشانهها، مانند اختلال عملکرد شناختی، ویژگیهای عصبی-روانی، اختلالات مربوط به سیستم حرکتی و سایر علائم غیرحرکتی، چالشبرانگیز باشد.[۱۶۴] افراد مبتلا به DLB علائم بسیار متفاوتی دارند که در طول زمان دچار نوسان میشود و درمان یک علامت میتواند علامت دیگر را تشدید کند. مراقبت غیربهینه ممکن است ناشی از عدم هماهنگی بین پزشکانی باشد که علائم مختلف بیماری را درمان میکنند.[۱۶۵] به همین علت یک رویکرد چند رشتهای و تشخیص زودهنگام و دقیق که شامل آموزش و حمایت از مراقبین میشود، در درمان و مدیریت DLB نقش حیاتی دارد.[۷۲][۱۶۶]
دارو درمانی
[ویرایش]«دشوارترین تصمیم در مدیریت DLB مربوط به استفاده از داروهای ضد روانپریشی است… بیماران DLB بهطور ویژه در معرض خطر عوارض و مرگ و میر ناشب از این داروها هستند.»
—بی.پی. بوت (۲۰۱۵)، درمان جامع زوال عقل با اجسام لویی[۷۱]
مدیریت دارویی DLB به علت اثرات نامطلوب داروها، پیچیدهاست،[۵۵] زیرا طیف گستردهای از علائم، نیازمند درمان هستند (شناختی، حرکتی، عصب روانپزشکی[م]، خودمختاری و خواب).[۲۳][۷۲] داروهایی که عوامل آنتیکولینرژیک و دوپامینرژیک را تنظیم میکنند میتوانند اثرات نامطلوبی در افراد مبتلا به DLBی دارای روانپریشی داشته باشند[۷۲] و داروهایی که برای درمان روانپریشی استفاده میشوند و دارای ترکیبات ناسازگار اند، خطرات زیادی را برای مبتلایان به DLB به وجود میآورند.[۱۶۷] نمونه دیگر، مهارکنندههای استیل کولین استراز (AChEIs) هستند که برای کاهش اختلالات شناختی تجویز میشوند و میتوانند عوارض جانبی متعددی در علائم دیساتونومی ایجاد کنند. همچنین درمان علائم حرکتی با آگونیستهای دوپامین ممکن است علائم عصبی-روانی را بدتر کند و درمان توهمات و بیماریهای روانی با داروهای ضد روانپریشی باعث بروز تأثیرات مختلف و گاهی مرگ میشود.[۱۶۴]
در استفاده از داروهای ضدروان پریشی در افراد مبتلا به DLB به دلیل حساسیت به برخی از ترکیبات این داروها، احتیاط بسیاری صورت میگیرد.[۱۶۸] واکنشهای شدید و تهدیدکننده زندگی تقریباً در نیمی از افراد مبتلا به DLB رخ میدهد[۸۶][۶] و میتواند، حتی پس از مصرف یک دوز از این داروها، منجر به مرگ شود؛[۷۱] به همین علت تنها از داروهای ضدروان پریشی با خاصیت مسدود کنندگی گیرنده D2 دوپامین[ن]، آن هم به صورت محدود و اندک، استفاده میشوند.[۶۹] اکثر محققان بر این باور اند، استفاده نکردن از داروهای اعصاب، با وجود اختلالات روانی، اغلب بهترین اقدام است.[۱۶۹] افراد مبتلا به زوال عقل اجسام لویی که داروهای اعصاب مصرف میکنند در معرض خطر ابتلا به سندرم بدخیم نورولپتیک، که یک بیماری تهدید کننده زندگی است، قرار میگیرند.[۵۷] هیچ شواهدی برای حمایت از اثر بخشی داروهای ضدروانپریشی برای درمان زوال عقل اجسام لویی وجود ندارد[۸۶] و ممکن است در صورت استفاده در افراد مسنِ مبتلا به زوال عقل، خطر اضافی سکته مغزی را نیز به همراه داشته باشد.[۹۰]
داروهایی با خواص آنتیکولینرژیک که از سد خونی مغزی عبور میکنند (از جمله داروهای ضدافسردگی سهحلقهای و داروهای بیاختیاری ادرار)، میتوانند باعث از دست دادن حافظه شوند.[۱۷۰] همچنین داروهای آنتیهیستامین، دیفنهیدرامین (بنادریل[و])، داروهای خواب مانند زولپیدم[۱۷۰] و بنزودیازپینها ممکن است گیجی یا علائم عصبی-روانی را وخیمتر کنند.[۱۷۱][۱۷۲] برخی از داروهای عمومی بیهوشی نیز باعث سردرگمی یا هذیان هنگام بیدار شدن از خواب، در افراد مبتلا به زوال عقل اجسام لویی میشوند و معمولاً زوال دائمی را به همراه دارند.[۱]
علائم شناختی
[ویرایش]شواهد قوی برای استفاده از مهارکنندههای استیل کولین استراز (AChEIs) در درمان مشکلات شناختی وجود دارد. این داروها شامل ریواستیگمین و دونپزیل هستند[۳][۱۷۳] و به عنوان اولین تجویزات درمانی DLB در بریتانیا شناخته میشوند.[۱۷۳] حتی زمانی که AChEIها منجر به بهبود علائم شناختی نمیشوند، افرادی که از آنها استفاده میکنند، ممکن است بهطور کلی بیماری با وخامت کمتری داشته باشد،[۱۷۳] اگرچه اثرات نامطلوب گوارشی در زمان مصرف این داروها وجود داد.[۱۷۴] استفاده از این داروها کاهش اثرات نامطلوب بیماری، کاهش زحمت مراقبین و بهبود فعالیتهای روزمره زندگی را نشان دادهاست.[۱۷۳] مصرف AChEI باید با دقت شروع شود زیرا میتواند اختلال عملکرد اتونومیک یا اختلالات خواب را بدتر کند.[۱۷۵] شواهد کمتری برای اثربخشی ممانتین در DLB وجود دارد،[۱۷۳] اما ممکن است به تنهایی یا همراه با AChEI به دلیل عوارض جانبی کم آن مورد استفاده قرار گیرد.[۷۲] هنگام بروز علائم شناختی از تجویز داروهای آنتیکولینرژیک اجتناب میکنند زیرا باعث تشدید این علائم میشوند.[۱۷۴]
برای بهبود هوشیاری در طول روز، شواهد متفاوتی برای استفاده از محرکهایی مانند متیل فنیدیت و دکستروآمفتامین وجود دارد. اگرچه وخیم شدن علائم عصبی-روانی رایج نیست، اما میتواند خطر بروز روان پریشی را افزایش دهد.[۱۷۶] مدافینیل و آرمودافینیل[ه] نیز میتوانند برای کاهش خواب آلودگی در طول روز مؤثر باشند.[۱۷۷]
علائم حرکتی
[ویرایش]به نظر میرسد علائم حرکتی در DLB تا حدودی کمتر به داروهایی که برای درمان بیماری پارکینسون استفاده میشوند، مانند لوودوپا، پاسخ میدهند.[۸] علاوه بر مورد فوق این داروها میتوانند علائم عصبی-روانی را نیز افزایش دهند.[۷۲] تقریباً از هر سه فرد مبتلا به DLB، یک نفر دچار روانپریشی ناشی از لوودوپا میشود.[۸] اگر چنین داروهایی برای علائم حرکتی مورد نیاز باشد، معرفی محتاطانه با افزایش آهسته تا کمترین دوز ممکن، میتواند به جلوگیری از روانپریشی کمک کند.[۷۲]
داروی ضد تشنجِ زونیسامید از سال ۲۰۰۹ در ژاپن برای درمان بیماری پارکینسون[۱۶۱] و از سال ۲۰۱۸ برای درمان پارکینسونیسم در DLB تأیید شدهاست.[۱۷۸] با توجه به رویکرد رتبهبندی قطعیتِ GRADE[ی]، اطمینان بالایی وجود دارد که این دارو برای درمان علائم حرکتی در DLB مؤثر واقع شود.[۱۷۹]
علائم عصبی-روانی
[ویرایش]علائم عصبی-روانی DLB (پرخاشگری، اضطراب، بیتفاوتی، هذیان، افسردگی و توهم) همیشه نیاز به درمان ندارند[۸۶] و در بسیاری از موارد عوارض جانبی داروها باعث ایجاد شدن این اختلالات میشوند. کم شدن مصرف داروها، خود میتواند به کاهش برخی از علائم عصبی-روانی کمک کند، برای مثال اولین روش درمان توهمات بینایی، کاهش استفاده از داروهای دوپامینرژیک است که میتواند بروز توهم را نیز کاهش دهد.[۱۷۴] اگر علائم عصبی-روانی جدیدی در مرحلهای از بیماری ظاهر شود، استفاده از داروهایی (مانند آنتی کولینرژیکها، داروهای ضد افسردگی سه حلقهای، بنزودیازپینها و اپیوئیدها) که ممکن است در ایجاد این علائم نقش داشته باشند، بررسی میشوند.[۱۸۰]
در میان مهارکنندههای استیل کولین استراز (AChEI)، ریواستیگمین و دونپزیل میتوانند به کاهش علائم عصبی-روانی کمک کنند[۱۸۱] و فراوانی و میزان توهمات را در مرحلهای که هنوز شدید نشدهاند، بهبود بخشند.[۶۶] برای درمان روان پریشی و بیقراری روانی ناشی از DLB، شواهد کمی از اثر بخشی ممانتین، اولانزاپین و آریپیپرازول و شواهد کمتری برای اثربخشی کوئتیاپین وجود دارد.[۱۸۱] تحقیقات اندکی در استفاده از کلوزاپین برای درمان توهمات بیناییِ DLB صورت گرفته (اگرچه در بیماری پارکینسون مؤثر نشان داده شدهاست) و استفاده از آن مستلزم نظارت منظم خون است.[۱۸۱][۱۷۴]
بیتفاوتی ممکن است با برخی از AChEIها درمان شود و توهم، هذیان، اضطراب و بیقراری را کاهش دهد.[۷۲] اکثر داروهایی که برای درمان اضطراب و افسردگی وجود دارند به اندازه کافی برای DLB بررسی نشدهاند.[۸۶] داروهای ضدافسردگی ممکن است بر خواب تأثیر بگذارند و RBD را بدتر کنند.[۱۱][۸۶] از میرتازاپین و SSRIها، بسته به میزان تحمل دارویی و با توصیههای کلی برای استفاده از داروهای ضد افسردگی در زوال عقل، میتوان برای درمان افسردگی استفاده کرد.[۷۲][۸۷] داروهای ضد افسردگی، با خواص آنتی کولینرژیکی که دارند، میتوانند باعث تشدید توهم و هذیان شوند.[۹۰] همچنین افراد مبتلا به سندرم کاپگراس ممکن است پاسخهای بیولوژیکی نامطلوبی به داروهای AChEI نشان دهند.[۶۹]
اختلالات خواب
[ویرایش]رفتارهای آسیب زا، در زمان از دست رفتن آتونی عضلانی، اولین اولویت درمانی اختلالات خواب است.[۵۶] RBD را میتوان با ملاتونین یا کلونازپام درمان کرد.[۱۸۲] داروهای خواب به دقت برای هر فرد مورد ارزیابی قرار میگیرند، زیرا خطر زمینخوردن، افزایش خوابآلودگی در طول روز و کاهش توانایی شناختی را به همراه دارند.[۱۱] ملاتونین از وقوع اختلالات جلوگیری میکند[۱۸۳] و جایگزین ایمنتری نسبت به دیگر داروها بهشمار میرود؛ زیرا کلونازپام میتواند ایجاد کننده زوال شناختی باشد[۷۲] و آپنه خواب را بدتر کند.[۱۸۳] برای برخی از افراد نیز مصرف ممانتین مفید است.[۱۱]
مودافینیل بهطور معمول برای پرخوابی استفاده میشود، اما هیچ شواهدی برای اثر بخشی آن در DLB وجود ندارد.[۹۰] داروهای ضد افسردگی (SSRIs, SNRIs، سه حلقهایها و MAOI), AChEI، بتا بلاکرها، کافئین و ترامادول نیز سبب تشدید RBD میشوند.[۱۸۳]
علائم اتونومیک
[ویرایش]با افزایش علائم افت فشار خون ارتواستاتیک (هنگام ایستادن) کاهش دوز آنتیسایکوتیکهای آتیپیک یا دوپامینرژیک صورت میگیرد و مصرف داروهایی که برای فشارخون بالا به کار میروند، برای مدت کوتاهی قطع میشود؛ این مسئله به کاهش اثرات افت فشارخون در DLB کمک میکند.[۹۰] هنگامی که درمانهای غیردارویی برای افت فشارخون ارتواستاتیک مؤثر نیست، مصرف داروهایی مانند فلودروکورتیزون، دروکسیدوپا یا میدودرین[اا] پیشنهاد میشوند،[۱۸۴] با این حال داروهای ذکر شده، تا به امروز بهطور خاص برای DLB مورد مطالعه قرار نگرفتهاند.[۹] تأخیر در تخلیه معده میتواند با داروهای دوپامینرژیک و یبوست با اپیوئیدها و داروهای آنتی کولینرژیک وخیمتر شود.[۹] آنتاگونیستهای موسکارینیک[اب] که برای مشکلات ادراری استفاده میشوند نیز اختلالات شناختی را در افراد مبتلا به زوال عقلِ اجسام لویی تقویت میکنند.[۹]
درمانهای دیگر
[ویرایش]شواهدی با کیفیتی برای مدیریت غیردارویی DLB وجود ندارد،[۷۲][۹] اما برخی از مداخلات برای درمان علائم مشابهی که در سایر زوال عقلها رخ میدهند مؤثر نشان داده شدهاند.[۱۸۵] برای مثال، فعالیتهای گروهی، موسیقی درمانی، فعالیت بدنی و کاردرمانی به درمان روانپریشی و بیقراری، همچنین ورزش و تمرین راهرفتن نیز میتواند به علائم حرکتی کمک کنند.[۱۸۵] درمان شناختی-رفتاری را اگرچه شواهدی مبنی بر استفاده از آن در DLB وجود ندارد، میتوان برای کاهش افسردگی یا توهم تجویز کرد،[۱۸۶] فعالیت دیگر، نشانههای محیطی است که برای کمک به بازیابی حافظه استفاده میشود؛ در این فعالیت فرد مبتلا در محیطی قرار میگیرد که امکان به یادآوری خاطراتش را داشته باشد.[۴۵]
اولین قدم در مدیریت اختلالات خواب، ارزیابی استفاده از داروهایی است که بر خواب تأثیر میگذارند و آموزشهایی را در مورد بهداشت خواب ارائه میدهند.[۱۱] شدت و حدت RBD ممکن است با درمان آپنه خواب، در صورت وجود، کاهش یابد.[۱۸۲]
برای اختلال عملکرد اتونومیک، چندین استراتژی غیر دارویی مانند تغییرات رژیم غذایی شامل اجتناب از وعدههای غذایی پرچرب[۹] و غذاهای شیرین، خوردن وعدههای غذایی کوچکتر و مکرر،[۱۸۷] پیادهروی بعد از غذا و افزایش مایعات یا فیبر غذایی میتواند برای درمان یبوست مفید باشد.[۹] ملینها نرمکنندهٔ مدفوع و ورزش نیز سبب بهبود یبوست میشوند.[۹] با پرهیز از الکل و غذاهای تند و استفاده از ملافههای نخی و لباسهای گشاد میتوان به تعریق زیاد و کاهش علائم اختلالات اتونومیک کمک کرد.[۹]

ورزش در حالت نشسته یا دراز کشیده و ورزش در آب (آکواتراپی) به حفظ شرایط طبیعی بدن کمک میکند.[۱۸۹] جوراب واریس، بالا بردن سر تخت خواب و افزایش مصرف مایعات یا نمک خوراکی را میتوان برای اختلالِ کاهش فشار خون ارتواستاتیک به کار برد.[۹] برای کاهش شکستگی در افراد در معرض خطر افتادن، غربالگری تراکم مواد معدنی استخوان و آزمایش سطح ویتامین D استفاده میشود[۱۹۰] و به مراقبان در مورد اهمیت پیشگیری از افتادن آموزش میدهند.[۱۹۱] نشان داده شدهاست که فیزیوتراپی برای زوال عقل بیماری پارکینسون مفید است، اما تا سال ۲۰۲۰، هیچ مدرکی برای حمایت از فیزیوتراپی در افراد مبتلا به DLB وجود ندارد.[۸]
مراقبت
[ویرایش]آموزش مراقبان برای مدیریت علائم عصبی-روانی (مانند بیقراری و روانپریشی) یکی از توصیههای اساسی برای مدیریت بیماری است.[۱۹۰] به دلیل علائم عصبی-روانی مرتبط با DLB، پیشآگهیهای نیازمند ارائه به مراقبان بیشتر از آلزایمر بوده،[۱۶۷] با این وجود آموزش مراقبان به اندازه بیماری آلزایمر و پارکینسون بهطور کامل مورد مطالعه قرار نگرفتهاست.[۷۲] عوامل متعددی باعث سختی مراقبت در DLB میشوند؛ نوسانات عاطفی،[۱۶۷] بیتفاوتی،[۱۹۲] روانپریشی، پرخاشگری، بیقراری، و رفتارهای شبانه مانند اختلالات خواب[۱۴۳] که منجر به از دست دادن خود مراقبتی، زودتر از آلزایمر میشود، نمونهای از این موارد هستند.[۱۹۳] مراقبان گاهی افسردگی و خستگی را تجربه میکنند و نیاز به حمایت افراد دیگر دارند.[۱۹۴] سایر اعضای خانواده که در مراقبت روزانه حضور ندارند، اغلب رفتارهای نوسانی را مشاهده نمیکنند و استرسی که بر مراقب وارد میشود، تشخیص نمیدهند؛ به همین علت ممکن است کاستیهایی در حمایت از افراد مبتلا به DLB توسط مراقبینشان ایجاد شود.[۲] آموزش مراقبین نه تنها ناراحتی و مشکلات آنان را کاهش میدهد، بلکه باعث افزایش مدیریت بیماری و کم شدن علائم برای فرد مبتلا به زوال عقل نیز میشود.[۱۸۵]
مدیریت توهمات بصری یکی از دشوارترین وظایف مراقبین در DLB بوده[۱۹۵] و آموزش مراقبان برای تغییر موضوع و پرت کردن حواس افراد در هنگام مواجهه با توهمات، مؤثرتر از بحث بر سر واقعی بودن یا نبودن آنها است.[۱۹۶][۱۹۷] راهبردهای مقابلهای به دلیل نداشتن عوارض جانبی خطرناک، حتی اگر شواهدی برای اثربخشی آنها وجود نداشته باشد، میتواند به مراقبین کمک کنند.[۱۹۸] یکی از راهبردها، ترغیب فردِ مبتلا به مشاهده پدیدهای در دور دست است. روشهای دیگر شامل نشان دادن یک عکس، دستور به تمرکز یا سعی بر لمس توهمات، صبور ماندن برای رفع خود به خودی و صحبت با فرد دربارهٔ تصوراتش میشود.[۱۹۹] هذیانها و توهمات ممکن است با افزایش نور در شب کاهش یابند، همچنین باید اطمینان حاصل شود، شب هنگام که فرد مبتلا در حالت خواب قرار داد، نوری وجود نداشته باشد.[۱۹۶]
با افزایش خطر عوارض جانبی داروهای ضد روانپریشی برای افراد مبتلا به DLB، مراقبان آموزش دیده و آگاه میتوانند به عنوان حامیان آنها عمل کنند.[۲۰۰] اگر ارزیابی یا درمان در اتاق اورژانس مورد نیاز باشد، مراقب میتواند خطرات استفاده از آنتی سایکوتیکها را برای پزشکان غیر متخصص توضیح دهد.[۵۷] آموزش مراقب، نظارت فعال[اپ]، شناسایی منابع درد و افزایش تعامل اجتماعی میتواند به حداقل رساندن بیقراری ناشی از بیماری کمک کند.[۸۸] افراد مبتلا به زوال عقل ممکن است نتوانند در مورد دردشان صحبت کنند، اما درد، خود یک محرک رایج برای بیقراری است.[۲۰۱] دستبندهای هشدار نوسانات علائم حیاتی پزشکی یا هشدارهای مربوط به حساسیت دارویی در دسترس هستند و میتوانند برای مراقبت از مبتلایان به DLB کمک کننده باشند.[۲۰۲] زمانی که خطر سقوط وجود دارد، ارزیابی ایمنی خانه اهمیت زیادی دارد.[۷۲] نردهها و صندلیهای حمام نیز میتوانند به جلوگیری از سقوط هنگام شستشو استفاده شوند.[۲۰۳]
افراد و مراقبان آنها بهتر است برای بهبود ایمنیِ اتاق خواب برای علائم RBD مشاوره شوند.[۷] با کاهش ارتفاع تخت یا قرار دادن تشک پایین تخت برای کاهش ضربه ناشی از افتادن و برداشتن اجسام نوک تیز از اطراف تخت یا بالشتک کردن آنها، میتوان از آسیبهای ناشی از افتادن یا پریدن از تخت جلوگیری کرد.[۱۱] سیستمهای هشداری برای جلوگیری از خوابگردی مفید هستند و اسلحههای سرد و گرم باید دور از دست، ترجیحاً مکانی قفل شده، نگهداری شوند.[۷] در مواردی نیز ممکن است خوابیدن در مکانی دیگر برای هم اتاقیها ایمنتر باشد.[۷]
توانایی رانندگی میتواند در اوایل DLB به دلیل توهمات بینایی، مسائل حرکتی مربوط به پارکینسونیسم و نوسانات در توانایی شناختی مختل شود و در برخی مواقع رانندگی برای فرد بیمار خطرناک است.[۲۰۴] اعضای خانواده معمولاً تعیین میکنند که چه زمانی بیمار توانایی رانندگی خود از دست داده و بهعنوان بخشی از فرایند مدیریت بیماری از این کار بازداشته شود.[۲۰۳][۲۰۴]
پیشآگهی
[ویرایش]تا سال ۲۰۲۳، هیچ درمانی برای DLB شناخته نشدهاست.[۲][۴][۱۶۱] پیش آگهی DLB به خوبی مورد مطالعه قرار نگرفته و مطالعات اولیه دارای محدودیتهای متعدد تجربی، مانند اندازه نمونه کم و سوگیری انتخاب هستند.[۲۰۵] نسبت به آلزایمر و سایر زوالعقلها، DLB بهطور کلی پر هزینه تر بوده[۲۰۶] و منجر به نرخ بالاتر ناتوانی، بستری شدن در بیمارستان و کاهش امید به زندگی و کیفیت زندگی میشود.[۱۲۰] افسردگی، بیتفاوتی و توهمات بصری یکی از مهمترین عوامل کاهش کیفیت زندگی هستند.[۲۰۷] زمانی که نقص ژن APOE یا زمانی که آلزایمر یا نشانگرهای زیستی آن نیز وجود داشته باشند، زوال ممکن است سریعتر اتفاق بیفتد.[۲۰۸] شدت افت فشار خون ارتواستاتیک نیز پیشآگهی بدتری را نشان میدهد.[۲۰۹] تصور میشد که نقص دیداری-فضایی در اوایل دوره DLB پیشبینیکننده افزایش سرعت زوال باشد،[۲۱۰] اما مطالعات جدیدتر ارتباطی میان این علائم پیدا نکرده و این مسئله را رد نمودند.[۳۶]
تعیین کلی مسیر زوال شناختی در DLB به دلیل نرخ بالای تشخیص از دست رفته دشوار است. دوره تأخیرِ معمولِ یک ساله در ایالات متحده و ۱٫۲ ساله در انگلستان برای تشخیص DLB، به این معنی است که یک خط پایه که از آن میتوان وخامت بیماری را اندازهگیری کرد، وجود ندارد.[۲۱۱] در مقایسه با آلزایمر، که بهتر و سریعتر تشخیص داده میشود، باور بر این است که حافظه برای مدت طولانیتری در DLB حفظ میشود، در حالی که تسلط کلامی میتواند سریعتر از بین برود.[۲۰۸] رایجترین ابزارهای مورد استفاده برای ارزیابی شناخت ممکن است شایعترین نقصهای شناختی در DLB را شناسایی نکنند و ارزیابیهای دیگری مورد نیاز باشد.[۲۱۲] علائم عصبی-روانی در DLB بیشتر از آلزایمر وجود دارند و معمولاً زودتر ظاهر میشوند، بنابراین پیشآگهی بدتری برای افراد مبتلا به DLB وجود دارد که می تواند سبب زوال شناختی سریعتر، نیاز بیشتر به مراقبتهای پزشکی و امید به زندگی پایینتر شود.[۲۰۵][۲۱۳] میزان بستری شدن در بیمارستان در مبتلایان به زوال عقل با اجسام لویی در مقایسه با آلزایمر به دلیل توهمات مکرر، گیجی و به دنبال آن زمینخوردن و عفونت معمولاً بیشتر است.[۲۱۴]
پیشبینی امید به زندگی در DLB دشوار بوده زیرا دادههای مطالعاتی محدودی در دسترس است.[۱۹۴] میزان عمر بیمار می تواند از نقطه شروع بیماری یا نقطه تشخیص تعریف شود.[۲۱۵] از آنجایی که DLB ممکن است به سرعت یا آهسته پیشرفت کند، تنوع زیادی در میزان طول عمر وجود دارد.[۱۲] یک متاآنالیز در سال ۲۰۱۹ میانگین آنالیز بقا پس از تشخیص را ۴٫۱ سال ارزیابی نمود.[۱۲] میانگین به دست آمده از امید به زندگی در DLB، نسبت به آلزایمر، ۱٫۶ سال از زمان تشخیص بیماری کمتر است.[۲۱۶] یک بررسی در سال ۲۰۱۷ امید به زندگی از زمان شروع بیماری را بین ۵٫۵ تا ۷٫۷ سال و بعد از تشخیص را بین ۱٫۹ تا ۶٫۳ سال نشان داد. تفاوت بین آلزایمر و DLB در این شاخص میتواند به این دلیل باشد که تشخیص DLB دشوارتر بوده و ممکن است بعد از گذشت زمان زیادی از بیماری، تشخیص داده شود.[۲۱۵] یک نظرسنجی آنلاین از ۶۵۸ پاسخدهنده نشان داد، پس از تشخیص، بیش از ۱۰٪ افراد مبتلا، در طول یک سال جان خود را از دست دادند، ۱۰٪ بیش از ۷ سال برخی افراد بیش از ۱۰[۱۲] و عدهای دیگر نیز در حدود ۲۰ سال عمر کردند.[۲] زمانی که توهمات بصری، راه رفتن غیرطبیعی و اختلالات شناختی متغیر، در اوایل بیماری وجود داشته باشند، بهطور معمول امید به زندگی کمتر است.[۱۹۴]
وجود ترس و اضطراب برای افراد مبتلا به زوال عقل اجسام لویی و مراقبین آنها بسیار شایع است. طیف وسیعی از پاسخهای احساسی در مورد آینده زندگی فرد دارای اجسام لویی، ترس از توهم، سقوط، کابوسهای شبانه در نتیجه RBD، اثرات خستگی و فرسودگی ذهنی، نوسانات خلقی، افسردگی، دلیریوم و خشونت به وجود میآید.[۲۱۷] برای حفظ روحیه اجتماعی اغلب به مقدار زیادی حمایت فیزیکی از طرف دوستان و خانواده نیاز است. افراد مبتلا به زوال عقل اجسام لویی، نیاز اجتماعی گستردهتری دارند، زیرا به دلیل افزایش نیازهای فیزیکی و ناتوانیهای ذهنی و جسمی حضور در رویدادهای اجتماعی را کمتر تجربه میکنند. ابعادِ گسترده نیاز اجتماعی افراد مبتلا به DLB سبب شده، اطرافیان فرد گزارشهایی از فشارها و تداخلات در زندگی شخصی را که میتواند منجر به نارضایتی و رنجش آنها هنگام برقراری ارتباط با بیمار شود را ارائه دهند.[۲۱۸]
در اواخر بیماری، افراد ممکن است نتوانند از خود مراقبت کنند.[۲۴] زمینخوردن، ناشی از عوامل بسیاری از جمله پارکینسونیسم، دیساتونومی و ضعف، باعث افزایش عوارض و علائم جسمانی در این افراد میشود.[۸] عدم رشد،[۱۲] پنومونی آسپیراسیون[ات] و عارضه دیسفاژی (مشکل در بلع)[اث]، که ناشی از دیساتونومی هستند،[۸۳] بیماریهای قلبی عروقی و سپسیس نیز از علل شایع مرگ و میر در افراد مبتلا به زوال عقل اجسام لویی بهشمار میروند.[۱۶۷]
همهگیرشناسی
[ویرایش]
طبق آمار در سال ۲۰۲۱، تمام زوال عقلهای اجسام لویی به عنوان یک گروه، دومین شکل شایع زوال عقل عصبی پس از آلزایمر هستند.[۲۰] DLB خود یکی از سه نوع شایع زوال عقل، به همراه آلزایمر و دمانس عروقی است.[توضیح ۵][۲][۲۲۴]
معیارهای تشخیصی برای DLB قبل از سال ۲۰۱۷ بسیار خاص اما نه چندان حساس بودند،[۲۲۵] به گونهای که بیش از نیمی از موارد ابتلا، از زمانی که این بیماری کشف شد، نادیده گرفته شدند.[۱۹۳] زوال عقل با اجسام لویی تا سال ۲۰۲۱ کمتر شناخته شده بود،[۱۲۰] از همین رو اطلاعات کمی در مورد اپیدمیولوژی آن وجود دارد.[۱۵۵] بروز و شیوع DLB بهطور دقیق شناخته نشده، اما برآوردها با شناخت بهتر این بیماری از سال ۲۰۱۷ در حال افزایش است.[۲۲۶]
حدود ۰٫۴٪ از افراد بالای ۶۵ سال به DLB مبتلا بوده[۱۳] و بین ۱ تا ۴ نفر از هر ۱۰۰۰ نفر هر ساله به این بیماری مبتلا میشوند.[۲۲۷][۲۲۸] علائم، معمولاً بین ۵۰ تا ۸۰ سالگی بروز میکنند[۱۳] (بهطور متوسط ۷۶ سالگی[۳]) و تشخیص آن قبل از ۶۵ سالگی غیر معمول نیست.[۱۵۵] تصور میشود که DLB در مردان، کمی بیشتر از زنان شایع باشد،[۳] اما این یافته به چالش کشیده شدهاست و در مطالعات مختلف ناسازگاری موجود دارد.[۲۲۹] از آنجا که RBD، بیشتر در مردان تشخیص داده میشود زنان ممکن است در جمعیتهای بالینی (مورد آزمایش) کمتر مورد بررسی قرار گرفته باشند.[۲۲۹] به نظر میرسد که این نشانهٔ بیماری در مردان زیر ۷۵ سال شیوع بیشتری داشته باشد، در حالی که در زنان دیرتر و با اختلالات شناختی بیشتر بروز میکند. مطالعات انجام شده در ژاپن، فرانسه و بریتانیا، برابری بیشتری نسبت به ایالات متحده از نظر ابتلا در مردان و زنان نشان میدهد.[۲۲۹]
تخمین زده میشود که ۱۰ تا ۱۵ درصد از زوال عقلهای تشخیص داده شده از نوع اجسام لویی هستند،[۱۵۵] اما تخمینها برای کسانی که در مطالعات بالینی حضور دارند تا ۲۳ درصد برآورد شدهاست.[۱۶۷] یک مطالعه در کشور فرانسه نشان داد که بروز این بیماری در افراد ۶۵ سال به بالا، تقریباً چهار برابر بیشتر از مطالعات یکسان در آمریکا است (۳۲ آمریکایی در مقابل ۱۱۲ فرانسوی در هر ۱۰۰۰۰۰ نفر در سال)؛ با این تفاوت که مطالعه صورت گرفته در ایالات متحده افراد مبتلا به پارکینسونیسم خفیف یا بدون پارکینسون را از مطالعه خارج نکرد (آنها را در بررسی آماری خود، غیر مبتلا به DLB به حساب آورد)، در حالی که مطالعه مشابه در فرانسه مبتلایان پارکینسونیسم را در ابتدای آزمایش غربالگری نمود.[۱۵۵] هیچیک از مطالعات بهطور سیستماتیک، برای تشخیص RBD ارزیابی نشد، بنابراین در هر دو مطالعه، آمار کمتری از میزان واقعی ابتلا، تشخیص داده شدهاست.[۱۵۵] یک مطالعه خانه به خانه نیز در ژاپن شیوع این بیماری را ۰٫۵۳٪ برای افراد ۶۵ سال به بالا و یک مطالعه مشابه در اسپانیا آمار یکسانی از مبتلایان در این کشور نشان داد.[۲۳۰]
تاریخچه
[ویرایش]فردریک لویی (۱۸۸۵–۱۹۵۰) اولین کسی بود که رسوبات پروتئینی غیرطبیعی را در اوایل دهه ۱۹۰۰ کشف کرد.[۲۳۱][۲۳۲] در سال ۱۹۱۲، با مطالعه بیماری پارکینسون،[۲۳۳] یافتههای اجسام انکلوزیونی درگیر در عصب واگ، هسته بازالیس[اچ] و سایر نواحی مغز را شرح داد.[۲۳۴][۲۳۵] او کتابی به نام «مطالعه تُون و حرکت عضلات» منتشر کرد که نتیجه تحقیقات سیستماتیکش در مورد فیزیولوژی، پزشکی بالینی، آسیبشناسی و پاتوژنز پارکینسون بود. او تنها در سال ۱۹۲۳ و سال بعدش در یک مقاله مختصر، هرگز دوباره به یافتههای خود اشاره نکرد.[۲۳۶]
در سال ۱۹۶۱، اوکازاکی و همکارانش در دو مورد کالبد شکافی، گزارشی از وابستگی زوال عقل با اجسام انکلوزیونیِ لویی[اح] منتشر کردند.[۲۳۱][۲۳۷] زوال عقل با اجسام لویی در یک کالبد شکافی توسط روانپزشک و نوروپاتولوژیست ژاپنی به نام کنجی کوساکا در سال ۱۹۷۶ توضیح داده شد.[۲۳۸][۲۳۹] کوساکا چهار سال بعد برای اولین بار، پس از ۲۰ مورد کالبد شکافی، اصطلاح بیماری اجسام لویی را پیشنهاد کرد.[۴۶][۲۳۷] در ابتدا تصور میشد DLB نادر است تا اینکه در دهه ۱۹۸۰ رنگآمیزی آلفا سینوکلئین کشف و اجسام لویی در کالبد شکافی مغز قابل شناسایی شد، همین مسئله باعث آسانی تشخیص این بیماری و افزایش موارد احتمالی بیماری گردید.[۲۳۱] کوساکا و همکارانش سی و چهار مورد را در ۱۹۸۴ و در بررسی یکسان دیگری، چهار مورد در بریتانیا توسط گیب و همکاران کالبدشکافی و تحلیل شدند. سه سال بعد مجله نورولوژیِ برین[اخ]، توجه جهان غرب را به بررسیهای این فرد ژاپنی جلب کرد[۲۴۰] و سبب شد سال ۱۹۸۸، بورکهارت و همکارانش اولین توصیف کلی از بیماریهای مشتق شده از اجسام لویی را منتشر کنند.[۲۴۱]
با وجود اینکه که محققان ژاپنی، بریتانیایی و آمریکایی در دهه ۱۹۹۰ دریافتند که DLB یک زوال عقل شایع است، همچنان هیچ دستورالعمل تشخیصی مشترک و مورد اعتمادی وجود نداشت و هر گروه، از اصطلاحات و روشهای متفاوتی استفاده میکرد.[۲۴۲] پژوهشگران مختلف به این نتیجه رسیدند، پیشبرد صحیح و علمی تحقیقات بر روی این بیماری رویکردی مشارکتی نیاز دارد،[۲۴۳] به همین علت کنسرسیوم DLB تأسیس شد و در سال ۱۹۹۶، اصطلاح زوال عقل با اجسام لویی مورد توافق واقع شد.[۹۳] همچنین به مرور زمان اولین معیارها برای تشخیص و مدیریت DLB مورد بررسی و توافق قرار گرفت.[۴۶]
دو اکتشافات سال ۱۹۹۷، اهمیت اجسام انکلوزیونی لویی را در فرایندهای زوال عصبی نشان داد:[۲۴۴]
- جهش در ژن SNCA که پروتئین آلفا سینوکلئین را رمزگذاری میکند و در مبتلایان به بیماری پارکینسون دیده میشود.
- کشف خاصیت ایمونواسی اجسام و نوریتهای لویی در آلفا-سینوکلئین که سبب شناخته شدن تجمع آلفا سینوکلئین به عنوان اولین عامل شکلگیری سینوکلئینوپاتی شد.
بین سالهای ۱۹۹۵ تا ۲۰۰۵، کنسرسیوم DLB سه گزارش اجماعی در مورد DLB صادر کرد.[۲۴۵] DLB در ویرایش چهارم DSM (DSM-IV-TR، منتشر شده در سال ۲۰۰۰) تحت عنوان «زوال عقل به دلیل سایر شرایط عمومی پزشکی» نام برده شد. در دهه ۲۰۱۰ نیز بررسی احتمال وجود علت ژنتیکی در این بیماری، آغاز گردید.[۹۶] چهارمین گزارش کنسرسیوم در سال ۲۰۱۷ صادر شد و وزن تشخیصی RBD و 123I-MIBG اسکن میوکارد، برای تشخیص DLB، افزایش داد.[۲۴۶]
جامعه و فرهنگ
[ویرایش]
نویسنده و شاعر بریتانیایی مروین پیک در سال ۱۹۶۸ درگذشت و پس از مرگ در مطالعهای که در سال ۲۰۰۳ توسط جاما نورولوژی[اد] صورت گرفت، به عنوان یک مورد احتمالی مبتلا به DLB، تشخیص داده شد.[۲۴۹] این مطالعات بر اساس نشانههایی در کار و نامههای وی از جمله زوال پیشرونده، کاهش تواناییهای شناختی، بدتر شدن عملکرد دیداری-فضایی، کاهش دامنه توجه، توهمات و هذیان، وجود داشت، به این نتیجه رسید که مروین پیک ممکن است، اولین فرد مشهور باشد که DLB علت احتمالی مرگ آن بودهاست.[۲۴۹]
رابین ویلیامز، بازیگر و کمدین آمریکایی، زمان خودکشی در ۱۱ اوت ۲۰۱۴، به بیماری پارکینسون مبتلا بود.[۲۵۰] به گفته همسرش، ویلیامز افسردگی، اضطراب و پارانویای فزاینده را به خاطر بیماری اش تجربه میکرد؛[۲۴۷] او در ادامه عنوان نمود، کالبد شکافی ویلیامز، بیماری منتشر اجسام لویی را تشخیص دادهاست.[۲۵۰][۲۴۷][۲۴۸] در زمان انتشار گزارش کالبد شکافی علت بیماری، زوال عقل منتشر اجسام لویی در نظر گرفته شده بود.[۲۵۱] دنیس دیکسون، سخنگوی انجمن زوال عقل اجسام لویی، این تمایز را اینگونه توضیح داد: «دمانس منتشر اجسام لویی که معمولاً بیماری منتشر اجسام لویی نامیده میشود، به زمینه اساسی بیماری اشاره دارد.»[۲۵۱] به گفته دیکسون، «اجسام لویی بهطور کلی در توزیع داخل مغز محدود هستند، اما در DLB، اجسام لویی بهطور گسترده در سراسر مغز پخش میشوند، همانگونه که در مورد رابین ویلیامز وجود داشت.»، علت بیماری زوال عقل با اجسام لویی تشخیص داده شد.[۲۵۱] همچنین مک کیث، استاد و محقق زوال عقل اجسام لویی، نیز اظهار داشت که علائم ویلیامز و یافتههای کالبد شکافی، ابتلای او به DLB را نشان دادهاست.[۲۵۲]
پژوهشهای جدید
[ویرایش]شناسایی بیومارکرهای پرودرومال در DLB، باعث آغاز سریعتر درمان میشود،[۲۵۳] توانایی غربالگری افراد و اندازهگیری اثربخشی در کارآزماییهای بالینی را بهبود میبخشد[۲۵۴] و به خانوادهها و پزشکان کمک میکند برای مداخلات اولیه و آگاهی از عوارض جانبی بالقوهٔ استفاده از داروهای ضد روان پریشی برنامهریزی کنند.[۲۵۵] معیارهایی در سال ۲۰۲۰ ایجاد شد تا به محققان کمک کند DLB را در مرحله پیش زوال عقل تشخیص دهند.[۲۸][۲۵۶] سه سندرم پیشنهادی پرودرومال برای DLB شامل اختلال شناختی خفیف همراه با اجسام لویی (MCI-LB)، دلیریوم همراه با شروع DLB و اختلالات روانی همراه با DLB میشود که ممکن است با یک دیگر همپوشانی نیز داشته باشند.[۲۵۷] از سال ۲۰۲۰، موضع گروه مطالعات تشخیصی DLB این است که معیارهای MCI-LB را میتوان برای تشخیص این بیماری توصیه کرد، اما تشخیص DLB که با دلریوم و اختلالات روانی همراه میگردد بدون نشانگرهای زیستی دقیقتر، دشوار است.[۲۵۷] با این وجود، اختلالات روانی دیررس شدید میتواند نشانهای برای در نظر گرفتن زوال عقل اجسام لویی باشد[۲۵۸] و دلیریوم غیرقابل توضیح، احتمال DLB پرودرومال را افزایش میدهد.[۱۳۳]
تشخیص DLB با استفاده از معیارهای کنسرسیوم DLB انجام میشود، اما یک مطالعه در سال ۲۰۱۷ روی نمونههای پوستی از ۱۸ فرد مبتلا به DLB نشان داد که همه آنها دارای رسوبات آلفا سینوکلئین فسفریله بودند، در حالی که هیچیک از آن بررسی و نظارتی بر روی پوست خود نکرده بودند،[۲۵۹] این تحقیق کوچک نشان میدهد، در صورت بررسی و تأیید پذیری، پوست نیز میتواند پتانسیل تشخیصی برای DLB ارائه دهد.[۲۶۰] سایر نشانگرهای زیستی بالقوهٔ در حال ارزیابی، الکتروانسفالوگرافی کمی، بررسی تصویربرداری از ساختارهای مغزی و اندازهگیری سینوکلئینوپاتی در مایع مغزی-نخاعی هستند.[۲۶۱] آزمایشهای تجاری بیوپسی پوست برای DLB در ایالات متحده وجود دارد و FDA مجوز «پیشرفت موفقیتآمیز[توضیح ۶]» را به آزمایش مایع مغزی-نخاعی دادهاست؛ با این حال، این آزمایشها بهطور گسترده در دسترس نیستند و تا سال ۲۰۲۲، نقش این آزمایشها در فرایند بالینی ثابت نشدهاند.[۲۶۳][۲۶۴] بررسیهای دیگر برای تشخیص آلفا سینوکلئین به وسیله آزمایش خون نیز همچنان در دست مطالعه هستند.[۲۶۴]
تمرین ذهن، تحریک عمقی مغز و تحریک جریان مستقیم جمجمهای در بیماری پارکینسون و آلزایمر بیشتر از زوال عقل با اجسام لویی مورد مطالعه قرار گرفتهاست و میتوانند درمانهایی بالقوه برای DLB باشند.[۲۵۳] چهار کارآزمایی بالینی برای درمان علائم پارکینسون در DLB به وسیله این دارو تا سال ۲۰۲۱ صورت گرفته، اما مطالعات بیشتری برای ارزیابی خطر در مقابل فواید، عوارض جانبی و استفاده طولانیمدت مورد نیاز است.[۱۷۸]
استراتژیهای مداخله در حال تحقیق، شامل اصلاح سِیر بیماری با استفاده از ایمونوتراپی، ژندرمانی، درمان با سلولهای بنیادی و کاهش تجمع آمیلوئید بتا یا آلفا سینوکلئین است. اغلب درمانهای تحت مطالعه از سال ۲۰۱۹ با هدف کاهش سطح آلفا سینوکلئین در مغز (با داروهای دارویی نیز آمبروکسول، NPT200-11 و E2027) یا استفاده از ایمونوتراپی برای کاهش التهاب عصبی گسترده ناشی از رسوبات آلفا سینوکلئین صورت پذیرفتهاست.[۲۵۳][۲۶۵]
جستارهای وابسته
[ویرایش]یادداشتها
[ویرایش]- ↑ پارکینسون پلاس سندرمی است که علائم و نشانههای بیماری پارکینسون را همراه با اختلالاتی دیگری نظیر DLB، آتروفی سیستم چندگانه[الف]، فلج فوقهستهای پیشرونده[ب]، زوالعصبی کورتیکوبازال[پ] و برخی شرایط دیگر، شامل میشود.[۱۷][۱۸]
- ↑ ۲٫۰ ۲٫۱ نواحی مغز و عملکردهای تحت تأثیر بیماری:
- قشر مغز - تفکر، ادراک و زبان؛
- دستگاه لیمبیک - احساسات و رفتار؛
- هیپوکامپ - حافظه؛
- مغز میانی و عقدههای قاعدهای - حرکت؛
- ساقه مغز - خواب، هشیاری، و اختلالات عملکرد خودکار؛
- پیاز بویایی - بویایی.
- همچنین هیپوتالاموس، نخاع و سیستم عصبی محیطی - اختلالات عملکرد خودکار.[۲۵]
- ↑ نهادهای انجمنهای اعصاب اروپا، انجمن عصبشناسی اروپا و انجمن سایکوفارماکولوژی بریتانیا نیز دستورالعملهای تشخیصی طرح کردهاند، اما این معیارها بهطور خاص برای DLB ایجاد نشده و دستورالعملهای کنسرسیوم DLB بیشترین استفاده و استناد را دارند.[۱۲۶]
- ↑ پرسشنامههایی مانند پرسشنامه غربالگری اختلال رفتاری خواب REM یا (RBDSQ)، پرسشنامه رفتاری خواب REM – هنگ کنگ (RBD-HK)، پرسشنامه خواب مایو (MSQ)، پرسشنامه رفتاری خواب REM اینسبروک و تک سؤال اختلال رفتاری خواب، پرسشنامههای تأیید شده برای تشخیص این اختلال هستند.[۱۳۶]
- ↑ کوساکا در سال ۲۰۱۷ مینویسد: «زوال عقل با اجسام لویی (DLB) اکنون به عنوان دومین زوال عقل شایع پس از بیماری آلزایمر (AD) شناخته شدهاست. از بین انواع زوال عقل، AD حدود ۵۰٪، DLB حدوداً ۲۰٪ و دمانس عروقی (VD) حدود ۱۵٪ را تشکیل میدهد؛ بنابراین AD ,DLB و VD در حال حاضر به عنوان شایعترین زوال عقلها در نظر گرفته میشوند.»[۲۲۰] مؤسسه ملی اختلالات عصبی و سکته مغزی در سال ۲۰۲۰ زوال عقل اجسام لویی را «یکی از شایعترین دمانسها» و فراوانترین زوال عقل، پس از بیماری آلزایمر و زوال عقل عروقی در نظر گرفتهاست.[۲] هرشی (۲۰۱۹) بر اساس ارزیابیهای خود میگوید: «DLB سومین بیماری عصبی شایع پس بیماری آلزایمر و پارکینسون است.»[۲۲۱] تساماکیس و مولر در تحقیقاتی مشترک در سال ۲۰۲۱، DLB را دومین شکل شایع زوال عقل عصبی تشخیص دادهاند[۲۲۲] و آرمسترانگ (۲۰۲۱) نیز زوال عقل اجسام لویی را دومین زوال عقل دژنراتیو پس از بیماری آلزایمر (AD) در نظر گرفتهاست (DLB تنها بخشی از جامعه تشخیصی او بودهاست).[۲۲۳]
- ↑ FDA زمانی که شواهد با کیفیتی از اثربخشی درمان برای یک بیماری خاص وجود نداشته باشد و آزمایشهای بالینی اولیه نشان دهد که این درمان ممکن است مزایای مدیریتی قابل توجهی نسبت به گزینههای موجود برای بیماران مبتلا به بیماریهای جدی یا تهدیدکننده حیات ارائه دهد، به آن مجوز «پیشرفت موفق آمیز» میدهد.[۲۶۲]
واژهنامه
[ویرایش]- ↑ Multiple system atrophy
- ↑ Progressive supranuclear palsy
- ↑ Corticobasal degeneration
- ↑ Synucleinopathy
- ↑ Konstantinos Tsamakis
- ↑ Christoph Mueller
- ↑ McKeith
- ↑ Atonia
- ↑ Selection bias
- ↑ Recall bias
- ↑ Bradykinesia
- ↑ Orthostatic hypotension
- ↑ Gastroparesis
- ↑ Tauopathy
- ↑ 123iodine-metaiodobenzylguanidine (123I-MIBG)
- ↑ Neuropsychological test
- ↑ Clinician Assessment of Fluctuation
- ↑ Mayo Fluctuation Composite Score
- ↑ Digit-span
- ↑ Spatial span
- ↑ Frontal Assessment Battery
- ↑ Wisconsin Card Sorting Test
- ↑ REM Sleep Behavior Disorder Single-Question Screen
- ↑ Progressive supranuclear palsy
- ↑ Corticobasal degeneration
- ↑ Corticobasal syndrome
- ↑ Temporoparietal junction
- ↑ Neuropsychiatry
- ↑ Dopamine receptor D2
- ↑ Benadryl
- ↑ Armodafinil
- ↑ Grading of Recommendations Assessment, Development and Evaluation
- ↑ Midodrine
- ↑ Muscarinic antagonist
- ↑ Active surveillance
- ↑ Aspiration pneumonia
- ↑ Dysphagia
- ↑ Alcohol-related dementia
- ↑ Nucleus basalis
- ↑ Lewy-type inclusions
- ↑ Brain: A Journal of Neurology
- ↑ JAMA Neurology
منابع
[ویرایش]- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ ۱٫۱۲ ۱٫۱۳ ۱٫۱۴ ۱٫۱۵ ۱٫۱۶ ۱٫۱۷ (McKeith et al. 2017, Table 1, p. 90.)
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ ۲٫۱۱ ۲٫۱۲ "Lewy body dementia: Hope through research". National Institute of Neurological Disorders and Stroke. US National Institutes of Health. January 10, 2020. Archived from the original on April 30, 2021. Retrieved March 18, 2020.
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ ۳٫۳ ۳٫۴ ۳٫۵ Hershey & Coleman-Jackson 2019, p. 309.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ "Dementia with Lewy bodies information page". National Institute of Neurological Disorders and Stroke. March 27, 2019. Archived from the original on March 18, 2021. Retrieved March 18, 2020.
- ↑ ۵٫۰۰ ۵٫۰۱ ۵٫۰۲ ۵٫۰۳ ۵٫۰۴ ۵٫۰۵ ۵٫۰۶ ۵٫۰۷ ۵٫۰۸ ۵٫۰۹ Gomperts 2016, p. 437.
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ ۶٫۳ ۶٫۴ Walker et al. 2015, p. 1685.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ ۷٫۳ St Louis & Boeve 2017, p. 1730.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ ۸٫۴ ۸٫۵ Taylor et al. 2020, sec. "Motor symptoms".
- ↑ ۹٫۰۰ ۹٫۰۱ ۹٫۰۲ ۹٫۰۳ ۹٫۰۴ ۹٫۰۵ ۹٫۰۶ ۹٫۰۷ ۹٫۰۸ ۹٫۰۹ ۹٫۱۰ ۹٫۱۱ ۹٫۱۲ Taylor et al. 2020, sec. "Autonomic dysfunction".
- ↑ Watts et al. 2022, p. 260, "review of pharmacological interventions".
- ↑ ۱۱٫۰ ۱۱٫۱ ۱۱٫۲ ۱۱٫۳ ۱۱٫۴ ۱۱٫۵ ۱۱٫۶ ۱۱٫۷ ۱۱٫۸ Taylor et al. 2020, sec. "Sleep disturbances".
- ↑ ۱۲٫۰ ۱۲٫۱ ۱۲٫۲ ۱۲٫۳ ۱۲٫۴ Armstrong 2021, sec. "Progression".
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ ۱۳٫۳ Levin et al. 2016, p. 62.
- ↑ Weil et al. 2017, Abstract.
- ↑ Taylor et al. 2020, Abstract.
- ↑ Levin et al. 2016, p. 61.
- ↑ Nuytemans et al. 2010, "Parkinson plus".
- ↑ Olfati et al. 2019, "Parkinson-Plus syndromes".
- ↑ Goedert, Jakes & Spillantini 2017, p. S56.
- ↑ ۲۰٫۰ ۲۰٫۱ ۲۰٫۲ ۲۰٫۳ ۲۰٫۴ Armstrong 2021, sec. "Vocabulary".
- ↑ Menšíková et al. 2022, Abstract and sec. "Conclusions".
- ↑ Armstrong 2019, p. 128.
- ↑ ۲۳٫۰ ۲۳٫۱ ۲۳٫۲ Boot 2015, Abstract.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ ۲۴٫۳ "What is Lewy body dementia?". National Institute on Aging. US National Institutes of Health. June 27, 2018. Archived from the original on October 6, 2016. Retrieved March 18, 2020.
- ↑ (Kosaka 2017, Orimo S, Chapter 9, p. 113)
- ↑ ۲۶٫۰ ۲۶٫۱ Kosaka 2017, Orimo S, Chapter 9, pp. 111–112.
- ↑ ۲۷٫۰ ۲۷٫۱ ۲۷٫۲ Palma & Kaufmann 2018, pp. 373–374.
- ↑ ۲۸٫۰ ۲۸٫۱ ۲۸٫۲ ۲۸٫۳ McKeith et al. 2020, p. 743.
- ↑ ۲۹٫۰ ۲۹٫۱ Armstrong 2021, sec. "Prodromal DLB".
- ↑ ۳۰٫۰ ۳۰٫۱ ۳۰٫۲ Donaghy, O'Brien & Thomas 2015, pp. 264–265.
- ↑ McKeith et al. 2020, p. 745.
- ↑ ۳۲٫۰۰ ۳۲٫۰۱ ۳۲٫۰۲ ۳۲٫۰۳ ۳۲٫۰۴ ۳۲٫۰۵ ۳۲٫۰۶ ۳۲٫۰۷ ۳۲٫۰۸ ۳۲٫۰۹ ۳۲٫۱۰ ۳۲٫۱۱ ۳۲٫۱۲ ۳۲٫۱۳ ۳۲٫۱۴ ۳۲٫۱۵ ۳۲٫۱۶ ۳۲٫۱۷ ۳۲٫۱۸ ۳۲٫۱۹ ۳۲٫۲۰ ۳۲٫۲۱ ۳۲٫۲۲ ۳۲٫۲۳ ۳۲٫۲۴ ۳۲٫۲۵ ۳۲٫۲۶ McKeith et al. 2017, sec. "Summary of changes", pp. 88–92.
- ↑ St Louis & Boeve 2017, p. 1727.
- ↑ Matar et al. 2020, sec. "Introduction".
- ↑ ۳۵٫۰ ۳۵٫۱ O'Dowd et al. 2019, sec. "Prevalence and natural history".
- ↑ ۳۶٫۰ ۳۶٫۱ ۳۶٫۲ ۳۶٫۳ Tsamakis & Mueller 2021, p. 4.
- ↑ Matar et al. 2020, sec. "Semiology of cognitive fluctuations".
- ↑ O'Dowd et al. 2019, sec. "Prevalence and natural history", citing McKeith, 2002.
- ↑ Tsamakis & Mueller 2021, pp. 4–5.
- ↑ ۴۰٫۰ ۴۰٫۱ ۴۰٫۲ ۴۰٫۳ ۴۰٫۴ Hershey & Coleman-Jackson 2019, p. 310.
- ↑ Tsamakis & Mueller 2021, pp. 1٬3.
- ↑ Karantzoulis & Galvin 2011, p. 1584.
- ↑ Hershey & Coleman-Jackson 2019, p. 314.
- ↑ Diamond 2013.
- ↑ ۴۵٫۰ ۴۵٫۱ ۴۵٫۲ ۴۵٫۳ Gomperts 2016, p. 436.
- ↑ ۴۶٫۰ ۴۶٫۱ ۴۶٫۲ ۴۶٫۳ Tousi 2017, sec. "Introduction".
- ↑ St Louis & Boeve 2017, p. 1724.
- ↑ ۴۸٫۰ ۴۸٫۱ St Louis, Boeve & Boeve 2017, p. 651.
- ↑ St Louis, Boeve & Boeve 2017, pp. 645, 651.
- ↑ Arnaldi et al. 2017, p. 87.
- ↑ ۵۱٫۰ ۵۱٫۱ ۵۱٫۲ Boot 2015, sec. "Rapid eye movement sleep behavior disorder".
- ↑ ۵۲٫۰ ۵۲٫۱ St Louis & Boeve 2017, p. 1729.
- ↑ Armstrong 2019, p. 133.
- ↑ Arnaldi et al. 2017, p. 92.
- ↑ ۵۵٫۰ ۵۵٫۱ ۵۵٫۲ Walker et al. 2015, p. 1690.
- ↑ ۵۶٫۰ ۵۶٫۱ ۵۶٫۲ ۵۶٫۳ St Louis, Boeve & Boeve 2017, p. 647.
- ↑ ۵۷٫۰ ۵۷٫۱ ۵۷٫۲ ۵۷٫۳ Gomperts 2016, p. 438.
- ↑ ۵۸٫۰ ۵۸٫۱ ۵۸٫۲ St Louis & Boeve 2017, p. 1728.
- ↑ ۵۹٫۰ ۵۹٫۱ ۵۹٫۲ ۵۹٫۳ St Louis, Boeve & Boeve 2017, p. 646.
- ↑ Aminoff, Greenberg & Simon 2005, pp. 241–245.
- ↑ ۶۱٫۰ ۶۱٫۱ Ogawa et al. 2018, pp. 145–155.
- ↑ ۶۲٫۰ ۶۲٫۱ Gomperts 2016, p. 447.
- ↑ Tousi 2017, sec. "Parkinsonism".
- ↑ Hansen et al. 2019, p. 635.
- ↑ Burghaus et al. 2012, pp. 149–151.
- ↑ ۶۶٫۰ ۶۶٫۱ Hershey & Coleman-Jackson 2019, p. 313.
- ↑ Burghaus et al. 2012, pp. 152–153.
- ↑ ۶۸٫۰ ۶۸٫۱ Pezzoli et al. 2017, sec. "Introduction".
- ↑ ۶۹٫۰ ۶۹٫۱ ۶۹٫۲ ۶۹٫۳ ۶۹٫۴ Tousi 2017, sec. "Hallucinations and delusions".
- ↑ ۷۰٫۰ ۷۰٫۱ ۷۰٫۲ Weil et al. 2017, Table 1.
- ↑ ۷۱٫۰ ۷۱٫۱ ۷۱٫۲ Boot 2015, sec. "Hallucinations and delusions".
- ↑ ۷۲٫۰۰ ۷۲٫۰۱ ۷۲٫۰۲ ۷۲٫۰۳ ۷۲٫۰۴ ۷۲٫۰۵ ۷۲٫۰۶ ۷۲٫۰۷ ۷۲٫۰۸ ۷۲٫۰۹ ۷۲٫۱۰ ۷۲٫۱۱ ۷۲٫۱۲ McKeith et al. 2017, sec. "Clinical management", pp. 93–95.
- ↑ Palma & Kaufmann 2018, pp. 373–377.
- ↑ Palma & Kaufmann 2018, p. 381.
- ↑ ۷۵٫۰ ۷۵٫۱ Palma & Kaufmann 2018, p. 382.
- ↑ ۷۶٫۰ ۷۶٫۱ Palma & Kaufmann 2018, p. 384.
- ↑ ۷۷٫۰ ۷۷٫۱ Tousi 2017, Figure 1.
- ↑ ۷۸٫۰ ۷۸٫۱ Walker et al. 2015, p. 1686.
- ↑ Kosaka 2017, Yamada M, Chapter 12, p. 157.
- ↑ Palma & Kaufmann 2018, p. 373.
- ↑ ۸۱٫۰ ۸۱٫۱ ۸۱٫۲ Palma & Kaufmann 2018, pp. 378–382.
- ↑ Zweig & Galvin 2014.
- ↑ ۸۳٫۰ ۸۳٫۱ Palma & Kaufmann 2018, p. 378.
- ↑ Palma & Kaufmann 2018, pp. 382–384.
- ↑ Karantzoulis & Galvin 2011, p. 1585.
- ↑ ۸۶٫۰ ۸۶٫۱ ۸۶٫۲ ۸۶٫۳ ۸۶٫۴ ۸۶٫۵ Taylor et al. 2020, sec. "Neuropsychiatric symptoms".
- ↑ ۸۷٫۰ ۸۷٫۱ Tousi 2017, sec. "Anxiety and depression".
- ↑ ۸۸٫۰ ۸۸٫۱ Boot 2015, sec. "Agitation and behavioral disturbances".
- ↑ ۸۹٫۰ ۸۹٫۱ ۸۹٫۲ Burghaus et al. 2012, p. 153.
- ↑ ۹۰٫۰ ۹۰٫۱ ۹۰٫۲ ۹۰٫۳ ۹۰٫۴ Walker et al. 2015, p. 1692.
- ↑ ۹۱٫۰ ۹۱٫۱ ۹۱٫۲ ۹۱٫۳ ۹۱٫۴ ۹۱٫۵ ۹۱٫۶ ۹۱٫۷ Walker et al. 2015, p. 1684.
- ↑ ۹۲٫۰ ۹۲٫۱ Arnaldi et al. 2017, p. 89.
- ↑ ۹۳٫۰ ۹۳٫۱ Tahami Monfared et al. 2019, p. 290.
- ↑ ۹۴٫۰ ۹۴٫۱ Linard et al. 2022, p. 1.
- ↑ Linard et al. 2022, pp. 1, 9.
- ↑ ۹۶٫۰ ۹۶٫۱ Weil et al. 2017, sec. "Genetics".
- ↑ Hansen et al. 2019, p. 637.
- ↑ Berge et al. 2014, pp. 1227–1231.
- ↑ Hansen et al. 2019, p. 645.
- ↑ Arnaldi et al. 2017, p. 82.
- ↑ Kosaka 2017, College L, Chapter 11, pp. 141–142.
- ↑ Gomperts 2016, p. 449.
- ↑ Kosaka 2017, Taylor JP, Chapter 13, pp. 23–24.
- ↑ Hansen et al. 2019, p. 636.
- ↑ Siderowf et al. 2018, p. 529.
- ↑ ۱۰۶٫۰ ۱۰۶٫۱ ۱۰۶٫۲ Weil et al. 2017, sec. "Introduction".
- ↑ Weil et al. 2017, sec. "Not 'prion-like' spread?".
- ↑ ۱۰۸٫۰ ۱۰۸٫۱ Hansen et al. 2019, p. 639.
- ↑ Siderowf et al. 2018, p. 531.
- ↑ ۱۱۰٫۰ ۱۱۰٫۱ Villemagne et al. 2018, pp. 225–236.
- ↑ Hershey & Coleman-Jackson 2019, pp. 310–311.
- ↑ Hansen et al. 2019, p. 644.
- ↑ Burghaus et al. 2012, p. 149.
- ↑ Goedert & Spillantini 2017.
- ↑ Walker et al. 2015, pp. 1684–1687.
- ↑ Yamada et al. 2020, p. 2.
- ↑ ۱۱۷٫۰ ۱۱۷٫۱ ۱۱۷٫۲ ۱۱۷٫۳ Tousi 2017, Abstract.
- ↑ Bentley et al. 2021, sec. 4.1, p. 4639; sec. "Discussion", p. 4641.
- ↑ ۱۱۹٫۰ ۱۱۹٫۱ ۱۱۹٫۲ Armstrong 2021, sec. "Diagnosis".
- ↑ ۱۲۰٫۰ ۱۲۰٫۱ ۱۲۰٫۲ Tsamakis & Mueller 2021, p. 2.
- ↑ McKeith et al. 2017, sec. "Pathology", p. 95.
- ↑ Armstrong 2021, sec. "Pathology and co-pathology".
- ↑ ۱۲۳٫۰ ۱۲۳٫۱ Bentley et al. 2021, sec. 4.1, p. 4639.
- ↑ Gomperts 2016, pp. 457–458.
- ↑ McKeith et al. 2005, pp. 1863–1872.
- ↑ (Tahami Monfared et al. 2019, p. 294)
- ↑ Chatzikonstantinou et al. 2021, sec."Electroencephalogram in dementia with Lewy bodies".
- ↑ Walker, Stefanis & Attems 2019, pp. 467–474.
- ↑ "International Statistical Classification of Diseases and Related Health Problems 10th Revision: Chapter VI: Diseases of the nervous system". World Health Organization. 2010. Archived from the original on March 31, 2020. Retrieved August 7, 2020.
- ↑ ۱۳۰٫۰ ۱۳۰٫۱ "Diagnosing dementia". National Institute on Aging. US National Institutes of Health. May 17, 2017. Archived from the original on October 3, 2016. Retrieved April 6, 2018.
- ↑ Haider & Dulebohn 2018.
- ↑ ۱۳۲٫۰ ۱۳۲٫۱ Tsamakis & Mueller 2021, pp. 2–4.
- ↑ ۱۳۳٫۰ ۱۳۳٫۱ ۱۳۳٫۲ Tsamakis & Mueller 2021, p. 5.
- ↑ Kosaka 2017, Mori E, Chapter 6, p. 74.
- ↑ Kosaka 2017, Mori E, Chapter 6, pp. 75–76.
- ↑ ( et al. 2017, p. 647)
- ↑ Tousi 2017, sec. "REM sleep behavior disorder".
- ↑ McKeith et al. 2020, p. 747.
- ↑ Kosaka 2017, Yamada M, Chapter 12, p. 162.
- ↑ ۱۴۰٫۰ ۱۴۰٫۱ ۱۴۰٫۲ Chung & Kim 2015, pp. 55–66.
- ↑ Bousiges & Blanc 2022, sec. "Abstract".
- ↑ "Caregiving briefs: Genetics" (PDF). Lewy Body Dementia Association. 2015. Archived from the original (PDF) on April 21, 2018. Retrieved April 20, 2018.
- ↑ ۱۴۳٫۰ ۱۴۳٫۱ ۱۴۳٫۲ ۱۴۳٫۳ Mueller et al. 2017, p. 392.
- ↑ McKeith et al. 2020, p. 749.
- ↑ Kosaka 2017, Orimo S, Chapter 9, p. 12.
- ↑ "Vascular contributions to cognitive impairment and dementia". National Institute of Aging. US National Institutes of Health. December 31, 2017. Archived from the original on April 13, 2018. Retrieved April 12, 2018.
- ↑ Gomperts 2016, pp. 436–437.
- ↑ Karantzoulis & Galvin 2011, pp. 1582–1587.
- ↑ Tahami Monfared et al. 2019, pp. 292–293.
- ↑ Karantzoulis & Galvin 2011, p. 1582.
- ↑ Walker et al. 2015, pp. 1686–1687.
- ↑ Karantzoulis & Galvin 2011, pp. 1583–1584.
- ↑ Siderowf et al. 2018, p. 528.
- ↑ Gomperts 2016, p. 444.
- ↑ ۱۵۵٫۰ ۱۵۵٫۱ ۱۵۵٫۲ ۱۵۵٫۳ ۱۵۵٫۴ ۱۵۵٫۵ ۱۵۵٫۶ Walker et al. 2015, p. 1683.
- ↑ Gomperts 2016, p. 442.
- ↑ Gomperts 2016, p. 448.
- ↑ ۱۵۸٫۰ ۱۵۸٫۱ Gomperts 2016, pp. 447–448.
- ↑ Tahami Monfared et al. 2019, p. 296.
- ↑ Yamada et al. 2020, p. 7.
- ↑ ۱۶۱٫۰ ۱۶۱٫۱ ۱۶۱٫۲ Armstrong 2021, sec. "Management".
- ↑ ۱۶۲٫۰ ۱۶۲٫۱ Hershey & Coleman-Jackson 2019, p. 317.
- ↑ Abdelnour et al. 2023, sec. "Introduction".
- ↑ ۱۶۴٫۰ ۱۶۴٫۱ Tahami Monfared et al. 2019, p. 298.
- ↑ Taylor et al. 2020, sec. "Introduction".
- ↑ Taylor et al. 2020, sec. "Conclusions and future directions".
- ↑ ۱۶۷٫۰ ۱۶۷٫۱ ۱۶۷٫۲ ۱۶۷٫۳ ۱۶۷٫۴ Lin & Truong 2019, pp. 144–150.
- ↑ "استفاده از داروهای ضدروانپریشی … با خطرات مختلف از جمله مرگ و میر همراه است … با توجه به افزایش خطر واکنش حساسیتی جدی، باید در صورت امکان از مصرف آنها اجتناب شود." (McKeith et al. 1992, pp. 673–674.) As cited in (McKeith et al. 2017, sec. "Clinical management", pp. 93–95.)
- ↑ Boot et al. 2013, p. 746.
- ↑ ۱۷۰٫۰ ۱۷۰٫۱ Gomperts 2016, Table 4-6, p. 457. Archive توسط Wayback Machine (بایگانیشده ژوئیه ۲۰, ۲۰۲۱)
- ↑ Gomperts 2016, p. 458.
- ↑ Boot et al. 2013, p. 749.
- ↑ ۱۷۳٫۰ ۱۷۳٫۱ ۱۷۳٫۲ ۱۷۳٫۳ ۱۷۳٫۴ Taylor et al. 2020, sec. "Cognitive impairment".
- ↑ ۱۷۴٫۰ ۱۷۴٫۱ ۱۷۴٫۲ ۱۷۴٫۳ Walker et al. 2015, p. 1691.
- ↑ Boot 2015, sec. "Cognitive symptoms".
- ↑ Boot et al. 2013, p. 756.
- ↑ Boot 2015, sec. "Sleep symptoms".
- ↑ ۱۷۸٫۰ ۱۷۸٫۱ Tousi & Leverenz 2021, Abstract.
- ↑ Watts et al. 2022, p. 207.
- ↑ Hershey & Coleman-Jackson 2019, p. 315.
- ↑ ۱۸۱٫۰ ۱۸۱٫۱ ۱۸۱٫۲ Watts et al. 2022, p. 206.
- ↑ ۱۸۲٫۰ ۱۸۲٫۱ St Louis & Boeve 2017, p. 1731.
- ↑ ۱۸۳٫۰ ۱۸۳٫۱ ۱۸۳٫۲ St Louis, Boeve & Boeve 2017, p. 653.
- ↑ Palma & Kaufmann 2018, pp. 375–377.
- ↑ ۱۸۵٫۰ ۱۸۵٫۱ ۱۸۵٫۲ Connors et al. 2018, sec. "Discussion".
- ↑ Walker et al. 2015, pp. 1692–1693.
- ↑ Palma & Kaufmann 2018, pp. 374–375.
- ↑ Bartels et al. 2007, sec. "Aquatic exercise".
- ↑ Palma & Kaufmann 2018, p. 375.
- ↑ ۱۹۰٫۰ ۱۹۰٫۱ Tahami Monfared et al. 2019, p. 297.
- ↑ Boot 2015, sec. "Movement symptoms".
- ↑ Bentley et al. 2021, sec. 4.3, p. 4640.
- ↑ ۱۹۳٫۰ ۱۹۳٫۱ Vann Jones & O'Brien 2014, sec. "Introduction".
- ↑ ۱۹۴٫۰ ۱۹۴٫۱ ۱۹۴٫۲ Mueller et al. 2017, p. 393.
- ↑ Cheng 2017, p. 64.
- ↑ ۱۹۶٫۰ ۱۹۶٫۱ Boot et al. 2013, p. 745.
- ↑ "Caregiving brief: Behavioral symptoms" (PDF). Lewy Body Dementia Association. 2015. Archived from the original (PDF) on April 21, 2018. Retrieved April 20, 2018.
- ↑ Burghaus et al. 2012, p. 156.
- ↑ Burghaus et al. 2012, p. 152.
- ↑ "Caregiving brief: Medications in Lewy body dementia" (PDF). Lewy Body Dementia Association. 2015. Archived from the original (PDF) on April 21, 2018. Retrieved April 20, 2018.
- ↑ Boot et al. 2013, p. 748.
- ↑ Boot et al. 2013, p. 759.
- ↑ ۲۰۳٫۰ ۲۰۳٫۱ Boot et al. 2013, p. 758.
- ↑ ۲۰۴٫۰ ۲۰۴٫۱ "Early stage LBD caregiving". Lewy Body Dementia Association. Archived from the original on April 21, 2018. Retrieved April 20, 2018.
- ↑ ۲۰۵٫۰ ۲۰۵٫۱ Mueller et al. 2017, p. 390.
- ↑ Tahami Monfared et al. 2019, pp. 298–300.
- ↑ Mueller et al. 2017, pp. 392–393.
- ↑ ۲۰۸٫۰ ۲۰۸٫۱ Mueller et al. 2017, p. 391.
- ↑ Boot 2015, sec. "Postural hypotension".
- ↑ Walker et al. 2015, p. 1687.
- ↑ Tsamakis & Mueller 2021, pp. 2–3.
- ↑ Tsamakis & Mueller 2021, pp. 1٬4.
- ↑ Tahami Monfared et al. 2019, p. 300.
- ↑ Tahami Monfared et al. 2019, p. 299.
- ↑ ۲۱۵٫۰ ۲۱۵٫۱ Mueller et al. 2017, pp. 393–394.
- ↑ Mueller et al. 2019, Abstract.
- ↑ Bentley et al. 2021, sec. 4.2, p. 4640.
- ↑ Bentley et al. 2021, sec. 4.4, p. 4640.
- ↑ Rossor et al. 2010, sec. "young-onset dementia".
- ↑ (Kosaka 2017, p. v)
- ↑ (Hershey & Coleman-Jackson 2019, p. 309)
- ↑ (Tsamakis & Mueller 2021, p. 1)
- ↑ (Armstrong 2021, sec. "Vocabulary")
- ↑ Kosaka 2017, p. v.
- ↑ Gomperts 2016, p. 440.
- ↑ Kosaka 2017, Asada T, Chapter 2, pp. 11–12.
- ↑ Hogan et al. 2016, pp. S83–S95.
- ↑ Kosaka 2017, Asada T, Chapter 2, p. 17.
- ↑ ۲۲۹٫۰ ۲۲۹٫۱ ۲۲۹٫۲ Chiu et al. 2023, sec. "Abstract" and "Sex differences in clinical and population cohorts".
- ↑ Kosaka 2017, Asada T, Chapter 2, p. 16.
- ↑ ۲۳۱٫۰ ۲۳۱٫۱ ۲۳۱٫۲ Gomperts 2016, p. 435.
- ↑ Kosaka 2014, pp. 301–306.
- ↑ Engelhardt 2017, pp. 751–753.
- ↑ Lin & Truong 2019, pp. 144–50.
- ↑ (Lewy 1912, pp. ۹۲۰–۳۹٫۳) As cited in (Goedert, Jakes & Spillantini 2017, p. S52.)
- ↑ Engelhardt & Gomes 2017, pp. 198–201.
- ↑ ۲۳۷٫۰ ۲۳۷٫۱ Kosaka 2017, Kosaka K, Chapter 1, p. 4.
- ↑ Arnaoutoglou, O'Brien & Underwood 2019, pp. 103–112.
- ↑ Kosaka et al. 1976, pp. 221–233.
- ↑ Kosaka 2017, McKeith IG, Chapter 5, p. 60.
- ↑ Kosaka 2017, McKeith IG, Chapter 5, pp. 60–61.
- ↑ Kosaka 2017, McKeith IG, Chapter 5, p. 63.
- ↑ McKeith 2006, pp. 417–423.
- ↑ Goedert et al. 2013, p. 13.
- ↑ Kosaka 2017, McKeith IG, Chapter 5, pp. 64–67.
- ↑ McKeith et al. 2017, Abstract, p. 88.
- ↑ ۲۴۷٫۰ ۲۴۷٫۱ ۲۴۷٫۲ Williams 2016.
- ↑ ۲۴۸٫۰ ۲۴۸٫۱ Robbins 2016.
- ↑ ۲۴۹٫۰ ۲۴۹٫۱ Sahlas 2003, pp. 889–892.
- ↑ ۲۵۰٫۰ ۲۵۰٫۱ Gallman 2015.
- ↑ ۲۵۱٫۰ ۲۵۱٫۱ ۲۵۱٫۲ "LBDA Clarifies Autopsy Report on Comedian, Robin Williams". Lewy Body Dementia Association. November 10, 2014. Archived from the original on August 12, 2020. Retrieved April 19, 2018.
- ↑ McKeith 2015.
- ↑ ۲۵۳٫۰ ۲۵۳٫۱ ۲۵۳٫۲ Velayudhan et al. 2017, p. 68.
- ↑ Siderowf et al. 2018, pp. 528–529, 533.
- ↑ McKeith et al. 2020, pp. 744, 748.
- ↑ Yamada et al. 2020, p. 1.
- ↑ ۲۵۷٫۰ ۲۵۷٫۱ McKeith et al. 2020, p. 751.
- ↑ Tsamakis & Mueller 2021, p. 3.
- ↑ Hershey & Coleman-Jackson 2019, p. 311.
- ↑ Yamada et al. 2020, p. 8.
- ↑ McKeith et al. 2020, pp. 747–748.
- ↑ Kepplinger 2015, "FDA's Expedited Approval Mechanisms".
- ↑ Armstrong 2021, sec. "Skin biopsy".
- ↑ ۲۶۴٫۰ ۲۶۴٫۱ Armstrong 2021, sec. "Fluid biomarkers".
- ↑ Hershey & Coleman-Jackson 2019, pp. 316–317.
آثار ذکر شده
[ویرایش]- Abdelnour C, Gonzalez MC, Gibson LL, Poston KL, et al. (June 2023). "Dementia with Lewy Bodies Drug Therapies in Clinical Trials: Systematic Review up to 2022". Neurol Ther. 12 (3): 727–749. doi:10.1007/s40120-023-00467-8. PMC 10195935. PMID 37017910.
- Aminoff MJ, Greenberg DA, Simon RP (2005). "Chapter 7: Movement disorders". Clinical Neurology (6th ed.). Lange: McGraw-Hill Medical. pp. 241–245. ISBN 978-0-07-142360-1.
- Armstrong MJ (February 2019). "Lewy Body Dementias". Continuum (Minneap Minn) (Review). 25 (1): 128–146. doi:10.1212/CON.0000000000000685. PMID 30707190. S2CID 73423732.
- Armstrong MJ (2021). "Advances in dementia with Lewy bodies". Ther Adv Neurol Disord (Review). 14: 17562864211057666. doi:10.1177/17562864211057666. PMC 8613883. PMID 34840608.
- Arnaoutoglou NA, O'Brien JT, Underwood BR (February 2019). "Dementia with Lewy bodies – from scientific knowledge to clinical insights". Nat Rev Neurol. 15 (2): 103–112. doi:10.1038/s41582-018-0107-7. PMID 30559465. S2CID 56176586. Archived from the original on July 16, 2020.
در سال ۱۹۷۶، کنجی کوساکا و همکارانش در اولین مورد کالبدشکافی پس از مرگ، در فرد مبتلا به زوال عقل زودرس (پیش از سالخوردگی)، مغز را دارای آسیب ناشی از «اجسام لویی» توصیف کردند و در سال ۱۹۸۴، کوساکا اصطلاح «بیماری منتشر اجسام لویی» را برای اولین بار مورد استفاده قرار داد.
- Arnaldi D, Antelmi E, St Louis EK, Postuma RB, Arnulf I (December 2017). "Idiopathic REM sleep behavior disorder and neurodegenerative risk: To tell or not to tell to the patient? How to minimize the risk?". Sleep Med Rev (Review). 36: 82–95. doi:10.1016/j.smrv.2016.11.002. PMID 28082168.
- Bartels, Else Marie; Lund, Hans; Hagen, Kåre Birger; Dagfinrud, Hanne; Christensen, Robin; Danneskiold-Samsøe, Bente (October 2007). "Aquatic exercise for the treatment of knee and hip osteoarthritis". Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd. doi:10.1002/14651858.cd005523.pub2.
- * Bentley A, Morgan T, Salifu Y, Walshe C (December 2021). "Exploring the experiences of living with Lewy body dementia: an integrative review". J Adv Nurs (Review). 77 (12): 4632–4645. doi:10.1111/jan.14932. hdl:2292/57351. PMID 34146346. S2CID 235479826. Archived from the original on January 28, 2024. Retrieved December 15, 2021.
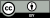 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License بایگانیشده در اکتبر ۱۶, ۲۰۱۷ توسط Wayback Machine.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License بایگانیشده در اکتبر ۱۶, ۲۰۱۷ توسط Wayback Machine. - Berge G, Sando SB, Rongve A, Aarsland D, White LR (November 2014). "Apolipoprotein E ε2 genotype delays onset of dementia with Lewy bodies in a Norwegian cohort". J. Neurol. Neurosurg. Psychiatry. 85 (11): 1227–1231. doi:10.1136/jnnp-2013-307228. PMC 4215279. PMID 24639435.
- Blanc F, Bousiges O (May 2022). "Biomarkers and diagnosis of dementia with Lewy bodies including prodromal: practical aspects". Rev Neurol (Paris). 178 (5): 472–483. doi:10.1016/j.neurol.2022.03.008. PMID 35491246.
- Boot BP (2015). "Comprehensive treatment of dementia with Lewy bodies". Alzheimers Res Ther (Review). 7 (1): 45. doi:10.1186/s13195-015-0128-z. PMC 4448151. PMID 26029267.
- Boot BP, McDade EM, McGinnis SM, Boeve BF (December 2013). "Treatment of dementia with Lewy bodies". Curr Treat Options Neurol (Review). 15 (6): 738–764. doi:10.1007/s11940-013-0261-6. PMC 3913181. PMID 24222315.
- Bousiges O, Blanc F (June 2022). "Biomarkers of dementia with Lewy bodies: differential diagnostic with Alzheimer's disease". Int J Mol Sci. 23 (12): 6371. doi:10.3390/ijms23126371. PMC 9223587. PMID 35742814.
- Burghaus L, Eggers C, Timmermann L, Fink GR, Diederich NJ (February 2012). "Hallucinations in neurodegenerative diseases". CNS Neurosci Ther (Review). 18 (2): 149–159. doi:10.1111/j.1755-5949.2011.00247.x. PMC 6493408. PMID 21592320.
- Chatzikonstantinou, Simela; McKenna, Jack; Karantali, Eleni; Petridis, Fivos; Kazis, Dimitrios; Mavroudis, Ioannis (May 2021). "Electroencephalogram in dementia with Lewy bodies: a systematic review". Aging Clinical and Experimental Research. 33 (5): 1197–1208. doi:10.1007/s40520-020-01576-2. ISSN 1720-8319. PMID 32383032.
- Cheng ST (August 2017). "Dementia caregiver burden: a research update and critical analysis". Curr Psychiatry Rep (Review). 19 (9): 64. doi:10.1007/s11920-017-0818-2. PMC 5550537. PMID 28795386.
- Chiu SY, Wyman-Chick KA, Ferman TJ, Bayram E, Holden SK, Choudhury P, Armstrong MJ (February 2023). "Sex differences in dementia with Lewy bodies: Focused review of available evidence and future directions". Parkinsonism Relat Disord (Review). 107: 105285. doi:10.1016/j.parkreldis.2023.105285. PMID 36682958.
- Chung EJ, Kim SJ (May 2015). "(123)I-Metaiodobenzylguanidine myocardial scintigraphy in Lewy body-related disorders: a literature review". J Mov Disord (Review). 8 (2): 55–66. doi:10.14802/jmd.15015. PMC 4460541. PMID 26090077.
- Connors MH, Quinto L, McKeith I, et al. (November 2018). "Non-pharmacological interventions for Lewy body dementia: a systematic review". Psychol Med (Review). 48 (11): 1749–1758. doi:10.1017/S0033291717003257. PMC 6088773. PMID 29143692.
- Diamond A (2013). "Executive functions". Annual Review of Psychology. 64: 135–168. doi:10.1146/annurev-psych-113011-143750. PMC 4084861. PMID 23020641.
توافق کلی در بین محققان این است که سه عملکرد اجراییِ (EF) اصلی وجود دارد: ۱. بازداری [کنترل بازدارنده، از جمله خودکنترلی (بازداری رفتاری) و کنترل تداخل (توجه انتخابی و بازداری شناختی)] ۲. حافظه کاری (WM) ۳. انعطافپذیری شناختی (همچنین تغییر شناخت، انعطافپذیری ذهنی، یا تغییر مجموعه ذهنی نیز نامیده میشود و ارتباط نزدیکی با خلاقیت دارد). از این سه نوع عملکرد، عملکردهایی با مرتبه بالاتر مانند استدلال، حل مسئله و برنامهریزی ساخته میشود.
- Donaghy PC, O'Brien JT, Thomas AJ (January 2015). "Prodromal dementia with Lewy bodies". Psychol Med (Review). 45 (2): 259–268. doi:10.1017/S0033291714000816. PMID 25066469. S2CID 21628548. Archived (PDF) from the original on July 20, 2021.
- Engelhardt E (October 2017). "Lafora and Trétiakoff: the naming of the inclusion bodies discovered by Lewy". Arq Neuropsiquiatr (Historical article). 75 (10): 751–753. doi:10.1590/0004-282X20170116. PMID 29166468.
- Engelhardt E, Gomes M (2017). "Lewy and his inclusion bodies: Discovery and rejection". Dement Neuropsychol. 11 (2): 198–201. doi:10.1590/1980-57642016dn11-020012. PMC 5710688. PMID 29213511.
- Gallman S (November 4, 2015). "Robin Williams' widow speaks: Depression didn't kill my husband". CNN. Archived from the original on November 4, 2015. Retrieved April 6, 2018.
- Goedert M, Jakes R, Spillantini MG (2017). "The synucleinopathies: Twenty years on". J Parkinsons Dis (Review). 7 (s1): S51–S71. doi:10.3233/JPD-179005. PMC 5345650. PMID 28282814.
- Goedert M, Spillantini MG, Del Tredici K, Braak H (January 2013). "100 years of Lewy pathology". Nat Rev Neurol (Practice guideline). 9 (1): 13–24. doi:10.1038/nrneurol.2012.242. PMID 23183883. S2CID 12590215.
- Goedert M, Spillantini MG (May 2017). "Propagation of Tau aggregates". Molecular Brain. 10 (1): 18. doi:10.1186/s13041-017-0298-7. PMC 5450399. PMID 28558799.
- Gomperts SN (April 2016). "Lewy body dementias: Dementia with Lewy bodies and Parkinson disease dementia". Continuum (Minneap Minn) (Review). 22 (2 Dementia): 435–463. doi:10.1212/CON.0000000000000309. PMC 5390937. PMID 27042903.
- Haider A, Dulebohn SC (2018). "Lewy Body Dementia". StatPearls Publishing. PMID 29494048. Archived from the original on July 20, 2021.
- Hansen D, Ling H, Lashley T, Holton JL, Warner TT (December 2019). "Review: Clinical, neuropathological and genetic features of Lewy body dementias". Neuropathol. Appl. Neurobiol. (Review). 45 (7): 635–654. doi:10.1111/nan.12554. PMID 30977926.
- Hershey LA, Coleman-Jackson R (April 2019). "Pharmacological management of dementia with Lewy dodies". Drugs Aging (Review). 36 (4): 309–319. doi:10.1007/s40266-018-00636-7. PMC 6435621. PMID 30680679.
- Hogan DB, Fiest KM, Roberts JI, et al. (April 2016). "The prevalence and incidence of dementia with Lewy bodies: a systematic review". Can J Neurol Sci (Review). 43 (Suppl 1): S83–S95. doi:10.1017/cjn.2016.2. hdl:1880/109525. PMID 27307129.
- Karantzoulis S, Galvin JE (November 2011). "Distinguishing Alzheimer's disease from other major forms of dementia". Expert Rev Neurother (Review). 11 (11): 1579–91. doi:10.1586/ern.11.155. PMC 3225285. PMID 22014137.
- Kepplinger, Erin E. (2015-02-01). "FDA's Expedited Approval Mechanisms for New Drug Products". Biotechnology Law Report. 34 (1): 15–37. doi:10.1089/blr.2015.9999. ISSN 0730-031X. PMC 4326266. PMID 25713472.
- Kosaka K, ed. (2017). Dementia with Lewy bodies: clinical and biological aspects (1st ed.). Springer: Japan. doi:10.1007/978-4-431-55948-1. ISBN 978-4-431-55948-1.
- Kosaka K (2014). "Lewy body disease and dementia with Lewy bodies". Proc Jpn Acad Ser B Phys Biol Sci (Historical Review). 90 (8): 301–306. Bibcode:2014PJAB...90..301K. doi:10.2183/pjab.90.301. PMC 4275567. PMID 25311140.
- Kosaka K, Oyanagi S, Matsushita M, Hori A (1976). "Presenile dementia with Alzheimer-, Pick- and Lewy-body changes". Acta Neuropathol. 36 (3): 221–233. doi:10.1007/bf00685366. PMID 188300. S2CID 162001.
- Levin J, Kurz A, Arzberger T, Giese A, Höglinger GU (February 2016). "The differential diagnosis and treatment of atypical parkinsonism". Dtsch Arztebl Int (Review). 113 (5): 61–69. doi:10.3238/arztebl.2016.0061. PMC 4782269. PMID 26900156.
- Lewy F (1912). "Paralysis agitans". In Lewandowsky M, Abelsdorff G (eds.). I. Pathologische Anatomie In Handbuch der Neurologie. Vol. 3. Springer Verlag, Berlin. pp. 920–933.
- Lin YW, Truong D (April 2019). "Diffuse Lewy body disease". J. Neurol. Sci. (Review). 399: 144–50. doi:10.1016/j.jns.2019.02.021. PMID 30807982. S2CID 72335064.
- Linard M, Ravier A, Mougué L, et al. (January 2022). "Infectious Agents as Potential Drivers of α-Synucleinopathies" (PDF). Mov Disord (Review). 37 (3): 464–477. doi:10.1002/mds.28925. PMID 35040520. S2CID 246014560. Archived (PDF) from the original on November 3, 2022. Retrieved November 2, 2022.
- Matar E, Shine JM, Halliday GM, Lewis SJ (January 2020). "Cognitive fluctuations in Lewy body dementia: towards a pathophysiological framework". Brain (Review). 143 (1): 31–46. doi:10.1093/brain/awz311. PMID 31612904. Archived from the original on July 20, 2021.
- McKeith IG (2006). "Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the Consortium on DLB International Workshop". J Alzheimers Dis. 9 (3 Suppl): 417–423. doi:10.3233/JAD-2006-9S347. PMID 16914880.
- McKeith IG (November 6, 2015). "Robin Williams had dementia with Lewy bodies – so, what is it and why has it been eclipsed by Alzheimer's?". The Conversation. Archived from the original on November 4, 2016. Retrieved April 6, 2018.
- McKeith IG, Boeve BF, Dickson DW, et al. (July 2017). "Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium". Neurology (Review). 89 (1): 88–100. doi:10.1212/WNL.0000000000004058. PMC 5496518. PMID 28592453.
- McKeith IG, Dickson DW, Lowe J, et al. (December 2005). "Diagnosis and management of dementia with Lewy bodies: Third report of the DLB Consortium". Neurology (Review). 65 (12): 1863–1872. doi:10.1212/01.wnl.0000187889.17253.b1. PMID 16237129. S2CID 14354793. Archived from the original on March 9, 2018.
- McKeith IG, Fairbairn A, Perry R, Thompson P, Perry E (September 1992). "Neuroleptic sensitivity in patients with senile dementia of Lewy body type". BMJ. 305 (6855): 673–674. doi:10.1136/bmj.305.6855.673. PMC 1882909. PMID 1356550.
حساسیت شدید و اغلب کشنده نورولپتیک ممکن است در شرایطی مانند پاسخهای نامطلوب اغراقآمیز به دوزهای استاندارد، ایجاد یا بدتر شدن عوارض خارج هرمی یا زوال فیزیکی حاد و شدید، رخ دهد.
- McKeith IG, Ferman TJ, Thomas AJ, et al. (April 2020). "Research criteria for the diagnosis of prodromal dementia with Lewy bodies". Neurology (Review). 94 (17): 743–755. doi:10.1212/WNL.0000000000009323. PMC 7274845. PMID 32241955.
- Menšíková K, Matěj R, Colosimo C, et al. (January 2022). "Lewy body disease or diseases with Lewy bodies?". npj Parkinson's Disease (Review). 8 (1): 3. doi:10.1038/s41531-021-00273-9. PMC 8748648. PMID 35013341. Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License بایگانیشده در اکتبر ۱۶, ۲۰۱۷ توسط Wayback Machine
- Mueller C, Ballard C, Corbett A, Aarsland D (May 2017). "The prognosis of dementia with Lewy bodies" (PDF). Lancet Neurol (Review). 16 (5): 390–398. doi:10.1016/S1474-4422(17)30074-1. PMID 28342649. S2CID 37835962. Archived (PDF) from the original on June 6, 2020.
- Mueller C, Soysal P, Rongve A, Isik AT, et al. (March 2019). "Survival time and differences between dementia with Lewy bodies and Alzheimer's disease following diagnosis: a meta-analysis of longitudinal studies" (PDF). Ageing Res Rev (Meta-analysis). 50: 72–80. doi:10.1016/j.arr.2019.01.005. PMID 30625375. S2CID 58634976. Archived (PDF) from the original on December 23, 2022. Retrieved November 2, 2022.
- Nuytemans, Karen; Theuns, Jessie; Cruts, Marc; Van Broeckhoven, Christine (July 2010). "Genetic etiology of Parkinson disease associated with mutations in the SNCA, PARK2, PINK1, PARK7, and LRRK2 genes: a mutation update". Human Mutation. 31 (7): 763–780. doi:10.1002/humu.21277. ISSN 1098-1004. PMC 3056147. PMID 20506312.
- O'Dowd S, Schumacher J, Burn DJ, et al. (November 2019). "Fluctuating cognition in the Lewy body dementias". Brain (Review). 142 (11): 3338–3350. doi:10.1093/brain/awz235. PMID 31411317. Archived from the original on February 23, 2021.
- Ogawa T, Fujii S, Kuya K, Kitao SI, Shinohara Y, Ishibashi M, Tanabe Y (September 2018). "Role of neuroimaging on differentiation of Parkinson's disease and its related diseases". Yonago Acta Med (Review). 61 (3): 145–155. doi:10.33160/yam.2018.09.001. PMC 6158357. PMID 30275744.
سندرم پارکینسونیسم گروهی از اختلالات حرکتی است که با علائم حرکتی معمول مانند لرزش، برادیکینزی و سفتی عضلانی مشخص میشود. این علائم اغلب به دلیل بیماری نورودژنراتیو اولیه (زوال عصبی) رخ میدهند و مشابه بیماریهای PD ,MSA ,PSP ,CBD و DLB با منشأ ناشناخته، منجر به از دست دادن پایانههای عصبی دوپامینرژیک در امتداد مسیر نیگروستریاتال میشود.
- Olfati, Nahid; Shoeibi, Ali; Litvan, Irene (February 2019). "Progress in the treatment of Parkinson-Plus syndromes". Parkinsonism & Related Disorders. 59: 101–110. doi:10.1016/j.parkreldis.2018.10.006. ISSN 1873-5126. PMID 30314846.
- Palma JA, Kaufmann H (March 2018). "Treatment of autonomic dysfunction in Parkinson disease and other synucleinopathies". Mov Disord (Review). 33 (3): 372–390. doi:10.1002/mds.27344. PMC 5844369. PMID 29508455.
- Pezzoli S, Cagnin A, Bandmann O, Venneri A (July 2017). "Structural and functional neuroimaging of visual hallucinations in Lewy body disease: A systematic literature review". Brain Sci (Review). 7 (12): 84. doi:10.3390/brainsci7070084. PMC 5532597. PMID 28714891.
- Robbins R (September 30, 2016). "How Lewy body dementia gripped Robin Williams". Scientific American. Archived from the original on April 10, 2018. Retrieved April 9, 2018.
- Rossor, Martin N.; Fox, Nick C.; Mummery, Catherine J.; Schott, Jonathan M.; Warren, Jason D. (August 2010). "The diagnosis of young-onset dementia". The Lancet Neurology (به انگلیسی). 9 (8): 793–806. doi:10.1016/S1474-4422(10)70159-9. ISSN 1474-4422. PMID 20650401.
- Sahlas DJ (June 2003). "Dementia with Lewy bodies and the neurobehavioral decline of Mervyn Peake". Arch Neurol (Historical article). 60 (6): 889–892. doi:10.1001/archneur.60.6.889. PMID 12810496. Archived from the original on June 16, 2018.
- Santos F, Cabreira V, Rocha S, Massano J (November 2022). "Blood biomarkers for the diagnosis of neurodegenerative dementia: a systematic review". J Geriatr Psychiatry Neurol. 36 (4): 267–281. doi:10.1177/08919887221141651. PMID 36423207. S2CID 253839381.
- Siderowf A, Aarsland D, Mollenhauer B, Goldman JG, Ravina B (April 2018). "Biomarkers for cognitive impairment in Lewy body disorders: Status and relevance for clinical trials". Mov Disord (Review). 33 (4): 528–536. doi:10.1002/mds.27355. PMID 29624752. S2CID 4634411.
- St Louis EK, Boeve AR, Boeve BF (May 2017). "REM sleep behavior disorder in Parkinson's disease and other synucleinopathies". Mov Disord (Review). 32 (5): 645–658. doi:10.1002/mds.27018. PMID 28513079. S2CID 46881921.
- St Louis EK, Boeve BF (November 2017). "REM sleep behavior disorder: Diagnosis, clinical implications, and future directions". Mayo Clin Proc (Review). 92 (11): 1723–1736. doi:10.1016/j.mayocp.2017.09.007. PMC 6095693. PMID 29101940. Archived from the original on July 20, 2021.
- Tahami Monfared AA, Meier G, Perry R, Joe D (December 2019). "Burden of disease and current management of dementia with Lewy bodies: A literature review". Neurol Ther (Review). 8 (2): 289–305. doi:10.1007/s40120-019-00154-7. PMC 6858913. PMID 31512165.
- Taylor JP, McKeith IG, Burn DJ, et al. (February 2020). "New evidence on the management of Lewy body dementia". Lancet Neurol (Review). 19 (2): 157–169. doi:10.1016/S1474-4422(19)30153-X. PMC 7017451. PMID 31519472.
- Tousi B (October 2017). "Diagnosis and management of cognitive and behavioral changes in dementia with Lewy bodies". Curr Treat Options Neurol (Review). 19 (11): 42. doi:10.1007/s11940-017-0478-x. PMID 28990131. S2CID 25850109.
- Tousi B, Leverenz JB (2021). "The application of zonisamide to patients suffering from dementia with Lewy bodies: emerging clinical data". Drug Des Devel Ther (Review). 15: 1811–1817. doi:10.2147/DDDT.S240865. PMC 8106402. PMID 33976533.
- Tsamakis K, Mueller C (2021). "Challenges in predicting cognitive decline in dementia with Lewy bodies". Dement Geriatr Cogn Disord (Review). 50 (1): 1–8. doi:10.1159/000515008. PMID 33780925. S2CID 232419112. Archived from the original on December 15, 2021. Retrieved December 15, 2021.
- Vann Jones SA, O'Brien JT (March 2014). "The prevalence and incidence of dementia with Lewy bodies: a systematic review of population and clinical studies". Psychol Med (Review). 44 (4): 673–683. doi:10.1017/S0033291713000494. PMID 23521899. S2CID 40151904.
- Velayudhan L, Ffytche D, Ballard C, Aarsland D (September 2017). "New therapeutic strategies for Lewy body dementias". Curr Neurol Neurosci Rep (Review). 17 (9): 68. doi:10.1007/s11910-017-0778-2. PMID 28741230. S2CID 3739100.
- Villemagne VL, Doré V, Burnham SC, Masters CL, Rowe CC (April 2018). "Imaging tau and amyloid-β proteinopathies in Alzheimer disease and other conditions". Nat Rev Neurol (Review). 14 (4): 225–236. doi:10.1038/nrneurol.2018.9. PMID 29449700. S2CID 4365310.
- Walker Z, Possin KL, Boeve BF, Aarsland D (October 2015). "Lewy body dementias". Lancet (Review). 386 (10004): 1683–1697. doi:10.1016/S0140-6736(15)00462-6. PMC 5792067. PMID 26595642.
- Walker L, Stefanis L, Attems J (September 2019). "Clinical and neuropathological differences between Parkinson's disease, Parkinson's disease dementia and dementia with Lewy bodies – current issues and future directions". J. Neurochem. (Review). 150 (5): 467–474. doi:10.1111/jnc.14698. PMID 30892688.
- Watts KE, Storr NJ, Barr PG, et al. (February 2022). "Systematic review of pharmacological interventions for people with Lewy body dementia". Aging Ment Health (Review). 27 (2): 203–216. doi:10.1080/13607863.2022.2032601. PMID 35109724.
- Weil RS, Lashley TL, Bras J, Schrag AE, Schott JM (2017). "Current concepts and controversies in the pathogenesis of Parkinson's disease dementia and dementia with Lewy bodies". F1000Res (Review). 6: 1604. doi:10.12688/f1000research.11725.1. PMC 5580419. PMID 28928962.
- Williams SS (September 2016). "The terrorist inside my husband's brain". Neurology. 87 (13): 1308–1311. doi:10.1212/WNL.0000000000003162. PMID 27672165. Archived from the original on March 24, 2018.
- Yamada M, Komatsu J, Nakamura K, et al. (January 2020). "Diagnostic Criteria for Dementia with Lewy Bodies: Updates and Future Directions". J Mov Disord (Review). 13 (1): 1–10. doi:10.14802/jmd.19052. PMC 6987529. PMID 31694357.
- Zweig YR, Galvin JE (2014). "Lewy body dementia: the impact on patients and caregivers". Alzheimers Res Ther (Review). 6 (2): 21. doi:10.1186/alzrt251. PMC 4054937. PMID 25031635.
پیوند به بیرون
[ویرایش]- Adams BD (۱۶ ژانویه ۲۰۱۳)، «زوال عقل اجسام لویی در بخش اورژانس» مجله پزشکی تحصیلات تکمیلی. بازبینی شده در ۱۴ فوریه ۲۰۲۲. (انگلیسی)
- McKeith IG (۱۰ اکتبر ۲۰۱۷)، «معیارهای تشخیصی به روز شده و مدیریت دمانس اجسام لویی» (ویدئو). بازبینی شده در ۸ آوریل ۲۰۱۸. (انگلیسی)
- «درمان اورژانسی روان پریشی» انجمن زوال عقل اجسام لویی، سپتامبر ۲۰۱۵. بازبینی شده در ۲۷ آوریل ۲۰۱۸. (انگلیسی)
- «زوال عقل با اجسام لویی» انجمن آلزایمر، بازبینی شده در ۱۵ فوریه ۲۰۲۲. (انگلیسی)
- «درمان علائم رفتاری: چه زمانی باید داروهای ضد روان پریشی را در LBD در نظر گرفت» انجمن زوال عقل اجسام لویی. بازیابی شده در ۲۸ نوامبر ۲۰۲۳. - فهرستی از داروهای ضدروانپریشی معمولی و غیرمعمول. (انگلیسی)
- «زوال عقل با اجسام لویی|آشنایی، تشخیص و عوامل خطر» مایو کلینیک، بازبینی شده در ۲۰ فوریه ۲۰۲۲. (انگلیسی)
- «دمانس» سازمان بهداشت جهانی، بازبینی شده در ۲ سپتامبر ۲۰۲۱. (انگلیسی)