آمیلوئید بتا
| آمیلوئید بتا پپتید (بتا-اِیپیپی) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
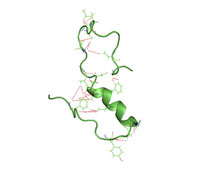 ساختار نیمه چینخوردهٔ آمیلوئید بتا(۱ ۴۰) در یک محیط آبی (pdb 2lfm)[۱] | |||||||||
| شناسهها | |||||||||
| نماد | APP | ||||||||
| پیفم | PF03494 | ||||||||
| اینترپرو | IPR013803 | ||||||||
| SCOPe | 2lfm / SUPFAM | ||||||||
| TCDB | 1.C.۵۰ | ||||||||
| OPM superfamily | ۳۰۴ | ||||||||
| OPM protein | 2y3k | ||||||||
| Membranome | ۴۵ | ||||||||
| |||||||||
آمیلوئید بتا (انگلیسی: Amyloid beta) که به اختصار Aβ یا Abeta هم گفته میشود، یک پروتئین ۳۶ تا ۴۳ پپتیدی و سازندهٔ اصلی پلاکهای آمیلوئید است که در مغز مبتلایان به بیماری آلزایمر یافت میشود.[۲] این پپتیدها از پروتئین پیشساز آمیلوئید-بتا (APP) حاصل میشوند که توسط آنزیمهای بتا سکرتاز ۱ و گاما سکرتاز تجزیه شده و آمیلوئید بتا بهدست میآید. تجمع مولکولهای آمیلوئید بتا، نوعی الیگومر محلولِ انعطافپذیر تشکیل میدهد که به شکلهای گوناگون یافت میشوند. امروزه عقیده بر آن است که برخی اُلیگومرهای بد چینخورده (که به آنها «بذر» یا «ریزدانه» میگویند) مولکولی دیگر آمیلوئید بتا را نیز وادار به چین خوردن نادرست میکنند و یک واکنش زنجیروار پدیدار میگردد که مشابه آن چیزی است که در عفونتهای پریونی دیده میشود. این اُلیگومرها برای یاختههای عصبی سمی هستند.[۳] یکی دیگر از پروتئینهای دخیل در ایجاد بیماری آلزایمر هم که پروتئین تاو نام دارد، اُلیگومرهای بد چینخورده شبه پریونی تشکیل میدهد و حتی شواهدی وجود دارد که آمیلوئید بتای بد چینخورده قادر است پروتئین تاو را وادار به تاشدن و چینخوردگی نادرست کند.[۴][۵]
طبق پژوهشی در سال ۲۰۱۳، احتمال دارد که خاستگاه پروتئین پیشساز آمیلوئید-بتا بسیار کهن باشد و قدمت آن به دورهٔ نخستین دهاندومیان برسد.[۶]
عملکرد[ویرایش]
هنوز به درستی معلوم نیست که وظیفهٔ آمیلوئید بتا در بدن چیست.[۷] برخی مطالعات حیوانی ثابت کردهاند که فقدان این پروتئین سبب نقص خاصی در عملکرد فیزیولوژیک نمیشود.[۸][۹] تا کنون چندین فعالیت بالقوه و احتمالی برای آمیلوئید بتا کشف شده که از جمله میتوان به فعالسازی آنزیم کیناز،[۱۰][۱۱] محافظت در برابر استرس اکسیداتیو،[۱۲][۱۳] تنظیم انتقال کلسترول،[۱۴][۱۵] ایفای نقش بهعنوان فاکتور رونویسی[۱۶][۱۷] و فعالیت ضد میکروبی (احتمالاً مرتبط با نقش التهابزای این پروتئین)[۱۸][۱۹][۲۰] اشاره کرد.
اهمیت بالینی[ویرایش]
آمیلوئید بتا سازندهٔ اصلی پلاکهای آمیلوئید است که بهصورت رسوبهای خارجسلولی در مغز مبتلایان به بیماری آلزایمر دیده میشود.[۲۱] آمیلوئید بتا همچنین میتواند باعث ایجاد رسوب در رگهای مغز در جریان آنژیوپاتی مغزی آمیلوئید میگردد. پلاکهای آمیلوئید متشکل از کلافهای از رشتههای منظم است که به آنها «فیبریلهای آمیلوئید» میگویند.[۲۲] این نوع تاشدگی پروتئین در پپتیدهای دیگری همچون پریونها دیده میشوند که مسئول ایجاد بیماریهای ناشی از تاشدگی نادرست پروتئین هستند.
بیماری آلزایمر[ویرایش]
تصور پژوهشگران بر آن است که برخی انواع اُلیگومرهای محلول این پپتیدها، عامل بروز بیماری آلزایمر هستند[۲۳][۲۴] و شدت سمیت اُلیگومرهای آمیلوئید بتا از همه بیشتر است.[۲۵] مطابق فرضیه مجرای یونی در بیماری آلزایمر، اُلیگومرهای محلول غیررشتهای، سبب تشکیل مجراهای یونی میشود که از طریق آنها، کلسیم خودمدار (کلسیمی که تحت نظارت و کنترل سامانههای تنظیمی بدن نیست) به داخل سلولهای عصبی (نرونها) سرازیر میشوند[۲۶] و بدین ترتیب هوموستازی یون کلسیم و متعاقب آن آپوپتوز بههم میریزد.[۲۷][۲۸] پژوهشهای محاسباتی نشان دادهاست که همچنین پپتیدهای آمیلوئید-بتا که بهصورت مونومرهایی با پیکربندی پیچشی غالب در غشاء سلول تعبیه شدهاند، ممکن است اُلیگومریزه شوند[۲۹] و در نهایت مجراهایی تشکیل دهند که پایداری و ساختار ترکیبی آنها با حضور همزمان و آرایش مولکولی کلسترول در ارتباط است.[۳۰] تعدادی از پژوهشهای ژنتیکی، زیستشناسی سلولی، بیوشیمیایی و مطالعات حیوانی از این فرضیه پشتیبانی میکنند که آمیلوئید-بتا نقشی اساسی در تکوین و ایجاد بیماری آلزایمر دارد.[۳۱][۳۲]
آمیلوئید-بتای مغز در افراد مبتلا به بیماری آلزایمر غیر ژنتیکی افزایش مییابد. آمیلوئید-بتا ماده اصلی سازنده پارانشیم مغزی و آمیلوئید عروقی است و در ایجاد ضایعات عروقی مغزی مشارکت دارد و برای سلولهای عصبی سمی است.[۳۱][۳۲][۳۳][۳۴] هنوز بهدرستی معلوم نیست این پروتئین چگونه در مغز تجمع یافته و بیماری را آغاز میکند. برخی از پژوهشگران دریافتهاند که الیگومرهای آمیلوئید-بتا برخی از نشانههای بیماری آلزایمر را از طریق رقابت با انسولین جهت اتصال به گیرنده آن القا میکنند و بنابراین متابولیسم گلوکز در مغز را مختل میکنند.[۳۵] تلاشهای فراوانی برای درک مکانیسمهای تولید آمیلوئید-بتا شدهاست، از جمله تحقیق بر روی آنزیمهای پروتئولیتیک گاما سکرتاز و بتا سکرتاز که سبب تشکیل آمیلوئید-بتا از پروتئین پیشساز آن، پروتئین پیشساز آمیلوئید (APP) میگردد.[۳۶][۳۷][۳۸][۳۹] آمیلوئید-بتا در پلاسما، مایع مغزی نخاعی (CSF) و مایع بینبافتی مغز (ISF) بهطور عمده به صورت مولکول محلول Aβ۴۰ گردش مییابد.[۳۱][۴۰] پلاکهای آمیلوئید مغز هر دو نوع پروتئین Aβ۴۰ و Aβ۴۲ را دارند،[۴۱] در حالی که آمیلوئید عروقی، عمدتاً دارای نوع کوتاهتر Aβ۴۰ هستند. چندین توالی مختلف آمیلوئید-بتا در هر دو ضایعه (مغزی و عروقی) یافت شدهاست.[۴۲][۴۳][۴۴] احتمال دارد تولید آمیلوئید-بتا در دستگاه عصبی مرکزی بهدنبال انتقال آکسونی بتا سکرتاز و پرسنیلین-۱ با واسطه پروتئین پیشساز آمیلوئید، در غشای آکسونی عصبی صورت گیرد.[۴۵]
افزایش در سطح کلی آمیلوئید-بتا یا غلظت نسبی هر دو مولکول Aβ۴۰ و Aβ۴۲ (که اولی بیشتر در پلاکهای عروق مغزی و دومی در پلاکهای عصبی متمرکز است)[۴۶] در پاتوژنز بیماری آلزایمر خانوادگی و غیر خانوادگی نقش دارند. به دلیل ماهیت آبگریز، مولکول Aβ۴۲ آمیلوئیدوژنیکترین شکل پپتید است. با این حال، مشخص شده که توالی مرکزی KLVFFAE به تنهایی قادر به تشکیل آمیلوئید است و احتمالاً هسته فیبریل را تشکیل میدهد. یک پژوهش دیگر، سطح Aβ۴۲ در مغز را هم با شروع بیماری آلزایمر و هم با کاهش فشار مایع مغزی نخاعی مرتبط میداند، و این موضوع نشان میدهد که تجمع یا ناتوانی در پاکسازی قطعات Aβ۴۲ احتمالاً در بیماریزایی آلزایمر نقش داشته باشد.[۴۷]
بیشتر پژوهشگران «فرضیهٔ آمیلوئید» (که میگوید پلاکهای آمیلوئیدی مسئول ایجاد آلزایمر هستند) را قبول دارند، اما این فرضیه بهطور قطعی اثبات نشدهاست. یک فرضیه دیگر بیان میدارد که الیگومرهای آمیلوئید (و نه پلاکهای آن) سبب ایجاد آلزایمر میشوند.[۲۵][۴۸] موشهایی که برای بیان الیگومرها (و نه پلاکها) دستکاری ژنتیکی شدهاند (APPE693Q) به آلزایمر مبتلا میشوند. علاوه بر این، احتمال ابتلا به آلزایمر در موشهایی که برای تبدیل الیگومرها به پلاک مهندسی ژنتیک شدهاند (APPE693Q X PS1ΔE9)، بیشتر از موشهای الیگومری نیست.[۴۹] رسوبات درون سلولی پروتئین تاو نیز در آلزایمر مشاهده شدهاست، و همچنین ممکن است تجمع آلفا-سینوکلئین در ایجاد آلزایمر مؤثر باشد.
سرطان[ویرایش]
با آنکه بهنظر میرسد آمیلوئید بتا در ایجاد سرطان نقش داشته باشد، تحقیقات اخیر در مورد انواع سرطانها جهت روشن کردن ماهیت اثرات احتمالی آن، نتایج غیرقابل اتکایی داشتهاست. سطح آمیلوئید بتا در برخی سرطانها همچون سرطان مری، سرطان روده بزرگ، سرطان ریه و سرطان کبد ارزیابی شدهاست، چرا که مشاهده شده در کسانی که از این سرطانها جان سالم بدر میبرند، احتمال بروز آلزایمر کم است. در تمامی این سرطانها، رابطهٔ مثبتی با افزایش سطح آمیلوئید بتا مشاهده شده، بهویژه در سرطانهای کبد.[۵۰] با این حال سمت و سوی این رابطه هنوز معلوم نیست. پژوهشهای مربوط به سلولهای سرطان پستان در انسان نشان داده که بیان پروتئین پیشساز آمیلوئید-بتا در این سلولها افزایش یافتهاست.[۵۱]
نشانگان داون[ویرایش]
در بزرگسالان مبتلا به نشانگان داون تجمع آمیلوئید در ارتباط با بیماری آلزایمرشان دیده شده که با افت عملکرد شناختی، حافظه، حرکات ظریف، کارکرد اجرایی و مهارتهای بینایی-فضایی در ارتباط است.[۵۲]
منابع[ویرایش]
- ↑ Vivekanandan S, Brender JR, Lee SY, Ramamoorthy A (July 2011). "A partially folded structure of amyloid-beta(1-40) in an aqueous environment". Biochemical and Biophysical Research Communications. 411 (2): 312–6. doi:10.1016/j.bbrc.2011.06.133. PMC 3148408. PMID 21726530.
- ↑ Hamley IW (October 2012). "The Amyloid Beta Peptide: A Chemist's Perspective. Role in Alzheimer's and Fibrillization" (PDF). Chemical Reviews. 112 (10): 5147–92. doi:10.1021/cr3000994. PMID 22813427.
- ↑ Haass C, Selkoe DJ (February 2007). "Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide". Nature Reviews. Molecular Cell Biology. 8 (2): 101–12. doi:10.1038/nrm2101. PMID 17245412. S2CID 32991755.
- ↑ Nussbaum JM, Seward ME, Bloom GS (Jan–Feb 2013). "Alzheimer disease: a tale of two prions". Prion. 7 (1): 14–9. doi:10.4161/pri.22118. PMC 3609044. PMID 22965142.
- ↑ Pulawski W, Ghoshdastider U, Andrisano V, Filipek S (April 2012). "Ubiquitous amyloids". Applied Biochemistry and Biotechnology. 166 (7): 1626–43. doi:10.1007/s12010-012-9549-3. PMC 3324686. PMID 22350870.
- ↑ Tharp WG, Sarkar IN (April 2013). "Origins of amyloid-β". BMC Genomics. 14 (1): 290. doi:10.1186/1471-2164-14-290. PMC 3660159. PMID 23627794.
- ↑ Hiltunen M, van Groen T, Jolkkonen J (2009). "Functional roles of amyloid-beta protein precursor and amyloid-beta peptides: evidence from experimental studies". Journal of Alzheimer's Disease. 18 (2): 401–12. doi:10.3233/JAD-2009-1154. PMID 19584429.
- ↑ Sadigh-Eteghad S, Talebi M, Farhoudi M, EJ Golzari S, Sabermarouf B, Mahmoudi J (2014). "Beta-amyloid exhibits antagonistic effects on alpha 7 nicotinic acetylcholine receptors in orchestrated manner". Journal of Medical Hypotheses and Ideas. 8 (2): 48–52. doi:10.1016/j.jmhi.2014.01.001.
- ↑ Luo Y, Bolon B, Damore MA, Fitzpatrick D, Liu H, Zhang J, et al. (October 2003). "BACE1 (beta-secretase) knockout mice do not acquire compensatory gene expression changes or develop neural lesions over time". Neurobiology of Disease. 14 (1): 81–8. doi:10.1016/S0969-9961(03)00104-9. PMID 13678669. S2CID 8367440.
- ↑ Bogoyevitch MA, Boehm I, Oakley A, Ketterman AJ, Barr RK (March 2004). "Targeting the JNK MAPK cascade for inhibition: basic science and therapeutic potential". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1697 (1–2): 89–101. doi:10.1016/j.bbapap.2003.11.016. PMID 15023353.
- ↑ Tabaton M, Zhu X, Perry G, Smith MA, Giliberto L (January 2010). "Signaling effect of amyloid-beta(42) on the processing of AβPP". Experimental Neurology. 221 (1): 18–25. doi:10.1016/j.expneurol.2009.09.002. PMC 2812589. PMID 19747481.
- ↑ Zou K, Gong JS, Yanagisawa K, Michikawa M (June 2002). "A novel function of monomeric amyloid beta-protein serving as an antioxidant molecule against metal-induced oxidative damage". The Journal of Neuroscience. 22 (12): 4833–41. doi:10.1523/JNEUROSCI.22-12-04833.2002. PMC 6757724. PMID 12077180.
- ↑ Baruch-Suchodolsky R, Fischer B (May 2009). "Abeta40, either soluble or aggregated, is a remarkably potent antioxidant in cell-free oxidative systems". Biochemistry. 48 (20): 4354–70. doi:10.1021/bi802361k. PMID 19320465.
- ↑ Yao ZX, Papadopoulos V (October 2002). "Function of beta-amyloid in cholesterol transport: a lead to neurotoxicity". FASEB Journal. 16 (12): 1677–9. doi:10.1096/fj.02-0285fje. PMID 12206998. S2CID 17813857.
- ↑ Igbavboa U, Sun GY, Weisman GA, He Y, Wood WG (August 2009). "Amyloid beta-protein stimulates trafficking of cholesterol and caveolin-1 from the plasma membrane to the Golgi complex in mouse primary astrocytes". Neuroscience. 162 (2): 328–38. doi:10.1016/j.neuroscience.2009.04.049. PMC 3083247. PMID 19401218.
- ↑ Maloney B, Lahiri DK (November 2011). "The Alzheimer's amyloid β-peptide (Aβ) binds a specific DNA Aβ-interacting domain (AβID) in the APP, BACE1, and APOE promoters in a sequence-specific manner: characterizing a new regulatory motif". Gene. 488 (1–2): 1–12. doi:10.1016/j.gene.2011.06.004. PMC 3381326. PMID 21699964.
- ↑ Bailey JA, Maloney B, Ge YW, Lahiri DK (November 2011). "Functional activity of the novel Alzheimer's amyloid β-peptide interacting domain (AβID) in the APP and BACE1 promoter sequences and implications in activating apoptotic genes and in amyloidogenesis". Gene. 488 (1–2): 13–22. doi:10.1016/j.gene.2011.06.017. PMC 3372404. PMID 21708232.
- ↑ Kagan BL, Jang H, Capone R, Teran Arce F, Ramachandran S, Lal R, Nussinov R (April 2012). "Antimicrobial properties of amyloid peptides". Molecular Pharmaceutics. 9 (4): 708–17. doi:10.1021/mp200419b. PMC 3297685. PMID 22081976.
- ↑ Schluesener HJ, Su Y, Ebrahimi A, Pouladsaz D (June 2012). "Antimicrobial peptides in the brain: neuropeptides and amyloid". Frontiers in Bioscience. 4 (4): 1375–80. doi:10.2741/S339. PMID 22652879.
- ↑ Li H, Liu CC, Zheng H, Huang TY (2018). "Amyloid, tau, pathogen infection and antimicrobial protection in Alzheimer's disease -conformist, nonconformist, and realistic prospects for AD pathogenesis". Translational Neurodegeneration. 7: 34. doi:10.1186/s40035-018-0139-3. PMC 6306008. PMID 30603085.
- ↑ Sadigh-Eteghad S, Sabermarouf B, Majdi A, Talebi M, Farhoudi M, Mahmoudi J (2014). "Amyloid-beta: a crucial factor in Alzheimer's disease". Medical Principles and Practice. 24 (1): 1–10. doi:10.1159/000369101. PMC 5588216. PMID 25471398.
- ↑ Parker MH, Reitz AB (2000). "Assembly of β-Amyloid Aggregates at the Molecular Level". Chemtracts-Organic Chemistry. 13 (1): 51–56.
- ↑ Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, et al. (August 2008). "Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory". Nature Medicine. 14 (8): 837–42. doi:10.1038/nm1782. PMC 2772133. PMID 18568035. Lay summary – Fox News.
{{cite journal}}: Cite uses deprecated parameter|lay-url=(help) - ↑ Prelli F, Castaño E, Glenner GG, Frangione B (August 1988). "Differences between vascular and plaque core amyloid in Alzheimer's disease". Journal of Neurochemistry. 51 (2): 648–51. doi:10.1111/j.1471-4159.1988.tb01087.x. PMID 3292706. S2CID 39952611.
- ↑ ۲۵٫۰ ۲۵٫۱ Zhao LN, Long H, Mu Y, Chew LY (2012). "The toxicity of amyloid β oligomers". International Journal of Molecular Sciences. 13 (6): 7303–27. doi:10.3390/ijms13067303. PMC 3397527. PMID 22837695.
- ↑ Arispe N, Rojas E, Pollard HB (January 1993). "Alzheimer disease amyloid beta protein forms calcium channels in bilayer membranes: blockade by tromethamine and aluminum". Proceedings of the National Academy of Sciences of the United States of America. 90 (2): 567–71. Bibcode:1993PNAS...90..567A. doi:10.1073/pnas.90.2.567. PMC 45704. PMID 8380642.
- ↑ Abramov AY, Canevari L, Duchen MR (December 2004). "Calcium signals induced by amyloid beta peptide and their consequences in neurons and astrocytes in culture". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 8th European Symposium on Calcium. 1742 (1–3): 81–7. doi:10.1016/j.bbamcr.2004.09.006. PMID 15590058.
- ↑ Ekinci FJ, Linsley MD, Shea TB (March 2000). "Beta-amyloid-induced calcium influx induces apoptosis in culture by oxidative stress rather than tau phosphorylation". Brain Research. Molecular Brain Research. 76 (2): 389–95. doi:10.1016/S0169-328X(00)00025-5. PMID 10762716.
- ↑ Pannuzzo M, Milardi D, Raudino A, Karttunen M, La Rosa C (June 2013). "Analytical model and multiscale simulations of Aβ peptide aggregation in lipid membranes: towards a unifying description of conformational transitions, oligomerization and membrane damage". Physical Chemistry Chemical Physics. 15 (23): 8940–51. Bibcode:2013PCCP...15.8940P. doi:10.1039/c3cp44539a. PMID 23588697.
- ↑ Pannuzzo M (June 2016). "On the physiological/pathological link between Aβ peptide, cholesterol, calcium ions and membrane deformation: A molecular dynamics study". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858 (6): 1380–9. doi:10.1016/j.bbamem.2016.03.018. PMID 27003127.
- ↑ ۳۱٫۰ ۳۱٫۱ ۳۱٫۲ Ghiso J, Frangione B (December 2002). "Amyloidosis and Alzheimer's disease". Advanced Drug Delivery Reviews. 54 (12): 1539–51. doi:10.1016/S0169-409X(02)00149-7. PMID 12453671.
- ↑ ۳۲٫۰ ۳۲٫۱ Selkoe DJ (October 2001). "Clearing the brain's amyloid cobwebs". Neuron. 32 (2): 177–80. doi:10.1016/S0896-6273(01)00475-5. PMID 11683988. S2CID 17860343.
- ↑ Hardy J, Duff K, Hardy KG, Perez-Tur J, Hutton M (September 1998). "Genetic dissection of Alzheimer's disease and related dementias: amyloid and its relationship to tau". Nature Neuroscience. 1 (5): 355–8. doi:10.1038/1565. PMID 10196523. S2CID 52807658.
- ↑ Roses AD (February 1998). "Alzheimer diseases: a model of gene mutations and susceptibility polymorphisms for complex psychiatric diseases". American Journal of Medical Genetics. 81 (1): 49–57. doi:10.1002/(SICI)1096-8628(19980207)81:1<49::AID-AJMG10>3.0.CO;2-W. PMID 9514588.
- ↑ Xie L, Helmerhorst E, Taddei K, Plewright B, Van Bronswijk W, Martins R (May 2002). "Alzheimer's beta-amyloid peptides compete for insulin binding to the insulin receptor". The Journal of Neuroscience. 22 (10): RC221. doi:10.1523/JNEUROSCI.22-10-j0001.2002. PMC 6757630. PMID 12006603.
- ↑ Ray WJ, Yao M, Mumm J, Schroeter EH, Saftig P, Wolfe M, et al. (December 1999). "Cell surface presenilin-1 participates in the gamma-secretase-like proteolysis of Notch". The Journal of Biological Chemistry. 274 (51): 36801–7. doi:10.1074/jbc.274.51.36801. PMID 10593990.
- ↑ Roberts SB (December 2002). "Gamma-secretase inhibitors and Alzheimer's disease". Advanced Drug Delivery Reviews. 54 (12): 1579–88. doi:10.1016/S0169-409X(02)00155-2. PMID 12453675.
- ↑ Vassar R, Bennett BD, Babu-Khan S, Kahn S, Mendiaz EA, Denis P, et al. (October 1999). "Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE". Science. 286 (5440): 735–41. doi:10.1126/science.286.5440.735. PMID 10531052.
- ↑ Vassar R (December 2002). "Beta-secretase (BACE) as a drug target for Alzheimer's disease". Advanced Drug Delivery Reviews. 54 (12): 1589–602. doi:10.1016/S0169-409X(02)00157-6. PMID 12453676.
- ↑ Zlokovic BV, Frangione B (2003). Transport-clearance hypothesis for Alzheimer's disease and potential therapeutic implications. Landes Bioscience. pp. 114–122.
- ↑ Masters CL, Simms G, Weinman NA, Multhaup G, McDonald BL, Beyreuther K (June 1985). "Amyloid plaque core protein in Alzheimer disease and Down syndrome". Proceedings of the National Academy of Sciences of the United States of America. 82 (12): 4245–9. Bibcode:1985PNAS...82.4245M. doi:10.1073/pnas.82.12.4245. PMC 397973. PMID 3159021.
- ↑ Castaño EM, Prelli F, Soto C, Beavis R, Matsubara E, Shoji M, Frangione B (December 1996). "The length of amyloid-beta in hereditary cerebral hemorrhage with amyloidosis, Dutch type. Implications for the role of amyloid-beta 1-42 in Alzheimer's disease". The Journal of Biological Chemistry. 271 (50): 32185–91. doi:10.1074/jbc.271.50.32185. PMID 8943274.
- ↑ Roher AE, Lowenson JD, Clarke S, Woods AS, Cotter RJ, Gowing E, Ball MJ (November 1993). "beta-Amyloid-(1-42) is a major component of cerebrovascular amyloid deposits: implications for the pathology of Alzheimer disease". Proceedings of the National Academy of Sciences of the United States of America. 90 (22): 10836–40. Bibcode:1993PNAS...9010836R. doi:10.1073/pnas.90.22.10836. PMC 47873. PMID 8248178.
- ↑ Shinkai Y, Yoshimura M, Ito Y, Odaka A, Suzuki N, Yanagisawa K, Ihara Y (September 1995). "Amyloid beta-proteins 1-40 and 1-42(43) in the soluble fraction of extra- and intracranial blood vessels". Annals of Neurology. 38 (3): 421–8. doi:10.1002/ana.410380312. PMID 7668828. S2CID 24568952.
- ↑ Kamal A, Almenar-Queralt A, LeBlanc JF, Roberts EA, Goldstein LS (December 2001). "Kinesin-mediated axonal transport of a membrane compartment containing beta-secretase and presenilin-1 requires APP". Nature. 414 (6864): 643–8. Bibcode:2001Natur.414..643K. doi:10.1038/414643a. PMID 11740561. S2CID 4421228.
- ↑ Lue LF, Kuo YM, Roher AE, Brachova L, Shen Y, Sue L, et al. (September 1999). "Soluble amyloid beta peptide concentration as a predictor of synaptic change in Alzheimer's disease". The American Journal of Pathology. 155 (3): 853–62. doi:10.1016/S0002-9440(10)65184-X. PMC 1866907. PMID 10487842.
- ↑ Schirinzi T, Di Lazzaro G, Sancesario GM, Colona VL, Scaricamazza E, Mercuri NB, et al. (December 2017). "Levels of amyloid-beta-42 and CSF pressure are directly related in patients with Alzheimer's disease". Journal of Neural Transmission. 124 (12): 1621–1625. doi:10.1007/s00702-017-1786-8. PMID 28866757. S2CID 22267507.
- ↑ Kayed R, Head E, Thompson JL, McIntire TM, Milton SC, Cotman CW, Glabe CG (April 2003). "Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis". Science. 300 (5618): 486–9. Bibcode:2003Sci...300..486K. doi:10.1126/science.1079469. hdl:2027.42/150615. PMID 12702875. S2CID 29614957.
- ↑ Gandy S, Simon AJ, Steele JW, Lublin AL, Lah JJ, Walker LC, et al. (August 2010). "Days to criterion as an indicator of toxicity associated with human Alzheimer amyloid-beta oligomers". Annals of Neurology. 68 (2): 220–30. doi:10.1002/ana.22052. PMC 3094694. PMID 20641005. Lay summary – Drug Discovery and Development.
{{cite journal}}: Cite uses deprecated parameter|lay-url=(help) - ↑ Jin WS, Bu XL, Liu YH, Shen LL, Zhuang ZQ, Jiao SS, et al. (February 2017). "Plasma Amyloid-Beta Levels in Patients with Different Types of Cancer". Neurotoxicity Research. 31 (2): 283–288. doi:10.1007/s12640-016-9682-9. PMID 27913965. S2CID 3795042.
- ↑ Lim S, Yoo BK, Kim HS, Gilmore HL, Lee Y, Lee HP, et al. (December 2014). "Amyloid-β precursor protein promotes cell proliferation and motility of advanced breast cancer". BMC Cancer. 14: 928. doi:10.1186/1471-2407-14-928. PMC 4295427. PMID 25491510.
- ↑ Hartley SL, Handen BL, Devenny D, Mihaila I, Hardison R, Lao PJ, et al. (October 2017). "Cognitive decline and brain amyloid-β accumulation across 3 years in adults with Down syndrome". Neurobiology of Aging. 58: 68–76. doi:10.1016/j.neurobiolaging.2017.05.019. PMC 5581712. PMID 28715661.
- مشارکتکنندگان ویکیپدیا. «Amyloid beta». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۹ ژوئن ۲۰۲۱.
