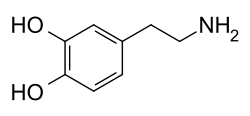
دوپامین
دوپامین (به انگلیسی Dopamine مخفف: DA) یک ترکیب آلی از خانواده کاتکولامینها و فنتیلآمینها است که نقش حیاتی در بدن و مغز دارد. دوپامین از پیشسازهایش در مغز و کلیه سنتز میشود، دوپامین همچنین در بیشتر گیاهان و جانوران سنتز میشود. دوپامین در مغز نقش ناقل عصبی و در خون نقش هورمونی دارد، دوپامین به صورت عمده در وزیکول (ریزکیسه)های نورون یاخته عصبی)های دوپامینرژیک و همچنین در غدد «آدرنال» ذخیره میشود. گیرندههای دوپامینرژیک به دو نوع همانند D1 متشکل از D1 و D5 و همانند D2 متشکل از D2, D3, D4 تقسیم میشوند که هرکدام در نواحی مختلف سیستم اعصاب مرکزی حضور دارند.[۱]
در مغز چهار مسیر دوپامین وجود دارد که مسیرهای دوپامینرژیک نامیده میشوند:
• مسیرهای مزوکورتیکولیمبیک
این بخش که به عنوان ({مسیر پاداش﴾) شناخته میشود به دو بخش مزولیمبیک و مزوکورتیکال تقسیم میشود و متشکل از VTA, Nucleus accumbens، جسم مخطط، عقدههای قاعده ای، برآمدگی بویایی، آمیگدال ﴿نقش: درک احساسات و پاسخ به آن _تعدیل درد_نقش مهم در یادگیری﴾و لوب فرونتال میباشد که نقش اساسی در خلق و خو، احساسات، پیشبینی و ارزیابی پاداش، حافظه کاری، انگیزه، تصمیمگیری و عملکرد اجرایی دارد. این بخشها بیشتر از سلولهای دوپامینرژیک نوع D1 و D2 تشکیل شدهاست.[۲]
•مسیر نایگرواستریاتال
این مسیر توده سیاه پارس کمپاکت را به جسم مخطط بالایی (هسته دم دار و پوتامن) متصل میکند و نقش اساسی در ایجاد حرکات بدن، مهار حرکات و لوپ عقدههای قاعده ای دارد. از بین رفتن نورونهایهای دوپامینرژیک در توده سیاه و این مسیر یکی از اساسیترین دلایل بیماری پارکینسون میباشد.
•مسیر توبرواینفوندیبولار
یکی از مسیرهای مهم دوپامینرژیک است که هیپوتالاموس، هسته اینفوندیبولار و غده هیپوفیز را درگیر میکند. فعال سازی این مسیر باعث ترشح پرولاکتین توسط هیپوفیز میگردد.
برخلاف آنچه در رسانه و عموم مردم دوپامین را به عنوان ماده شیمیایی پاداش یا هورمون لذت و پاداش تبلیغ میکنند، در علوم مغز و اعصاب و داروشناسی تصور بر این است که دوپامین در اصل نقش برجسته ای در برانگیخته سازی و تشخیص محرک لذت بخش در محیط فرد دارد.[۳] بهطور ساده توجه شخص را به سمت محرکهای لذت بخشی که توسط سیستم اعصاب محیطی درک میشوند (غذا، شیرینی، رابطه جنسی، بازیهای رایانه ای یا مواد مخدر) جلب میکند و شخص را به سمت رفتار موجب لذت سوق میدهد و باعث ایجاد میل و رغبت به این محرکهای لذت بخش میگردد. [۴] در برخی موارد تکرار این رفتارها، موجب ایجاد عادت شده و بسته به نوع محرک و لذت ایجاد شده ناشی از آن میتواند موجب وابستگی روانی و جسمی یا حتی اعتیاد گردد. لازم است بدانیم دوپامین یا میزان ترشح دوپامین عامل ایجاد اعتیاد نیست و عمده دوپامین با جویای تازگی شدن (Novelty seeking) و برانگیخته کردن شخص برای انجام کار لذت بخش نقش خود را ایفا میکند.[۵] حس سرخوشی پس از مصرف مواد مخدر تنها به دلیل ترشح این ناقل عصبی نبوده و تعداد گستردهای از شبکههای مغزی را درگیر میکند و ترشحات اندورفین، بتا اندورفین، انکفالین و سروتونین تأثیرات فیزیکی و روانی به مراتب بیشتری در سرخوشی دارند. دوپامین یک ناقل عصبی حیاتی برای بقای هر جانوری میباشد.[۶]
دوپامین همچنین در کنترل دستگاه حرکتی نقش دارد بهطوری که با از بین رفتن نورونهای دوپامینرژیک در توده سیاه پارس کمپامت علائم بیماری پارکینسون پدید میآیند. از کارکردهای دیگر دوپامین در مغز کنترل و تنظیم ترشح هورمونهاست. دوپامین از طریق تحریک گیرنده دو دوپامینی (D2) ترشح پرولاکتین را کاهش میدهد و از این طریق بر تولید شیر نیز اثرگذار است.
در خارج از مغز و در بدن، دوپامین نقش هورمونی دارد، دوپامین در خون از آزادسازی نوراپینفرین جلوگیری میکند و باعث تنگی عروق خونی میگردد، در کلیه دفع سدیم و حجم ادرار را افزایش میدهد. ترشح انسولین از «پانکراس» را کاهش و تحرک دستگاه گوارش را نیز کاهش میدهد.
ساختار[ویرایش]
یک مولکول دوپامین شامل یک واحد کاتکول است که توسط یک زنجیره اتیل به واحد آمینی متصل شدهاست. دوپامین یکی از سادهترین ملکولهای خانواده کاتکول آمین است. همانند اکثر آمینها دوپامین نیز یک باز آلی است و با محیط اسیدی واکنش اسید-باز میدهد. دوپامین جهت مصارف پزشکی و آزمایشگاهی به صورت نمک هیدروکلرید عرضه میشود.
بیوشیمی[ویرایش]
سنتز[ویرایش]
دوپامین در سلولهای مختلفی از جمله نورونها و بعضی از سلولهای غدد فوق کلیوی سنتز میشود. مسیر اولیه و مسیرهای ثانویه سنتز دوپامین:
مسیر اولیه
مسیر ثانویه:
مسیر ثانویه:
اختلالات، فارماکولوژی و بیماریها[ویرایش]
اختلال کمبود توجه و بیش فعالی (ADHD)
نقش سیستمهای دوپامینرژیک بشدت در بیماری اختلال کمبود توجه و بیش فعالی(ADHD) تأثیر گذار است. داروهایی که برای درمان این بیماری مورد استفاده قرار میگیرند (متیل فنیدات، آمفتامینها و آتوموکستین) با افزایش دوپامین و نوراپینفرین علائم این بیماری را کاهش میدهند. ریتالین برای مثال با مهار کردن بازجذب دوپامین و نوراپینفرین در محلهای پس سیناپسی کارآمدی این ناقلهای عصبی را افزایش میدهد. نواحی فرونتال و استریتال مغز بشدت توسط دوپامین پیامرسانی میشود و دلیل تفاوت ساختار مغز افراد مبتلا به بیش فعالی نسبت به افراد غیر مبتلا را تا حد زیادی توجیه میکند. البته بیش فعالی ساختار ژنتیکی قوی داشته، و ژنهایی که در این بیماری تأثیر میگذارند معمولاً فرایند متابولیسم دوپامین را مختل میکنند، در نتیجه موجب اختلالات رفتاری مانند مشکل در تمرکز و تمرکز پایدار، مهار کردن رفتار (مهار کنترل) و فراموش کردن اشیا و به یاد نداشتن جزئیات(حافظه کاری). ژنهای دخیل در علل بیش فعالی و کمبود توجه، ژن دوپا دکربولیکساز که برای متابولیسم دوپامین حیاتی ست و ژنهای DRD1، DRD4 و ژن COMT میباشند.
عصبشناسی[ویرایش]
ارتباط بین اجتماعی بودن و دوپامین بسیار شناخته شدهاست. سوء مصرف مواد دوپامینرژیک مثل کوکائین، زانتینها و آمفتامینها جهت بهبود عملکرد اجتماعی، افزایش اطمینان و اعتماد به نفس بسیار رایج است. در یک مطالعه جدید ارتباط مستقیمی بین موقعیت اجتماعی افراد و میزان چسبندگی گیرندههای دوپامین نوع دوم و سوم (D2/3 binding affinity) در استریاتوم(striatum) یافت شدهاست.[۱] برخی از مطالعات نیز دقیقاً کاهش میزان چسبندگی گیرندههای نوع دوم دوپامین را در استریاتوم افراد مبتلا به اضطراب اجتماعی نشان میدهد.[۲] برخی مطالعات دیگر به غیرطبیعی بودن میزان ترانسپورترهای دوپامین(dopamine transporter) در استریاتوم افراد مبتلا اشاره کردهاند.[۳][۴] هر چند برخی از محققین نیز نتایج متفاوتی به دست آوردهاند.[۵] ولی شواهد بسیاری بر نوعی ناهنجاری در سیستم دوپامینرژیک مبتلایان تأکید میکند. به عنوان مثال نقص در تمرکز، خستگی، بی علاقگی به امور روزمره و روابط اجتماعی، کاهش اعتماد به نفس و … در مبتلایان دیده میشود. مبتلایان نیز داروهای دوپامینرژیک را مؤثرترین داروها در برخورد کوتاه مدت با این اختلال میپندارند. برخی تحقیقات نیز میزان بالای شیوع اضطراب اجتماعی در بین بیماران مبتلا به پارکینسون و شیزوفرنی را نشان میدهد. در یک مطالعه اضطراب اجتماعی در ۵۰ درصد از مبتلایان به پارکینسون تشخیص داده شدهاست.[۶] مطالعات دیگری نیز نشان دادهاند برخی آنتاگونیستهای دوپامین(dopamine antagonists) مثل هالوپریدول ممکن است در افراد غیرمبتلا علائم اضطراب اجتماعی ایجاد کند.[۷] که نقش دوپامین در اضطراب اجتماعی را پررنگ تر میکند.
دیگر کارکردها[ویرایش]
دوپامین در هیپوفیز موجب توقف تراوش پرولاکتین میشود، بنابراین در تراوش شیر وقفه ایجاد میکند و آگونیستهای گیرنده دوپامین مانند کابرگولین در درمان هایپرپرولاکتینمی و تراوش شیر نابجا استفاده میشوند. داروهای آنتاگونیست دوپامین موجب کاهش تهوع میشوند؛ مانند متوکلوپرامید آنتاگونیست گیرنده D2. داروهای آنتاگونیست دوپامین همچنین در درمان اسکیزوفرنی کاربرد دارند مانند تری فلوپرازین و هالوپریدول.
منابع[ویرایش]
- ↑ Diana Martinez, Daria Orlowska, Rajesh Narendran, Mark Slifstein, Fei Liu, Dileep Kumar, Allegra Broft,Ronald Van Heertum, and Herbert D. Kleber (2010). "Dopamine Type 2/3 Receptor Availability in the Striatum and Social Status in Human Volunteers". BIOL PSYCHIATRY. 67: 275–278.
{{cite journal}}: Cite has empty unknown parameter:|month=(help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Franklin R. Schneier, M.D. , Michael R. Liebowitz, M.D. , Anissa Abi-Dargham, M.D. , Yolanda Zea-Ponce, Ph.D. , Shu-Hsing Lin, Ph.D. , and Marc Laruelle, M.D. (2000). "Low Dopamine D2 Receptor Binding Potential in Social Phobia". Am J Psychiatry. 157 (3): 457–459.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ van der Wee; et al. (2008). "Increased Serotonin and Dopamine Transporter Binding in Psychotropic Medication–Naïve Patients with Generalized Social Anxiety Disorder Shown by 123I-ß-(4-Iodophenyl)-Tropane SPECT". The Journal of Nuclear Medicine. 49 (5): 757–63. doi:10.2967/jnumed.107.045518. PMID 18413401.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help) - ↑ Jari Tiihonen, M.D. , Ph.D. , Jyrki Kuikka, Ph.D. , Kim Bergström, Ph.D. ,
Ulla Lepola, M.D. , Ph.D. , Hannu Koponen, M.D. , Ph.D. , and Esa Leinonen, M.D. , Ph.D. (1997). "Dopamine Reuptake Site Densities in Patients With Social Phobia". Am J Psychiatry. 154: 239–242.
{{cite journal}}: line feed character in|author=at position 75 (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Franklin R. Schneier, M.D. , Anissa Abi-Dargham, M.D. , Diana Martinez, M.D. , Mark Slifstein, Ph.D. , Dah-Ren Hwang, Ph.D. , Michael R. Liebowitz, M.D. , and Marc Laruelle, M.D. (2009). "Dopamine Transporters, D2 Receptors, and Dopamine Release in
Generalized Social Anxiety Disorder". Depress Anxiety. 26 (5): 411–418. doi:10.1002/da.20543.
{{cite journal}}: line feed character in|title=at position 61 (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Kummer A, Cardoso F, Teixeira AL. (2008). "Frequency of social phobia and psychometric properties of the Liebowitz social anxiety scale in Parkinson's disease". Mov Disord. 23 (12): 1739–1743.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Mikkelsen EJ, Detlor J, Cohen DJ (1981). "School avoidance and social phobia triggered by haloperidol in patients with Tourette's disorder". Am J Psychiatry. 138 (12): 1572–1576.
{{cite journal}}: Cite has empty unknown parameter:|month=(help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link)