مغز انسان: تفاوت میان نسخهها
جز ابرابزار |
←مرکز کنترل بدن: ابرابزار |
||
| خط ۱۰۲: | خط ۱۰۲: | ||
=== مرکز کنترل بدن === |
=== مرکز کنترل بدن === |
||
[[لوب پیشانی]] در [[استدلال]]، [[حرکت]] ارادی، [[احساسات|احساس]] و [[زبان]] نقش دارد. این لوب [[کورتکس حرکتی|قشر حرکتی]]، [[قشر پیشپیشانی|قشر پیش پیشانی]] و [[منطقه بروکا]] را نیز شامل میشود. قشر حرکتی مسئول ایجاد، تعادل و [[هماهنگی حرکتی|هماهنگی حرکات]] در بدن است؛ قشر پیش پیشانی، مسئول [[عملکردهای شناختی]] سطح بالا و پیچیدهاست و منطقه بروکا برای فرایندهای مرتبط با زبان ضروریست<ref>{{یادکرد وب|عنوان=Parts of the Brain {{!}} Introduction to Psychology|نشانی=https://courses.lumenlearning.com/wmopen-psychology/chapter/outcome-parts-of-the-brain/|وبگاه=courses.lumenlearning.com|بازبینی=2021-10-18|کد زبان=en-US}}</ref> و آسیب به آن میتواند بیماریهایی مانند [[آفازی بروکا]] را ایجاد کند.<ref name=":12">{{یادکرد کتاب|عنوان=انجمن علوم اعصاب، مترجم رضا پناهی. بهنام سور، علی شهبازی، عباس حقپرست، حقایق مغز. تهران: مؤسسه انتشارات ستایش هستی، ۱۳۹۸ {{شابک|978-622-6445-63-4}}، ص ۸۱.}}</ref> مغز به وسیله ارتباط با مخچه پیامهای ارادی و نیمه ارادی را از طریق [[اعصاب مغزی]] به نورونهای حرکتی بدن منتقل و به وسیله [[مجرای نخاعی]] پیامهای حرکتی را از مغز، به دیگر بخشهای بدن و [[عضو (کالبدشناسی)|اندام]]ها ارسال میکند.{{sfn|Guyton & Hall|2011|p=۶۸۵}} اعصاب اطراف [[جمجمه]] نیز حرکات مربوط به [[چشم]]، [[دهان انسان|دهان]] و صورت را بدون واسطه تنظیم و هماهنگ میکند.{{sfn|Guyton & Hall|2011|p=۶۸۷}} |
[[لوب پیشانی]] در [[استدلال]]، [[حرکت]] ارادی، [[احساسات|احساس]] و [[زبان]] نقش دارد. این لوب [[کورتکس حرکتی|قشر حرکتی]]، [[قشر پیشپیشانی|قشر پیش پیشانی]] و [[منطقه بروکا]] را نیز شامل میشود. قشر حرکتی مسئول ایجاد، تعادل و [[هماهنگی حرکتی|هماهنگی حرکات]] در بدن است؛ قشر پیش پیشانی، مسئول [[عملکردهای شناختی]] سطح بالا و پیچیدهاست و منطقه بروکا برای فرایندهای مرتبط با زبان ضروریست<ref>{{یادکرد وب|عنوان=Parts of the Brain {{!}} Introduction to Psychology|نشانی=https://courses.lumenlearning.com/wmopen-psychology/chapter/outcome-parts-of-the-brain/|وبگاه=courses.lumenlearning.com|بازبینی=2021-10-18|کد زبان=en-US}}</ref> و آسیب به آن میتواند بیماریهایی مانند [[آفازی بروکا]] را ایجاد کند.<ref name=":12">{{یادکرد کتاب|عنوان=انجمن علوم اعصاب، مترجم رضا پناهی. بهنام سور، علی شهبازی، عباس حقپرست، حقایق مغز. تهران: مؤسسه انتشارات ستایش هستی، ۱۳۹۸ {{شابک|978-622-6445-63-4}}، ص ۸۱.}}</ref> مغز به وسیله ارتباط با مخچه پیامهای ارادی و نیمه ارادی را از طریق [[اعصاب مغزی]] به نورونهای حرکتی بدن منتقل و به وسیله [[مجرای نخاعی]] پیامهای حرکتی را از مغز، به دیگر بخشهای بدن و [[عضو (کالبدشناسی)|اندام]]ها ارسال میکند.{{sfn|Guyton & Hall|2011|p=۶۸۵}} اعصاب اطراف [[جمجمه]] نیز حرکات مربوط به [[چشم]]، [[دهان انسان|دهان]] و صورت را بدون واسطه تنظیم و هماهنگ میکند.{{sfn|Guyton & Hall|2011|p=۶۸۷}} |
||
== پژوهش == |
|||
مغز بهطور کامل درک نشدهاست و تحقیقات در مورد آن همچنان در حال انجام است.<ref name="HCP2009">{{Cite journal|last=Van Essen|first=D.C.|displayauthors=etal|date=October 2012|title=The Human Connectome Project: A data acquisition perspective|journal=NeuroImage|volume=62|issue=4|pages=2222–2231|doi=10.1016/j.neuroimage.2012.02.018|pmc=3606888|pmid=22366334}}</ref> دانشمندان [[علوم اعصاب]]، همراه با محققانی از رشتههای دیگر، چگونگی کارکرد مغز انسان را مطالعه میکنند. مرزهای بین تخصصهای علوم اعصاب، [[عصبشناسی]] و سایر رشتهها مانند [[روانپزشکی|روانپزشکی]] از بین رفتهاست زیرا همه آنها تحت تأثیر [[پژوهش بنیادی|پژوهشهای بنیادی]] در علوم اعصاب قرار دارند. |
|||
پژوهشهای علوم اعصاب در دهههای اخیر بهطور قابل توجهی گسترش یافتهاست. " دهه مغز " ([[:en:Decade_of_the_Brain|Decade of the Brain]])، ابتکار دولت ایالات متحده در دهه ۱۹۹۰، در نظر گرفته میشود که موجب افزایش تحقیقات در این زمینه را مشخص کردهاست،<ref>{{Cite journal|last=Jones|first=E.G.|last2=Mendell|first2=L.M.|date=April 30, 1999|title=Assessing the Decade of the Brain|journal=Science|volume=284|issue=5415|page=739|bibcode=1999Sci...284..739J|doi=10.1126/science.284.5415.739|pmid=10336393}}</ref> و در سال ۲۰۱۳ توسط [[:en:BRAIN_Initiative|BRAIN Initiative]] دنبال شد.<ref>{{Cite web|title=A $4.5 Billion Price Tag for the BRAIN Initiative?|url=http://www.sciencemag.org/news/2014/06/45-billion-price-tag-brain-initiative|website=Science {{!}} AAAS|date=June 5, 2014|archiveurl=https://web.archive.org/web/20170618154752/http://www.sciencemag.org/news/2014/06/45-billion-price-tag-brain-initiative|archivedate=June 18, 2017}}</ref> [[پروژه ارتباط انسانی]] یک مطالعه پنج ساله بود که در سال ۲۰۰۹ برای تجزیه و تحلیل اتصالات آناتومیکی و کارکردی بخشهای مغز راهاندازی شد و دادههای زیادی ارائه کردهاست.<ref name="HCP2009">{{Cite journal|last=Van Essen|first=D.C.|displayauthors=etal|date=October 2012|title=The Human Connectome Project: A data acquisition perspective|journal=NeuroImage|volume=62|issue=4|pages=2222–2231|doi=10.1016/j.neuroimage.2012.02.018|pmc=3606888|pmid=22366334}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFVan_Essen2012">Van Essen, D.C. ; et al. </cite></ref> |
|||
=== مواد و روشها === |
|||
دادههای مربوط به ساختار و کارکرد مغز انسان از روشهای آزمایشی گوناگون، از جمله حیوانات و انسانها به دست میآید. اطلاعات مربوط به ضربه مغزی و سکته مغزی اطلاعاتی در مورد عملکرد بخشهایی از مغز و اثرات [[آسیب مغزی]] ارائه کردهاست. [[تصویربرداری عصبی]] برای تجسم مغز و ثبت فعالیت مغز استفاده میشود. [[الکتروفیزیولوژی]] برای اندازهگیری، ثبت و نظارت بر فعالیت الکتریکی قشر مغز استفاده میشود. اندازهگیریها ممکن است پتانسیل میدانی موضعی نواحی قشر مغز یا فعالیت یک نورون یکتا باشد. [[نوار مغزی|الکتروانسفالوگرام]] میتواند فعالیت الکتریکی قشر مغز را با استفاده از [[الکترود|الکترودهایی]] که بهرصورت غیر مخرب وی [[پوست سر]] قرار میگیرند، ثبت کند.<ref>{{Cite journal|last=Towle|first=V.L.|displayauthors=etal|date=January 1993|title=The spatial location of EEG electrodes: locating the best-fitting sphere relative to cortical anatomy|journal=Electroencephalography and Clinical Neurophysiology|volume=86|issue=1|pages=1–6|doi=10.1016/0013-4694(93)90061-y|pmid=7678386}}</ref> {{Sfn|Purves|2012}} |
|||
روشهای مخرب شامل [[ایکاگ|الکتروکورتیکوگرافی]] است که از الکترودهایی استفاده میکند که مستقیماً روی سطح مغز قرار میگیرند. این روش در نقشهبرداری تحریکی قشر مغز ([[:en:Cortical_stimulation_mapping|cortical stimulation mapping]]) استفاده میشود که در مطالعه رابطه بین نواحی قشر مغز و کارکرد سیستمیک آنها استفاده میشود.<ref>{{Cite journal|last=Silverstein|first=J.|year=2012|title=Mapping the Motor and Sensory Cortices: A Historical Look and a Current Case Study in Sensorimotor Localization and Direct Cortical Motor Stimulation|url=http://www.readperiodicals.com/201203/2662763741.html|journal=The Neurodiagnostic Journal|volume=52|issue=1|pages=54–68|pmid=22558647|archive-url=https://web.archive.org/web/20121117021132/http://www.readperiodicals.com/201203/2662763741.html|archive-date=November 17, 2012}}</ref> با استفاده از میکروالکترودهای ([[:en:Microelectrode|microelectrodes]]) بسیار کوچکتر، ضبطهای تک واحدی ([[:en:Single-unit_recording|single-unit recordings]]) را میتوان از یک نورون منفرد انجام داد که [[وضوح فضایی]] و [[وضوح زمانی]] بالایی را ارائه میدهد. این امکان ارتباط بین فعالیت مغز با رفتار و ایجاد نقشههای عصبی را فراهم کردهاست.<ref>{{Cite journal|last=Boraud|first=T.|last2=Bezard|first2=E.|displayauthors=etal|year=2002|title=From single extracellular unit recording in experimental and human Parkinsonism to the development of a functional concept of the role played by the basal ganglia in motor control|journal=Progress in Neurobiology|volume=66|issue=4|pages=265–283|doi=10.1016/s0301-0082(01)00033-8|pmid=11960681}}</ref> |
|||
توسعه [[شبهاندام مغزی|ارگانوئیدهای مغزی]] راههایی را برای مطالعه رشد مغز و قشر مغز و درک رشد بیماری باز کردهاست و پیامدهای بیشتری را برای کاربردهای درمانی ارائه میدهد.<ref name="Lancaster">{{Cite journal|last=Lancaster|first=MA|last2=Renner|first2=M|last3=Martin|first3=CA|last4=Wenzel|first4=D|last5=Bicknell|first5=LS|last6=Hurles|first6=ME|last7=Homfray|first7=T|last8=Penninger|first8=JM|last9=Jackson|first9=AP|date=September 19, 2013|title=Cerebral organoids model human brain development and microcephaly.|journal=Nature|volume=501|issue=7467|pages=373–9|bibcode=2013Natur.501..373L|doi=10.1038/nature12517|pmc=3817409|pmid=23995685}}</ref><ref name="Lee">{{Cite journal|last=Lee|first=CT|last2=Bendriem|first2=RM|last3=Wu|first3=WW|last4=Shen|first4=RF|date=August 20, 2017|title=3D brain Organoids derived from pluripotent stem cells: promising experimental models for brain development and neurodegenerative disorders.|journal=Journal of Biomedical Science|volume=24|issue=1|page=59|doi=10.1186/s12929-017-0362-8|pmc=5563385|pmid=28822354}}</ref> |
|||
=== تصویربرداری === |
|||
{{اصلی|تصویربرداری رزونانس مغناطیسی مغز}} |
|||
=== بیان ژن و پروتئین === |
|||
{{اصلی|بیوانفورماتیک}} |
|||
== فیزیولوژی == |
== فیزیولوژی == |
||
نسخهٔ ۱ نوامبر ۲۰۲۱، ساعت ۰۹:۵۲
| مغز انسان | |
|---|---|
 مغز انسان و جمجمه | |
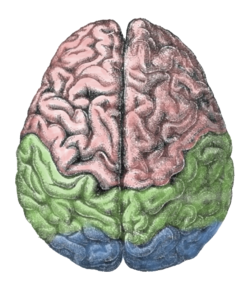 لوبهای بالایی از نیمکرههای مخ: لوبهای پیشانی (صورتی)، لوبهای آهیانهای (سبز)، لوبهای پسسری (آبی) | |
| جزئیات | |
| ساخته از | لوله عصبی |
| دستگاه | دستگاه عصبی مرکزی |
| سرخرگها | سرخرگ کاروتید درونی، سرخرگ مهرهای |
| سیاهرگها | سیاهرگ ژوگولار داخلی، وریدهای داخلی مخ؛ وریدهای خارجی: (فوقانی، میانی و وریدهای مخ تحتانی)، ورید قاعدهای و وریدهای مخچهای |
| شناسهها | |
| لاتین | مخ[۱] |
| یونانی | ἐγκέφαλος (enképhalos)[۲] |
| TA98 | A14.1.03.001 |
| TA2 | 5415 |
| FMA | 50801 |
مغز انسان، عضو مرکزی دستگاه عصبی انسان است که به همراه طناب نخاعی، دستگاه عصبی مرکزی را تشکیل میدهند. مغز، شامل مخ، ساقه مغز و مخچه است. این عضو، اکثر فعالیتهای بدن، همچون پردازش، یکپارچه سازی و هماهنگکردن اطلاعات دریافتی از اعضای حسی را کنترل کرده و با ارسال دستورالعملهایی به سایر نقاط بدن، تصمیمسازی میکند. مغز در استخوانهای جمجمه قرار داشته و توسط آنها محافظت میشود.
مخ، بزرگترین بخش از مغز انسان است و شامل دو نیمکره است. هر نیمکره دارای هسته داخلی از جنس ماده سفید است به طوری که سطح خارجی آن – قشر مغز – از ماده خاکستری تشکیل شدهاست. قشر مغز دارای لایهای خارجی به نام نئوکورتکس و لایهای داخلی به نام آلوکورتکس[الف] است. نئوکورتکس از شش لایه نورونی تشکیل شده در حالی که آلوکورتکس، سه یا چهار لایه نورونی دارد. هر نیمکره بهطور قراردادی به چهار لوب تقسیمبندی شده: پیشانی، گیجگاهی، آهیانه، پسسری. لوب پیشانی، جایگاه عملکردهای اجرایی همچون خود-کنترلی، برنامهریزی، استدلال و تفکر مجرد است در حالی که لوب پسسری به بینایی اختصاص داده شدهاست. در داخل هر لوب، نواحی قشری دارای مناطق عملکردی بهخصوصی چون حسی، حرکتی و ارتباطی[ب] است. گرچه که نیمکرههای چپ و راست شباهت گستردهای از نظر شکل و عملکرد با یکدیگر دارند، به طوری که برخی از این عملکردها مرتبط با یک سمت اند، همچون زبان که به نیمکره چپ و توانایی تصور بصری-فضایی که به سمت راست نیمکره مغز مرتبط اند. نیمکرهها توسط نوارهای عصبی رابط به هم متصل میشوند، بزرگترین این نوارها، جسم پینهای است.
مخ، توسط ساقه مغز به طناب نخاعی متصل شدهاست. ساقه مغز شامل میانمغز، پل مغز و بصل النخاع است. مخچه توسط سه جفت نوار عصبی به نام پایکهای مخچهای[پ] به ساقه مغز وصل شدهاست. در مخ، دستگاه بطنی شامل چهار بطن به هم متصل قرار دارد که در آنها مایع مغزی-نخاعی تولید شده و به گردش در میآید. زیر قشر مخ، ساختارهای مهم و متعددی قرار دارند که شامل این مواردند: تالاموس، اپیتالاموس، غده کاجی، هیپوتالاموس، غده هیپوفیز و سابتالاموس؛ ساختارهای لیمبیک، شامل آمیگدال و هیپوکامپ؛ کلاستروم، هستههای مختلف از عقدههای قاعدهای؛ ساختارهای قاعدهای مغز قدامی و سه عضو حول بطنی.[ت] سلولهای مغز شامل نورونها و سلولهای گلیال پشتیبان اند. بیش از ۸۶ میلیارد نورون در مغز وجود دارند و تعداد سایر سلولهای مغز نیز عددی کم و بیش برابر با همین مقدار است. فعالیت مغزی به دلیل اتصالات بین نورونها و آزاد شدن ناقلان عصبی از نورونها در پاسخ به پتانسیل عمل است. نورونها به یکدیگر متصل میشوند تا مسیرهای نورونی، مدارهای عصبی و سامانههای شبکهای را تشکیل دهند. کل این ساختار مداری براساس فرایند انتقال عصبی[ث] کار میکند.
مغز توسط جمجمه محافظت شده، در مایع مغزی-نخاعی معلق مانده و از جریان خون توسط سد خونی-مغزی جدا شدهاست. با این حال، مغز هنوز هم در معرض آسیب، بیماری و عفونت قرار دارد. ممکن است آسیب توسط تروما یا فقدان تغذیه خونِ ناشی از سکته ناشی شود. مغز نسبت به اختلالات زوال آسیبپذیر است، این اختلالات شامل بیماری آلزایمر و MS میشوند. تصور بر این است که بیماریهای روانی شامل اسکیزوفرنی و افسردگی بالینی مرتبط با بدعملکردیهای مغزی باشند. ممکن است مغز، هم محل تومورهای خوشخیم باشد و بدخیم؛ عمدهٔ این تومورها ناشی از متاستاز از سایر نقاط بدن میباشند.
مطالعه کالبدشناسی مغز را نوروآناتومی نامیده، در حالی که مطالعه عملکردهای مغزی را علوم اعصاب مینامند. فنون مختلفی جهت مطالعه مغز به کار میروند. بهطور سنتی، نمونههایی از سایر حیوانات که برخی مواقع بر رویشان مطالعات میکروسکوپی صورت میپذیرفت، اطلاعات زیادی را ارائه میکرد. همچنین فناوریهای تصویربرداری پزشکی چون تصویربرداری عصبی کارکردی و نوار مغزی (EEG) در مطالعه مغز نقش مهمی را ایفا میکنند. تاریخچه پزشکی افراد دچار آسیب مغزی، باعث شدهاست که بینش ما نسبت به عملکرد هر بخش از مغز افزایش یابد. تحقیقات روی مغز طی زمان پیشرفت کرده و مراحلِ فلسفی، آزمایشی و نظری را پشت سر نهادهاست. یکی از این مراحل نوظهور، شبیهسازی فعالیتهای مغزی است.[۳]
فلسفه ذهن برای قرنها تلاش کرده تا مسئلهٔ طبیعتِ خودآگاهی و مسئلهٔ ذهن و بدن[ج] را حل کند. شبهعلمی به نام فرنولوژی تلاش کرد تا در قرن نوزدهم میلادی، ویژگیهای شخصیتی را در نواحی از قشر مغزی موضعیسازی کند. در داستانهای علمی-تخیلی، پیوند مغز در قالب افسانههایی چون مغزِ دونووان (۱۹۴۲ میلادی)[چ] به تصویر کشیده شدهاست.
ساختار

کالبدشناسی کلی

مغز انسان بالغ بهطور میانگین وزنی بین ۱٫۲ تا ۱٫۴ کیلوگرم دارد که در حدود ۲ درصد از وزن کل بدن است.[۴][۵] حجم مغز در مردان حدود ۱۲۶۰ و در زنان ۱۱۳۰ سانتیمتر مکعب است.[۶] وزن مغز بین افراد مختلف دارای نوسان زیادی است،[۶] به طوری که رنج مرجع استاندارد برای مردان ۱٬۱۸۰ تا ۱٬۶۲۰ گرم[۷] و برای زنان ۱٬۰۳۰ تا ۱٬۴۰۰ گرم است.[۸]
مخ، شامل نیمکرههای مغز است که بزرگترین بخش مغز را تشکیل داده و بر روی سایر ساختارهای مغزی قرار دارد.[۹] ناحیه بیرونی نیمکرهها، یعنی قشر مغز، ماده خاکستری است که شامل لایههای قشری از نورونها است. هر نیمکره به چهار لوب تقسیمبندی میگردد: لوب پیشانی، لوب آهیانهای، لوب گیجگاهی و لوب پسسری.[۱۰] برخی منابع سه لوب دیگر را نیز فهرست میکنند که شامل یک لوب مرکزی، لوب لیمبیک و لوب اینسولار است.[۱۱] لوب مرکزی، شکنج پیشمرکزی[ح] و شکنج پسمرکزی[خ] را تشکیل میدهد و آن را به عنوان لوبی مجزا در نظر گرفتهاند، چرا که نقش عملکردی متمایزی دارد.[۱۱][۱۲]
ساقه مغز که شبیه ساقه است، در ابتدای ناحیه میانمغز به مخ متصل شده و در همان موقعیت مخ را ترک میکند. ساقه مغز شامل میانمغز، پل مغز و بصل النخاع است. پشت ساقه مغز، مخچه[د] قرار دارد.[۹]
مخ، ساقه مغز، مخچه و طناب نخاعی توسط سه غشاء مننژ پوشیده شدهاند. این سه غشاء شامل لایهٔ سختی به نام سختشامه، لایهٔ میانیِ عنکبوتیه و لایه لطیف نرمشامهی در سمت داخل اند. بین عنکبوتیه و نرمشامه، فضای زیرعنکبوتیه و تیغههای زیرعنکبوتیهای قرار دارد که شامل مایع مغزی-نخاعی میشود.[۱۳] بیرونیترین غشای قشر مخ، غشای قاعدهای نرمشامه به نام گلیای محدود کننده[ذ] قرار داشته که بخش مهمی از سد خونی-مغزی است.[۱۴] مغز زنده بسیار نرم بوده و مثل توفو حالتی ژل مانند دارد.[۱۵] لایههای قشری از جنس نورون، بخش اعظم ماده خاکستری مخ را تشکیل میدهند، در حالی که نواحی زیرقشری از جنس آکسونهای میلینی شده، ماده سفید را تشکیل میدهند.[۹] مادهٔ سفید مغز، حدود نیمی از حجم کلِ مغز را تشکیل میدهد.[۱۶]
مخ
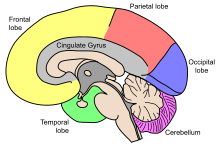
مخ، بزرگترین بخش مغز است و توسط شکاف عمیقی به نام شیار طولی،[ر] به نیمکرههای چپ و راست تقسیمبندی میشود که تقریباً متقارن اند.[۱۷] به عدم تقارن بین لوبها، پتالیا[ز] میگویند.[۱۸] نیمکرهها توسط پنج رابط به هم متصل اند که کل شیار طولی را پیموده و بزرگترین بخش آن را جسم پینهای مینامند.[۹] هر نیمکره به صورت قراردادی به چهار لوب اصلی تقسیمبندی میگردند؛ لوب پیشانی، لوب آهیانهای، لوب گیجگاهی و لوب پسسری که نامگذاریشان براساس استخوانهای جمجمهای است که بر روی هر کدام از این قسمتها قرار دارند.[۱۰] هر لوب با یک یا دو عملکرد اختصاصی همراه است که این عملکردها با یکدیگر همپوشانی دارند.[۱۹] سطح مغز چین خوردگیهایی دارد که به برآمدگیهایی به نام شکنج[ژ] و فرورفتگیهایی به نام شیار[س] تقسیمبندی شده و اغلب براساس موقعیتشان نامگذاری میشوند، همچون شکنج پیشانی از لوب پیشانی یا شیار مرکزی که نواحی مرکزی نیمکرهها را از هم جداسازی میکند. تغییرات کوچک بسیاری در نوع چین خوردگیهای دوم و سوم، بین افراد مختلف وجود دارد.[۲۰]
بخش بیرونی مخ را قشر مغز مینامند که از ماده خاکستری تشکیل شده و در لایههای مختلف آرایش یافتهاند. این لایه بین ۲ تا ۴ میلیمتر ضخامت دارد و به صورت عمیق تا خورده و ظاهری پیچخورده را ایجاد میکند.[۲۱] زیر قشر مغز، ماده سفید مخی قرار دارد. بزرگترین بخش از قشر مخ، نئوکورتکس است که دارای شش لایه نورونی است. باقی قشر را آلوکورتکس مینامند که دارای سه یا چهار لایه است.[۹]
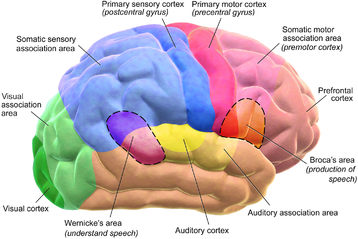
با تقسیمبندی قشر به حدود پنجاه ناحیه عملکردی متفاوت به نام نواحی برادمن،[ش] بر روی قشر مغز نقشهای نگاشته شدهاست. وقتی این نواحی زیر میکروسکوپ دیدهشوند، تمایز واضحی بینشان دیده میشود.[۲۲] قشر به دو ناحیه عملکردی اصلی تقسیم میشود: یک قشر حرکتی و یک قشر حسی.[۲۳] قشر حرکتی اولیه که آکسونها را به سمت پایینِ نورونهای حرکتی در ساقه مغز و طناب نخاعی میفرستد، بخش عقبی لوب پیشانی را مستقیماً جلوی ناحیه پیکری-حسی اشغال میکند. نواحی حسی اولیه، پیامها را از طریق هستههای رلهای از اعصاب حسی و نوارها در تالاموس دریافت میکنند. نواحی حسی اولیه شامل قشر بصری لوب پسسری، قشر شنوایی در بخشهایی از لوب گیجگاهی، قشر اینسولار و قشر پیکری-حسی در لوب آهیانهای است. بخشهای باقیمانده از قشر را نواحی ارتباطی[ص] مینامند. این نواحی ورودیهایشان را از نواحی حسی و بخشهای پایینتر مغز دریافت کرده و درگیر فرایندهای شناختی پیچیدهٔ ادراک، تفکر و تصمیمگیری اند.[۲۴] عملکردهای اصلی لوب پیشانی مربوط به کنترل توجه، تفکر انتزاعی، رفتار، حل مسئله و واکنشهای فیزیکی و شخصیت است.[۲۵][۲۶] لوب پسسری، کوچکترین لوب است؛ عملکردهای اصلی آن شامل ادراک بصری، پردازش بصری-فضایی، حرکت و ادراک رنگ است.[۲۵][۲۶] یک لبول کوچکتر در لوب وجود دارد به نام کونئوس. لوب گیجگاهی خاطرات شنوایی، بصری، زبانی و برخی از خاطرات گفتاری را کنترل میکند.[۲۵]
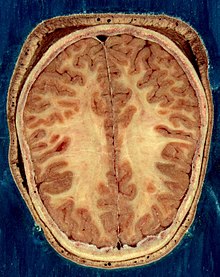
مخ شامل بطنها است که مایع مغزی-نخاعی در آن مکانها تولید شده و به گردش در میآید. در زیر جسم پینهای، دیوارهٔ شفاف[ض] قرار دارد که غشای جداکنندهٔ بطنهای طرفی میباشد. زیر بطنهای طرفی تالاموس قرار دارد و در جلو و پایین آن نیز هیپوتالاموس است. هیپوتالاموس به جلو کشیده شده و غده هیپوفیز را شکل میدهد. عقبِ تالاموس، ساقهٔ مغز واقع شدهاست.[۲۷]
عقدههای قاعدهای که به آنها هستههای قاعدهای نیز گفته میشود، دستهای از ساختارها در عمق نیمکرهها هستند که درگیر تنظیم رفتار و حرکت میباشند.[۲۸] بزرگترین مؤلفهٔ آن، جسم مخطط است، سایر مؤلفهها گلوبوس پالیدوس، توده سیاه و هسته سابتالاموس است.[۲۸] جسم مخطط به بخش شکمی و پشتی دستهبندی میشود، تقسیمبندی که براساس عملکرد و ارتباطات بنا شدهاست. جسم مخطط شکمی شامل هسته اکومبنس[ط] و دگمهٔ بویایی[ظ] است در حالی که جسم مخطط پشتی شامل هسته دمدار و پوتامن است. پوتامن و گلوبوس پالیدوس توسط کپسول داخلی از بطنهای طرفی و تالاموس جدا شدهاند، در حالی که هسته دمدار حول بطنهای طرفی و روی وجوه بیرونی آن کشیده شده و بر آنها مماس است.[۲۹] در عمیقترین بخش شیار جانبی، بین قشر اینسولار و جسم مخطط، ورقه نورونی نازکی به نام کلاستروم قرار دارد.[۳۰]
در پایین و جلوی جسم مخطط، تعدادی از ساختارهای مغز قدامی قاعدهای[ع] قرار دارند. این ساختارها شامل این موارد اند: نوکلئوس باسالیس،[غ] نوار قطری بروکا،[ف] سابستنشا اینومیناتا[ق] و هسته سپتال مدیال. این ساختارها در تولید ناقل عصبی به نام استیلکولین مهم اند، که پس از تولید بهطور گسترده در سرتاسر مغز منتشر میگردد. مغز قدامی قاعدهای، به خصوص نوکلئوس باسالیس را به عنوان خروجی کولینرژیک اصلیِ دستگاه عصبی مرکزی به جسم مخطط و نئوکورتکس در نظر میگیرند.[۳۱]
مخچه
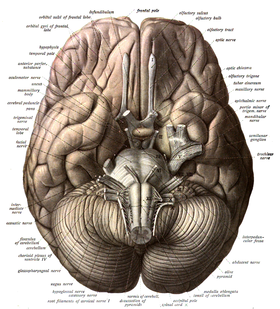
مخچه به یک لوب قدامی، یک لوب خلفی و لوب فلوکولوندولار[ک][۳۲] تقسیمبندی میگردد. کرمینه، بین لوبهای خلفی و قدامی قرار داشته و آنها را به هم متصل میکند.[۳۳] مخچه، در مقایسه با قشر مخ، قشر بیرونی بسیار نازکتری دارد، به طوری که شیارهای باریکی بر روی آن چندین چین خوردگی عرضی خمیده را ایجاد میکنند.[۳۳] زیر و بین این دو لوب، لوب سوم فلوکولوندولار قرار دارد.[۳۴] مخچه در سمت عقب حفره کرانیال قرار دارد، به طوری که زیر لوبهای پسسری قرار داشته و توسط چادرینه مخچه که ورقهای از فیبرها است از اینها جدا شدهاست.[۳۵]
مخچه توسط سه جفت از نوارهای عصبی به نام پایکهای مخچهای[گ] به ساقه مغز وصل شدهاند. جفت پایکهای فوقانی به میانمغز وصل میشوند؛ جفت پایکهای میانی به بصل النخاع و جفت پایک تحتانی نیز به پل مغزی متصل میگردند.[۳۳] مخچه شامل بخشی از بصل النخاعِ داخلی از جنس ماده سفید و یک قشر خارجی از جنس ماده خاکستری که غنی از چینخوردگی است.[۳۵] به نظر میرسد که لوبهای قدامی و خلفی مخچه در هماهنگکردن و هموار سازی حرکات پیچیده و لوب فلوکولوندولار نیز در حفظ تعادل نقش ایفا میکند[۳۶] گرچه که اختلاف نظرهایی در مورد عملکردهای شناختی، رفتاری و حرکتی آن وجود دارد.[۳۷]
ساقه مغز
ساقه مغز پایینترین بخش مغز است که در امتداد نخاع و در جلو مخچه قرار دارد. این قسمت از سه بخش مغز میانی، پل مغزی و بصل النخاع تشکیل شدهاست.
وظایف و عملکرد
مغز انسان از ۸۶ میلیارد سلول عصبی تشکیل شدهاست؛ این سیستم به وسیله ارتباط میان بخشهای مختلف بدن مانند دستگاه گردش خون، دستگاه گوارش، سیستم ایمنی و … باعث ایجاد هماهنگی در فعالیتهای بدن میشود.[۳۸] مدارهای حرکتی دستورات را به ماهیچهها برده و رفلکسهای سادهٔ ارادی را ایجاد میکند؛ مدارات حسی پیامها را از گیرندههای حسی دریافت و به سمت مغز هدایت میکند تا پاسخ مناسبی به این پدیدهها داده شود. همچنین فعالیتهای شناختی مانند حافظه، تصمیمگیری و ادراک توسط کورتکس پردازش و فعالیتهای پیچیده مانند زبان و برنامهریزی را ایجاد میکند.[۳۹][۴۰]
مرکز کنترل بدن
لوب پیشانی در استدلال، حرکت ارادی، احساس و زبان نقش دارد. این لوب قشر حرکتی، قشر پیش پیشانی و منطقه بروکا را نیز شامل میشود. قشر حرکتی مسئول ایجاد، تعادل و هماهنگی حرکات در بدن است؛ قشر پیش پیشانی، مسئول عملکردهای شناختی سطح بالا و پیچیدهاست و منطقه بروکا برای فرایندهای مرتبط با زبان ضروریست[۴۱] و آسیب به آن میتواند بیماریهایی مانند آفازی بروکا را ایجاد کند.[۴۲] مغز به وسیله ارتباط با مخچه پیامهای ارادی و نیمه ارادی را از طریق اعصاب مغزی به نورونهای حرکتی بدن منتقل و به وسیله مجرای نخاعی پیامهای حرکتی را از مغز، به دیگر بخشهای بدن و اندامها ارسال میکند.[۴۳] اعصاب اطراف جمجمه نیز حرکات مربوط به چشم، دهان و صورت را بدون واسطه تنظیم و هماهنگ میکند.[۴۴]
پژوهش
مغز بهطور کامل درک نشدهاست و تحقیقات در مورد آن همچنان در حال انجام است.[۴۵] دانشمندان علوم اعصاب، همراه با محققانی از رشتههای دیگر، چگونگی کارکرد مغز انسان را مطالعه میکنند. مرزهای بین تخصصهای علوم اعصاب، عصبشناسی و سایر رشتهها مانند روانپزشکی از بین رفتهاست زیرا همه آنها تحت تأثیر پژوهشهای بنیادی در علوم اعصاب قرار دارند.
پژوهشهای علوم اعصاب در دهههای اخیر بهطور قابل توجهی گسترش یافتهاست. " دهه مغز " (Decade of the Brain)، ابتکار دولت ایالات متحده در دهه ۱۹۹۰، در نظر گرفته میشود که موجب افزایش تحقیقات در این زمینه را مشخص کردهاست،[۴۶] و در سال ۲۰۱۳ توسط BRAIN Initiative دنبال شد.[۴۷] پروژه ارتباط انسانی یک مطالعه پنج ساله بود که در سال ۲۰۰۹ برای تجزیه و تحلیل اتصالات آناتومیکی و کارکردی بخشهای مغز راهاندازی شد و دادههای زیادی ارائه کردهاست.[۴۵]
مواد و روشها
دادههای مربوط به ساختار و کارکرد مغز انسان از روشهای آزمایشی گوناگون، از جمله حیوانات و انسانها به دست میآید. اطلاعات مربوط به ضربه مغزی و سکته مغزی اطلاعاتی در مورد عملکرد بخشهایی از مغز و اثرات آسیب مغزی ارائه کردهاست. تصویربرداری عصبی برای تجسم مغز و ثبت فعالیت مغز استفاده میشود. الکتروفیزیولوژی برای اندازهگیری، ثبت و نظارت بر فعالیت الکتریکی قشر مغز استفاده میشود. اندازهگیریها ممکن است پتانسیل میدانی موضعی نواحی قشر مغز یا فعالیت یک نورون یکتا باشد. الکتروانسفالوگرام میتواند فعالیت الکتریکی قشر مغز را با استفاده از الکترودهایی که بهرصورت غیر مخرب وی پوست سر قرار میگیرند، ثبت کند.[۴۸] [۴۹]
روشهای مخرب شامل الکتروکورتیکوگرافی است که از الکترودهایی استفاده میکند که مستقیماً روی سطح مغز قرار میگیرند. این روش در نقشهبرداری تحریکی قشر مغز (cortical stimulation mapping) استفاده میشود که در مطالعه رابطه بین نواحی قشر مغز و کارکرد سیستمیک آنها استفاده میشود.[۵۰] با استفاده از میکروالکترودهای (microelectrodes) بسیار کوچکتر، ضبطهای تک واحدی (single-unit recordings) را میتوان از یک نورون منفرد انجام داد که وضوح فضایی و وضوح زمانی بالایی را ارائه میدهد. این امکان ارتباط بین فعالیت مغز با رفتار و ایجاد نقشههای عصبی را فراهم کردهاست.[۵۱]
توسعه ارگانوئیدهای مغزی راههایی را برای مطالعه رشد مغز و قشر مغز و درک رشد بیماری باز کردهاست و پیامدهای بیشتری را برای کاربردهای درمانی ارائه میدهد.[۵۲][۵۳]
تصویربرداری
بیان ژن و پروتئین
فیزیولوژی
انتقال عصبی

فعالیت مغز در اثر تعامل و فعالیتهای پیچیده نورونها شکل گرفتهاست. این تعامل و هماهنگی موجب شده انسان غالب بر ۱۰۶ بیت اطلاعات را در هر ثانیه به صورت خود آگاه پردازش کند.[۵۴] در صورت ایجاد اختلال در فعالیت نورونها، ممکن است اختلالاتی همچون صرع و آلودینیا ایجاد شود.[۵۵] نورون از جسم سلولی، آکسون و دندریت تشکیل شدهاست. دندریتها اغلب شاخههای گستردهای هستند که اطلاعات را به صورت پیام عصبی از پایانههای آکسون سایر نورونها یا به صورت گیرنده پیامهای محرکهای محیطی را دریافت میکنند. (گیرندههای درد و فشار)[۵۶][۵۷] سیگنالهای دریافتی ممکن است باعث شود، نورون یک پتانسیل عمل (سیگنال الکتروشیمیایی یا تکانه عصبی) را از طریق آکسون خود به پایانه آکسونی ارسال و از طریق فضایی به نام سیناپس آن را به دندریتها یا جسم سلولی نورون بعد از خود منتقل کند.[۵۸][۵۹] یک پتانسیل عمل غالباً در بخش اولیه آکسون، که شامل مجموعه ای تخصصی از پروتئینها است، آغاز میشود. هنگامی که یک پتانسیل عمل به پایانه آکسونی میرسد، باعث آزاد شدن انتقال دهندههای عصبی واقع در وزیکولهایی (ترشح به صورت اگزوسیتوز) در سیناپس شده و با اتصال به گیرندههایشان در نورونهای پس سیناپسی، اختلاف پتانسیل را در این نورونها تغییر میدهند.[۶۰] این انتقال دهندههای عصبی شیمیایی (ناقلین عصبی) دوپامین، سروتونین، GABA، گلوتامات و استیل کولین را شامل میشوند.[۵۷][۶۱] GABA اصلیترین انتقال دهنده عصبی بازدارنده و گلوتامات اصلیترین انتقال دهنده عصبی تحریکی در مغز است.[۶۲] نورونها در سیناپسها با هم ارتباط بر قرار میکنند و مسیرهای عصبی، مدارهای عصبی و سیستمهای پیچیده بزرگ مانند شبکه برجسته و شبکه حالت پیش فرض را تشکیل میدهند که فعالیت بین آنها توسط فرآیند انتقال عصبی هدایت میشود.[۶۳]
متابولیسم
مغز بیش از ۲۰ درصد از انرژی مورد استفاده بدن انسان را، بیش از هر اندامی دیگر، مصرف میکند.[۶۴] در انسان، گلوکز موجود در خون منبع اصلی تأمین انرژی بیشتر سلولهای بدن است و برای انجام عملکردهای طبیعی در بسیاری از بافتها، از جمله مغز، حیاتی است.[۶۵] متابولیسم مغز بهطور معمول به گلوکز خون به عنوان یک منبع انرژی متکی است، اما در زمان پایین بودن گلوکز خون (مانند ابتدای صبح، حین ورزشهای استقامتی یا مصرف محدود کربوهیدرات)، مغز از اجسام کتونی و مقدار کمتری گلوکز به عنوان سوخت استفاده میکند؛ همچنین میتواند از لاکتات در حین ورزش برای تأمین انرژی خود استفاده کند.[۶۶] مغز گلوکز را به شکل گلیکوژن، در مقادیر بسیار کمتر نسبت به کبد و ماهیچههای اسکلتی، ذخیره میکند.[۶۷] اسیدهای چرب بلند زنجیر نمیتوانند از سد خونی-مغزی عبور کنند، به همبن دلیل کبد آنها را تجزیه کرده و اجسام کتونی تولید کند؛[۶۸] با این حال، اسیدهای چرب کوتاه زنجیر (به عنوان مثال اسید بوتیریک، پروپیونیک اسید و استیک اسید) و اسیدهای چرب با زنجیرهٔ متوسط (مانند اکتانوئیک اسید و هپتانوئیک اسید)، میتوانند از سد خونی مغزی عبور کرده و توسط سلولهای مغزی متابولیزه شوند.[۶۹][۷۰]

اگرچه مغز انسان تنها ۲٪ از وزن بدن را شامل میشود، اما ۱۵٪ از حجم خون خروجی قلب، ۲۰٪ از کل اکسیژن مصرفی بدن و ۲۵٪ از کل گلوکز بدن را دریافت میکند.[۷۱] مغز بیشتر از گلوکز برای انرژی استفاده میکند و محرومیت از گلوکز، همان گونه که در هیپوگلیسمی اتفاق میافتد، میتواند منجر به از دست دادن هوشیاری شود.[۷۲] مصرف انرژیِ مغز در طول زمان تغییر زیادی نمیکند، اما مناطق فعال مغز، مانند کورتکس، انرژی بیشتری نسبت دیگر مناطق مغز مصرف میکنند؛ که اساس روشهای تصویربرداریِ عصبیِ عملکردیِ برشنگاری با گسیل پوزیترون و FMRI است.[۷۳] این روشهای تصویربرداری، تصویری سه بعدی از فعالیت متابولیک مغز ارائه میدهند.[۷۴] مطالعات اولیه نشان داد که فعالیتهای متابولیکی مغزِ انسان در حدود پنج سالگی به حداکثر خود میرسد.[۷۵]
عملکرد خواب بهطور کامل درک نشدهاست؛ با این حال، شواهدی وجود دارد که نشان میدهد خواب در پاکسازی مواد زائد متابولیکی، استراحت و ترمیم مغز، تثبیت حافظه و تنظیم ناقلهای عصبی مؤثر است و بی خوابی بیش از حد میتواند، همانند نوشیدن الکل، فرایندهای عصبی را مختل کند.[۷۶][۷۷][۷۸] شواهد نشان میدهد که افزایش پاکسازی مواد زائد متابولیکی در طول خواب از طریق افزایش عملکرد سیستم گلیمپاتیک رخ میدهد.[۷۶]خواب همچنین ممکن است با تضعیف ارتباطات غیر ضروری (هرس سیناپسی) بر تنظیم و تثبیت عملکردهای شناختی تأثیر بگذارد.[۷۹]
اهمیت بالینی
آسیب مغز
آسیب به مغز میتواند به شکلهای گوناگونی نمایان گردد. ضربه مغزی، به عنوان مثال در ورزشهای برخوردی، پس از سقوط، یا تصادف رانندگی یا کار، میتواند با مشکلات فوری و بلند مدت همراه باشد. مشکلات فوری ممکن است شامل خونریزی در مغز باشد، این اسیبدیدگی ممکن است بافت مغز را فشرده کرده یا به خونرسانی آن آسیب برساند. ممکن است کبودی در مغز ایجاد شود. کبودی ممکن است باعث آسیب گسترده به مجاری عصبی شود که میتواند منجر به وضعیت آسیب آکسون (diffuse axonal injury) شود.[۸۰] شکستگی جمجمه (fractured skull)، آسیب به ناحیه ای خاص، ناشنوایی و ضربه مغزی نیز از جمله آسیبهای احتمالی هستند. علاوه بر محل آسیب، طرف مقابل مغز نیز ممکن است تحت تأثیر قرار گیرد که به آن آسیب پیشانی (contrecoup) میگویند. مسائل طولانی مدت که ممکن است ایجاد شوند شامل اختلال اضطراب پس از سانحه و هیدروسفالی است. انسفالوپاتی تروماتیک مزمن میتواند به دنبال آسیبهای ترومای سر ایجاد شود.[۸۱]
زوال عصبی
بیماریهای تخریبکننده عصبی منجر به آسیب پیشرونده به قسمتهای مختلف عملکرد مغز میشود و با افزایش سن بدتر میشود. نمونههای رایج شامل زوال عقل مانند بیماری آلزایمر، زوال عقل الکلی یا زوال عقل عروقی است. بیماری پارکینسون؛ و سایر علل نادر عفونی ، ژنتیکی یا متابولیک مانند بیماری هانتینگتون، بیماریهای نورون حرکتی، زوال عقل HIV، زوال عقل ناشی از سفلیس و بیماری ویلسون از دیگر بیماریهای این دسته بهشمار میروند. بیماریهای تخریب کننده عصبی میتوانند قسمتهای مختلف مغز را تحت تأثیر قرار دهند و بر حرکت، حافظه و شناخت تأثیر بگذارند.[۸۲]
مغز، اگرچه توسط سد خونی - مغزی محافظت میشود، اما میتواند تحت تأثیر عفونتهایی از جمله ویروسها، باکتریها و قارچها قرار گیرد. عفونت ممکن است شامگان (مننژیت)، ماده مغز (آنسفالیت)، یا در داخل ماده مغز (مانند آبسه مغزی) باشد.[۸۳] بیماریهای نادر پریون از جمله بیماری کروتزفلد -یاکوب و سویه آن، و کورو نیز ممکن است بر مغز تأثیر بگذارد.[۸۳]
تومور مغزی
تومورهای مغزی میتوانند خوشخیم یا سرطانی باشند. بیشتر تومورهای بدخیم از قسمت دیگری از بدن، بیشتر از ریه، سینه و پوست بوجود میآیند. سرطان بافت مغز نیز میتواند رخ دهد و از هر بافت داخل و اطراف مغز منشأ میگیرد. مننژیوما، سرطان مننژهای اطراف مغز، رایجتر از سرطانهای بافت مغزی است. سرطانهای درون مغز ممکن است علائم مربوط به اندازه یا موقعیت خود را ایجاد کنند، با علائمی از جمله سردرد و حالت تهوع، یا گسترش تدریجی نشانههای کانونی مانند مشکل در دیدن تدریجی، خوردن، صحبت کردن یا تغییر خلق و خو همراه است. سرطانها بهطور کلی با استفاده از سی تی اسکن و اسکن MRI بررسی میشوند. انواع گوناگونی آزمایش از جمله آزمایش خون و لامبر پانچر ممکن است برای بررسی علت سرطان و ارزیابی نوع و مرحله سرطان مورد استفاده قرار گیرد. کورتیکواستروئید دگزامتازون اغلب برای کاهش تورم بافت مغزی در اطراف تومور تجویز میشود. ممکن است جراحی در نظر گرفته شود، اما با توجه به ماهیت پیچیده بسیاری از تومورها یا بر اساس مرحله یا نوع تومور، پرتودرمانی یا شیمی درمانی مناسب تر تلقی میشود.[۸۴]
اختلالات روانی
اختلالات روانی مانند افسردگی، اسکیزوفرنی، اختلال دوقطبی، اختلال استرس پس از سانحه اختلال کمتوجهی - بیشفعالی، اختلال وسواس فکری-عملی، سندرم تورت و اعتیاد، با عملکرد مغز ارتباط دارند.[۸۵][۸۶] درمان اختلالات روانی ممکن است شامل رواندرمانی، روانپزشکی، مداخله اجتماعی و بازیابی شخصی یا رفتاردرمانی شناختی باشد. مسائل اساسی و پیش آگهیهای مرتبط بین افراد بهطور قابل توجهی متفاوت است.
صرع
تصور میشود که تشنجهای صرعی مربوط به فعالیتهای الکتریکی غیرطبیعی است. فعالیت تشنجی میتواند به صورت فقدان هوشیاری، اثرات کانونی مانند حرکت اندام یا موانع گفتاری نمایان گردد، یا ماهیتی کلی داشته باشد. بحران صرعی به تشنج یا مجموعه ای از حملههایی گفته میشود که بیش از ۵ دقیقه ادامه پیدا کند.[۸۷] تشنج دلایل زیادی دارد، با این حال بسیاری از تشنجها بدون یافتن علت قطعی رخ میدهند. در افراد مبتلا به صرع، عوامل خطر برای تشنج بیشتر ممکن است شامل بی خوابی، مصرف دارو و الکل و استرس باشد. تشنجها ممکن است با استفاده از آزمایش خون، نوار مغزی یا EEG و تکنیکهای مختلف تصویربرداری پزشکی بر اساس سابقه پزشکی و یافتههای معاینه بالینی ارزیابی شوند. علاوه بر درمان علت زمینه ای و کاهش قرار گرفتن در معرض عوامل خطر، داروهای ضد تشنج میتوانند در جلوگیری از تشنج بیشتر نقش داشته باشند.[۸۸]
اختلال مادرزادی
برخی از اختلالات مغزی مانند تی-سکس اختلال مادرزادی هستند، و با جهشهای ژنتیکی و کروموزومی مرتبط هستند.[۸۹] گروه نادری از اختلالات مادرزادی چون سفالیک که به عنوان لیسنسفالی شناخته میشوند، با فقدان یا ناکافی شدن چین خوردگی قشر مشخص میشود. رشد طبیعی مغز میتواند در دوران بارداری تحت تأثیر کمبودهای تغذیهای، تراتوژنها، بیماریهای عفونی، و استفاده از داروهای تفریحی، از جمله الکل که ممکن است منجر به ناهنجاریهای جنینی ناشی از الکل شود گردد.[۹۰]
سکته مغزی
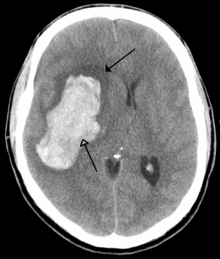
سکته مغزی کاهش خون رسانی به ناحیه ای از مغز است که باعث مرگ سلولی و آسیب مغزی میشود. این آسیب میتواند منجر به طیف وسیعی از علائم شود، از جمله علائم "سریع " افتادگی صورت، ضعف بازو و مشکلات گفتاری (از جمله در صحبت کردن و یافتن کلمات یا تشکیل جملات) هستند.[۹۱] علائم مربوط به عملکرد ناحیه آسیب دیده مغز است و میتواند به محل و علت احتمالی سکته مغزی اشاره کند. مشکلات حرکتی، گفتاری یا بینایی معمولاً مربوط به مخ است، در حالی که عدم تعادل، دوبینی، سرگیجه و علائم که بر بیش از یک طرف بدن تأثیر میگذارد معمولاً مربوط به ساقه مغز یا مخچه است.[۹۲]
بیشتر سکتههای مغزی ناشی از از دست دادن خون است، معمولاً به دلیل آمبولی، پارگی پلاک چربی باعث ایجاد ترومبوز یا تنگ شدن شریانهای کوچک میشود.[۹۳] سکته مغزی همچنین میتواند ناشی از خونریزی درون مغز باشد. حملات ایسکمیک گذرا (TIAs) سکتههایی هستند که علائم آنها در عرض ۲۴ ساعت برطرف میشود. بررسی سکته مغزی شامل یک معاینه پزشکی (از جمله معاینه عصبی) و گرفتن سابقه پزشکی، با تمرکز بر مدت زمان علائم و عوامل خطر (از جمله فشار خون بالا، فیبریلاسیون دهلیزی و سیگار کشیدن) خواهد بود.[۹۴] در بیماران جوانتر نیاز به بررسی بیشتر است. برای تشخیص فیبریلاسیون دهلیزی ممکن استنوار قلب و بیوتل متری انجام شود. سونوگرافی میتواند تنگی سرخرگ کاروتید را بررسی کند. از اکوکاردیوگرام میتوان برای جستجوی لخته در قلب، نارسایی دریچه قلب یا وجود یک نقص دیواره بیندهلیزیتخمدان ثبت شده استفاده کرد. آزمایش خون بهطور معمول به عنوان بخشی از تشخیص پزشکی شامل آزمایش دیابت و مشخصات چربی انجام میشود.[۹۵]
برخی از درمانهای سکته مغزی از نظر زمانی بسیار مهم هستند. این موارد شامل انحلال لخته یا برداشتن لخته برای سکتههای ایسکمیک و رفع فشار برای سکتههای خونریزی مغزی است. [۹۶][۹۷] آنجایی که سکته مغزی از نظر زمانی بسیار مهم است،[۹۸] بیمارستانها و حتی مراقبتهای پیش از بیمارستان سکته مغزی شامل تحقیقات سریع است-معمولاً سی تی اسکن برای بررسی سکته مغزی دارای خونریزی و آنژیوگرافی یا سیتی برای ارزیابی شریانهای تأمین کننده مغز استفاده میشود. اسکنهای تصویرسازی تشدید مغناطیسی یا MRI، که بهطور گسترده در دسترس نیستند، ممکن است بتوانند ناحیه آسیب دیده مغز را به ویژه در سکته مغزی ایسکمیک با دقت بیشتری نشان دهند.[۹۵]
با تجربه سکته مغزی، ممکن است فردی در واحد سکته مغزی بستری شود و درمانها به عنوان پیشگیری از سکتههای مغزی در آینده، از جمله ضد انعقاد مداوم (مانند آسپرین یا کلوپیدوگرل)، داروهای ضد فشار خون بالا و داروهای کاهش دهنده چربی خون، مورد استفاده قرار گیرد. [۹۹] یک تیم میانرشتهای شامل آسیب شناسان گفتار، فیزیوتراپیستها، کاردرمانگران و روانشناسان نقش مهمی در حمایت از فرد مبتلا به سکته مغزی و توانبخشی آنها ایفا میکند.[۱۰۰] [۹۵] سابقه سکته مغزی خطر ابتلا به زوال عقل را حدود ۷۰ درصد و سکته مغزی جدید خطر را حدود ۱۲۰ افزایش میدهد.[۱۰۱]
مرگ مغزی
مرگ مغزی به از بین رفتن کامل عملکرد مغزی اشاره میکند.[۱۰۲][۱۰۳] این آسیب با کما، از دست دادن واکنش غیرارادی و توقف تنفس مشخص میشود،[۱۰۲] با این حال، اعلام مرگ مغزی از نظر جغرافیایی متفاوت است و همیشه پذیرفته نمیشود.[۱۰۳] در برخی کشورها نیز سندرم مرگ ساقه مغز تعریف شدهاست.[۱۰۴] اعلان مرگ مغزی میتواند پیامدهای عمیقی داشته باشد زیرا اعلامیه، بر اساس اصل بیهودگی پزشکی، با قطع حمایت از زندگی همراه خواهد بود و افرادی که دارای مرگ مغزی هستند اغلب دارای اعضای مناسب برای اهداء عضو هستند.[۱۰۳] [۱۰۵] این فرایند اغلب با ارتباط ضعیف با خانواده بیماران مشکلتر میشود.
برای فرد مشکوک به مرگ مغزی تشخیص افتراقی مانند الکترولیت، عصبی و سرکوب شناختی مرتبط با دارو باید حذف شوند.[۱۰۶][۱۰۷] آزمایشهای واکنش غیرارادی [ل] و همچنین عدم پاسخ و تنفس میتواند در تصمیمگیری کمک کننده باشد. [۱۰۶] مشاهدات بالینی، از جمله عدم پاسخگویی کامل، یک تشخیص شناخته شده و شواهد تصویربرداری عصبی، ممکن است همه در تصمیمگیری برای مرگ مغزی نقش داشته باشند.[۱۰۲]
جستارهای وابسته
پانویس
- Hall, John (2011). Guyton and Hall Textbook of Medical Physiology (12th ed.). Philadelphia, PA: Saunders/Elsevier. ISBN 978-1-4160-4574-8.
منابع
- ↑ "Cerebrum Etymology". dictionary.com. Archived from the original on October 24, 2015. Retrieved October 24, 2015.
- ↑ "Encephalo- Etymology". واژهنامه برخط ریشهشناسی. Archived from the original on October 2, 2017. Retrieved October 24, 2015.
- ↑ Fan, Xue; Markram, Henry (2019-05-07). "A Brief History of Simulation Neuroscience". Frontiers in Neuroinformatics. 13: 32. doi:10.3389/fninf.2019.00032. ISSN 1662-5196. PMC 6513977. PMID 31133838.
- ↑ Parent, A.; Carpenter, M.B. (1995). "Ch. 1". Carpenter's Human Neuroanatomy. Williams & Wilkins. ISBN 978-0-683-06752-1.
- ↑ Bigos, K.L.; Hariri, A.; Weinberger, D. (2015). Neuroimaging Genetics: Principles and Practices. Oxford University Press. p. 157. ISBN 978-0-19-992022-8.
- ↑ ۶٫۰ ۶٫۱ Cosgrove, K.P.; Mazure, C.M.; Staley, J.K. (2007). "Evolving knowledge of sex differences in brain structure, function, and chemistry". Biol Psychiatry. 62 (8): 847–855. doi:10.1016/j.biopsych.2007.03.001. PMC 2711771. PMID 17544382.
- ↑ Molina, D. Kimberley; DiMaio, Vincent J.M. (2012). "Normal Organ Weights in Men". The American Journal of Forensic Medicine and Pathology. 33 (4): 368–372. doi:10.1097/PAF.0b013e31823d29ad. ISSN 0195-7910. PMID 22182984. S2CID 32174574.
- ↑ Molina, D. Kimberley; DiMaio, Vincent J. M. (2015). "Normal Organ Weights in Women". The American Journal of Forensic Medicine and Pathology. 36 (3): 182–187. doi:10.1097/PAF.0000000000000175. ISSN 0195-7910. PMID 26108038. S2CID 25319215.
- ↑ ۹٫۰ ۹٫۱ ۹٫۲ ۹٫۳ ۹٫۴ Gray's Anatomy 2008, pp. 227–9.
- ↑ ۱۰٫۰ ۱۰٫۱ Gray's Anatomy 2008, pp. 335–7.
- ↑ ۱۱٫۰ ۱۱٫۱ Ribas, G. C. (2010). "The cerebral sulci and gyri". Neurosurgical Focus. 28 (2): 7. doi:10.3171/2009.11.FOCUS09245. PMID 20121437.
- ↑ Frigeri, T.; Paglioli, E.; De Oliveira, E.; Rhoton Jr, A. L. (2015). "Microsurgical anatomy of the central lobe". Journal of Neurosurgery. 122 (3): 483–98. doi:10.3171/2014.11.JNS14315. PMID 25555079.
- ↑ Purves 2012, p. 724.
- ↑ Cipolla, M.J. (January 1, 2009). Anatomy and Ultrastructure. Morgan & Claypool Life Sciences. Archived from the original on October 1, 2017.
- ↑ "A Surgeon's-Eye View of the Brain". NPR.org. Archived from the original on November 7, 2017.
- ↑ Sampaio-Baptista, C; Johansen-Berg, H (December 20, 2017). "White Matter Plasticity in the Adult Brain". Neuron. 96 (6): 1239–1251. doi:10.1016/j.neuron.2017.11.026. PMC 5766826. PMID 29268094.
- ↑ Davey, G. (2011). Applied Psychology. John Wiley & Sons. p. 153. ISBN 978-1-4443-3121-9.
- ↑ Arsava, E. Y.; Arsava, E. M.; Oguz, K. K.; Topcuoglu, M. A. (2019). "Occipital petalia as a predictive imaging sign for transverse sinus dominance". Neurological Research. 41 (4): 306–311. doi:10.1080/01616412.2018.1560643. PMID 30601110. S2CID 58546404.
- ↑ Ackerman, S. (1992). Discovering the brain. Washington, D.C.: National Academy Press. pp. 22–25. ISBN 978-0-309-04529-2.
- ↑ Larsen 2001, pp. 455–456.
- ↑ Kandel, E.R.; Schwartz, J.H.; Jessel T.M. (2000). -9780838577011/page/324 Principles of Neural Science. McGraw-Hill Professional. p. -9780838577011/page/324 324. ISBN 978-0-8385-7701-1.
{{cite book}}: Check|url=value (help) - ↑ Guyton & Hall 2011, p. 574.
- ↑ Guyton & Hall 2011, p. 667.
- ↑ Principles of Anatomy and Physiology 12th Edition – Tortora, p. 519.
- ↑ ۲۵٫۰ ۲۵٫۱ ۲۵٫۲ Freberg, L. (2009). Discovering Biological Psychology. Cengage Learning. pp. 44–46. ISBN 978-0-547-17779-3.
- ↑ ۲۶٫۰ ۲۶٫۱ Kolb, B.; Whishaw, I. (2009). Fundamentals of Human Neuropsychology. Macmillan. pp. 73–75. ISBN 978-0-7167-9586-5.
- ↑ Pocock 2006, p. 64.
- ↑ ۲۸٫۰ ۲۸٫۱ Purves 2012, p. 399.
- ↑ Gray's Anatomy 2008, pp. 325–6.
- ↑ Goll, Y.; Atlan, G.; Citri, A. (August 2015). "Attention: the claustrum". Trends in Neurosciences. 38 (8): 486–95. doi:10.1016/j.tins.2015.05.006. PMID 26116988. S2CID 38353825.
- ↑ Goard, M.; Dan, Y. (October 4, 2009). "Basal forebrain activation enhances cortical coding of natural scenes". Nature Neuroscience. 12 (11): 1444–1449. doi:10.1038/nn.2402. PMC 3576925. PMID 19801988.
- ↑ Guyton & Hall 2011, p. 699.
- ↑ ۳۳٫۰ ۳۳٫۱ ۳۳٫۲ Gray's Anatomy 2008, p. 298.
- ↑ Netter, F. (2014). Atlas of Human Anatomy Including Student Consult Interactive Ancillaries and Guides (6th ed.). Philadelphia, Penn.: W B Saunders Co. p. 114. ISBN 978-1-4557-0418-7.
- ↑ ۳۵٫۰ ۳۵٫۱ Gray's Anatomy 2008, p. 297.
- ↑ Guyton & Hall 2011, pp. 698–9.
- ↑ Squire 2013, pp. 761–763.
- ↑ "Brain Anatomy and How the Brain Works". www.hopkinsmedicine.org (به انگلیسی). Retrieved 2021-10-18.
- ↑ انجمن علوم اعصاب، مترجم رضا پناهی. بهنام سور، علی شهبازی، عباس حقپرست، حقایق مغز. تهران: مؤسسه انتشارات ستایش هستی، ۱۳۹۸ شابک ۹۷۸−۶۲۲−۶۴۴۵−۶۳−۴، ص ۱۱.
- ↑ «Brain anatomy, Anatomy of the human brain | Mayfield Brain & Spine Cincinnati, Ohio». mayfieldclinic.com (به انگلیسی). دریافتشده در ۲۰۲۱-۱۰-۱۸.
- ↑ «Parts of the Brain | Introduction to Psychology». courses.lumenlearning.com (به انگلیسی). دریافتشده در ۲۰۲۱-۱۰-۱۸.
- ↑ انجمن علوم اعصاب، مترجم رضا پناهی. بهنام سور، علی شهبازی، عباس حقپرست، حقایق مغز. تهران: مؤسسه انتشارات ستایش هستی، ۱۳۹۸ شابک ۹۷۸−۶۲۲−۶۴۴۵−۶۳−۴، ص ۸۱.
- ↑ Guyton & Hall 2011, p. 685.
- ↑ Guyton & Hall 2011, p. 687.
- ↑ ۴۵٫۰ ۴۵٫۱ Van Essen, D.C. (October 2012). "The Human Connectome Project: A data acquisition perspective". NeuroImage. 62 (4): 2222–2231. doi:10.1016/j.neuroimage.2012.02.018. PMC 3606888. PMID 22366334.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) خطای یادکرد: برچسب<ref>نامعتبر؛ نام «HCP2009» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Jones, E.G.; Mendell, L.M. (April 30, 1999). "Assessing the Decade of the Brain". Science. 284 (5415): 739. Bibcode:1999Sci...284..739J. doi:10.1126/science.284.5415.739. PMID 10336393.
- ↑ "A $4.5 Billion Price Tag for the BRAIN Initiative?". Science | AAAS. June 5, 2014. Archived from the original on June 18, 2017.
- ↑ Towle, V.L. (January 1993). "The spatial location of EEG electrodes: locating the best-fitting sphere relative to cortical anatomy". Electroencephalography and Clinical Neurophysiology. 86 (1): 1–6. doi:10.1016/0013-4694(93)90061-y. PMID 7678386.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Purves 2012.
- ↑ Silverstein, J. (2012). "Mapping the Motor and Sensory Cortices: A Historical Look and a Current Case Study in Sensorimotor Localization and Direct Cortical Motor Stimulation". The Neurodiagnostic Journal. 52 (1): 54–68. PMID 22558647. Archived from the original on November 17, 2012.
- ↑ Boraud, T.; Bezard, E. (2002). "From single extracellular unit recording in experimental and human Parkinsonism to the development of a functional concept of the role played by the basal ganglia in motor control". Progress in Neurobiology. 66 (4): 265–283. doi:10.1016/s0301-0082(01)00033-8. PMID 11960681.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Lancaster, MA; Renner, M; Martin, CA; Wenzel, D; Bicknell, LS; Hurles, ME; Homfray, T; Penninger, JM; Jackson, AP (September 19, 2013). "Cerebral organoids model human brain development and microcephaly". Nature. 501 (7467): 373–9. Bibcode:2013Natur.501..373L. doi:10.1038/nature12517. PMC 3817409. PMID 23995685.
- ↑ Lee, CT; Bendriem, RM; Wu, WW; Shen, RF (August 20, 2017). "3D brain Organoids derived from pluripotent stem cells: promising experimental models for brain development and neurodegenerative disorders". Journal of Biomedical Science. 24 (1): 59. doi:10.1186/s12929-017-0362-8. PMC 5563385. PMID 28822354.
- ↑ Miller, G. A. (1956-03). "The magical number seven plus or minus two: some limits on our capacity for processing information". Psychological Review. 63 (2): 81–97. ISSN 0033-295X. PMID 13310704.
{{cite journal}}: Check date values in:|date=(help) - ↑ Pocock, G. ; Richards, C. (2006). Human Physiology: The Basis of Medicine (3rd ed.). Oxford: Oxford University Press. ISBN 978-0-19-856878-0. p 68.
- ↑ Flores A, Maldonado R, Berrendero F (December 2013). "Cannabinoid-hypocretin cross-talk in the central nervous system: what we know so far". Frontiers in Neuroscience. 7: 256. doi:10.3389/fnins.2013.00256. PMC 3868890. PMID 24391536.
Direct CB1-HcrtR1 interaction was first proposed in 2003 (Hilairet et al. , 2003). Indeed, a 100-fold increase in the potency of hypocretin-1 to activate the ERK signaling was observed when CB1 and HcrtR1 were co-expressed ... In this study, a higher potency of hypocretin-1 to regulate CB1-HcrtR1 heteromer compared with the HcrtR1-HcrtR1 homomer was reported (Ward et al. , 2011b). These data provide unambiguous identification of CB1-HcrtR1 heteromerization, which has a substantial functional impact. ... The existence of a cross-talk between the hypocretinergic and endocannabinoid systems is strongly supported by their partially overlapping anatomical distribution and common role in several physiological and pathological processes. However, little is known about the mechanisms underlying this interaction. ... Acting as a retrograde messenger, endocannabinoids modulate the glutamatergic excitatory and GABAergic inhibitory synaptic inputs into the dopaminergic neurons of the VTA and the glutamate transmission in the NAc. Thus, the activation of CB1 receptors present on axon terminals of GABAergic neurons in the VTA inhibits GABA transmission, removing this inhibitory input on dopaminergic neurons (Riegel and Lupica, 2004). Glutamate synaptic transmission in the VTA and NAc, mainly from neurons of the PFC, is similarly modulated by the activation of CB1 receptors (Melis et al. , 2004).
• Figure 1: Schematic of brain CB1 expression and orexinergic neurons expressing OX1 (HcrtR1) or OX2 (HcrtR2) • Figure 2: Synaptic signaling mechanisms in cannabinoid and orexin systems • Figure 3: Schematic of brain pathways involved in food intake - ↑ ۵۷٫۰ ۵۷٫۱ Ayakannu, Thangesweran; Taylor, Anthony H.; Marczylo, Timothy H.; Willets, Jonathon M.; Konje, Justin C. (2013). "The Endocannabinoid System and Sex Steroid Hormone-Dependent Cancers". International Journal of Endocrinology. 2013: 259676. doi:10.1155/2013/259676. ISSN 1687-8337. PMC 3863507. PMID 24369462.
- ↑ Clark, B.D.; Goldberg, E.M.; Rudy, B. (December 2009). "Electrogenic tuning of the axon initial segment". The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ↑ Freund TF, Katona I, Piomelli D (July 2003). "Role of endogenous cannabinoids in synaptic signaling". Physiological Reviews. 83 (3): 1017–66. doi:10.1152/physrev.00004.2003. PMID 12843414.
- ↑ Pocock, G. ; Richards, C. (2006). Human Physiology: The Basis of Medicine (3rd ed.). Oxford: Oxford University Press. ISBN 978-0-19-856878-0. p 70-74.
- ↑ "NIMH " Brain Basics". www.nimh.nih.gov. Archived from the original on March 26, 2017. Retrieved March 26, 2017.
- ↑ Purves, Dale (2011). Neuroscience (5. ed.). Sunderland, Mass.: Sinauer. p. 139. ISBN 978-0-87893-695-3.
- ↑ Melis M, Pistis M (December 2007). "Endocannabinoid signaling in midbrain dopamine neurons: more than physiology?". Current Neuropharmacology. 5 (4): 268–77. doi:10.2174/157015907782793612. PMC 2644494. PMID 19305743.
Thus, it is conceivable that low levels of CB1 receptors are located on glutamatergic and GABAergic terminals impinging on DA neurons [127, 214], where they can fine-tune the release of inhibitory and excitatory neurotransmitter and regulate DA neuron firing.
Consistently, in vitro electrophysiological experiments from independent laboratories have provided evidence of CB1 receptor localization on glutamatergic and GABAergic axon terminals in the VTA and SNc. - ↑ Swaminathan, N (April 29, 2008). "Why Does the Brain Need So Much Power?". Scientific American. Archived from the original on January 27, 2014. Retrieved November 19, 2010.
- ↑ Wasserman DH (January 2009). "Four grams of glucose". American Journal of Physiology. Endocrinology and Metabolism. 296 (1): E11–21. doi:10.1152/ajpendo.90563.2008. PMC 2636990. PMID 18840763.
Four grams of glucose circulates in the blood of a person weighing 70 kg. This glucose is critical for normal function in many cell types. In accordance with the importance of these 4 g of glucose, a sophisticated control system is in place to maintain blood glucose constant. Our focus has been on the mechanisms by which the flux of glucose from liver to blood and from blood to skeletal muscle is regulated. ... The brain consumes ∼60% of the blood glucose used in the sedentary, fasted person. ... The amount of glucose in the blood is preserved at the expense of glycogen reservoirs (Fig. 2). In postabsorptive humans, there are ∼100 g of glycogen in the liver and ∼400 g of glycogen in muscle. Carbohydrate oxidation by the working muscle can go up by ∼10-fold with exercise, and yet after 1 h, blood glucose is maintained at ∼4 g. ... It is now well established that both insulin and exercise cause translocation of GLUT4 to the plasma membrane. Except for the fundamental process of GLUT4 translocation, [muscle glucose uptake (MGU)] is controlled differently with exercise and insulin. Contraction-stimulated intracellular signaling (52, 80) and MGU (34, 75, 77, 88, 91, 98) are insulin independent. Moreover, the fate of glucose extracted from the blood is different in response to exercise and insulin (91, 105). For these reasons, barriers to glucose flux from blood to muscle must be defined independently for these two controllers of MGU.
- ↑ Quistorff, B; Secher, N; Van Lieshout, J (July 24, 2008). "Lactate fuels the human brain during exercise". The FASEB Journal. 22 (10): 3443–3449. doi:10.1096/fj.08-106104. PMID 18653766. S2CID 15394163.
- ↑ Obel, L.F.; Müller, M.S.; Walls, A.B.; Sickmann, H.M.; Bak, L.K.; Waagepetersen, H.S.; Schousboe, A. (2012). "Brain glycogen-new perspectives on its metabolic function and regulation at the subcellular level". Frontiers in Neuroenergetics. 4: 3. doi:10.3389/fnene.2012.00003. PMC 3291878. PMID 22403540.
- ↑ Marin-Valencia, I.; et al. (February 2013). "Heptanoate as a neural fuel: energetic and neurotransmitter precursors in normal and glucose transporter I-deficient (G1D) brain". Journal of Cerebral Blood Flow and Metabolism. 33 (2): 175–82. doi:10.1038/jcbfm.2012.151. PMC 3564188. PMID 23072752.
- ↑ Tsuji, A. (2005). "Small molecular drug transfer across the blood-brain barrier via carrier-mediated transport systems". NeuroRx. 2 (1): 54–62. doi:10.1602/neurorx.2.1.54. PMC 539320. PMID 15717057.
Uptake of valproic acid was reduced in the presence of medium-chain fatty acids such as hexanoate, octanoate, and decanoate, but not propionate or butyrate, indicating that valproic acid is taken up into the brain via a transport system for medium-chain fatty acids, not short-chain fatty acids. ... Based on these reports, valproic acid is thought to be transported bidirectionally between blood and brain across the BBB via two distinct mechanisms, monocarboxylic acid-sensitive and medium-chain fatty acid-sensitive transporters, for efflux and uptake, respectively.
- ↑ Vijay, N.; Morris, M.E. (2014). "Role of monocarboxylate transporters in drug delivery to the brain". Curr. Pharm. Des. 20 (10): 1487–98. doi:10.2174/13816128113199990462. PMC 4084603. PMID 23789956.
Monocarboxylate transporters (MCTs) are known to mediate the transport of short chain monocarboxylates such as lactate, pyruvate and butyrate. ... MCT1 and MCT4 have also been associated with the transport of short chain fatty acids such as acetate and formate which are then metabolized in the astrocytes [78].
- ↑ Clark, D.D.; Sokoloff. L. (1999). Siegel, G.J.; Agranoff, B.W.; Albers, R.W.; Fisher, S.K.; Uhler, M.D. (eds.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects. Philadelphia: Lippincott. pp. 637–670. ISBN 978-0-397-51820-3.
- ↑ Mrsulja, B.B. (2012). Pathophysiology of Cerebral Energy Metabolism. Springer Science & Business Media. pp. 2–3. ISBN 978-1-4684-3348-7.
- ↑ Raichle, M.; Gusnard, DA (2002). "Appraising the brain's energy budget". Proc. Natl. Acad. Sci. U.S.A. 99 (16): 10237–10239. Bibcode:2002PNAS...9910237R. doi:10.1073/pnas.172399499. PMC 124895. PMID 12149485.
- ↑ Gianaros, Peter J.; Gray, Marcus A.; Onyewuenyi, Ikechukwu; Critchley, Hugo D. (2010). "Chapter 50. Neuroimaging methods in behavioral medicine". In Steptoe, A. (ed.). Handbook of Behavioral Medicine: Methods and Applications. Springer Science & Business Media. p. 770. doi:10.1007/978-0-387-09488-5_50. ISBN 978-0-387-09488-5.
- ↑ Kuzawa, C. W.; Chugani, H. T.; Grossman, L. I.; Lipovich, L.; Muzik, O.; Hof, P. R.; Wildman, D. E.; Sherwood, C. C.; Leonard, W. R.; Lange, N. (2014-09-09). "Metabolic costs and evolutionary implications of human brain development". Proceedings of the National Academy of Sciences. 111 (36): 13010–13015. Bibcode:2014PNAS..11113010K. doi:10.1073/pnas.1323099111. ISSN 0027-8424. PMC 4246958. PMID 25157149.
- ↑ ۷۶٫۰ ۷۶٫۱ Bacyinski A, Xu M, Wang W, Hu J (November 2017). "The Paravascular Pathway for Brain Waste Clearance: Current Understanding, Significance and Controversy". Frontiers in Neuroanatomy. 11: 101. doi:10.3389/fnana.2017.00101. PMC 5681909. PMID 29163074.
The paravascular pathway, also known as the “glymphatic” pathway, is a recently described system for waste clearance in the brain. According to this model, cerebrospinal fluid (CSF) enters the paravascular spaces surrounding penetrating arteries of the brain, mixes with interstitial fluid (ISF) and solutes in the parenchyma, and exits along paravascular spaces of draining veins. ... In addition to Aβ clearance, the glymphatic system may be involved in the removal of other interstitial solutes and metabolites. By measuring the lactate concentration in the brains and cervical lymph nodes of awake and sleeping mice, Lundgaard et al. (2017) demonstrated that lactate can exit the CNS via the paravascular pathway. Their analysis took advantage of the substantiated hypothesis that glymphatic function is promoted during sleep (Xie et al. , 2013; Lee et al. , 2015; Liu et al. , 2017).
- ↑ Bacyinski A, Xu M, Wang W, Hu J (November 2017). "The Paravascular Pathway for Brain Waste Clearance: Current Understanding, Significance and Controversy". Frontiers in Neuroanatomy. 11: 101. doi:10.3389/fnana.2017.00101. PMC 5681909. PMID 29163074.
The paravascular pathway, also known as the “glymphatic” pathway, is a recently described system for waste clearance in the brain. According to this model, cerebrospinal fluid (CSF) enters the paravascular spaces surrounding penetrating arteries of the brain, mixes with interstitial fluid (ISF) and solutes in the parenchyma, and exits along paravascular spaces of draining veins. ... In addition to Aβ clearance, the glymphatic system may be involved in the removal of other interstitial solutes and metabolites. By measuring the lactate concentration in the brains and cervical lymph nodes of awake and sleeping mice, Lundgaard et al. (2017) demonstrated that lactate can exit the CNS via the paravascular pathway. Their analysis took advantage of the substantiated hypothesis that glymphatic function is promoted during sleep (Xie et al. , 2013; Lee et al. , 2015; Liu et al. , 2017).
- ↑ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O'Donnell J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M (October 2013). "Sleep drives metabolite clearance from the adult brain". Science. 342 (6156): 373–377. Bibcode:2013Sci...342..373X. doi:10.1126/science.1241224. PMC 3880190. PMID 24136970.
Thus, the restorative function of sleep may be a consequence of the enhanced removal of potentially neurotoxic waste products that accumulate in the awake central nervous system.
- ↑ Tononi, Guilio; Cirelli, Chiara (August 2013). "Perchance to Prune" (PDF). Scientific American. 309 (2): 34–39. Bibcode:2013SciAm.309b..34T. doi:10.1038/scientificamerican0813-34. PMID 23923204. S2CID 54052089. Archived from the original (PDF) on 2018-12-26.
- ↑ "Brain Injury, Traumatic". Medcyclopaedia. GE. Archived from the original on May 26, 2011.
- ↑ Dawodu, S.T. (March 9, 2017). "Traumatic Brain Injury (TBI) – Definition and Pathophysiology: Overview, Epidemiology, Primary Injury". Archived from the original on April 9, 2017.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Davidson's 2010, pp. 1196–7.
- ↑ ۸۳٫۰ ۸۳٫۱ Davidson's 2010, pp. 1205–15.
- ↑ Davidson's 2010, pp. 1216–7.
- ↑ "NIMH " Brain Basics". www.nimh.nih.gov. Archived from the original on March 26, 2017. Retrieved March 26, 2017.
- ↑ Volkow, N.D.; Koob, G.F.; McLellan, A.T. (January 2016). "Neurobiologic advances from the brain disease model of addiction". The New England Journal of Medicine. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013.
- ↑ "Status Epilepticus". Epilepsy Foundation.
- ↑ Davidson's 2010, pp. 1172–9.
- ↑ Pennington, B.F. (2008). Diagnosing Learning Disorders, Second Edition: A Neuropsychological Framework. Guilford Press.
- ↑ Perese, E.F. (2012). Psychiatric Advanced Practice Nursing: A Biopsychsocial Foundation for Practice. F.A. Davis. pp. 82–88.
- ↑ Harbison, J.; Massey, A.; Barnett, L.; Hodge, D.; Ford, G.A. (June 1999). "Rapid ambulance protocol for acute stroke". Lancet. 353 (9168): 1935. doi:10.1016/S0140-6736(99)00966-6. PMID 10371574.
- ↑ Davidson's 2010, p. 1183.
- ↑ Davidson's 2010, pp. 1180–1.
- ↑ Davidson's 2010, pp. 1181, 1183–1185.
- ↑ ۹۵٫۰ ۹۵٫۱ ۹۵٫۲ Davidson's 2010, pp. 1183–1185.
- ↑ Davidson's 2010, pp. 1185-1189.
- ↑ Goyal, M. (April 2016). "Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials". The Lancet. 387 (10029): 1723–1731. doi:10.1016/S0140-6736(16)00163-X. PMID 26898852.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Saver, J. L. (December 8, 2005). "Time is brain—quantified". Stroke. 37 (1): 263–266. doi:10.1161/01.STR.0000196957.55928.ab. PMID 16339467.
- ↑ Davidson's 2010, pp. 1185–1189.
- ↑ Winstein, C.J. (June 2016). "Guidelines for adult stroke rehabilitation and recovery". Stroke. 47 (6): e98–e169. doi:10.1161/STR.0000000000000098. PMID 27145936.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Kuźma, Elżbieta; Lourida, Ilianna; Moore, Sarah F.; Levine, Deborah A.; Ukoumunne, Obioha C.; Llewellyn, David J. (November 2018). "Stroke and dementia risk: A systematic review and meta-analysis". Alzheimer's & Dementia. 14 (11): 1416–1426. doi:10.1016/j.jalz.2018.06.3061. ISSN 1552-5260. PMC 6231970. PMID 30177276.
- ↑ ۱۰۲٫۰ ۱۰۲٫۱ ۱۰۲٫۲ Goila, AK; Pawar, M (2009). "The diagnosis of brain death". Indian Journal of Critical Care Medicine. 13 (1): 7–11. doi:10.4103/0972-5229.53108. PMC 2772257. PMID 19881172.
- ↑ ۱۰۳٫۰ ۱۰۳٫۱ ۱۰۳٫۲ Wijdicks, EFM (January 8, 2002). "Brain death worldwide: accepted fact but no global consensus in diagnostic criteria". Neurology. 58 (1): 20–25. doi:10.1212/wnl.58.1.20. PMID 11781400.
- ↑ Dhanwate, AD (September 2014). "Brainstem death: A comprehensive review in Indian perspective". Indian Journal of Critical Care Medicine. 18 (9): 596–605. doi:10.4103/0972-5229.140151. PMC 4166875. PMID 25249744.
- ↑ Davidson's 2010, p. 200.
- ↑ ۱۰۶٫۰ ۱۰۶٫۱ Davidson's 2010.
- ↑ Pawar, Mridula; Goila, Ajay Kumar (2009-03). "The diagnosis of brain death". Indian Journal of Critical Care Medicine (به انگلیسی). 13 (1): 7–11. doi:10.4103/0972-5229.53108. ISSN 0972-5229. PMC 2772257. PMID 19881172.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Davidson's 2010, p. 1158.
خطای یادکرد: خطای یادکرد: برچسب <ref> برای گروهی به نام «persian-alpha» وجود دارد، اما برچسب <references group="persian-alpha"/> متناظر پیدا نشد. ().