مننژیت
| مننژیت | |
|---|---|
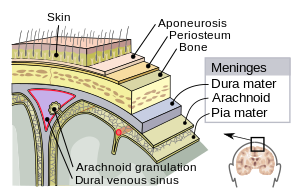 | |
| مننژهای پوشاننده سیستم عصبی مرکزی (مغز) شامل سختشامه، آراکنوئید (عنکبوتیه)، نرمشامه. | |
| تخصص | عصبشناسی، بیماری عفونی (تخصص پزشکی) |
| طبقهبندی و منابع بیرونی | |
| آیسیدی-۱۰ | G00–G03 |
| آیسیدی-۹-سیام | 320–322 |
| دادگان بیماریها | 22543 |
| مدلاین پلاس | 000680 |
| ئیمدیسین | med/۲۶۱۳ emerg/309 emerg/390 |
| پیشنت پلاس | مننژیت |
| سمپ | D008581 |
مننژیت (نام علمی: Meningitis) یا سرسام (نام فارسی به معنی آماس سر) التهاب پردههای محافظی میباشد که مغز و نخاع را پوشاندهاند و بهطور مشترک مننژ یا شامگان نامیده میشوند.[۱] این التهاب ممکن است عامل ویروسی، باکتریایی، یا سایر ریزاندامگان داشته باشد، و در موارد کمتری در اثر تجویز داروهای خاصی به وجود آید.[۲] مننژیت میتواند به دلیل نزدیکی التهاب به مغز و نخاع، زندگی بیمار را به خطر اندازد؛ بنابراین این شرایط را تحت عنوان فوریت پزشکی دستهبندی میکنند.[۱][۳]
رایجترین نشانههای مننژیت سردرد و خشکی گردن همراه با تب، گیجی یا هشیاری دگرگون شده، استفراغ، و ناتوانی در تحمل نور (نور هراسی) یا صداهای بلند (صدا هراسی) میباشد. معمولاً در کودکان فقط نشانههای غیراختصاصی مانند تحریکپذیری و خوابآلودگی مشاهده میشود. اگر ضایعهٔ پوستی مشاهده شود، ممکن است نشان دهندهٔ علت مشخصی برای مننژیت باشد؛ مثلاً، مننژیت در اثر باکتری مننگوکوک ممکن است همراه با ضایعهٔ پوستی مشخصی باشد.[۱][۴]
با یک بزل کمری میتوان مننژیت را تشخیص داد یا از بروز آن جلوگیری کرد. یک سوزن وارد مجرای نخاعی میشود تا نمونهای از مایع مغزی-نخاعی (CSF)، که مغز و نخاع را احاطه کردهاست، برداشته شود. CSF در آزمایشگاه تشخیص طبی آزمایش میشود.[۳] اولین درمان در مننژیت حاد شامل تجویز آنتیبیوتیک و گاهی داروهای ضدویروس متناسب میباشد. همچنین میتوان از کورتیکواستروئید برای جلوگیری از عوارض التهاب شدید استفاده کرد.[۳][۴] مننژیت ممکن است منجر به عوارض طولانی مدت جدی مانند ناشنوایی، صرع، هیدروسفالی، و کسریهای شناختی شود، به ویژه اگر بهسرعت درمان نشود.[۱][۴] برخی انواع مننژیت (مانند انواعی که همراه با عفونتهای مننگوکوک، "هموفیلوس آنفلوآنزاً نوع ب، پنوموکوک، یا ویروس گوشک، میباشد) را میتوان با ایمنسازی پیشگیری کرد.[۱]
علائم و نشانهها[ویرایش]
ویژگیهای بالینی[ویرایش]

در بزرگسالان، رایجترین نشانهٔ مننژیت سردرد شدید است که در حدود ۹۰٪ از مننژیتهای باکتریایی رخ میدهد و همراه با خشکی پس گردن (ناتوانی در انعطاف راحت گردن به سمت جلو به دلیل افزایش سفتی گردن و خشک شدگی است).[۵] نشانههای تشخیصی سهگانهٔ کلاسیک عبارتند از خشکی پس گردن، تب شدید ناگهانی، و وضعیت ذهن دگرگون شده؛ البته هر سه مورد همزمان فقط در ۴۶–۴۴٪ درصد از موارد مننژیت باکتریایی وجود دارد.[۵][۶] اگر هیچیک از علائم وجود نداشته باشد، مننژیت کاملاً نامحتمل است.[۶] سایر علائم رایج در همراهی مننژیت عبارتند از نورهراسی (عدم تحمل نور زیاد) یا صداهراسی (عدم تحمل صداهای بلند). کودکان در سنین پایین معمولاً نشانههای ذکرشده را ندارند، و فقط ممکن است تحریکپذیر شوند و مریض به نظر آیند.[۱] نرمهٔ سر (بخش نرم در بالای جمجمهٔ کودک) ممکن است در نوزدان تا ۶ ماهه برآمده شود. سایر ویژگیهایی که مننژیت را در کودکان از سایر بیماریهای کم خطرتر متمایز میکند عبارتند از پادرد، سردی دستها و پاها، و رنگ پوست غیرطبیعی میباشد.[۷][۸]
خشکی پس گردن در ۷۰٪ مننژیتهای باکتریایی در بزرگسالان رخ میدهد.[۶] سایر علائم مننژیت شامل وجود علامت کرنیگ مثبت یا علامت برودژینسکی میباشد. علامت کرنیگ به این صورت تشخیص داده میشود که شخص طاقباز خوابیده، و مفصل ران و زانو ۹۰ درجه انعطاف یافتهاند. در شخصی که علامت کرنیگ مثبت دارد، درد موجب محدود شدن کشش راحت زانو میشود. علامت مثبت برودژینسکی وقتی رخ میدهد که انعطاف گردن موجب انعطاف غیرارادی زانو و مفصل ران میشود. اگرچه علائم کرنیگ و برودژینسکی هردو معمولاً برای آزمایش مننژیت به کار میروند، حساسیت این آزمونها محدود است.[۶][۹] البته این دو دقت بسیار خوبی برای مننژیت دارند: این نشانهها بهندرت در سایر بیماریها رخ میدهند.[۶] آزمون دیگری به نام «آزمایش فشار تکانهای» به تعیین وجود یا عدم وجود مننژیت در تب و سردرد گزارش شده کمک میکند. از فرد خواسته میشود تا سرش را به صورت افقی به سرعت بچرخاند؛ اگر این کار موجب بدتر شدن سردرد نشد، مننژیت نامحتمل است.[۶]
مننژیت ایجاد شده توسط باکتری «نایسریا مننژیتیدیس» (که به نام «مننژیت مننگوکوک» معروف است) را میتوان به دلیل گسترش سریع ضایعهٔ پوستی ناشی از خون مردگی که ممکن است بر سایر علائم تقدم داشته باشد، از مننژیتهای ایجاد شده با عوامل دیگر متمایز کرد.[۷] این ضایعهٔ پوستی شامل تعداد زیادی لکههای ریز و غیرطبیعی بنفش یا قرمز («ابره») بر روی بالاتنه، انتهای دست و پا، غشاهای مخاطی، ملتحمهٔ چشم، و (گاهی) کف دست یا کف پا میباشد. این ضایعهٔ پوستی رنگ پریده نمیشود؛ وقتی با انگشت یا تهلیوان آن را فشار بدهیم، قرمزی از بین نمیرود. اگرچه این ضایعهٔ پوستی الزاماً در مننژیت مننگوکوک وجود ندارد، نسبتاً خاص همین بیماری است؛ البته گاهی هم در مننژیت ایجاد شده با سایر باکتریها وجود دارد.[۱] سایر علامتهای مننژیت ممکن است شامل علائم بیماری دست، پا و دهان و تبخالهای اندام تناسلی باشد که هردو همراه با انواع مننژیتهای ویروسی هستند.[۱۰]
عوارض اولیه[ویرایش]

مشکلات دیگری هم ممکن است در مراحل اولیهٔ بیماری رخ دهد. این مشکلات ممکن است نیاز به درمانی خاص داشته باشد، و گاهی نشان دهندهٔ بیماری وخیم یا پیشآگهی بدتری است. عفونت ممکن است شروعکنندهٔ مسمومیت عفونی باشد، یک سندروم واکنشی التهابی در بدن از افت فشار خون، تپش سریع قلب، دمای بالا یا پایین غیرطبیعی بدن، و تنفس سریع. در مرحلهٔ اول ممکن است فشار خون بسیار پایین اتفاق بیفتد، به ویژه اما نه منحصر به مننژیت مننگوکوک؛ این مسئله ممکن است موجب نرسیدن خون کافی به سایر اندامها شود.[۱] انعقاد درونرگی منتشر، فعالیت بیش از حد لخته شدن خون، ممکن است مانع جریان خون به اندامها شود و در مقابل خطر خونریزی را افزایش دهد. قانقاریا اندامها ممکن است در بیماری مننگوکوک رخ بدهد.[۱] عفونتهای شدید مننگوکوک و پنوموکوک ممکن است منجر به خونریزی غدد فوق کلیوی شده و به سندروم واترهوس-فردریشن ختم شود که اغلب کشنده است.[۱۱]
بافتهای مغز ممکن است متورم شوند، فشار داخل جمجمه ممکن است افزایش یابد و مغز متورم شده ممکن است از طریق بستر جمجمه دچار فتق شود. این اتفاق را میتوان از طریق کاهش سطح هوشیاری، از دست رفتن واکنش مردمک به نور، و وضع اندامی غیرطبیعی مشاهده کرد.[۴] تشنج ممکن است به دلایل مختلف اتفاق بیفتد؛ در کودکان، تشنج در مراحل اولیهٔ مننژیت رایج است (در ۳۰٪ موارد) و لزوماً نشانگر عاملی اساسی نیست.[۳] تشنج ممکن است در نتیجهٔ فشار افزایش یافته و مناطقی از بافت مغز که ملتهب شدهاست باشد.[۴] تشنج موضعی (تشنجی که یک اندام یا بخش از بدن را درگیر میکند)، تشنج پایدار، تشنج دیر به دیر و مواردی که نمیتوان به آسانی با دارو کنترلشان کرد نشان دهندهٔ نتیجهٔ ضعیفتری در درازمدت هستند.[۱]
التهاب مننژها ممکن است منجر به وضعیت غیرطبیعی در اعصاب جمجمهای شود، گروهی از اعصاب که از ساقهٔ مغز شروع شده و مناطق سر و گردن را تغذیه میکنند و در کنار سایر عملکردها، حرکات چشم، حرکات صورت، و شنوایی را کنترل میکنند.[۱][۶] علائم دیداری و از دست رفتن شنوایی ممکن است پس از مرحلهای مننژیت ادامه یابد.[۱] التهاب مغز (آنسفالیت) یا عروق خونی آن (واسکولیتیس مغزی)، به همراه شکل گرفتن لختههای خونی در رگها (ترومبوز سیاهرگی مغزی) ممکن است منجر به ضعف، از دست رفتن حواس، یا حرکت و عملکرد غیرطبیعی بخشی از بدن که در ارتباط با قسمت آسیب دیدهٔ مغز میباشد شود.[۱][۴]
عوامل[ویرایش]
مننژیت معمولاً به علت عفونت با ریزاندامگان عارض میشود. اکثر عفونتها به دلیل ویروس است،[۶] و باکتری، قارچ، و تکیاختهها علتهای رایج بعدی هستند.[۲] اصطلاح «مننژیت بدون عفونت» به مواردی از مننژیت گفته میشود که در آنها هیچگونه عفونت باکتریایی قابل تشخیص نیست. این نوع مننژیت معمولاً علتی ویروسی دارد، اما ممکن است به دلیل عفونت باکتریایی باشد که بخشی از آن درمان شدهاست، وقتی که باکتری از مننژها ناپدید میشود یا پاتوژنها فضایی متصل به مننژها را عفونی میکنند (مثلاً سینوزیت). التهاب غشاء داخلی قلب (عفونت دریچههای قلب که خوشههای کوچکی از باکتری را در جریان خون پخش میکند) ممکن است علت مننژیت بدون عفونت باشد. همچنین ممکن است مننژیت بدون عفونت در نتیجهٔ عفونت با اسپیروکتها باشد، نوعی باکتری که دارای «ترپونیما پالیدوم» (عامل سیفلیس و «بورلیا بورگدورفری» که برای ایجاد بیماری لایم شناخته شدهاست) است. ممکن است با مننژیت در مالاریای مغزی (مالاریایی که مغز را عفونی میکند) رو به رو شویم یا مننژیت آمیبی، مننژیتی که به دلیل عفونت با آمیبهایی مانند «ناگلریا فولری» به وجود میآید، که در منابع آب شیرین وجود دارند.[۲]
باکتریایی[ویرایش]
نوع باکتری که موجب مننژیت باکتریایی میشود براساس گروه سنی فرد مبتلا متفاوت است.
- در کودکان نارس و نوزادان تا سه ماه، عوامل رایج عبارتند از «گروه B استرپتوککها» (نوع فرعی III که معمولاً در مهبل ساکن است و معمولاً عامل اصلی در طول هفتهٔ اول زندگی است) و باکتریهایی که معمولاً در دستگاه گوارش ساکن هستند مانند «اشریشیا کولای» (حامل آنتیژن K1). «لیستریا مونوسیتوژن» (سروتایپ IVb) میتواند بر نوزادان تأثیر گذاشته و به شکل اپیدمی اتفاق بیفتد.
- کودکان در سن بالاتر اغلب تحت تأثیر «نایسریا مننژیتیدیس» (مننگوکوک) و «استرپتوکک پنومونیه» (سروتایپهای ۶، ۹، ۱۴، ۱۸ و ۲۳) قرار میگیرند و کودکان زیر پنج سال تحت تأثیر «گروه B «هموفیلوس آنفلوآنزا»» (در کشورهایی که واکسیناسیون وجود ندارد) قرار میگیرند.[۱][۳]
- در بزرگسالان، «نایسریا مننژیتیدیس» و «استروپتوکک پنومونیه» به صورت مشترک عامل ۸۰٪ موارد مننژیت باکتریایی هستند. خطر آلودگی با «لیستریا مونوسیتوژن» در افراد بالای ۵۰ سال افزایش مییابد.[۳][۴] معرفی واکسن پنوموکوک موجب کاهش میزان مننژیت پنوموکوک در کودکان و بزرگسالان شدهاست.[۱۲]
ترومای جمجمهای جدید میتواند به صورت بالقوه به باکتری حفرهٔ بینی امکان ورود به فضای مننژی را بدهد. سایر ابزارهای به کار رفته در مغز و مننژ مانند شنت مغزی، مایع گذر خارج از شکمچهٔ مغز یا مخزن اومایا، نیز به همین ترتیب خطر افزایش یافتهای برای مننژیت به همراه دارند. در این موارد احتمال بیشتر این است که افراد با استافیلوکوک، شبه تک میله، و سایر باکتریهای گرم-منفی آلوده شوند.[۳] همچنین این پاتوژنها در افراد با سیستم ایمنی ناقص با مننژیت در ارتباط هستند.[۱] عفونتی در قسمت سر یا گردن، مانند عفونت گوش میانی یا عفونت استخوان پس گوش در افراد کمی ممکن است منجر به مننژیت شود.[۳] دریافت کنندگان کاشت حلزونی برای ضعف شنوایی بیشتر در خطر مننژیت پنوموکوک هستند.[۱۳]
مننژیت سلی، که مننژیت ناشی از «میکوباکتریوم سل» است، در میان اهالی کشورهایی رایجتر است که سل در آن جا بومگیر است، و البته در افراد با مشکلات ایمنی، مانند ایدز، هم اتفاق میافتد.[۱۴]
مننژیت باکتریایی عودکننده ممکن است به علت نقصهای ادامهدار کالبدشناختی، چه مادرزادی و چه اکتسابی، یا به دلیل اختلالات سیستم ایمنی باشد.[۱۵] نقصهای کالبدشناختی امکان پیوستگی میان محیط بیرون و سیستم عصبی را میدهد. رایجترین علت مننژیت عودکننده، شکستگی جمجمه است،[۱۵] به خصوص شکستگیهایی که بر پایین جمجمه تأثیر میگذارند یا تا سینوسها و هرم خارهای کشیده میشوند.[۱۵] حدود ۵۹٪ از موارد مننژیتهای عودکننده به دلیل چنین شرایط غیرطبیعی کالبدشناختی است، ۳۶٪ به دلیل نقصهای ایمنی است (مانند نقص مکمل، که به ویژه مستعد مننژیت مننگوکوک عودکننده است)، و ۵٪ به دلیل عفونت در بخشهای مجاور مننژهاست.[۱۵]
ویروسی[ویرایش]
ویروسهایی که عامل مننژیت هستند عبارتند از آنتروویروس، ویروس هرپس سیمپلکس نوع ۲ (و نوع ۲ با رواجی کمتر)، ویروس زونا (که به عامل آبله مرغان و زونا شناخته میشود)، ویروس اوریون، اچ آی وی، و ال سی ام وی.
قارچی[ویرایش]
تعدادی عامل خطر برای مننژیت قارچی وجود دارد، شامل ایمنی فرونشانی (مثلاً پس از پیوند اعضا)، ایدز،[۱۶] و از دست رفتن ایمنی همراه با افزایش سن.[۱۷] این مورد در افرادی که سیستم ایمنی طبیعی دارند، رایج نیست[۱۸] اما با آلودگی دارویی اتفاق افتادهاست.[۱۹] علائم در آغاز تدریجیتر هستند، و سردرد و تب چند هفته قبل از تشخیص به وجود میآید.[۱۷] رایجترین مننژیت قارچی مننژیت کریپتوکوکال به علت «کریپتوکوکوزیس» است.[۲۰] تخمین زده میشود که در آفریقا، مننژیت کریپتوکوکال، رایجترین علت مننژیت است[۲۱] و دلیل ۲۵–۲۰٪ مرگ و میر مربوط به ایدز در آفریقا میباشد.[۲۲] سایر عوامل قارچی عبارتند از گونههای «هیستوپلاسما کپسولاتوم»، «کوکیدیودس ایمیتیس»، «بلاستومایسس درماتیتیدیس»، و «کاندیدا».[۱۷]
انگلی[ویرایش]
معمولاً احتمال عامل انگلی در زمان نفوذ ائوزینوفیل (نوعی گلبول سفید) در CSF میرود. رایجترین انگلهای حاضر عبارتند از «آنژیوسترونژیلوس کانتونسیس»، «گناتوستوما اسپینیژروم»، «شیستوزوم» و شرایط کسیتیکروکوسیس، تاکسوکاریاسیس، بایلیساسکاریس، پاراگونیمیاسیس، و تعدادی عفونتها و شرایط غیرعفونی کمتر رایج.[۲۳]
غیرعفونی[ویرایش]
مننژیت ممکن است در نتیجهٔ علتهای متعدد غیرعفونی به وجود بیاید: گسترش سرطان به مننژیت («مننژیت نئوپلاستیک یا بدخیم»)[۲۴] و داروهای خاص (به ویژه داروهای غیراستروئیدی ضدالتهاب، آنتیبیوتیک، و ایمونو گلوبولین).[۲۵] همچنین ممکن است در اثر شرایط التهابی متنوعی باشد، مانند سارکوئیدوز (که آنگاه به آن سارکوئیدوز عصبی گفته میشود)، اختلالهای بافتهای پیوندی مانند لوپوس منتشر، و گونههای خاصی از التهاب رگ (شرایط التهاب دیوارهٔ رگهای خونی)، مانند بیماری راه ابریشم.[۲] کیست بشرهای و کیست شبه پوستی میتوانند با رهاسازی مادهٔ تحریککننده در فضای غشای پردهٔ عنکبوتیه موجب مننژیت شوند.[۲][۱۵] مننژیت مولارت سندرومی از مراحل مننژیتهای غیرعفونی است؛ گمان بر این است که عامل آن ویروس هرپس سیمپلکس نوع ۲ میباشد. در موارد نادری، میگرن ممکن است عامل مننژیت شود، اما معمولاً این تشخیص زمانی انجام میشود که سایر عوامل از بین رفته باشند.[۲]
سازوکار[ویرایش]
مننژها از سه غشاء تشکیل شدهاند که، همراه با مایع مغزی-نخاعی، مغز و نخاع (سیستم عصبی مرکزی) را احاطه کرده و از آنها محافظت میکنند. نرم شامه غشاء بسیار ظریف و ناتراوایی است که محکم به سطح مغز چسبیدهاست و روی تمام شیارها وجود دارد. غشاء عنکبوتیه (که به دلیل شباهتش به تار عنکبوت اینگونه نامگذاری شدهاست)، کیسهای است به صورتی ناپایدار بالای نرم شامه قرار گرفتهاست. فضای تحت غشاء عنکبوتیه دو غشاء عنکبوتیه و نرم شامه را از هم جدا میکند و با مایع مغزی-نخاعی پر شدهاست. بیرونیترین غشاء، سخت شامه است که غشایی ضخیم و بادوام میباشد و هم به غشاء عنکبوتیه و هم به جمجمه چسبیدهاست.
در مننژیت باکتریایی، باکتریها از یکی از این دو راه به مننژها میرسند: از طریق جریان خون یا از طریق تماس مستقیم بین مننژها و حفرهٔ بینی یا پوست. در اکثر موارد، مننژیت همراه با حملهٔ اندامگانی که در سطوح مخاطی مانند حفرهٔ بینی زندگی میکنند، به جریان خون است. این اتفاق اغلب با عفونت ویروسی از قبل همراه است که سد طبیعی ایجاد شده توسط غشاء مخاطی را از بین میبرد. وقتی که باکتریها وارد جریان خون شوند، در مکانهایی که سد خونی-مغزی آسیبپذیر است – مانند شبکهق مشیمیه – به فضای زیر غشاء عنکبوتیه وارد میشوند. مننژیت در ۲۵٪ نوزادان با عفونتهای ناشی از استروپتوکوکهای گروه B موجود در جریان خون اتفاق میافتد؛ این عارضه در بزرگسالان کمتر رایج است.[۱] آلودگی مستقیم مایع مغزی-نخاعی ممکن است در اثر ابزارهای کارگذاشته شده درون بدن، شکستگیهای جمجمه، یا عفونت حلق و بینی یا سینوسهای بینی که با فضای زیر غشاء عنکبوتیه تشکیل یک دستگاه تار عصبی را دادهاند رخ بدهد (به قسمت قبل رجوع کنید)؛ گاهی نقصهای مادرزادی در سخت شامه را میتوان تشخیص داد.[۱]
التهاب گسترده که در طول در فضای زیر غشاء عنکبوتیه رخ میدهد، نتیجهٔ مستقیم عفونت باکتریایی نیست بلکه بیشتر میتوان آن را به واکنشهای سیستم ایمنی نسبت به ورود باکتری به سیستم عصبی مرکزی نسبت داد. وقتی اجزای غشاء سلولی باکتریایی توسط سلولهای ایمنی مغز (آستروسیت و میکروگلیال) شناسایی میشوند، با آزاد کردن مقادیر زیادی سیتوکین، واسطههای هورمون شکلی که سایر سلولهای ایمنی را به کار میگیرند و بافتهای دیگر را تحریک میکنند تا در واکنشی ایمنی شرکت کنند، واکنش نشان میدهند. سد خونی-مغزی تراواتر میشود که منجر به ادم مغزی وازوژنیک (تورم مغز به دلیل نشت مایع از رگهای خونی) میشود. تعداد زیادی گلبول سفید به CSF وارد میشوند و موجب التهاب مننژها شده و منجر به ادم بینابینی (تورم به دلیل مایع میان سلولها) میشوند. علاوه بر این، خود دیوارهٔ رگهای خونی هم ملتهب میشود (التهاب رگهای مغزی) که منجر به جریان خون کاهش یافته و نوع سومی از ادم، ادم سیتو تاکسیک، میشود. هر سه نوع ادم مغزی منجر به افزایش فشار داخل جمجمهای میشود؛ معنای این مسئله که اغلب همراه با فشار خون افت کردهٔ حاصل از عفونت حاد است این میباشد که خون سختتر میتواند وارد مغز شود، در نتیجه سلولهای مغز از اکسیژن محروم میمانند و دچار مرگ برنامهریزی شده یاخته (مرگ سلول) میشوند.[۱] مشخص شدهاست که بهکارگیری آنتیبیوتیک ممکن است درابتدا، با افزایش میزان محصولات باکتریایی سلول غشا که از طریق نابودی باکتریها آزاد میشوند، روند یادشده را بدتر کند. درمانها خاص مانند استفاده از کورتیکواستروئید با هدف تعدیل پاسخ سیستم ایمنی به این فرایند به کار میرود.[۱][۴]
تشخیص[ویرایش]
| گونهٔ مننژیت | گلوکز | پروتئین | سلولها |
|---|---|---|---|
| باکتریایی حاد | پایین | بالا | PMNs, معمولاً> ۳۰۰/mm³ |
| ویروسی حاد | عادی | عادی یا بالا | تکهستهای، <۳۰۰/mm³ |
| سل | پایین | بالا | تک هستهای و PMNs, <۳۰۰/mm³ |
| قارچی | پایین | بالا | <۳۰۰/mm³ |
| بدخیم | پایین | بالا | معمولاً تک هستهای |
آزمایش خون و تصویربرداری[ویرایش]
برای کسی که مشکوک به مننژیت است، آزمایش خون برای نشانگرهای التهاب انجام میشود (مثلاً پروتئین C واکنشی، شمارش کامل خون)، و نیز کشت خون.[۳][۲۷]
مهمترین آزمایش برای تشخیص یا رد کردن مننژیت، بررسی مایع مغزی-نخاعی از طریق سوراخ کمری میباشد (LP، برداشت مایع نخاع).[۲۸] البته اگر تودهای (تومور یا ورم) در مغز باشد یا فشار درون جمجمهای (ICP) بالا رفته باشد نباید از سوراخ کمری استفاده کرد چرا که ممکن است منجر به فتقدار شدن مغز شود. اگر فرد در معرض خطر توده یا ICP بالا رفته باشد (آسیب جدید به سر، مشکل شناخته شده در سیستم ایمنی، نشانههای عصبشناختی موضعی، یا نشانههایی بر ICP بالا رفته) انجام اسکن سیتی یا اسکن امآرآی قبل از سوراخ کمری توصیه میشود.[۳][۲۷][۲۹] این مسئله در ۴۵٪ موارد بزرگسالان صدق میکند.[۴] اگر قبل از الپی نیاز به سیتی یا امآرآی باشد، یا انجام الپی مشکل باشد، دستورالعمل حرفهای این است که ابتدا باید از آنتیبیوتیک برای جلوگیری از تأخیر در درمان استفاده کرد،[۳] بهویژه اگر این کار ممکن است بیش از ۳۰ دقیقه به طول بینجامد.[۲۷][۲۹] اغلب سیتی اسکن یا امآرآی در مراحل بعدی انجام میشوند تا پیچیدگی مننژیت سنجیده شود.[۱]
در انواع حاد مننژیت، کنترل الکترولیتهای خون ممکن است مهم باشد؛ مثلاً هیپوناترمی در مننژیت باکتریایی، بنا به مجموعهای از عوامل شامل کمآبی بدن، دفع نامناسب در هورمون کاهنده ادرار (SIADH) یا تزریق مایع درون وریدی بسیار تهاجمی، رایج است.[۴][۳۰]
سوراخ کمری[ویرایش]

سوراخ کمری معمولاً این گونه انجام میشود که که فرد را به پهلو میخوابانند و از بیحسی موضعی استفاده میکنند، سپس سوزنی را به کیسه سختشامهای (کیسهای دو طناب نخاعی) وارد میکنند تا مایع مغزی-نخاعی (CSF) را جمع کنند. وقتی این کار انجام شد، «فشار باز» CSF بااستفاده از مانومتر سنجیده میشود. فشار معمولاً بین ۶ و۱۸ سانتیمتر آب (cmH۲O) است؛[۲۸] در مننژیت باکتریایی معمولاً فشار افزایش مییابد.[۳][۲۷] در مننژیت کریپتوکوکال، فشار درون جمجمهای به میزان قابل توجهی افزایش مییابد.[۳۱] ظاهر شدن اولیه مایع ممکن است اثبات نشانهای از ماهیت عفونت باشد: CSF کدر نشاندهندهٔ سطوح بالاتری از پروتئین، گلبولهای قرمز و سفید بیشتر و/یا باکتری است، و در نتیجه ممکن است نشانهٔ مننژیت باکتریایی باشد.[۳]
نمونهٔ CSF برای وجود و گونههای گلبول سفید، گلبول قرمز، محتوای پروتئین و سطح گلوکز آزمایش میشود.[۳] رنگآمیزی گرم نمونه ممکن است در مننژیت باکتریایی نشان دهندهٔ باکتریها باشد، اما نبود باکتری اثباتکنندهٔ عدم مننژیت باکتریایی نیست چرا که این مسئله فقط در ۶۰٪ موارد دیده میشود؛ این رقم در صورت استفاده از آنتیبیوتیک قبل از نمونهگیری، ۲۰٪ دیگر هم کاهش مییابد. رنگآمیزی گرم هم در عفونتهای خاصی مثل لیستریوسیس کمتر قابل اعتماد است. کشت میکروبشناسی نمونه دقت بیشتری دارد (در ۸۵–۷۰٪ موارد، ارگانیزم را شناسایی میکند) اما نتایج پس از ۴۸ ساعت آماده میشوند.[۳] نوع گلبول سفید غالب (به جدول رجوع کنید) مشخص میکند که آیا مننژیت باکتریایی است (معمولاً غلبه با نوتروفیل است) یا ویروسی (معمولاً غلبه با لنفوسیت است)،[۳] البته این روش در شروع بیماری، مشخصکنندهٔ معتبری نیست. با رواجی کمتر، غلبهٔ ائوزینوفیل بیشتر از احتمال علت انگلی یا قارچی خبر میدهد.[۲۳]
تراکم گلوکز در CSF معمولاً ۴۰٪ از آن در خون است. در مننژیت باکتریایی این میزان کمتر است؛ در نتیجه سطح گلوکز CSF توسط گلوکز خون (نسبت گلوکز CSF به گلوکز سروم) تقسیم میشود. نسبتی ≤ ۰٫۴ نشان دهندهٔ مننژیت باکتریایی است؛[۲۸] در نوزادان، سطح گلوکز در CSF معمولاً بالاتر است و بنابراین نسبت کمتر از ۰٫۶ (۶۰٪) غیرطبیعی تلقی میشود.[۳] سطح بالای لاکتات در CSF نشاندهندهٔ احتمال بالاتری بر وجود مننژیت باکتریایی است، همانطوریکه تعداد زیاد گلبول سفید هم گویای همین مطلب است.[۲۸] اگر سطح لاکتات کمتر از ۳۵ mg/dl باشد و شخص قبلاً آنتیبیوتیک دریافت نکرده باشد، آنگاه این نشانه احتمالاً وجود مننژیت باکتریایی را رد میکند.[۳۲]
آزمایشهای تخصصی متنوع دیگری هم میتوان برای تشخیص میان گونههای مننژیت انجام داد. آزمایش تثبیت لاتکس ممکن است در مننژیت با عامل «استروپتوکوک پنومونیه»، «نایسریا مننژیدیتیس»، «هموفیلوس آنفلوآنزا»، «اشریشیا کولای» و «گروه B استرپتوکوکها» مثبت باشد؛ انجام عادی آن توصیه نمیشود چرا که بهندرت منجر به تغییر درمان میشود، اما اگر سایر آزمایشها کمکی به تشخیص نکرد میتوان از آن استفاده نمود. به همین ترتیب، آزمایش لیمولوس لیسات ممکن است در مننژیت با عامل باکتری گرم-منفی، مثبت باشد اما کاربرد آن محدود است مگر اینکه سایر آزمایشها کمکی نکند.[۳] واکنش زنجیرهای پلیمراز (PCR) روشی است که برای بزرگ کردن نشانههای DNA باکتریایی به کار میرود تا آنکه بتوان تشخیص داد آیا DNA باکتریایی یا ویروسی در مایع مغزی-نخاعی وجود دارد یا خیر؛ این آزمایش بسیار حساس و تخصصی است چرا که فقط میزانی در حد نشانه از DNA عامل آلوده نیاز است. این آزمایش ممکن است باکتری را در مننژیت باکتریایی تشخیص داده و به تشخیص عوامل مختلف مننژیت ویروسی کمک کند (آنتروویروس، ویروس هرپس سیمپلکس ۲ و اوریون در کسانی که واکسینه نشدهاند).[۱۰] سرولوژی (تشخیص پادتنها از ویروسها) ممکن است در مننژیت ویروسی مفید باشد.[۱۰] اگر احتمال مننژیت سلی باشد، نمونه برای رنگآمیزی زایهل-نیلسن پردازش میشود، که حساسیت پایینی دارد، و کشت سل که پردازش آن زمانی طولانی میبرد؛ PCR بهطور فزایندهای در حال کاربرد است. تشخیص مننژیت کریپتوکوک را میتوان با هزینهای کم و با استفاده از رنگآمیزی CSF جوهر هند انجام داد؛ البته آزمایش برای آنتیژن کریپتوکوک در خون یا CSF حساستر است، بهویژه در افراد مبتلا به ایدز.[۳۳][۳۴]
یکی از مشکلات تشخیص و درمان «مننژیت نیمه درمانشده» است، یعنی زمانی که پس از دریافت آنتیبیوتیک (مانند سینوزیت احتمالی) علائم مننژیت وجود دارد. وقتی چنین اتفاقی میافتد، یافتههای CSF ممکن است شبیه به مننژیت ویروسی باشد، اما ممکن است نیاز باشد که درمان با آنتیبیوتیک را ادامه داد تا شواهد قطعی عامل ویروسی مثبت مشاهده شود (مثلاً آنتروویروس مثبت PCR).[۱۰]
کالبدشکافی[ویرایش]

مننژیت را پس از مرگ هم میتوان تشخیص داد. یافتههای کالبدشکافی معمولاً التهاب گستردهٔ نرمشامه و لایههای عنکبوتیه مننژها را نشان میدهد. نتروفیل گرانولوسیت متمایل به رفتن به مایع مغزی-نخاعی و پایین مغز شدهاند، و عصب جمجمهای و نخاع، ممکن است، به همراه رگهای مننژها، در چرک محصور باشند.[۳۵]
پیشگیری[ویرایش]
برای برخی عوامل مننژیت، میتوان از طریق واکسیناسیون مقاومت در بلندمدت را فراهم کرد، یا در کوتاهمدت از آنتیبیوتیک استفاده کرد. برخی اقدامات رفتاری نیز ممکن است مؤثر باشد.
رفتاری[ویرایش]
مننژیت باکتریایی و ویروسی واگیردار هستند، البته هیچکدام به واگیرداری سرماخوردگی یا آنفلوآنزا نیستند.[۳۶] احتمال انتقال هر دو از طریق ذرات ترشحات تنفسی در حین برخوردهای نزدیک مانند بوسیدن، عطسه یا سرفه کردن به طرف کسی وجود دارد، اما صرف تنفس هوایی که فرد مبتلا به مننژیت در آن نفس کشیدهاست باعث انتقال آنها نمیشود.[۳۶] مننژیت ویروسی معمولاً توسط آنتروویروسها به وجود میآید، و بیشتر از طریق آلودگی مدفوعی منتشر میشود.[۳۶] احتمال آلودگی را میتوان با تغییر رفتارهای منجر به انتقال کاهش داد.
واکسیناسیون[ویرایش]
از دههٔ ۱۹۸۰ بسیاری از کشورها ایمنسازی در برابر «هموفیلوس آنفلوآنزا» نوع ب را در برنامهٔ معمول واکسیناسیون کودکان قرار دادهاند. این کار باعث از بین رفتن عملی این پاتوژن به عنوان یکی از عوامل مننژیت در نوجوانان در این کشورها شدهاست. البته در کشورهایی که میزان ابتلا به این بیماری زیاد است، واکسن آن هنوز بسیار گرانقیمت میباشد.[۳۷][۳۸] به همین ترتیب، ایمنسازی در برابر اوریون نیز باعث کاهش شدید تعداد موارد مننژیت اوریونی شدهاست که قبل از واکسیناسیون در ۱۵٪ موارد ابتلا به اوریون رخ میداد.[۱۰]
واکسنهای مننگوکوک برای مقابله با گروههای A, C، W۱۳۵ و Y وجود دارد.[۳۹] در کشورهایی که واکسن مننگوکوک گروه C استفاده شدهاست، موارد ابتلا به دلیل این پاتوژن کاهش اساسی داشتهاست.[۳۷] امروزه واکسنی چهارظرفیتی وجود دارد که هر چهار واکسن در آن جمع شدهاند. امروزه ایمنسازی با واکسن ACW135Y در برابر هر چهار نوع یکی از ملزومات صدور ویزا برای حج است.[۴۰] ساخت واکسن برای مننگوکوکهای گروه B بسیار سختتر است چرا که پروتئینهای سطح آن (که معمولاً برای ساخت واکسن از آنها استفاده میشود) واکنش سیستم ایمنی ضعیفی ظاهر میکنند، یا با پروتئینهای معمولی انسانی واکنش پیوندی میدهند.[۳۷][۳۹] البته کشورهایی مانند نیوزیلند، کوبا، نروژ و شیلی واکسنهایی در برابر گونههای بومی مننگوکوکهای گروه B ساختهاند؛ برخی نتایج خوبی به دست دادهاند و در برنامههای ایمنسازی بومی استفاده میشوند.[۳۹] در آفریقا تا دورههای اخیر رویکرد پیشگیری و کنترل همهگیری مننژیتی مبتنی بود بر تشخیص سریع بیماری و واکسیناسیون گستردهٔ جمعیت در معرض خطر با واکسنهای پلیساکارید دوظرفیتی A/C یا سهظرفیتی A/C/W135.[۴۱] اما معرفی مِنافریکواک (واکسن مننگوکوک گروه A) تأثیری در افراد جوان نشان دادهاست و بهعنوان مدلی برای همکاری در توسعهٔ محصول در محیطهای با منابع محدود تعریف شدهاست.[۴۲][۴۳]
واکسیناسیون معمول در برابر «استروپتوکوک نومونیا» با واکسن پنوموکوک کونژوگهبا نام Prevenar13 که در برابر ۱۳ سروتایپ بیماریزای رایج این پاتوژن فعال است، به شکل قابل توجهی وقوع مننژیت پنوموکوکی را کاهش میدهد و امروزه در بیش از ۱۱۸ کشور دنیا به شکل اجباری برای کودکان تزریق میگردد. این واکسن برای افراد بالاتر از ۵۰ سال نیز شدیداً توصیه میشود. علاوه بر آن افراد مبتلا به بیماریهای مزمن قلبی ریوی کبدی و کلیوی، افراد دیابتی، مبتلایان به انواع بدخیمی، آنمی سیکل سل و هموگلوبینوپاتی، مشکلات طحال، افراد سیگاری یا الکلی، کاندید پیوند، کاشت حلزون شنوائی، دریافت کنندگان داروهای سرکوبکننده ایمنی همچون شیمی درمانی و کورتون درمانی طولانی مدت نیز باید واکسنPrevenar13 را دریافت کنند. این واکسن هماکنون در ایران نیز موجود است.[۳۷][۴۴] واکسن پلیساکارید پنوموکوک که ۲۳ گونه را پوشش میدهد فقط برای گروههای خاصی تجویز میشود (مثلاً کسانی که طحالبرداری، عمل جراحی برای خارج کردن طحال داشتهاند)؛ این واکسن واکنش ایمنی مشخصی را در تمام دریافتکنندگان، مثلاً خردسالان، موجب نمیشود.[۴۴] واکسیناسیون دوران طفولیت با ب س ژ موجب کاهش چشمگیر میزان مننژیت سلی شدهاست، اما افول تأثیر آن در بزرگسالی باعث ترغیب برای جستجوی واکسن بهتری شدهاست.[۳۷]
آنتیبیوتیکها[ویرایش]
پیشگیری کوتاهمدت با آنتیبیوتیک یکی دیگر از روشهای پیشگیری است، بهویژه برای مننژیت مننگوکوک. در موارد مننژیت مننگوکوک، درمان پیشگیرانهٔ افراد نزدیک با آنتیبیوتیک (مثلاً ریفامپین، سیپروفلوکساسین، یا سفتریاکسون) میتواند از خطر ابتلا به آن شرایط بکاهد، اما در برابر آلودگیهای آینده مقاومتی ایجاد نمیکند.[۲۷][۴۵] مقاومت نسبت به ریفامپین پس از استفاده مشاهده شدهاست، به همین دلیل برخی استفاده از سایر عوامل را توصیه میکنند.[۴۵] در حالیکه آنتیبیوتیکها بهطور مستمر برای جلوگیری از مننژیت در افراد با ترک بخش تحتانی جمجمه استفاده میشود، شواهد کافی مبنی بر مفید یا مضر بودن این روش وجود ندارد.[۴۶] این روش در افراد دارای CSF یا غیر آن استفاده میشود.[۴۶]
کنترل[ویرایش]
مننژیت بهصورت بالقوه خطر مرگ به همراه دارد و اگر درمان نشود میزان مرگ و میر آن زیاد است و گاهی بر اثر درمان نشدن وتاخیر در زدن آمپول های درمانی در نخاع مغز دچار خونریزی شده و دچار سکته خفیف میشود و فرد دچار خون دماغ به صورت لک و بعد از دقایقی دچار خونریزی متوسط میشود این نشانه بارز سکته مغزی خفیف و به شدت خطرناک میباشد.؛[۳] تأخیر در درمان همراه با نتایجی ضعیفتر است.[۴] بنابراین، درمان با مجموعهای از آنتیبیوتیکها را نباید به تأخیر انداخت و در عین حال آزمایشهای تأییدی را هم باید انجام داد.[۲۹] اگر در مرحلهٔ اولیه مشکوک به بیماری مننگوکوک هستیم، راهنماها توصیه میکنند که قبل از اعزام به بیمارستان، بنزیل پنیسیلین استفاده شود.[۷] مایعات درون وریدی باید تجویز شوند اگر فشار خون پایین (پایین بودن فشار خون) یا شوک وجود داشته باشد.[۲۹] از آنجا که مننژیت میتواند باعث عوارض شدید اولیه شود، بررسیهای پزشکی منظم برای تشخیص این عوارض[۲۹] و در صورت نیاز انتقال فرد به بخش مراقبتهای ویژه توصیه میشود.[۴]
ممکن است در صورت پایین بودن سطح هوشیاری یا وجود شواهد توقف تنفس نیاز به تنفس مصنوعی باشد. اگر علائم افزایش فشار درونجمجمهای مشاهده شود، بهتر است اقدامات سنجش فشار انجام شود؛ با این کار میتوان به بهینهسازی فشار فضای مغز و درمانهای گوناگون برای کاهش فشار درونجمجمهای با دارو (مثلاً مانیتول) کمک کرد.[۴] حملات را با ضدتشنجها درمان میکنند.[۴] هیدروسفالی (جریان مسدود شدهٔ CSF) ممکن است نیاز به کار گذاشتن موقت یا بلندمدت وسیلهٔ خروج مایع مانند شنت مغزی داشته باشد.[۴]
مننژیت باکتریایی[ویرایش]
آنتیبیوتیکها[ویرایش]

آنتیبیوتیکهای تجربی (درمان بدون تشخیص قطعی) باید سریعاً آغاز شود، حتی قبل از مشخص شدن نتایج سوراخ کمری و CSF. انتخاب درمان اولیه تا حد زیادی وابسته به نوع باکتری به وجود آورندهٔ مننژیت در مکان و میان افراد خاص است؛ مثلاً در بریتانیا، درمان تجربی شامل سفالوسپورین نسل سوم مانند سفوتاکسیم یا سفتریاگزون است.[۲۷][۲۹] در ایالات متحد آمریکا که مقاومت روبهرشد به سفالوسپورینها در استروپتوکوکها مشاهده میشود، افزودن وانکومیسین به درمان اولیه توصیه میشود.[۳][۴][۲۷] کلرامفنیکل چه به تنهایی و چه همراه با آمپیسیلین هم به نظر میرسد که کارکرد یکسانی داشته باشند.[۴۷]
درمان تجربی را میتوان براساس سن فرد، اینکه آلودگی بعد از آسیب به سر اتفاق افتادهاست یا نه، اینکه فرد اخیراً تحت جراحی مغز و اعصاب قرار گرفتهاست یا نه، و وجود یا نبود شنت مغزی انتخاب کرد.[۳] در خردسالان و افراد بالای ۵۰ سال، همچنین کسانی که به لحاظ ایمنی به خطر افتادهاند، افزودن آمپیسیلین برای پوشش «لیستریا مونوسیتوژنها» توصیه میشود.[۳][۲۷] وقتی نتایج رنگآمیزی گرم مشخص شد، و گونهٔ کلی عامل باکتریایی شناخته شد، میتوان آنتیبیوتیکها را به انواع مؤثرتر بر گروه پاتوژنهای تشخیص داده شده، تغییر داد.[۳] مشخص شدن نتایج کشت CSF معمولاً بیشتر طول میکشد (۴۸–۲۴ ساعت). بعد از مشخص شدن نتیجه، میتوان درمان تجربی را به درمان با آنتیبیوتیک خاص معطوف به ارگانیزم عامل خاص و حساسیت آن به آنتیبیوتیک تغییر داد.[۳] برای آنکه آنتیبیوتیک در مننژیت مؤثر باشد نه تنها باید در برابر باکتری پاتوژنی فعال شود بلکه به میزان مناسب به مننژها برسد؛ برخی آنتیبیوتیکها درجهٔ نفوذ نامناسبی دارند و در نتیجه در درمان مننژیت چندان به کار نمیآیند. اکثر آنتیبیوتیکهایی که در مننژیت به کار میروند مستقیماً در کارآزمایی بالینی بر روی افراد مبتلا به مننژیت آزمایش نشدهاند. بلکه دانش مربوطه بیشتر از طریق مطالعهٔ آزمایشگاهی بر روی خرگوش به دست آمدهاست.[۳] مننژیت سلی نیاز به درمان طولانیمدت با آنتیبیوتیک دارد. در حالیکه درمان سل ششها معمولاً در شش ماه صورت میپذیرد، افراد مبتلا به مننژیت سلی معمولاً یکسال یا بیشتر تحت درمان قرار میگیرند.[۱۴]
استروئیدها[ویرایش]
درمان کمکی با کورتیکواستروئید (در اغلب موارد دگزامتازون) مزایایی مانند کاهش ناشنوایی،[۴۸] و نتایج بهتر عصبشناختی در کوتاه مدت[۴۹] در نوجوانان و بزرگسالان ساکن در کشورهای دارای نرخ پایین ایدز نشان دادهاست.[۵۰] برخی تحقیقات نشاندهندهٔ کاهش نرخ مرگ و میر[۵۰] است در حالیکه سایر تحقیقات حکایت از چنین نتیجهای ندارند.[۴۹] همچنین به نظر میرسد این داروها در افراد مبتلا به مننژیت سلی، حداقل در آنانی که اچآیوی منفی هستند، نیز مفید هستند.[۵۱]
در نتیجه، راهنماهای حرفهای به شروع مصرف دگزامتازون یا یک کورتیکواستروئید مشابه قبل از دادن اولین دوز از آنتیبیوتیک و ادامهٔ این کار به مدت چهار روز توصیه میکنند.[۲۷][۲۹] با توجه به اینکه بیشتر فواید درمان محدود به افراد با مننژیت پنوموکوک است، برخی راهنماها توصیه میکنند که اگر علت دیگری برای مننژیت مشخص شد، مصرف دگزامتازون متوقف شود.[۳][۲۷] سازوکار احتمالی، خنثی کردن التهاب بیشفعال است.[۵۲] کورتیکواستروئیدها کمکی در کودکان نقشی متفاوت نسبت به بزرگسالان دارد. اگرچه مزایای کورتیکواستروئیدها برای بزرگسالان و کودکان در کشورهای پردرآمد ثابت شدهاست، استفاده از آنها در کودکان کشورهای کم درآمد به تأیید شواهد نرسیدهاست؛ دلیل این تفاوت مشخص نیست.[۴۹] حتی در کشورهای پردرآمد، مزایای کورتیکواستروئیدها فقط زمانی دیده میشود که قبل از اولین دوز آنتیبیوتیک استفاده شود، و بهترین تأثیر آن در موارد مننژیت «اچ. آنفلوآنزا» است،[۳][۵۳] که موارد آن از زمان به بازار آمدن واکسن هموفیلوس آنفلوآنزا بسیار کاهش یافتهاست؛ بنابراین، کورتیکواستروئیدها در درمان مننژیت اطفال توصیه میشوند در صورتی که عامل آن «اچ. آنفلوآنزا» باشد، و اینکه باید قبل از اولین دوز آنتیبیوتیک استفاده شود؛ سایر استفادهها مورد بحث است.[۳]
مننژیت ویروسی[ویرایش]
مننژیت ویروسی معمولاً فقط نیاز به درمان حمایتی دارد؛ اکثر ویروسهای عامل مننژیت به درمان خاصی پاسخ نمیدهند. مننژیت ویروسی نسبت به مننژیت باکتریایی کم خطرتر میباشد. ویروس تبخال و ویروس آبله مرغان ممکن است به درمان با داروهای ضدویروس مانند اسیکلوویر پاسخ دهند، اما هیچ آزمایش بالینی وجود ندارد که مشخصاً بیان کرده باشد که این درمان مؤثر میباشد.[۱۰] موارد خفیفتر مننژیت ویروسی را میتوان در خانه با اقدامات معمول مانند مصرف مایعات، استراحت، و داروهای ضددرد درمان کرد.[۵۴]
مننژیت قارچی[ویرایش]
مننژیت قارچی، مانند مننژیت کریپتوکوکال، را با دورههای طولانی و دوز بالا از ضدقارچها، مانند آمفوتریسین بی و فلوکیتوسین درمان میکنند.[۳۳][۵۵] افزایش فشار درون جمجمهای در مننژیت قارچی رایج است، و سوراخ کردن متناوب (در حالت ایدئال روزانه) ناحیهٔ کمری برای کاهش فشار توصیه میشود،[۳۳] یا میتوان از خالی کردن آب ناحیهٔ کمری هم به صورت جایگزین استفاده کرد.[۳۱]
پیشبینی[ویرایش]

no data <10 ۱۰–۲۵ ۲۵–۵۰ ۵۰–۷۵ ۷۵–۱۰۰ ۱۰۰–۲۰۰ | ۲۰۰–۳۰۰ ۳۰۰–۴۰۰ ۴۰۰–۵۰۰ ۵۰۰–۷۵۰ ۷۵۰–۱۰۰۰ >۱۰۰۰ |
مننژیت باکتریایی اگر درمان نشود تقریباً در تمام موارد مرگآور است. در مقابل، مننژیت ویروسی در اکثر موارد درمان میشود و به ندرت کشنده است. مرگ و میر (خطر مرگ) از مننژیت باکتریایی با درمان بستگی به سن شخص و دلیل اصلی بیماری دارد. در میان نوزادان، ممکن است ۳۰–۲۰٪ با یک بار ابتلا به مننژیت باکتریایی از دنیا بروند. این خطر در کودکان بزرگتر بسیار کمتر است و مرگ و میر آنها به حدود ۲٪ میرسد اما در بزرگسالان دوباره افزایش یافته و به ۳۷–۱۹٪ میرسد.[۱][۴] خطر مرگ براساس عوامل متنوع دیگری غیر از سن هم پیشبینی میشود، مانند پاتوژن و زمانی که طول میکشد تا پاتوژن را از مایع مغزی-نخاعی پاک کنند،[۱] شدت عمومی بیماری، سطح هوشیاری کاهش یافته یا تعداد کم و غیرطبیعی گلبولهای سفید خون در CSF.[۴] مننژیت بر اثر «اچ. آنفلوآنزا» و مننگوکوک را بهتر میتوان پیشبینی کرد نسبت به موارد ایجاد شده به علت استرپتوکوکهای گروه B، کلیفرمها و «ذات الریه اس.».[۱] در بزرگسالان هم مننژیت مننگوکوک، مرگ و میر کمتری (۷–۳٪) نسبت به بیماری پنوموکوک دارد.[۴]
در کودکان، معلولیتهای متعدد بالقوهای وجود دارد که ممکن است از آسیب به سیستم عصبی ناشی شود، شامل کاهش عصبی حسی شنوایی، صرع، یادگیری و مشکلات رفتاری، و نیز کاهش هوش.[۱] این مشکلات در حدود ۱۵٪ از بیمارانی که زنده میمانند رخ میدهد.[۱] امکان درمان برخی از مشکلات شنوایی وجود دارد.[۵۷] در بزرگسالان، ۶۶٪ از موارد بدون معلولیت است. مهمترین مشکلات عبارتند از ناشنوایی (در ۱۴٪) و اختلال شناختی (در ۱۰٪).[۴]
واگیرشناسی[ویرایش]

اگرچه مننژیت در بسیاری از کشورها بیماری گزارش دادنی است، نرخ دقیق شیوع آن ناشناخته است.[۱۰] در کشورهای غربی مننژیت باکتریایی هرساله از هر ۱۰۰۰۰۰ نفر، ۳ نفر را آلوده میکند. مطالعات جمعیتی نشان دادهاست که مننژیت ویروسی رایجتر است، با نسبت ۹/۱۰ به ازای هر ۱۰۰۰۰۰ نفر و بیشتر در تابستان اتفاق میافتد. در برزیل، میزان مننژیت باکتریایی با نسبت ۸/۴۵ به ازای هر ۱۰۰۰۰۰ نفر به صورت سالانه بیشتر است.[۶] آفریقای جنوب صحرا در طول بیش از یک قرن تحت حملهٔ واگیرهای گستردهٔ مننژیت مننگوکوک بودهاست،[۵۸] که منجر به نامگذاری این منطقه به نام «کمربند مننژیت» شدهاست. واگیرها معمولاً در فصل خشک (دسامبر تا ژوئن) رخ میدهند و موج واگیری ممکن است دو تا سه سال طول بکشد و در مدت فصول بارانی میانی کمتر میشود.[۵۹] در این منطقه میزان حمله به ازای هر ۱۰۰۰۰۰ نفر، ۸۰۰–۱۰۰ مورد است،[۶۰] که به خوبی تحت مراقبت پزشکی قرار نمیگیرد. این موارد به ویژه توسط مننگوکوکها رخ میدهند.[۶] بزرگترین همهگیری ثبت شده در تاریخ بین سالهای ۱۹۹۷–۱۹۹۶ این منطقه را درنوردید و موجب ۲۵۰۰۰۰ مورد ابتلا و ۲۵۰۰۰ مرگ شد.[۶۱]
بیماری مننگوکوک به صورت واگیر در مناطقی رخ میدهد که افراد بسیاری برای اولین بار در کنار یکدیگر زندگی میکنند، مثلاً آسایشگاههای سربازان در حین بسیج نیروها، خوابگاههای دانشجویی[۱] و مراسم سالانهٔ حج.[۴۰] اگرچه الگوی دورههای واگیری در آفریقا کاملاً شناخته نشدهاست، عوامل متعددی در گسترش همهگیریها در کمربند مننژیت دخالت داشتهاند. این عوامل عبارتند از: شرایط پزشکی (آسیبپذیری ایمنیشناسی جمعیت)، شرایط جمعیتشناسی (سفر و جابهجایی جمعیتهای زیاد)، شرایط اجتماعی-اقتصادی (جمعیت زیاد و شرایط نامناسب زندگی)، شرایط جوی (خشکسالی و توفان شن)، و عفونتهای همزمان (عفونتهای تنفسی حاد).[۶۰]
تفاوتهای قابل توجهی در توزیع محلی عوامل برای مننژیت باکتریایی وجود دارد؛ مثلاً در حالیکه گروههای B و C «ان. مننژیتیدس» عامل اکثر رخدادهای این بیماری در اروپا هستند، گروه A در آسیا مشاهده میشود و در آفریقا هم غلبه دارد یعنی جایی که موجب بیشترین همهگیریهای بزرگ در کمربند مننژیت میشود و باعث حدود ۸۰ تا ۸۵٪ موارد مننژیتهای مننگوکوک ثبت شده میباشد.[۶۰]
تاریخچه[ویرایش]
برخی میگویند که احتمالاً بقراط به وجود مننژیت پی برده بودهاست،[۶] و به نظر میرسد که علائم مننژیت برای طبیبان پیش از رنسانس مانند ابن سینا شناخته شده بودهاست.[۶۲] توصیف مننژیت سلی، که در آن زمان «ورم در مغز» نامیده میشدهاست، معمولاً به پزشک اهل ادینبورگ سر رابرت ویت، نسبت داده میشود که در گزارشی منتشر شده پس از مرگ وی در سال ۱۷۶۸ یافته شدهاست، اگرچه ارتباطی میان سل و پاتوژن آن تا قرن بعد کشف نشد.[۶۲][۶۳]
به نظر میرسد که مننژیت همهگیر، عارضهای معاصر باشد.[۶۴] اولین شیوع گسترده به سال ۱۸۰۵ در ژنو ثبت شدهاست.[۶۴][۶۵] به فاصلهای کم، همهگیریهای متعددی در اروپا و آمریکا گزارش شدهاست، و اولین گزارش همهگیری در آفریقا مربوط به سال ۱۸۴۰ میباشد. همهگیریها در آفریقا در قرن ۲۰ بسیار رایج شد که شروع آنها با همهگیری بین سالهای ۱۹۰۸–۱۹۰۵ بود که نیجریه و غنا را درنوردید.[۶۴]
اولین گزارش از عفونت باکتریایی ایجادکنندهٔ مننژیت را باکتریشناس اتریشی آنتون ویشسلباوم ارائه کرد، که در سال ۱۸۸۷ «مننگوکوک» را توصیف نمود.[۶۶] در گزارشهای اولیه، مرگ و میر ناشی از مننژیت بسیار بالا (بیش از ۹۰٪) بود. در سال ۱۹۰۶، سرم پادتن در بدن اسب تولید شد؛ این کار به دست دانشمند آمریکایی سایمون فلکسنر پیشرفت کرد و باعث کاهش چشمگیر مرگ و میر ناشی از بیماری مننگوکوک شد.[۶۷][۶۸] در سال ۱۹۴۴، اولین گزارش از تأثیر پنیسیلین بر مننژیت ارائه شد.[۶۹] شناخت واکسنهای «هموفیلوس» در اواخر قرن ۲۰ منجر به کاهش چشمگیر مننژیت همراه با این پاتوژن شد،[۳۸] و در سال ۲۰۰۲ شواهدی یافت شد که درمان با استروئیدها میتواند باعث بهبود پیشبینی مننژیت باکتریایی شود.[۴۹][۵۲][۶۸]
منابع[ویرایش]
- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ ۱٫۱۲ ۱٫۱۳ ۱٫۱۴ ۱٫۱۵ ۱٫۱۶ ۱٫۱۷ ۱٫۱۸ ۱٫۱۹ ۱٫۲۰ ۱٫۲۱ ۱٫۲۲ ۱٫۲۳ ۱٫۲۴ ۱٫۲۵ Sáez-Llorens X, McCracken GH (2003). "Bacterial meningitis in children". Lancet. 361 (9375): 2139–48. doi:10.1016/S0140-6736(03)13693-8. PMID 12826449.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ ۲٫۵ Ginsberg L (2004). "Difficult and recurrent meningitis" (PDF). Journal of Neurology, Neurosurgery, and Psychiatry. 75 Suppl 1 (90001): i16–21. doi:10.1136/jnnp.2003.034272. PMC 1765649. PMID 14978146.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ ۳٫۰۰ ۳٫۰۱ ۳٫۰۲ ۳٫۰۳ ۳٫۰۴ ۳٫۰۵ ۳٫۰۶ ۳٫۰۷ ۳٫۰۸ ۳٫۰۹ ۳٫۱۰ ۳٫۱۱ ۳٫۱۲ ۳٫۱۳ ۳٫۱۴ ۳٫۱۵ ۳٫۱۶ ۳٫۱۷ ۳٫۱۸ ۳٫۱۹ ۳٫۲۰ ۳٫۲۱ ۳٫۲۲ ۳٫۲۳ ۳٫۲۴ ۳٫۲۵ ۳٫۲۶ ۳٫۲۷ Tunkel AR; Hartman BJ; Kaplan SL; et al. (2004). "Practice guidelines for the management of bacterial meningitis" (PDF). Clinical Infectious Diseases. 39 (9): 1267–84. doi:10.1086/425368. PMID 15494903.
{{cite journal}}: Unknown parameter|author-separator=ignored (help); Unknown parameter|month=ignored (help) - ↑ ۴٫۰۰ ۴٫۰۱ ۴٫۰۲ ۴٫۰۳ ۴٫۰۴ ۴٫۰۵ ۴٫۰۶ ۴٫۰۷ ۴٫۰۸ ۴٫۰۹ ۴٫۱۰ ۴٫۱۱ ۴٫۱۲ ۴٫۱۳ ۴٫۱۴ ۴٫۱۵ ۴٫۱۶ ۴٫۱۷ ۴٫۱۸ ۴٫۱۹ van de Beek D, de Gans J, Tunkel AR, Wijdicks EF (2006). "Community-acquired bacterial meningitis in adults". The New England Journal of Medicine. 354 (1): 44–53. doi:10.1056/NEJMra052116. PMID 16394301.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۵٫۰ ۵٫۱ van de Beek D, de Gans J, Spanjaard L, Weisfelt M, Reitsma JB, Vermeulen M (2004). "Clinical features and prognostic factors in adults with bacterial meningitis" (PDF). The New England Journal of Medicine. 351 (18): 1849–59. doi:10.1056/NEJMoa040845. PMID 15509818.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۶٫۰۰ ۶٫۰۱ ۶٫۰۲ ۶٫۰۳ ۶٫۰۴ ۶٫۰۵ ۶٫۰۶ ۶٫۰۷ ۶٫۰۸ ۶٫۰۹ ۶٫۱۰ Attia J, Hatala R, Cook DJ, Wong JG (1999). "The rational clinical examination. Does this adult patient have acute meningitis?". Journal of the American Medical Association. 282 (2): 175–81. doi:10.1001/jama.282.2.175. PMID 10411200.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۷٫۰ ۷٫۱ ۷٫۲ Theilen U, Wilson L, Wilson G, Beattie JO, Qureshi S, Simpson D (2008). "Management of invasive meningococcal disease in children and young people: Summary of SIGN guidelines". BMJ (Clinical research ed.). 336 (7657): 1367–70. doi:10.1136/bmj.a129. PMC 2427067. PMID 18556318.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Management of invasive meningococcal disease in children and young people (PDF). Edinburgh: Scottish Intercollegiate Guidelines Network (SIGN). 2008. ISBN 978-1-905813-31-5. Archived from the original (PDF) on 7 May 2016. Retrieved 18 اكتبر 2013.
{{cite book}}: Check date values in:|access-date=(help); Unknown parameter|month=ignored (help) - ↑ Thomas KE, Hasbun R, Jekel J, Quagliarello VJ (2002). "The diagnostic accuracy of Kernig's sign, [[Brudzinski neck sign]], and nuchal rigidity in adults with suspected meningitis" (PDF). Clinical Infectious Diseases. 35 (1): 46–52. doi:10.1086/340979. PMID 12060874.
{{cite journal}}: URL–wikilink conflict (help); Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۱۰٫۰ ۱۰٫۱ ۱۰٫۲ ۱۰٫۳ ۱۰٫۴ ۱۰٫۵ ۱۰٫۶ Logan SA, MacMahon E (2008). "Viral meningitis". BMJ (Clinical research ed.). 336 (7634): 36–40. doi:10.1136/bmj.39409.673657.AE. PMC 2174764. PMID 18174598.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Varon J, Chen K, Sternbach GL (1998). "Rupert Waterhouse and Carl Friderichsen: adrenal apoplexy". J Emerg Med. 16 (4): 643–7. doi:10.1016/S0736-4679(98)00061-4. PMID 9696186.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Hsu HE; Shutt KA; Moore MR; et al. (2009). "Effect of pneumococcal conjugate vaccine on pneumococcal meningitis". N Engl J Med. 360 (3): 244–256. doi:10.1056/NEJMoa0800836. PMID 19144940.
{{cite journal}}: Unknown parameter|author-separator=ignored (help) - ↑ Wei BP, Robins-Browne RM, Shepherd RK, Clark GM, O'Leary SJ (2008). "Can we prevent cochlear implant recipients from developing pneumococcal meningitis?" (PDF). Clin. Infect. Dis. 46 (1): e1–7. doi:10.1086/524083. PMID 18171202.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۱۴٫۰ ۱۴٫۱ Thwaites G, Chau TT, Mai NT, Drobniewski F, McAdam K, Farrar J (2000). "Tuberculous meningitis" (PDF). Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3): 289–99. doi:10.1136/jnnp.68.3.289. PMC 1736815. PMID 10675209.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۱۵٫۰ ۱۵٫۱ ۱۵٫۲ ۱۵٫۳ ۱۵٫۴ Tebruegge M, Curtis N (2008). "Epidemiology, etiology, pathogenesis, and diagnosis of recurrent bacterial meningitis". Clinical Microbiology Reviews. 21 (3): 519–37. doi:10.1128/CMR.00009-08. PMC 2493086. PMID 18625686.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Raman Sharma R (2010). "Fungal infections of the nervous system: current perspective and controversies in management". International journal of surgery (London, England). 8 (8): 591–601. doi:10.1016/j.ijsu.2010.07.293. PMID 20673817.
- ↑ ۱۷٫۰ ۱۷٫۱ ۱۷٫۲ Sirven JI, Malamut BL (2008). Clinical neurology of the older adult (2nd ed. ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 439. ISBN 978-0-7817-6947-1.
{{cite book}}:|edition=has extra text (help) - ↑ Honda H, Warren DK (2009 Sep). "Central nervous system infections: meningitis and brain abscess". Infectious disease clinics of North America. 23 (3): 609–23. doi:10.1016/j.idc.2009.04.009. PMID 19665086.
{{cite journal}}: Check date values in:|date=(help) - ↑ Kauffman CA, Pappas PG, Patterson TF (19 October 2012). "Fungal infections associated with contaminated methyprednisolone injections—preliminary report". New England Journal of Medicine. Online first. doi:10.1056/NEJMra1212617.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Kauffman CA, Pappas PG, Sobel JD, Dismukes WE. Essentials of clinical mycology (2nd ed. ed.). New York: Springer. p. 77. ISBN 978-1-4419-6639-1.
{{cite book}}:|edition=has extra text (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Kauffman CA, Pappas PG, Sobel JD, Dismukes WE. Essentials of clinical mycology (2nd ed. ed.). New York: Springer. p. 31. ISBN 978-1-4419-6639-1.
{{cite book}}:|edition=has extra text (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Park, Benjamin J (1 February 2009). "Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS". AIDS. 23 (4): 525–530. doi:10.1097/QAD.0b013e328322ffac. PMID 19182676.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)نگهداری یادکرد:تاریخ و سال (link) - ↑ ۲۳٫۰ ۲۳٫۱ Graeff-Teixeira C, da Silva AC, Yoshimura K (2009). "Update on eosinophilic meningoencephalitis and its clinical relevance" (PDF). Clinical Microbiology Reviews. 22 (2): 322–48. doi:10.1128/CMR.00044-08. PMC 2668237. PMID 19366917. Archived from the original (PDF) on 3 February 2014. Retrieved 18 اكتبر 2013.
{{cite journal}}: Check date values in:|access-date=(help); Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Gleissner B, Chamberlain MC (2006). "Neoplastic meningitis". Lancet Neurol. 5 (5): 443–52. doi:10.1016/S1474-4422(06)70443-4. PMID 16632315.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Moris G, Garcia-Monco JC (1999). "The Challenge of Drug-Induced Aseptic Meningitis" (PDF). Archives of Internal Medicine. 159 (11): 1185–94. doi:10.1001/archinte.159.11.1185. PMID 10371226.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Provan, Drew (2005). Oxford Handbook of Clinical and Laboratory Investigation. Oxford: Oxford University Press. ISBN 0-19-856663-8.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ۲۷٫۰۰ ۲۷٫۰۱ ۲۷٫۰۲ ۲۷٫۰۳ ۲۷٫۰۴ ۲۷٫۰۵ ۲۷٫۰۶ ۲۷٫۰۷ ۲۷٫۰۸ ۲۷٫۰۹ Chaudhuri A; Martinez–Martin P; Martin PM; et al. (2008). "EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS Task Force on acute bacterial meningitis in older children and adults". European Journal of Neurolology. 15 (7): 649–59. doi:10.1111/j.1468-1331.2008.02193.x. PMID 18582342.
{{cite journal}}: Unknown parameter|author-separator=ignored (help); Unknown parameter|month=ignored (help) - ↑ ۲۸٫۰ ۲۸٫۱ ۲۸٫۲ ۲۸٫۳ Straus SE, Thorpe KE, Holroyd-Leduc J (2006). "How do I perform a lumbar puncture and analyze the results to diagnose bacterial meningitis?". Journal of the American Medical Association. 296 (16): 2012–22. doi:10.1001/jama.296.16.2012. PMID 17062865.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۲۹٫۰ ۲۹٫۱ ۲۹٫۲ ۲۹٫۳ ۲۹٫۴ ۲۹٫۵ ۲۹٫۶ Heyderman RS, Lambert HP, O'Sullivan I, Stuart JM, Taylor BL, Wall RA (2003). "Early management of suspected bacterial meningitis and meningococcal septicaemia in adults" (PDF). The Journal of infection. 46 (2): 75–7. doi:10.1053/jinf.2002.1110. PMID 12634067. Archived from the original (PDF) on 25 July 2011. Retrieved 18 اكتبر 2013.
{{cite journal}}: Check date values in:|access-date=(help); Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) – formal guideline at British Infection Society & UK Meningitis Research Trust (2004). "Early management of suspected meningitis and meningococcal septicaemia in immunocompetent adults". British Infection Society Guidelines. Archived from the original on 19 اكتبر 2013. Retrieved 2008-10-19.{{cite web}}: Check date values in:|archive-date=(help); Unknown parameter|month=ignored (help) - ↑ Maconochie I, Baumer H, Stewart ME (2008). MacOnochie, Ian K (ed.). "Fluid therapy for acute bacterial meningitis". Cochrane Database of Systematic Reviews (1): CD004786. doi:10.1002/14651858.CD004786.pub3. PMID 18254060. CD004786.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۳۱٫۰ ۳۱٫۱ Perfect JR, Dismukes WE, Dromer F; et al. (2010). "Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the infectious diseases society of america". Clinical Infectious Diseases. 50 (3): 291–322. doi:10.1086/649858. PMID 20047480.
{{cite journal}}: Explicit use of et al. in:|author=(help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Sakushima, K (2011 Apr). "Diagnostic accuracy of cerebrospinal fluid lactate for differentiating bacterial meningitis from aseptic meningitis: a meta-analysis". The Journal of infection. 62 (4): 255–62. doi:10.1016/j.jinf.2011.02.010. PMID 21382412.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ۳۳٫۰ ۳۳٫۱ ۳۳٫۲ Bicanic T, Harrison TS (2004). "Cryptococcal meningitis" (PDF). British Medical Bulletin. 72 (1): 99–118. doi:10.1093/bmb/ldh043. PMID 15838017.
- ↑ Sقرضی D, Dlamini S, Paul N, Dedicoat M (2008). Sقرضی, Derek (ed.). "Treatment of acute cryptococcal meningitis in HIV infected adults, with an emphasis on resource-limited settings". Cochrane Database of Systematic Reviews (4): CD005647. doi:10.1002/14651858.CD005647.pub2. PMID 18843697. CD005647.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Warrell DA, Farrar JJ, Crook DWM (2003). "24.14.1 Bacterial meningitis". Oxford Textbook of Medicine Volume 3 (Fourth ed.). Oxford University Press. pp. 1115–29. ISBN 0-19-852787-X.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۳۶٫۰ ۳۶٫۱ ۳۶٫۲ "CDC – Meningitis: Transmission". Centers for Disease Control and Prevention (CDC). August 6, 2009. Archived from the original on 29 June 2011. Retrieved 18 June 2011.
- ↑ ۳۷٫۰ ۳۷٫۱ ۳۷٫۲ ۳۷٫۳ ۳۷٫۴ Segal S, Pollard AJ (2004). "Vaccines against bacterial meningitis" (PDF). British Medical Bulletin. 72 (1): 65–81. doi:10.1093/bmb/ldh041. PMID 15802609.
- ↑ ۳۸٫۰ ۳۸٫۱ Peltola H (2000). "Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates" (PDF). Clinical Microbiology Reviews. 13 (2): 302–17. doi:10.1128/CMR.13.2.302-317.2000. PMC 100154. PMID 10756001. Archived from the original (PDF) on 8 July 2014. Retrieved 18 اكتبر 2013.
{{cite journal}}: Check date values in:|access-date=(help); Unknown parameter|month=ignored (help) - ↑ ۳۹٫۰ ۳۹٫۱ ۳۹٫۲ Harrison LH (2006). "Prospects for vaccine prevention of meningococcal infection" (PDF). Clinical Microbiology Reviews. 19 (1): 142–64. doi:10.1128/CMR.19.1.142-164.2006. PMC 1360272. PMID 16418528. Archived from the original (PDF) on 8 July 2014. Retrieved 18 اكتبر 2013.
{{cite journal}}: Check date values in:|access-date=(help); Unknown parameter|month=ignored (help) - ↑ ۴۰٫۰ ۴۰٫۱ Wilder-Smith A (2007). "Meningococcal vaccine in travelers". Current Opinion in Infectious Diseases. 20 (5): 454–60. doi:10.1097/QCO.0b013e3282a64700. PMID 17762777.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ WHO (2000). "Detecting meningococcal meningitis epidemics in highly-endemic African countries" (PDF). Weekly Epidemiological Record. 75 (38): 306–9. PMID 11045076.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Bishai, DM (2011 Jun). "Product development partnerships hit their stride: lessons from developing a meningitis vaccine for Africa". Health affairs (Project Hope). 30 (6): 1058–64. doi:10.1377/hlthaff.2011.0295. PMID 21653957.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Marc LaForce, F (2009 Jun 24). "Epidemic meningitis due to Group A Neisseria meningitidis in the African meningitis belt: a persistent problem with an imminent solution". Vaccine. 27 Suppl 2: B13-9. doi:10.1016/j.vaccine.2009.04.062. PMID 19477559.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ۴۴٫۰ ۴۴٫۱ Weisfelt M, de Gans J, van der Poll T, van de Beek D (2006). "Pneumococcal meningitis in adults: new approaches to management and prevention". Lancet Neurol. 5 (4): 332–42. doi:10.1016/S1474-4422(06)70409-4. PMID 16545750.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۴۵٫۰ ۴۵٫۱ Zalmanovici Trestioreanu, A (2011 Aug 10). "Antibiotics for preventing meningococcal infections". Cochrane database of systematic reviews (Online) (8): CD004785. doi:10.1002/14651858.CD004785.pub4. PMID 21833949.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ۴۶٫۰ ۴۶٫۱ Ratilal, BO (2011 Aug 10). "Antibiotic prophylaxis for preventing meningitis in patients with basilar skull fractures". Cochrane database of systematic reviews (Online) (8): CD004884. doi:10.1002/14651858.CD004884.pub3. PMID 21833952.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Prasad, K (2007 Oct 17). "Third generation cephalosporins versus conventional antibiotics for treating acute bacterial meningitis". Cochrane database of systematic reviews (Online) (4): CD001832. doi:10.1002/14651858.CD001832.pub3. PMID 17943757.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ van de Beek D (2010). "Adjunctive dexamethasone in bacterial meningitis: a meta-analysis of individual patient data". Lancet Neurol. 9 (3): 254–63. doi:10.1016/S1474-4422(10)70023-5. PMC 2835871. PMID 20138011.
{{cite journal}}: Invalid|display-authors=3(help); Unknown parameter|author-separator=ignored (help); Unknown parameter|month=ignored (help) - ↑ ۴۹٫۰ ۴۹٫۱ ۴۹٫۲ ۴۹٫۳ Brouwer MC, McIntyre P, de Gans J, Prasad K, van de Beek D (2010). Van De Beek, Diederik (ed.). "Corticosteroids for acute bacterial meningitis". Cochrane Database of Systematic Reviews (9): CD004405. doi:10.1002/14651858.CD004405.pub3. PMID 20824838. CD004405.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۵۰٫۰ ۵۰٫۱ Assiri AM, Alasmari FA, Zimmerman VA, Baddour LM, Erwin PJ, Tleyjeh IM (2009). "Corticosteroid administration and outcome of adolescents and adults with acute bacterial meningitis: a meta-analysis". Mayo Clin. Proc. 84 (5): 403–9. doi:10.4065/84.5.403. PMC 2676122. PMID 19411436.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Prasad, K (2008 Jan 23). "Corticosteroids for managing tuberculous meningitis". Cochrane database of systematic reviews (Online) (1): CD002244. doi:10.1002/14651858.CD002244.pub3. PMID 18254003.
{{cite journal}}: Check date values in:|date=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ۵۲٫۰ ۵۲٫۱ de Gans J, van de Beek D (2002). "Dexamethasone in adults with bacterial meningitis" (PDF). The New England Journal of Medicine. 347 (20): 1549–56. doi:10.1056/NEJMoa021334. PMID 12432041.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ McIntyre PB; Berkey CS; King SM; et al. (1997). "Dexamethasone as adjunctive therapy in bacterial meningitis. A meta-analysis of randomized clinical trials since 1988". Journal of the American Medical Association. 278 (11): 925–31. doi:10.1001/jama.1997.03550110063038. PMID 9302246.
{{cite journal}}: Unknown parameter|author-separator=ignored (help); Unknown parameter|month=ignored (help) - ↑ "Meningitis and Encephalitis Fact Sheet". National Institute of Neurological Disorders and Stroke (NINDS). 2007-12-11. Archived from the original on 4 January 2014. Retrieved 2009-04-27.
- ↑ Gottfredsson M, Perfect JR (2000). "Fungal meningitis". Seminars in Neurology. 20 (3): 307–22. doi:10.1055/s-2000-9394. PMID 11051295.
- ↑ "Mortality and Burden of Disease Estimates for WHO Member States in 2002" (xls). World Health Organization (WHO). 2002.
- ↑ Richardson MP, Reid A, Tarlow MJ, Rudd PT (1997). "Hearing loss during bacterial meningitis" (PDF). Archives of Disease in Childhood. 76 (2): 134–38. doi:10.1136/adc.76.2.134. PMC 1717058. PMID 9068303.
{{cite journal}}: Unknown parameter|month=ignored (help)نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Lapeyssonnie L (1963). "Cerebrospinal meningitis in Africa". Bulletin of the World Health Organization. 28: SUPPL:1–114. PMC 2554630. PMID 14259333.
- ↑ Greenwood B (1999). "Manson Lecture. Meningococcal meningitis in Africa". Trans. R. Soc. Trop. Med. Hyg. 93 (4): 341–53. doi:10.1016/S0035-9203(99)90106-2. PMID 10674069.
- ↑ ۶۰٫۰ ۶۰٫۱ ۶۰٫۲ World Health Organization (1998). Control of epidemic meningococcal disease, practical guidelines, 2nd edition, WHO/EMC/BA/98 (PDF). Vol. 3. pp. 1–83.
- ↑ WHO (2003). "Detecting meningococcal meningitis epidemics in highly-endemic African countries" (PDF). Weekly Epidemiological Record. 78 (33): 294–6. PMID 14509123.
- ↑ ۶۲٫۰ ۶۲٫۱ Arthur Earl Walker, Edward R. Laws, George B. Udvarhelyi (1998). "Infections and inflammatory involvement of the CNS". The Genesis of Neuroscience. Thieme. pp. 219–21. ISBN 1-879284-62-6.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Whytt R (1768). Observations on the Dropsy in the Brain. Edinburgh: J. Balfour.
- ↑ ۶۴٫۰ ۶۴٫۱ ۶۴٫۲ Greenwood B (2006). "100 years of epidemic meningitis in West Africa – has anything changed?" (PDF). Tropical Medicine & International health: TM & IH. 11 (6): 773–80. doi:10.1111/j.1365-3156.2006.01639.x. PMID 16771997.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Vieusseux G (1806). "Mémoire sur le Maladie qui a regne à Génève au printemps de 1805". Journal de Médecine, de Chirurgie et de Pharmacologie (Bruxelles) (به فرانسوی). 11: 50–53.
- ↑ Weichselbaum A (1887). "Ueber die Aetiologie der akuten Meningitis cerebro-spinalis". Fortschrift der Medizin (به آلمانی). 5: 573–583.
- ↑ Flexner S (1913). "The results of the serum treatment in thirteen hundred cases of epidemic meningitis" (PDF). J Exp Med. 17 (5): 553–76. doi:10.1084/jem.17.5.553. PMC 2125091. PMID 19867668.
- ↑ ۶۸٫۰ ۶۸٫۱ Swartz MN (2004). "Bacterial meningitis—a view of the past 90 years". The New England Journal of Medicine. 351 (18): 1826–28. doi:10.1056/NEJMp048246. PMID 15509815.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Rosenberg DH, Arling PA (1944). "Penicillin in the treatment of meningitis". Journal of the American Medical Association. 125 (15): 1011–17. doi:10.1001/jama.1944.02850330009002. reproduced in Rosenberg DH, Arling PA (1984). "Penicillin in the treatment of meningitis". Journal of the American Medical Association. 251 (14): 1870–6. doi:10.1001/jama.251.14.1870. PMID 6366279.
{{cite journal}}: Unknown parameter|month=ignored (help)
