الکترون
 اوربیتالهای اتم هیدروژن در سطوح مختلف انرژی. نواحی روشنتر، نواحی هستند که در هر لحظه از زمان، احتمال یافتن الکترون در آن نواحی بیشتر است. | |
| آمار | فرمیون |
|---|---|
| نسل | اول |
| نیروهای بنیادی | جاذبه، الکترومغناطیس، نیروی ضعیف |
| نماد | −e یا −β |
| پادذره | پوزیترون (به آن پادالکترون هم گفته میشود) |
| نظریهپردازی | ریچارد لامینگ (۱۸۳۸–۱۸۵۱)[۱] جرج استونی (۱۸۷۴) و دیگران[۲][۳] |
| کشف | جی جی تامسون (۱۸۹۷)[۴] |
| جرم | ۹٫۱۰۹۳۸۲۹۱(۴۰)×۱۰−۳۱ kg[۵] ۵٫۴۸۵۷۹۹۰۹۴۶(۲۲)×۱۰−۴ u[۵] [۱۸۲۲٫۸۸۸۴۸۴۵(۱۴)]−1 u[note ۱] ۰٫۵۱۰۹۹۸۹۲۸(۱۱) MeV/c۲[۵] |
| بار الکتریکی | −۱ e[note ۲] −۱٫۶۰۲۱۷۶۵۶۵(۳۵)×۱۰−۱۹ C[۵] −۴٫۸۰۳۲۰۴۵۱(۱۰)×۱۰−۱۰ esu |
| اسپین | 1⁄2 |
اِلِکترون[۶] (به انگلیسی: electron) (با نماد −e یا −β) یک ذره زیر اتمیست با بار الکتریکی منفی و برابر با بار بنیادی.[۷] الکترونها به نسل نخست از خانواده لپتونها تعلق دارند[۸] و بهطور عمومی به عنوان ذره بنیادی شناخته میشوند زیرا هیچ جزء و زیرساختار تشکیلدهنده شناختهشدهای ندارند.[۹] الکترون جرمی تقریباً برابر با یک بر روی ۱۸۳۶ جرم پروتون دارد.[۱۰] ویژگیهای کوانتومی الکترون شامل تکانه زاویهای ذاتی (اسپین) با مقدار نیمهصحیح بر حسب ħ (ثابت کاهیدهٔ پلانک) است و این یعنی الکترون یک نوع فرمیون است. به دلیل فرمیون بودن، طبق اصل طرد پاولی، دو الکترون مختلف نمیتوانند حالات کوانتومی یکسانی را اشغال کنند.[۸] الکترونها، همانند همهٔ مواد، هم ویژگیهای ذرهای و هم موجی را دارا هستند، یعنی هم میتوانند با ذرات دیگر برخورد کنند و هم مانند نور دچار پراش شوند. مشاهده ویژگیهای موجی الکترون نسبت به ذراتی مانند نوترون و پروتون آسانتر است زیرا جرم الکترون کمتر است و در نتیجه طول موج دوبروی آن برای انرژیهای معمول بالاتر است.
در بسیاری از پدیدههای فیزیکی مانند الکتریسیته، مغناطیس و رسانش گرمایی، الکترونها نقشی اساسی را ایفا میکنند و همچنین در برهمکنشهای گرانشی، الکترومغناطیسی و هستهای ضعیف نیز شرکت میکند.[۱۱] الکترون یک میدان الکتریکی در اطراف خود ایجاد میکند. یک الکترون در حال حرکت نسبت به یک ناظر، یک میدان مغناطیسی تولید میکند، و میدانهای مغناطیسی خارجی نیز باعث انحراف مسیر حرکت الکترون میشوند. هنگامی که یک الکترون شتاب میگیرد، انرژی را به شکل فوتون جذب یا تابش میکند. وسایل آزمایشگاهی با بهرهگیری از میدانهای الکترومغناطیسی توانایی دربرگرفتن و مشاهده الکترونهای تکی و پلاسمای الکترون را دارند و تلسکوپهای ویژهای نیز وجود دارند که میتوانند پلاسماهای الکترون را در فضا آشکار سازند. الکترون کاربرهای فراوانی دارد که از جمله آنها میتوان به الکترونیک، جوشکاری با تشعشعات الکترونی، لامپ پرتوی کاتدی، میکروسکوپ الکترونی، پرتودرمانی، لیزر الکترون آزاد، آشکارسازهای یونیزاسیون گازی و شتابدهنده ذرهای اشاره نمود.
برهمکنشهای دربرگیرنده الکترون و ذرات زیراتمی دیگر در دانشهایی مانند شیمی و فیزیک هستهای مورد توجه ویژهای قرار میگیرند. برهمکنش نیروی کولنی میان پروتونهای مثبت هسته اتم و الکترونهای منفی باعث تشکیل شدن اتم میشود. یونیزهشدن و تغییر در نسبتهای ذرات باعث تغییر در انرژی بستگی سیستم میشود. تبادل یا به اشتراکگذاری الکترون میان دو یا چند اتم عامل اصلی بوجودآمدن پیوندهای شیمیایی است.[۱۲] فیلسوف طبیعی بریتانیایی، ریچارد لامینگ نخستین بار در سال ۱۸۳۸ فرضیهای شامل مفهوم یک مقدار تجزیهناپذیر بار الکتریکی برای توضیح ویژگیهای شیمیایی اتمها ارائه داد.[۲] فیزیکدان ایرلندی، جرج استونی، در سال ۱۸۹۱ نام این بار را الکترون گذاشت و جی جی تامسون و تیم متشکل از فیزیکدانان بریتانیایی او این ذره را در سال ۱۸۹۷ شناسایی کردند.[۴][۱۳][۱۴] الکترونها در واکنشهای هستهای مانند هستهزایی در ستارگان نیز میتوانند شرکت کنند که در آنجا با نام ذرات بتا شناخته میشوند. الکترونها ممکن است در واپاشی بتای ایزوتوپهای رادیواکتیو و همچنین در برخوردهای پرانرژی، مانند وقتی که پرتو کیهانی وارد اتمسفر میشود، بهوجود آیند. پادذره الکترون، پوزیترون نام دارد که دقیقاً مانند الکترون است اما بار الکتریکی و دیگر بارهای آن علامت مخالف با الکترون دارند. وقتی یک الکترون به یک پوزیترون برخورد میکند، ممکن است هردو کاملاً نابود شوند و فوتونهای پرتو گاما تولید کنند.
تاریخچه[ویرایش]
یونانیان باستان متوجه شدند که وقتی کهربا با پشم مالش داده شود، اشیای کوچک را به سمت خود جذب میکند. این پدیده به همراه آذرخش نخستین تجربههای ثبتشده بشر از الکتریسیته هستند.[۱۵] در دههٔ ۱۶۰۰ دانشمندی انگلیسی به نام ویلیام گیلبرت در مقالهای با عنوان «مگنت (De Magnete)»، برای اشاره به این ویژگی جذب اشیای کوچک پس از مالش، واژهٔ لاتین جدیدی به نام الکتریکوس را به کار برد.[۱۶] واژههای الکتریسیته و الکتریک هر دو از واژهٔ لاتین الکتروم (همچنین ریشهٔ ترکیب همان اسم) که خود برگرفته از واژهٔ یونانی ήλεκτρον (الکترون) به معنی کهربا است، مشتق شدهاند.
در اوایل دهه ۱۷۰۰، فرانسیس هاوکسبی و یک شیمیدان فرانسوی به نام شارل فرانسوا دو فی بهطور جداگانه چیزی کشف کردند که از آن با عنوان دو گونه متفاوت از الکتریسیته مالشی یاد کردند؛ یکی تولید شده از مالش شیشه، و دیگری از مالش رزین. دوفی نتیجه گرفت که الکتریسیته از دو شار الکتریکی با نامهای «ویترئوس» و «رزینوس» تشکیل شدهاست که مالش باعث جدا شدن آنها از یکدیگر میشود و هنگامی که با هم ترکیب شوند، یکدیگر را خنثی میکنند.[۱۷] یک دهه بعد، بنجامین فرانکلین پیشنهاد داد که الکتریسیته از انواع متفاوتی از شارههای الکتریکی ناشی نمیشود، بلکه ناشی از یک نوع شاره الکتریکی تحت فشارهای مختلف است. او همانند نامگذاری امروزی بارهای الکتریکی، آنها را به ترتیب مثبت و منفی نامید.[۱۸] فرانکلین حامل بار را مثبت در نظر گرفته بود، اما به درستی تشخیص نداده بود که کدام شرایط مربوط به افزونی بار و کدام مربوط به کمبود بار بود.[۱۹]
در ۱۸۰۷- ۱۸۰۸ همفری دیوی شیمی دان انگلیسی با تجزیه مواد مرکب به کمک جریان الکتریسیته، ۵ عنصر پتاسیم، سدیم، کلسیم، استرنسیم و باریم را کشف کرد و نتیجه گرفت که عناصر با نیروی جاذبه ای به هم متصل هستند که ماهیت الکتریکی دارد.
در ۱۸۳۲-۱۸۳۳ مایکل فارادی هم همانند دیوی آزمایشهایی را به وسیله برقکافت انجام داد و رابطه بین مقدار الکتریسیته مصرف شده و میزان ماده مرکب تجزیه شده به دست آورد.
بین سالهای ۱۸۳۸ تا ۱۸۵۱، فیلسوف طبیعی انگلیسی ریچارد لامینگ این ایده را مطرح نمود که اتم متشکل از یک هستهٔ مادی است که توسط ذرات زیر اتمی با بار الکتریکی واحد در بر گرفته شدهاست.[۱] در اوایل سال ۱۸۳۶، یک فیزیکدان آلمانی به نام ویلهلم ادوارد وبر، نظریهای مطرح کرد که طبق آن، الکتریسیته متشکل از شارههای باردار مثبت و منفی است که برهمکنش میان آنها از قانون مربع معکوس پیروی میکند. در سال ۱۸۷۴، فیزیکدان ایرلندی جورج جانستون استونی، پس از مطالعه پدیده برقکافت، پیشنهاد کرد که یک مقدار واحد مشخص از الکتریسیته وجود دارد که همان بار یون تک ظرفیتی است. او توانستهبود، مقدار این بار بنیادی را به وسیلهٔ قوانین برقکافت فاراده تخمین بزند.[۲۰] هرچندکه او معتقد بود این بارها بهطور دائمی به اتمها متصل هستند و نمیتوان آنها را از اتم جدا کرد. در سال ۱۸۸۱ یک فیزیکدان آلمانی به نام هرمان وان هلمولتز ادعا نمود که بارهای مثبت و منفی هر دو به قسمتهای بنیادی تری تقسیم میشوند که هر کدام از آنها «مانند اتمهای الکتریسیته رفتار میکنند».[۲]
استونی در ابتدا واژه الکترولیون را در سال ۱۸۸۱ ابداع نمود. ده سال بعد آن را به الکترون تغییر داد تا با آن، این بارهای بنیادی را توصیف کند. او در سال ۱۸۹۴ چنین مینویسد: «... تخمینی از این قابل توجهترین مقدار واحد پایهای از الکتریسیته زده شد، که از آن زمان تصمیم گرفتم که برای آن نام الکترون را پیشنهاد بدهم».[۲۱] در سال ۱۹۰۶ پیشنهادی برای تغییر آن به الکتریون مطرح شد که با شکست روبهرو شد زیرا هندریک لورنتز ترجیح داد نام الکترون را نگه دارد.[۲۲][۲۳] واژه الکترون ترکیبی از واژه الکتریک و پسوند یون میباشد،[۲۴] پسوند -ون که در نامیدن ذرات زیراتمی دیگر مانند پروتون و نوترون نیز بهکار میرود از الکترون گرفته شدهاست.[۲۵][۲۶]
کشف[ویرایش]

یوهان ویلهلم هیترف، فیزیکدان آلمانی، رسانایی الکتریکی را در گازهای رقیق مطالعه نمود: در سال ۱۸۶۹ او تابشی را کشف کرد که از کاتد منتشر میشد و اندازهٔ آن با کاهش فشار گاز افزایش مییافت. در سال ۱۸۷۶، یک دانشمند آلمانی به نام اویگن گلدشتاین، نشان داد که پرتوهای این تابش سایه ایجاد میکنند و این پرتوها را پرتوهای کاتدی نامید.[۲۸] در طول دههٔ ۱۸۷۰، یک شیمیدان و فیزیکدان انگلیسی به نام سر ویلیام کروکس، نخستین لامپ پرتو کاتدی از نوع محفظه خلأ را ساخت.[۲۹] او سپس نشان داد که پرتوهای تابناکی که در داخل لوله پدیدار میشوند، حامل انرژی هستند و از کاتد به سوی آند حرکت میکنند. علاوه بر این، او توانست با بهرهگیری از یک میدان مغناطیسی مسیر پرتوها را منحرف کند و بدین ترتیب نشان داد که این پرتوها بهگونهای رفتار میکنند که گویی بار منفی دارند.[۳۰][۳۱] در سال ۱۸۷۹ او پیشنهاد داد که این ویژگیها را میتوان با آنچه که وی «مادهٔ پرتوزا» نامیدهبود، توضیح داد. پیشنهاد وی این بود که این حالت چهارمی از ماده است که شامل مولکولهایی با بار منفی میشود که با سرعت بالا از کاتد تابیده میشوند.[۳۲]
یک فیزیکدان آلمانیالاصل انگلیسی به نام آرتور شوستر، آزمایشها کروکس را گسترش داد و چند صفحه فلزی را همراستا با پرتوهای کاتدی درون محفظه خلاء قرار داد و بین صفحات، پتانسیل الکتریکی ایجاد نمود. میدان ایجادشده پرتوها را به سوی صفحهٔ با بار مثبت منحرف میکرد، که گواه دیگری بر منفی بودن بار الکتریکی این پرتوها بود. در سال ۱۸۹۰، شوستر، با اندازهگیری این انحراف به ازای یک جریان معین، توانست نسبت جرم به بار اجزای تشکیلدهنده این پرتو را تخمین بزند. از آنجا که این نسبت بیش از هزار بار بزرگتر از آنچه انتظار میرفت بود، عدهٔ کمی به آن توجه کردند.[۳۰][۳۳]
در سال ۱۸۹۲، هندریک لورنتز پیشنهاد داد که جرم این ذرات (الکترونها) ممکن است ناشی از بار الکتریکی آنها باشد.[۳۴]
در سال ۱۸۹۶ یک فیزیکدان انگلیسی به نام ج. ج تامسون با همکارانش به نامهای جان سیلی تاونزند و هارولد ویلسون،[۱۳] آزمایشهایی را انجام دادند که نشان داد پرتوهای کاتدی، برخلاف آنچه پیشتر پنداشته میشد، موج، اتم یا مولکول نیستند، بلکه از ذرات منحصربهفردی تشکیل شدهاند.[۴] از آنجاییکه انحراف این ذرات با اندازه بار ذره متناسب بوده و با جرم آن نسبت عکس دارد، تامسون توانست تخمینهای خوبی از بار e و جرم m زد که نشان میداد، ذرات پرتو کاتدی، که او آنها را «کورپاسکل» مینامیده بود، احتمالاً دارای جرمی برابر با حدود یکهزارم جرم سبکترین یون شناختهشده یعنی هیدروژن هستند.[۴][۱۴] او همچنین نشان داد که نسبت بار به جرم آنها یعنی e/m به جنس کاتد بستگی ندارد. افزون بر این، او نشان داد که ذرات با بار منفی تولید شده به وسیلهٔ مواد رادیواکتیو، مواد حرارت دادهشده و مواد تحت تابش نورانی، یکسان هستند.[۴][۳۵] سپس شعاع انحرافی را که بر اثر شدت میدان مغناطیسی معینی ایجاد شده بود، اندازه گرفت و سپس میدان الکتریکی لازم برای برقراری توازن با میدان مغناطیسی به شکلی که انحراف مؤثری در پرتو کاتدی مشاهده نشود را تعیین نمود. از این راه او نسبت بار به جرم ذره را q/m= ۱.۷۵۸۸۲۰۰۲۴×۱۰۸ C/g اندازهگیری کرد.
نام الکترون دوباره برای این ذرات توسط یک فیزیکدان ایرلندی به نام جرج فیتزجرالد پیشنهاد داده شد و از آن زمان تاکنون این نام مورد پذیرش جهانی قرار گرفتهاست.[۳۰]

در سال ۱۸۹۶ یک فیزیکدان فرانسوی به نام هانری بکرل، هنگام مطالعهٔ مواد معدنی دارای ویژگی فلوئورسانس، کشف کرد که این مواد بدون نیاز به قرار گرفتن در معرض یک منبع انرژی خارجی، پرتو تابش میکنند. این مواد پرتوزا مورد علاقه فراوان دانشمندان از جمله فیزیکدان نیوزلندی به نام ارنست رادرفورد قرارگرفت. او کشف کرد که این مواد، ذره تابش میکنند. او این ذرات را بر اساس توانایی نفوذشان در مواد، آلفا و بتا نامید.[۳۶] در سال ۱۹۰۰ بکرل نشان داد که پرتوهای بتای تولید شده به وسیلهٔ رادیوم توسط میدان الکتریکی منحرف میشوند و نسبت جرم به بار آنها با پرتوهای کاتدی یکسان است.[۳۷] این مشاهده، دیدگاه وجود الکترونها به عنوان جزئی از اتمها را تقویت کرد.[۳۸][۳۹]
اندازه گیری بار الکترون[ویرایش]
در سال ۱۹۰۹ بار الکترون با دقت بیشتری توسط دانشمندان آمریکایی به نامهای رابرت میلیکان و هاروی فلچر بهوسیله آزمایش قطره روغن آنها اندازهگیری شد که نتایج آن در سال ۱۹۱۱ منتشر نمود. در این آزمایش از اثر پرتوهای ایکس برای تولید الکترون از مولکولهای هوا استفاده شده بود. سپس قطرههای ریز روغن به هوا پاشیده میشد تا الکترونها را جذب کند و از یک میدان الکتریکی استفاده شده بود تا از سقوط قطرههای کوچک روغن بر اثر گرانش جلوگیری کنند. در واقع بار الکتریکی بین دو صفحه مدار میتوانست به شکلی تنظیم شود که قطرههای روغن سقوط نکنند. این وسیله میتوانست بار الکتریکی را برای تعداد کمی همچون ۱–۱۵۰ یون را با خطای کمتر از۰٫۳٪ اندازه بگیرد. پیش از این آزمایشهای مشابهی توسط گروه تامسون انجام شده بود،[۴] که در آنها از بخار قطرات ریز آب باردار که به وسیله برقکافت تولید شده بودند، استفاده شده بود،[۱۳] و در سال ۱۹۱۱ نیز آبرام ایوف بهطور جداگانه به همان نتیجهٔ میلیکان با استفاده از ریزذرات فلزات دست یافت، و نتایج آن را در سال ۱۹۱۳ منتشر کرد.[۴۰] هر چند که قطرههای روغن به دلیل سرعت تبخیر کمتر، از قطرههای آب پایدار تر و در نتیجه برای آزمایش دقیق در زمانهای طولانی مناسب تر بودند.[۴۱] از سوی دیگر ممکن بود که یک قطره روغن بیش از یک الکترون جذب کند و در نتیجه مقدار بارهای محاسبه شده بر روی همه قطرههای روغن همسان نباشند اما همه آنها مضربی ساده از یک مقدار معین بودند. بنابراین یک الکترون باری برابر با q=−۱.۶۰۲۱۷۶۴۸۷(40)×۱۰−۱۹ C دارد. با توجه به میزان q/m تعیین شده توسط تامسون و بار الکتریکی یک الکترون میتوان جرم الکترون را اینگونه محاسبه نمود: m=q/m= ۹/۱۰۹۶x۱۰−۲۸ g
در اوایل قرن بیستم مشخص شد که در شرایط خاصی، یک ذرهٔ باردار متحرک با سرعت بالا در طول مسیر خود، باعث میعان بخار آب فوق اشباع میشوند. در سال ۱۹۱۱ چارلز ویلسون از این ویژگی برای طراحی اتاقک ابر خود استفاده کرد که امکان عکس گرفتن از مسیر ذرات باردار، مانند الکترونهای پرسرعت را فراهم نمود.[۴۲]
نظریهٔ اتمی[ویرایش]
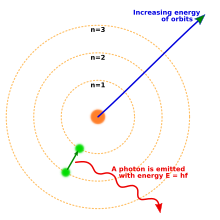
در سال ۱۹۱۴ آزمایشهای انجام شده به وسیلهٔ فیزیکدانانی چون ارنست رادرفورد، هنری موزلی، جیمز فرانک و گوستاو هرتز، تا حد زیادی تصویر ساختار اتم را به صورت یک هسته فشرده با بار مثبت و احاطهشده توسط الکترونهایی با جرم کمتر، تثبیت نمودهبودند.[۴۳] در سال ۱۹۱۳ یک فیزیکدان دانمارکی به نام نیلز بور چنین فرض نمود که الکترون در حالتهای (مدارهای) انرژی کوانتایی مشخصی قرار میگیرد که انرژی آنها توسط تکانه زاویهای مدارهای الکترون در اطراف هسته تعیین میشود. الکترونها میتوانند با نشر یا جذب فوتونهایی با بسامدهای مشخص، بین این حالتها یا مدارها حرکت کنند. او به وسیلهٔ این مدارهای کوانتایی، توضیح دقیقی در مورد خطوط طیفی اتم هیدروژن ارائه داد.[۴۴] با این وجود، مدل بور از توضیح دلیل شدت نسبی خطوط طیف و همچنین توضیح طیف اتمهای پیچیدهتر ناتوان بود.[۴۳]
پیوندهای شیمیایی بین اتمها توسط گیلبرت نیوتون لوییس توضیح داده شدند. او در سال ۱۹۱۶ پیشنهاد داد که یک پیوند کووالانسی بین دو اتم به وسیلهٔ دو الکترون به وجود میآید که بین دو اتم به اشتراک گذاشته میشوند.[۴۵] بعدها در سال ۱۹۲۷ والتر هایتلر و فریتس لندن توضیح کاملی در مورد شکلگیری جفتالکترون و پیوند شیمیایی به زبان مکانیک کوانتومی ارائه دادند.[۴۶] در سال ۱۹۱۹ یک شیمیدان آمریکایی به نام ایروینگ لانگمویر مدل اتمی استاتیک لوییس را گسترش داد و معتقد بود که همهٔ الکترونها در پوستههای کروی (تقریباً) هممرکز با ضخامت یکسان بهطور متوالی توزیع شدهاند.[۴۷] پوستهها نیز به نوبه خود به سلولهایی تقسیم میشدند که هر کدام از آنها شامل یک جفت الکترون بود. با استفاده از این مدل لانگمویر قادر بود تا بهطور کیفی، ویژگیهای شیمیایی همهٔ عناصر جدول تناوبی را توضیح دهد،[۴۶] که بنا بر قانون تناوبی تصور میشد تا حدود زیادی خودشان را تکرار میکنند.[۴۸]
در سال ۱۹۲۴ یک فیزیکدان اتریشی به نام ولفگانگ پاولی دریافت که ساختار پوستهمانند اتم را میتوان به وسیله مجموعهای از ۴ پارامتر توضیح داد که تمام حالتهای کوانتومی انرژی را تعریف میکنند، به شرط این که هر یک از این حالتها به وسیلهٔ تنها یک الکترون اشغال شود. (این محدودیت که یک حالت کوانتومی انرژی نمیتواند توسط بیش از یک الکترون اشغال شود، به نام اصل طرد پاولی شهرت یافت)[۴۹] سازوکار فیزیکی برای توضیح پارامتر چهارم این مجموعه پارامترهای چهارگانه، که دو مقدار متمایز ممکن برای آن وجود دارد، به وسیلهٔ فیزیکدانهای هلندی به نامهای ساموئل گودسمیت و جرج اولنبک، ارائه شد. در سال ۱۹۲۵ آنها پیشنهاد کردند که الکترون علاوه بر اندازه حرکت زاویهای ناشی از حرکت دایرهای، خودش نیز دارای یک اندازه حرکت زاویهای و گشتاور مغناطیسی ذاتی است.[۴۳][۵۰] تکانه زاویهای ذاتی الکترون با نام اسپین شهرت یافت، و شکافهای ابهامآمیز موجود در خطوط طیفی مشاهدهشده توسط یک طیفسنج با وضوح بالا را توضیح داد؛ امروزه این پدیده به عنوان شکاف ساختار ریز شناخته میشود.[۵۱]
مکانیک کوانتومی[ویرایش]

در سال ۱۹۲۴ یک فیزیکدان فرانسوی به نام لوییس دوبروی در مقاله اش با عنوان (تحقیق دربارهٔ نظریهٔ کوانتوم) فرضیهای را مطرح کرد که همهٔ مواد، مانند نور، دارای یک موج دوبروی میباشند.[۵۲] یعنی در شرایط مناسب، الکترونها یا مواد دیگر ممکن است از خودشان ویژگیهای ذرات یا امواج را بروز دهند. ویژگیهای ذرهای یک ذره هنگامی بروز میکنند که اینگونه نشان میدهد که در هر لحظه از زمان، در طول مسیرش یک موقعیت محلی در فضا دارد.[۵۳] ماهیت موجی هنگامی مشاهده میشود که مثلاً یک پرتو نور از درون شکافهای موازی عبور میکند و الگوهای تداخلی ایجاد میکند. در سال ۱۹۲۷، الگوهای تداخلی برای یک پرتو از الکترونها و با استفاده از یک پرده نازک فلزی، توسط یک فیزیکدان انگلیسی به نام جورج پاجت تامسون مشاهده شد و همچنین دو فیزیکدان آمریکایی به نامهای کلینتون دیویسون و لستر گرمر این اثر را با استفاده از یک بلور نیکل مشاهده کردند.[۵۴]
پیشبینی دوبروی در مورد ماهیت موجی الکترون سبب شد شرودینگر معادله موجی برای الکترونهای در حال حرکت تحت تأثیر هسته در اتم، ارائه دهد. در سال ۱۹۲۶، این معادله، یعنی معادله شرودینگر به شکل موفقیتآمیزی چگونگی انتشار امواج الکترونی را توصیف کرد.[۵۵] این معادله موج به جای اینکه به پاسخی برای تعیین مکان الکترون در طول زمان بینجامد، میتواند برای پیشبینی احتمال یافتن یک الکترون در نزدیکی یک مکان مورد استفاده قرار گیرد، به ویژه در نواحی از فضا که الکترون در آن مقید است، زیرا معادله موج الکترون در این نواحی با گذشت زمان تغییر نمیکند. این دیدگاه منجر به فرمولبندی دوم مکانیک کوانتومی (که فرمولبندی نخست آن توسط هایزنبرگ در سال ۱۹۲۵ انجام شدهبود) شد و پاسخهای معادله شرودینگر مانند هایزنبرگ منجر به نتیجهگیریهایی در مورد حالات انرژی یک الکترون در اتم هیدروژن میشد که معادل همانهایی بودند که توسط بور در سال ۱۹۱۳ نتیجهگیری شدهبود و به عنوان عامل ایجاد خطوط طیفی هیدروژن شناخته میشدند.[۵۶] هنگامی که اسپین و برهمکنش میان الکترونها در نظر گرفته شدند، مکانیک کوانتومی بعدها این امکان را فراهم نمود که قرارگیری الکترونها در اتمهای با اعداد اتمی بالاتر از هیدروژن نیز، پیشبینی شوند.[۵۷]
در سال ۱۹۲۸ پائول دیراک بر مبنای کار ولفگانگ پاولی، مدلی از الکترون به نام معادلهٔ دیراک ارائه داد که با نظریه نسبیت سازگار بود و با بکار بردن آثار نسبیتی و تقارن در فرمولبندی هامیلتونی مکانیک کوانتومی میدان الکترومغناطیسی.[۵۸] در سال ۱۹۳۰ دیراک به منظور رفع برخی اشکالات موجود در معادلهٔ نسبیتی اش، یک مدل از خلأ به عنوان یک دریای نامتناهی از ذرات با انرژی منفی ارائه داد که دریای دیراک نامیده شد. این موضوع منجر شد که او وجود پوزیترون را که پادماده همتای الکترون است، پیشبینی کند.[۵۹] این ذره در سال ۱۹۳۲ توسط کارل اندرسون کشف شد و پیشنهاد داد که الکترونهای استاندارد نگاترون نامیده شوند و الکترون به عنوان یک عبارت عمومی بکار برده شود که هر دو گونه دارای بار مثبت و منفی را توصیف میکند.[۶۰][۶۱] ش در سال ۱۹۴۷، ویلیس اوژن لمب به هنگام همکاری با یک دانشجوی فوقلیسانس به نام رابرت رادرفورد، متوجه شد که حالتهای کوانتومی معینی از اتم هیدروژن که باید انرژیهای یکسانی داشته باشند نسبت به یکدیگر تغییر میکنند که این تفاوت موجود با نام تغییر لمب شناخته میشود. تقریباً در همان زمان، پولیکارپ کوش هنگام کار با هنری فولی، کشف کرد که گشتاور مغناطیسی الکترون کمی بیشتر از آن چیزی است که توسط نظریه دیراک پیشبینی شدهاست. این تفاوت کوچک بعدها گشتاور دوقطبی مغناطیسی نابهنجار الکترون نامیده شد. این اختلاف بعدها توسط نظریه الکترودینامیک کوانتومی که اواخر دههٔ ۱۹۴۰ توسط سین ایتیرو توموناگا، جولیان شوینگر و ریچارد فاینمن ارائه شده بود، توضیح دادهشد.[۶۲]
شتاب دهندههای ذرات[ویرایش]
با پیدایش دستگاههای شتاب دهندهٔ ذرهای در خلال نیمهٔ اول قرن بیستم، فیزیکدانان کاوشهای ژرفتری در مورد ویژگیهای ذرات زیر اتمی آغاز نمودند.[۶۳] نخستین تلاش موفقیتآمیز برای شتاب بخشیدن به الکترونها با استفاده از القای الکترومغناطیسی را دونالد کرست در سال ۱۹۴۲ انجام داد. بتاترون اولیه وی به انرژیهایی در سطح ۲٫۳MeV رسید، درحالیکه بتاترونهای بعدی به انرژیهایی در حد ۳۰۰MeV دست یافتند. در سال ۱۹۴۷ تابش سینکروترون با استفاده از یک سینکروترون الکترونی ۷۰MeV و در شرکت جنرال الکتریک کشف شد. این تابش از شتاب گرفتن الکترونها و حرکت آنها با سرعتی نزدیک به سرعت نور در درون یک میدان مغناطیسی، ناشی میشود.[۶۴]
اولین برخورد دهنده ی ذرات با انرژی بالا آدون نام داشت که انرژی پرتو آن ۱٫۵GeV بود و در سال ۱۹۶۸ شروع به کار کرد.[۶۵] این وسیله هم به الکترونها و هم به پوزیترونها در جهت مخالف مم شتاب میداد، که به شکل مؤثری، انرژی برخورد آنها را در مقایسه با برخورد الکترون با یک هدف ساکن، دوبرابر میکرد.[۶۶] برخورددهنده بزرگ الکترون-پوزیترون (LEP) در سرن که از سال ۱۹۸۹ تا ۲۰۰۰ در حال کار بود، توانست به انرژیهای برخوردی در حد ۲۰۹GeV دست یابد و سنگ محک مهمی برای مدل استاندارد فیزیک ذرات بود.[۶۷][۶۸]
حبسنمودن یک تک الکترون[ویرایش]
الکترونهای تکی را امروزه میتوان در یک ترانزیستور فوق کوچک (۲۰x۲۰ نانومتر) سیموس محبوس نمود که در دماهای پایینی از ۲۶۹- تا ۲۵۸- درجه سانتیگراد عمل میکند.[۶۹] تابع موج الکترون در یک شبکه نیمههادی پخش میشود و با الکترونهای ظرفیت برهمکنشی قابل چشمپوشی دارد و میتوان با جایگزینی جرم آن با تانسور جرم مؤثر، از صوریسازی تکذره استفاده نمود
ویژگیها[ویرایش]
طبقهبندی[ویرایش]

در مدل استاندارد فیزیک ذرات، الکترونها به گروهی از ذرات زیر اتمی به نام لپتونها تعلق دارند که ذرات بنیادی یا اولیه در نظر گرفته میشوند. الکترونها دارای کمترین مقدار جرم در میان لپتونهای باردار (و یا هر نوع ذره دارای بار الکتریکی) هستند و متعلق به اولین نسل ذرات بنیادی هستند.[۷۰] دومین و سومین نسل لپتونهای باردار میون و تاو هستند که از نظر بار، اسپین و برهم کنش با الکترونها یکسان بوده ولی دارای جرم بیشتری میباشند. لپتونها از نظر نداشتن برهم کنش قوی با جزء دیگر تشکیل دهندهٔ ماده به نام کوارک تفاوت دارند. همهٔ اعضای گروه لپتونها فرمیون هستند زیرا همگی آنها دارای اسپین نیمهصحیح هستند؛ الکترون دارای اسپین ۱⁄۲ است.[۷۱]
ویژگیهای بنیادی[ویرایش]
جرم نامتغیر یک الکترون تقریباً ۹٫۱۰۹×۱۰−۳۱ کیلوگرم یا ۵٫۴۸۹×۱۰−۴ واحد جرم اتمی است.[۷۲] برپایه اصل همارزی جرم-انرژی اینشتین، این میزان جرم معادل با انرژی سکونی برابر ۰٫۵۱۱ مگاالکترونولت است. نسبت جرم پروتون به الکترون در حدود ۱۸۳۶ است.[۱۰][۷۳] مشاهدات اخترشناسی نشان دادهاست که همانطور که مدل استاندارد پیشبینی میکند، نسبت جرم پروتون به الکترون حداقل در نیمی از عمر جهان، همین مقدار را داشتهاست.[۷۴]
الکترون دارای بار الکتریکی برابر با −۱٫۶۰۲×۱۰−۱۹ کولن است[۷۲] که به عنوان یکای استاندارد بار الکتریکی برای ذرات زیراتمی در نظر گرفتهمیشود و با نام بار بنیادی نیز شناختهمیشود. این بار بنیادی عدم قطعیت استانداردی به اندازه ۲٫۲×۱۰−۸ دارد.[۷۲] در محدوده دقت آزمایشهای تجربی، میزان بار الکترون برابر با بار پروتون و با علامت مخالف آن است.[۷۵] از آنجاییکه نماد e برای بار بنیادی بهکاربرده میشود، معمولاً الکترون را با نماد -e نمایش میدهند که علامت منفی نشاندهنده منفی بودن بار آن است. پوزیترون را با نماد +e نمایش میدهند زیرا ویژگیهایش مانند الکترون است با این تفاوت که بار آن مثبت است.[۷۱][۷۲]
الکترون دارای یک تکانه زاویهای ذاتی یا اسپین به اندازه ۱⁄۲ است.[۷۲] به دلیل این ویژگی الکترون یک ذره اسپین-۱⁄۲ بهشمار میآید.[۷۱] اندازه اسپین چنین ذراتی برابر با
است و اندازه تصویر اسپین روی هر محور ħ⁄۲± است. افزون بر اسپین، الکترون یک گشتاور مغناطیسی ذاتی نیز در امتداد محور اسپین خود دارد.[۷۲] مقدار آن تقریباً برابر با یک مگنتون بور[۷۶][note ۴] است که ثابتی فیزیکی با اندازه ۹٫۲۷۴۰۰۹۱۵(۲۳)×۱۰−۲۴ ژول بر تسلا میباشد.[۷۲]
جهتگیری اسپین نسبت به گشتاور الکترون یکی از ویژگیهای ذرات بنیادی به نام مارپیچگی را تعریف میکند.[۷۷]
الکترون هیج زیرساختار شناختهشدهای ندارد[۹][۷۸] و گمان میرود که یک ذره نقطهای با بار نقطهای و بدون اندازه فضایی باشد.[۸] در فیزیک کلاسیک، تکانه زاویهای و گشتاور مغناطیسی یک جسم به ابعاد فیزیکیاش بستگی دارند. از این رو مفهوم یک الکترون بدون بعد که دارای این ویژگیها باشد، با مشاهدات تجربی در آزمایشهای دام پنینگ، که به شعاع متناهی غیر صفر الکترون اشاره میکنند، در تناقض به نظر میرسد. یک توضیح ممکن برای این شرایط متناقضنما در مبحث ذرات مجازی و با در نظرگرفتن تبدیل فولدی-ووتویسن مطرح میشود. مسئله شعاع الکترون یکی از مسائل چالشآمیز در فیزیک نظری نوین است. پذیرفتن فرضیه متناهی بودن شعاع الکترون با پیشفرضهای نظریه نسبیت عام در تناقض است. از سوی دیگر، یک الکترون نقطهای (شعاع صفر) نیز مشکلات ریاضیاتی جدی ایجاد میکند زیرا خود-انرژی الکترون به بینهایت میل میکند.[۷۹] این جنبهها بهطور مفصل توسط دیمیتری ایواننکو و آرسنی سوکولوف تحلیل شدهاست.
مشاهدات مربوط به یک تک الکترون در یک دام پنینگ نشان میدهد که حداکثر شعاع ممکن برای ذره ۱۰×۱۰−۲۲ m متر است.[۸۰] یک ثابت فیزیکی به نام شعاع کلاسیک الکترون وجود دارد که مقدار بسیار بیشتری برابر با ۲٫۸۱۷۹×۱۰−۱۵ m متر دارد که از شعاع پروتون نیز بزرگتر است. واژه کلاسیک در اینجا اشاره به محاسبه سادهانگارانهای میکند که آثار مکانیک کوانتومی را نادیده میگیرد؛ در واقعیت، شعاع کلاسیک الکترون ارتباط اندکی با ساختار بنیادی الکترون دارد.[۸۱][note ۵]
ذرات بنیادی وجود دارند که خود به خود به ذرات با جرم کمتر واپاشی میشوند. یک نمونه از این ذرات میون است که با میانگین طول عمر ۲٫۲×۱۰−۶ به یک الکترون، یک نوترینو و یک پادنوترینو واپاشی میشود. اما در مباحث نظری الکترون، ذرهای پایدار بهشمار میآید: الکترون کم جرمترین ذره با بار الکتریکی غیرصفر است، پس واپاشی آن قانون پایستگی بار را نقض میکند.[۸۲] حد پایین تجربی طولعمر میانگین الکترون، با ۹۰٪ سطح اطمینان، ۴٫۶×۱۰۲۶ سال است.[۸۳][۸۴]
ویژگیهای کوانتومی[ویرایش]
مانند سایر ذرات، الکترون نیز میتواند ویژگیهای موجی از خود بروز دهد. این ویژگی را دوگانگی موج-ذره مینامند و میتوان از طریق آزمایش دوشکاف آن را نمایش داد.
ماهیت موج-مانند الکترون به آن اجازه میدهد که از دو شکاف بهطور همزمان عبور کند، در حالیکه یک ذره کلاسیک در یک زمان مشخص تنها میتواند از یک شکاف عبور کند. در مکانیک کوانتومی ویژگی موج-مانند ذره را میتوان توسط یک تابع مختلط مقدار به نام تابع موج (ψ)، به زبان ریاضی توصیف نمود. مجذور قدر مطلق این تابع احتمال اینکه یک ذره در نزدیکی یک مکان مشخص مشاهده شود را بهدست میدهد و یک تابع چگالی احتمال است.[۸۵]: ۱۶۲–۲۱۸
الکترونها ذرات یکسانی هستند زیرا نمیتوان دو الکترون مختلف را برپایه ویژگیهای فیزیکی ذاتی آنها از یکدیگر متمایز نمود. این در مکانیک کوانتومی بدین معناست که میتوان جای دو الکترون در حال برهمکنش را با یکدیگر عوض نمود، بدون آنکه تغییری در وضعیت کوانتومی سیستم به وجود آید. تابع موج فرمیونها (که شامل الکترون نیز میشوند) پادتقارنی است یعنی هرگاه جای الکترونها با هم عوض شود، علامت آن تغییر مییابد؛ یعنی (ψ(r۱, r۲) = −ψ(r۲, r۱ که در آن متغیرهای r۱ و r۲ متناظر با الکترون اول و دوم هستند. از آنجا که تعویض علامت، تأثیری در مقدار قدر مطلق ندارد، احتمالات متناظر با این دو حالت یکسان هستند. بوزونها (مانند فوتون) برعکس فرمیونها تابع موج تقارنی دارند.[۸۵]: ۱۶۲–۲۱۸
در مورد امواج پادتقارنی، حل معادله موج برای دو الکترون در حال برهمکنش، نتیجه میدهد که احتمال اینکه هر دو ذره یک جفت، حالت کوانتومی یکسانی را داشته باشند، صفر است. این اصل بسیاری از ویژگیهای الکترون را توضیح میدهد. این موضع سبب میشود که گروههای الکترونهای محدود در یک اتم، به جای اینکه همگی در یک مدار روی هم قرار بگیرند، اوربیتالهای اتمی مختلفی را در اتم اشغال کنند.[۸۵]: ۱۶۲–۲۱۸
ذرات مجازی[ویرایش]
با نگاهی سادهنگرانه، میتوان گفت که هر فوتون زمانی را به شکل ترکیبی از یک الکترون مجازی و پادذره آن یعنی پوزیترون مجازی سپری میکند که اندکی پس از آن به سرعت یکدیگر را نابود میکنند.[۸۶] ترکیب تغییرات انرژی مورد نیاز برای ایجاد این ذرات و زمانی که طی آن وجود دارند، باید پایینتر از آستانه مشاهدهپذیری توصیف شده توسط رابطه عدم قطعیت هایزنبرگ باشد، یعنی
در حقیقت انرژی ΔE مورد نیاز برای ایجاد این ذرات مجازی را میتوان برای بازه زمانی Δt، از خلاء قرض گرفت، با این شرط که حاصلضرب این دو از ثابت پلانک کاهشیافته،ħ ≈ ۶٫۶×۱۰−۱۶ eV·s بیشتر نباشد. از این رو برای یک الکترون مجازی، Δt حداکثر برابر ۱٫۳×۱۰−۲۱ s است.[۸۷]

در زمانی که یک جفت الکترون-پوزیترون مجازی وجود دارند نیروی کولنی ناشی از میدان الکتریکی اطراف الکترون، باعث میشود که یک پوزیترون ایجاد شده جذب الکترون اصلی شود، در حالیکه الکترون ایجاد شده دفع میشود. این سبب چیزی میشود که به قطبش خلاء مشهور است. در حقیقت خلاء مانند یک رسانا با گذردهی نسبی دیالکتریک بیشتر از یک عمل میکند؛ بنابراین بار مؤثر یک الکترون در حقیقت کمتر از مقدار واقعی آن است؛ و بار با افزایش فاصله از الکترون کاهش مییابد.[۸۸][۸۹] این پدیده قطبش در سال ۱۹۹۷ توسط شتابدهنده ذرات ژاپنی تریستان مورد تأیید تجربی قرار گرفت.[۹۰] ذرات مجازی سبب ایجاد یک اثر پوششی برای جرم الکترون هم میشوند.[۹۱]
همچنین از طریق برهمکنش با ذرات مجازی میتوان اختلاف اندک (در حدود ۰٫۱٪) گشتاور مغناطیسی ذاتی الکترون از مگنتون بور را توضیح داد.[۷۶][۹۲] همخوانی فوقالعاده دقیق این اختلاف پیشبینی شده با مقدار تعیینشده از راه تجربی، یکی از دستاوردهای مهم الکترودینامیک کوانتومی شمرده میشود.[۹۳]
پارادوکس ظاهری مشاهدهشده در مورد یک الکترون نقطهای که دارای تکانه زاویهای و گشتاور مغناطیسی باشد را میتوان با استفاده از شکلگیری فوتونهای مجازی در میدان الکتریک تولید شده توسط الکترون توضیح داد. این فوتونها باعث میشوند که الکترونها به شکل رقصان انتقال یابند که سبب یک حرکت دایرهای تقدیمی میشود.[۹۴] این حرکت اسپین و گشتاور مغناطیسی الکترون را تولید میکند.[۸][۹۵] در اتمها این پیدایش فوتونهای مجازی تغییر لمب مشاهدهشده در خطوط طیفی را توضیح میدهد.[۸۸]
برهمکنش[ویرایش]
یک الکترون، میدان الکتریکی ایجاد میکند که بر ذرات با بار مثبت مانند پروتون، نیروی جاذبه و بر ذرات دارای بار منفی نیروی دافعه وارد میکند. میزان قدرت این نیرو توسط قانون مربع معکوس کولن تعیین میشود.[۹۶] الکترون وقتی در حال حرکت باشد، میدان مغناطیسی ایجاد میکند.[۸۵]: ۱۴۰ قانون آمپر-ماکسول، ارتباط میان میدان مغناطیسی ایجاد شده با حرکت دستهجمعی الکترونها نسبت به یک ناظر(جریان) را توصیف میکند. این ویژگی القایی، میدان مغناطیسی مورد نیاز برای چرخش یک موتور الکتریکی فراهم میکند.[۹۷] میدان الکترومغناطیسی یک ذره باردار دلخواه در حال حرکت، توسط پتانسیلهای لینار-ویشرت توصیف میشود که حتی وقتی سرعت ذره نزدیک به سرعت نور باشد(نسبیتی) نیز معتبر هستند.

وقتی الکترونی در درون یک میدان مغناطیسی حرکت میکند در معرض نیروی لورنتز قرار میگیرد که عمود بر صفحه تعریف شده توسط میدان مغناطیسی و سرعت الکترون وارد میشود. این نیروی مرکزگرا سبب مارپیجی شدن مسیر حرکت الکترون درون میدان میشود که شعاع این مسیر پیچهای ژیرورادیوس نامیده میشود. شتاب ناشی از این حرکت دایرهای الکترون را القا میکند تا انرژی به شکل تابش سینکروترون آزاد کند.[۸۵]: 160 [۹۸][note ۶] انتشار انرژی به نوبه خود سبب پسزنی الکترون میشود که با نام نیروی آبراهام-لورنتز-دیراک شناخته میشود که اصطکاکی ایجاد میکند که باعث کند شدن حرکت الکترون میشود. این نیرو ناشی از واکنش به عقب خود میدان الکترون نسبت به خودش است.[۹۹]
در الکترودینامیک کوانتومی، فوتونها واسطه برهمکنش میان ذرات هستند. یک الکترون منزوی با سرعت ثابت نمیتواند یک فوتون واقعی را جذب یا منتشر کند؛ این کار باعث نقض پایستگی انرژی و تکانه میشود. در عوض، فوتونهای مجازی میتوانند تکانه را میان دو ذره باردار منتقل کنند. مثلاً این تبادل فوتونهای مجازی باعث ایجاد نیروی کولنی میگردد.[۱۰۰] انتشار انرژی میتواند وقتی که مسیر یک الکترون در حال حرکت توسط ذره بارداری مانند پروتون منحرف میشود، اتفاق بیفتد. شتاب گرفتن الکترون باعث انتشار تابش ترمزی میشود.[۱۰۱]
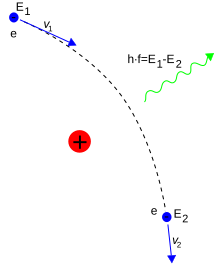
یک برخورد ناکشسان بین یک فوتون (نور) و یک الکترون تکی (آزاد)، پراکندگی کامپتون نامیده میشود. چنین تصادمی سبب انتقال تکانه و انرژی میان ذرات میشود که باعث تغییر طول موج فوتون به اندازه مقداری که انتقال کامپتون نام دارد، میشود.[note ۷] حداکثر مقدار این تغییر طول موج، h/mec است که با نام طول موج کامپتون شناخته میشود.[۱۰۲] مقدار آن برای الکترون برابر با ۲٫۴۳×۱۰−۱۲ m است.[۷۲] وقتی طول موج نور بلند باشد (مثلاً طول موج نور مرئی ۰٫۷–۰٫۴ میکرومتر است)، میزان تغییر طول موج ناچیز و قابل چشمپوشی است. چنین برهمکنشی میان نور و الکترونهای آزاد، پراکندگی تامسون یا پراکندگی خطی تامسون نامیده شدهاست.[۱۰۳]
قدرت نسبی برهمکنش الکترومغناطیس میان دو ذره باردار مانند الکترون و پروتون توسط ثابت ساختار ریز بهدست میآید. این مقدار یک کمیت بدون بعد است که نسبت دو انرژی را نشان میدهد: انرژی جاذبه (یا دافعه) الکترواستاتیک در فاصلهای به اندازه یک طول موج کامپتون و انرژی سکون بار. مقدار آن برابر است با α ≈ ۷٫۲۹۷۳۵۳×۱۰−۳ که تقریباً معادل ۱⁄۱۳۷ است.[۷۲]
وقتی الکترون و پوزیترون با هم برخورد میکنند، یکدیگر را نابود میکنند و دو یا چند فوتون پرتو گاما پدید میآورند. اگر تکانه الکترون و پوزیترون قابل چشمپوشی باشد، امکان پیدایش یک اتم پوزیترونیوم پیش از آنکه نابودسازی منجر به تولید سه فوتون پرتو گاما (مجموعاً ۱٫۰۲۲ مگا الکترونولت) شود، وجود دارد.[۱۰۴][۱۰۵] از سوی دیگر، فوتونهای پرانرژی ممکن است در فرایندی به نام جفتسازی تبدیل به یک الکترون و یک پوزیترون شوند، البته تنها در صورتی که در نزدیکی یک ذره باردار مانند هسته اتم قرار بگیرد.[۱۰۶][۱۰۷] در نظریه برهمکنش الکتروضعیف، مؤلفه چپدست تابع موج الکترون، با الکتروننوترینو یک دوگان ایزواسپین ضعیف تشکیل میدهد. این بدین معنی است که الکتروننوترینوها در برهمکنشهای ضعیف مانند الکترون عمل میکنند. هر یک از اعضای این دوگان میتواند تحت یک برهمکنش جریان باردار، با انتشار یا جذب یک بوزون W به عضو دیگر تبدیل شوند. بار در این واکنش پایسته میماند زیرا بوزون W نیز حامل بار است و میزان تغییرات خالص بار در حین تبدیل صفر است. برهمکنشهای جریان باردار، مسئول پدیده واپاشی بتا در اتمهای پرتوزا هستند. هر دوی الکترون و الکتروننوترینو میتوانند از طریق مبادله یک بوزون 0Z در برهمکنش جریان خنثی شرکت کنند و این ویژگی سبب پیدایش پدیده پراکندگی کشسان نوترینو-الکترون میشود.[۱۰۸]
اتمها و مولکولها[ویرایش]
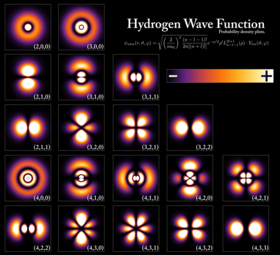
الکترون را میتوان از طریق یک نیروی جاذبه کولنی مقید به هسته اتم نمود. سامانه متشکل از یک یا چند الکترون مقید به یک هسته، «اتم» نام دارد. اگر در اتمی تعداد الکترونها با بار الکتریکی هسته برابر نباشد، به آن «یون» گفته میشود. رفتار موج-مانند یک الکترون مقید توسط تابعی به نام اوربیتال اتمی توصیف میشود. هر اوربیتال مجموعهای از اعداد کوانتومی (مانند انرژی، تکانه زاویهای و تصویر تکانه زاویهای) خاص خود را داراست. و تنها تعداد گسستهای از این اوربیتالها میتوانند در اطراف هسته وجود داشتهباشند. بنا بر اصل طرد پاولی، هر اوربیتال میتواند حداکثر توسط دو الکترون اشغال شود که باید عدد کوانتومی اسپین آنها از یکدیگر متفاوت باشد.
الکترونها میتوانند با انتشار یا جذب فوتون بین اوربیتالهای مختلف منتقل شوند. انرژی فوتون آزاد شده برابر با اختلاف پتانسیل دو اوربیتال خواهد بود.[۱۰۹] از دیگر روشهای انتقال اوربیتال الکترون میتوان به برخورد دادن آن با ذرات و همچنین اثر اوژه اشاره نمود.[۱۱۰] برای گریختن از اتم، انرژی الکترون باید از انرژی بستگی آن با اتم(انرژی یونش) بیشتر باشد. این اتفاق مثلاً در پدیده فوتوالکتریک روی میدهد که در آن یک فوتون تصادفی که انرژی آن از انرژی یونش اتم بیشتر است توسط الکترون جذب میشود.[۱۱۱]
تکانه زاویهای اوربیتالی الکترون کوانتایی است. از آنجا که الکترون باردار است، یک گشتاور مغناطیسی اوربیتالی تولید میکنند که متناسب با تکانه زاویهای الکترون است. گشتاور مغناطیسی خالص یک اتم برابر با جمع برداری گشتاورهای مغناطیسی اسپین و اوربیتال همه الکترونها و هسته اتم است. گشتاور مغناطیس هسته دز مقابل الکترونها قابل چشمپوشی است. گشتاورهای مغناطیسی دو الکترونی که یک اوربیتال را اشغال کردهاند، میتوانند همدیگر را خنثی کنند.[۱۱۲]
پیوندهای شیمیایی که میان اتمها روی میدهند، نتیجه برهمکنشهای الکترومغناطیسی هستند که توسط مکانیک کوانتوم توصیف میشوند.[۱۱۳] قویترین پیوندها به اشتراکگذاری یا انتقال الکترون بین اتمها شکل میگیرند و بدینترتیب امکان شکلگیری مولکولها را فراهم میکنند.[۱۲] در درون یک مولکول، الکترونها تحت تأثیر هستههای اتمهای متعدد هستند و همانطور که در اتمهای منفرد، اوربیتالهای اتمی را پر میکردند، در مولکولها اوربیتالهای مولکولی را پر میکنند.[۱۱۴] یکی از فاکتورهای بنیادی در این ساختارهای مولکولی وجود جفت الکترونهاست. این الکترونها باید اسپین مخالف داشتهباشند تا بنا بر اصل طرد پاولی بتوانند با هم یک اوربیتال مولکولی را پرکنند (مانند اتمها). اوربیتالهای مولکولی مختلف توزیعهای فضایی متفاوتی از چگالی الکترون دارند. مثلاً در جفتهای پیوندی (یعنی جفت الکترونهایی که در واقع اتمها را به یکدیگر پیوند میدهند) با بیشترین احتمال میتوان الکترون را در حجم کوچکی بین دو هسته یافت، در حالیکه جفت الکترونهای غیرپیوندی در حجم بزرگی در اطراف هستهها توزیع شدهاند.[۱۱۵]
رسانایی[ویرایش]

چنانچه شمار الکترونهای جسمی بیشتر یا کمتر از شمار لازم برای ایجاد تعادل با بار مثبت هستههای اتمهایش باشد، آن جسم دارای بار الکتریکی خالص خواهد بود. اگر جسم دارای فزونی الکترون باشد، گفته میشود که جسم دارای بار منفی و اگر کمبود الکترون داشته باشد بار آن را مثبت میخوانند. وقتی شمار الکترونها و پروتونها برابر باشد، یکدیگر را خنثی میکنند و گفته میشود که جسم از نظر الکتریکی خنثی است. در نتیجه پدیدهای به نام اثر برق مالشی میتوان با مالش در اجسام ماکروسکوپی بار الکتریکی ایجاد نمود.[۱۱۹]
الکترونهای مستقلی که در حال حرکت در خلاء باشند را «الکترون آزاد» میگویند. الکترونها در فلزات به گونهای رفتار میکنند که گویی آزاد هستند. ذرّاتی در فلزات و جامدات دیگر به نام الکترون شناخته میشوند، در واقع شبه ذره الکترون هستند که همان بار الکتریکی، اسپین و گشتاور مغناطیسی الکترونهای واقعی را دارند اما ممکن است جرمشان متفاوت باشد.[۱۲۰] وقتی الکترونهای آزاد (چه در خلاء و چه در فلزات) حرکت میکنند یک شاره خالص از بار تولید میکنند که جریان الکتریکی نامیده میشود و باعث ایجاد یک میدان مغناطیسی میشود و بالعکس میتوان با یک میدان مغناطیسی متغیر، جریان الکتریکی تولید نمود. این برهمکنشها را میتوان با استفاده از معادلات ماکسول به زبان ریاضی بیان نمود.[۱۲۱]
در هر دمای دلخواه، هر مادهای میزان خاصی از رسانایی الکتریکی دارد که مقدار جریان الکتریکی را در زمانی که پتانسیل برقرار شود، تعیین میکند. نمونه رساناهای خوب فلزاتی مانند مس و طلا هستند، در حالیکه شیشه و تفلون رساناهای ضعیفی هستند. در مواد دیالکتریک، الکترونها مقید به اتمهایشان باقی میمانند و ماده به عنوان عایق عمل میکند. بیشتر نیمرسانا (نیمههادی)ها سطح متغیری از رسانایی بین رسانای کامل و عایق الکتریکی دارند.[۱۲۲] از سوی دیگر فلزات یک ساختار نوار الکترونیکی دارند که عبارت است از نوارهای الکترونیکی نیمهپر. وجود چنین نوارهایی به الکترونها اجازه میدهد که به گونهای رفتار کنند که گویا الکترون آزاد یا الکترون نامتمرکز هستند. این الکترونها با اتم خاصی مرتبط نیستند، در نتیجه وقتی یک میدان الکتریکی اعمال میشود آزاد هستند که مانند یک گاز (گاز فرمی)[۱۲۳] در درون ماده حرکت کنند.
به دلیل برخوردهای میان اتمها و الکترونها، سرعت رانش الکترون در یک رسانا در مرتبه میلیمتر بر ثانیه است، اما سرعت انتشار، یعنی سرعتی که یک تغییر در جریان در یک نقطه از ماده به نقاط دیگر ماده سرایت میکند و باعث تغییر جریان در قسمتهای دیگر میشود، معمولاً در حدود ۷۵٪ سرعت نور است.[۱۲۴] دلیل این موضوع آن است که سیگنالهای الکتریکی به شکل یک موج منتشر و با سرعتی که وابسته به ثابت دیالکتریک ماده است، منتشر میشوند.[۱۲۵]
فلرات رساناهای خوبی برای گرما هستند زیرا الکترونهای نامتمرکز میتوانند آزادانه حرکت کنند و انرژی گرمایی را میان اتمها منتقل کنند. اما بر خلاف رسانایی الکتریکی، رسانایی گرمایی یک فلز، تقریباً مستقل از دماست. این موضوع را میتوان با قانون ویدمان-فرانتس به زبان ریاضی بیان نمود. این قانون چنین میگوید که نسبت رسانایی گرمایی به رسانایی الکتریکی متناسب با دماست. بینظمی گرمایی در شبکه فلزی مقاومت الکتریکی ماده را افزایش میدهد و بدین ترتیب وابستگی میان جریان الکتریکی و دما ایجاد میکند.[۱۲۶]
وقتی مواد تا دماهای پایینتر از دمای بحرانی سرد شوند، دچار تغییر فازی میشوند که طی آن تمامی مقاومت خود در برابر جریان الکتریکی را از دست میدهند. به این فرایند ابررسانایی گفته میشود. در نظریه بیسیاس، این رفتار توسط جفتالکترونهایی که وارد بک حالت کوانتومی به نام چگالش بوز-اینشتین میشوند، مدل میشود. این جفتهای کوپر، از طریق ارتعاشات شبکهای به نام فونون، حرکتشان را به ماده نزدیکشان مرتبط میسازند و بدین ترتیب از برخوردشان با اتمها که منشاء معمول مقاومت الکتریکی است، جلوگیری میکنند.[۱۲۷] (جفتهای کوپر شعاعی تقریباً برابر با ۱۰۰ نانومتر دارند، بنابراین میتوانند یکدیگر را همپوشانی کنند)[۱۲۸] هرچند سازوکار عملکرد ابررساناهای دماهای بالا هنوز مشخص نیست.
الکترونهای درون جامدات رسانا که خود در واقع شبهذره هستند، وقتی در دماهای نزدیک به صفر مطلق بسیار فشرده شوند، بهگونهای رفتار میکنند که گویا خود به سه شبهذره دیگر تقسیم شدهاند: اسپینون، اوربیتون و هولون[۱۲۹][۱۳۰] اولی حامل اسپین و گشتاور مغناطیسی است، دومی حامل مکان اوربیتالش و آخری حامل بار الکتریکی است.
حرکت و انرژی[ویرایش]
بنا بر نظریه نسبیت خاص اینشتین، وقتی سرعت الکترون به سرعت نور نزدیک میشود، از دید یک ناظر، جرم نسبیتی آن افزایش مییابد و در نتیجه شتاب دادن به آن از درون چارچوب مرجع ناظر، دشوارتر و دشوارتر میشود. سرعت الکترون میتواند به سرعت نور در خلاء (c) نزدیک شود اما هرگز به آن نمیرسد. هرچند وقتی الکترونهای نسبیتی (یعنی الکترونهایی که با سرعتی نزدیک به نور حرکت میکنند) به درون یک رسانه دیالکتریک (مانند آب) تزریق شوند که در آن سرعت نور بسیار کمتر از c است، الکترونها در آن رسانه موقتاً سریعتر از نور حرکت خواهند کرد. در حین برهمکنش با رسانه، نور کمسویی تولید میکنند که تابش چرنکوف نام دارد.[۱۳۱]
آثار نسبیت خاص برپایه کمیتی به نام فاکتور لورنتز بنا شدهاند که به شکل تعریف میشود و v سرعت ذره است. انرژی جنبشی Ke الکترونی که با سرعت v حرکت میکند برابر است با:
که در آن me جرم الکترون است. شتابدهنده خطی استانفورد قادر است به الکترون تا تقریباً ۵۱ گیگاالکترونولت شتاب دهد.[۱۳۲] از آنجا که الکترون رفتار موجی دارد، یک طول موج دوبروی به آن نسبت داده میشود. این طول موج از رابطه λe = h/p بهدست میآید که h ثابت پلانک و p تکانه است.[۵۲] برای ۵۱ گیگا الکترونولت ذکرشده، طول موج در حدود ۲٫۴×۱۰−۱۷ m خواهد بود که به اندازه کافی کوچک هست که بتواند در اکتشاف ساختارهای بسیار کوچکتر از اندازه هسته اتم سودمند باشد.[۱۳۳]
شکلگیری[ویرایش]

نظریه مهبانگ پذیرفتهشدهترین نظریه علمی برای توضیح مراحل اولیه در تکامل جهان است.[۱۳۴] در نخستین میلیثانیه پس از مهبانگ، دماها بیشتر از ۱۰ میلیارد درجه کلوین بودند و میانگین انرژی فوتونها بیش از یک میلیون الکترونولت بود. این فوتونها به اندازه کافی پرانرژی بودند که بتوانند با یکدیگر واکنش دهند و جفتهای الکترون و پوزیترون را بهوجود آورند و به همین شکل جفتهای پوزیترون-الکترون یکدیگر را نابود کرده و فوتونهای پرانرژی منتشر میکنند:
در این مرحله از تکامل جهان بین الکترونها و پوزیترونها و فوتونها تعادلی وجود داشت؛ اما پس از ۱۵ ثانیه دمای جهان پایینتر از حدی بود که شکلگیری الکترون-پوزیترون بتواند رخ دهد. بیشتر الکترونها و پوزیترونهای باقیمانده همدیگر را نابود کردند و باعث تابش پرتو گامایی شدند که جهان را مجدداً اندکی گرمتر کرد.[۱۳۵]
به دلایلی که هنوز نامشخص است در حین فرایند لپتونزایی شمار الکترونها نسبت به پوزیترونها اندکی فزونی یافت.[۱۳۶] در نتیجه در حدود یک الکترون از هر یک میلیارد الکترون از فرایند نابودسازی نجات یافت. این مقدار اضافی با مقدار پروتونهای اضافی نسبت به پادپروتونها در شرایطی به نام عدم تقارن باریون برابر بود و در نتیجه بار خالص جهان صفر بود.[۱۳۷][۱۳۸] پروتونها و نوترونهای باقیمانده، در فرایندی به نام هستهزایی (سنتز هستهای) شروع به واکنش با یکدیگر و تشکیل ایزوتوپهای هلیم و هیدروژن و مقادیر اندکی لیتیم نمودند. این فرایند پس از حدود ۵ دقیقه به اوج رسید.[۱۳۹] همه نوترونهای باقیماندهای دچار واپاشی بتای منفی با نیمه عمر ۱۰۰۰ ثانیه شدند و طی این فرایند هرکدام یک پروتون و یک الکترون آزاد کردند:
تا ۳۰۰۰۰۰–۴۰۰۰۰۰ سال بعدی، الکترونهای اضافی پرانرژیتر از آن بودند که در بند هستههای اتمی بیفتند.[۱۴۰] در پی آن دورهای به نام دوره بازترکیب آغاز شد که طی آن اتمهای خنثی شکل گرفتند و جهان در حال انبساط نسبت به تابش شفاف شد.[۱۴۱]
تقریباً یک میلیون سال پس از مهبانگ، نخستین نسل از ستارهها شروع به شکل گرفتن نمودند.[۱۴۱] در درون ستارهها، هستهزایی ستارهای منجر به تولید پوزیترونها از همجوشی هستههای اتمی میشود. این ذرات پادماده بلافاصله توسط الکترونها نابود میشوند و پرتو گاما آزاد میکنند. نتیجه نهایی این فرایند یک کاهش پایدار در شمار الکترونها و به همان میزان افزایش تعداد نوترونهاست، اما فرایند تکامل ستارگان ممکن است منجر به سنتز ایزوتوپهای رادیواکتیو شود. ایزوتوپهای انتخاب شده ممکن است دچار واپاشی بتای منفی شوند و یک الکترون و یک پادنوترینو از هسته منتشر کنند.[۱۴۲]
مثلاً ایزوتوپ کبالت-۶۰ (60Co) واپاشی میشود و به نیکل-۶۰ (60
Ni) تبدیل میشود.[۱۴۳]

ستارهای که جرمی بیش از ۲۰ جرم خورشیدی داشتهباشد، در پایان دوران عمرش ممکن است دچار رمبش گرانشی شود و سیاهچاله تشکیل دهد.[۱۴۴] طبق فیزیک کلاسیک این اجسام پرجرم ستارهای نیروی جاذبه گرانشی اعمال میکنند که آنقدر قدرتمند است که هیچ چیز حتی تابش الکترومغناطیسی یارای گریختن ار شعاع شوارتزشیلد را ندارد. اما در فیزیک کوانتومی گمان میرود که آثار مکانیک کوانتومی این پتانسیل را دارند که اجازه بدهند تابش هاوکینگ از ان منتشر شود. چنین تصور میشود که در افق رویداد این بقایای ستارهای الکترون (و پوزیترون) تولید میشود.
وقتی جفتهای ذرات مجازی (مثلاً الکترون و پروتون) در درون افق رویداد بهوجود میآیند، توزیع فضایی تصادفی این ذرات ممکن است سبب شود که یکی از آنها در خارج از افق رویداد بهوجود آید. این فرایند را تونلزنی کوانتومی میگویند، سپس پتانسیل گرانشی این سیاهچاله ممکن است انرژی لازم برای تبدیل این ذره مجازی به ذره حقیقی را فراهم کند و باعث تابش آن در فضا شود.[۱۴۵] در عوض، عضو دیگر این جفت انرژی منفی دریافت میکند که باعث کاهش جرم-انرژی سیاهچاله میشود. با کاهش جرم سرعت تابش هاوکینگ بیشتر میشود و باعث تبخیر سیاهچاله میشود تا سرانجام منفجر شود.[۱۴۶]
پرتوهای کیهانی ذراتی هستند که با انرژی بالا در فضا حرکت میکنند. رویدادهای انرژی به بزرگی ۳٫۰×۱۰۲۰ eV ثبت شدهاست.[۱۴۷] وقتی این ذرات با نوکلئونهای جو زمین برخورد میکنند، دوشی از ذرات از جمله پیونها تشکیل میشود. بیش از نیمی از پرتوهای کیهانی مشاهدهشده از زمین از میونها تشکیل میشود. میون یکی از اعضای خانواده لپتونهاست که در اتمسفر بالایی بر اثر واپاشی پیونها به وجود میآید.
میون نیز به نوبه خود میتواند به یک الکترون یا پوزیترون واپاشی شود.[۱۴۸]
مشاهده[ویرایش]

مشاهدات از راه دور الکترونها نیازمند آشکارسازی انرژی تابشی آنهاست. مثلاً در محیطهای پرانرژی مانند تاج خورشیدی یک ستاره الکترونهای آزاد تشکیل پلاسمایی میدهند که تابش ترمزی منتشر میکند. گاز الکترون ممکن است دچار نوسان پلاسما شود. نوسان پلاسما به موجهایی گفته میشود که بر اثر تغیرات همزمان در چگالی الکترونها پدید میآیند و اینها تولید انرژی میکنند که توسط رادیوتلسکوپها قابل ردیابی اسنت.[۱۵۰]
بسامد یک فوتون متناسب با انرژی آن است. وقتی که یک الکترون مقید بین سطوح مختلف انرژی در اتم انتقال مییابد، فوتونهای با بسامد مشخصی را جذب یا نشر میکنند. مثلاً وقتی اتمها تحت تابش از سوی منبعی با طیف گسترده قرار گیرند، خطوط جذبی متمایزی در طیف تابش منتقلشده پدیدار میشوند. هر عنصر یا مولکولی مجموعه مشخصی از خطوط طیفی خاص خود را دارد؛ مثلاً خطوط طیفی هیدروژن. اندازهگیریهای طیفبینی قدرت و پهنای این خطوط، این امکان را فراهم میآورد که ترکیب و ویژگیهای فیزیکی یک ماده را تعیین نمود.[۱۵۱][۱۵۲]
در شرایط آزمایشگاهی، برهمکنشهای الکترونهای منفرد را میتوان با استفاده از آشکارسازهای ذرات مشاهده نمود، که امکان اندازهگیری ویژگیهای خاصی مانند انرژی، اسپین و بار را فراهم میکند.[۱۱۱] با پیدایش روشهایی مانند دام پل یا دام پنینگ میتوان درات باردار را در فضای کوچکی برای مدتی طولانی نگاه داشت. این کار امکان اندازهگیری دقیق ویژگیهای ذره را فراهم میکند.[۱۵۳] مثلاً در یک نمونه، با استفاده از دام پنینگ، یک الکترون به مدت ده ماه در محفظهای دربرگرفته شد.[۱۵۳] گشتاور مغناطیسی الکترون در این تلاش، تا ۱۱ رقم دقت تعیین شد که در سال ۱۹۸۰ دقیقترین مقدار در بین مقادیر ثابتهای فیزیکی بهشمار میآمد.[۱۵۴]
نخستین تصاویر ویدئویی از توزیع انرژی یک الکترون در فوریه ۲۰۰۸، توسط تیمی در دانشگاه لوند سوئد گرفته شد. دانشمندان از فلاشهای بسیار کوتاهمدت نور که به پالسهای اتوثانیهای مشهورند استفاده کردند که اجازه مشاهده حرکت الکترون را برای نخستین بار ممکن ساخت.[۱۵۵][۱۵۶]
توزیع الکترون در مواد جامد را میتوان با استفاده از روش طیفنگاری ایآرپیئیاس (ARPES) تصویر نمود. این تکنیک از اثر فوتوالکتریک بهره میبرد تا فضای دوجانبه را اندازه بگیرد. با استفاده از ایآرپیئیاس میتوان جهت، سرعت و پراکندگی الکترون را در درون مواد تعیین نمود.[۱۵۷]
کاربردها[ویرایش]
پرتوهای ذرهای[ویرایش]

از پرتوهای الکترونی در نوعی جوشکاری با نام جوشکاری با تشعشعات الکترونی استفاده میشود.[۱۵۹] با این پرتوها میتوان چگالی بالایی از انرژی تا ۱۰۷ W·cm−۲ را در نوار باریکی به قطر ۱٫۱–۱٫۳ mm متمرکز نمود و معمولاً نیازی به ماده پرکننده نیز ندارند. این شیوه جوشکاری باید در خلاء انجام شود تا از برهمکنش میان الکترونها و مولکولهای گازها پیش از رسیدن به هدف جلوگیری شود و میتوان از آن برای جوش دادن مواد رسانایی استفاده نمود که بدون این روش، مواد مناسبی برای جوشکاری نیستند.[۱۶۰][۱۶۱]
طرح نگاری الکترونی (EBL) نام روشی برای قلمزنی نیمرساناها (نیمههادیها) در دقتهایی در مقیاسهای کوچکتر از یک میکرومتر است.[۱۶۲] محدودیتهای این تکنیک هزینه بالا، کند بودن، نیاز به خلاء برای کار کردن و تمایل الکترونها به پراکندگی در جامدات است. مشکل آخری دقت را به ۱۰ نانومتر محدود میکند، به همین دلیل از روش EBL بیشتر برای تولید برخی از مدارهای مجتمع ویژه در تعداد اندک استفاده میشود.[۱۶۳]
از روش پردازش پرتو الکترونی برای پرتوافکنی به مواد جهت تغییر ویژگیهای فیزیکی یا استریلیزه کردن محصولات غذایی و پزشکی استفاده میشود.[۱۶۴] پرتوهای الکترونی در تابشهای شدید باعث شارهای شدن یا شبه ذوب شیشه، بدون افزایش قابل توجهی در دمای آن میشوند: مثلاً تابش شدید الکترون باعث مرتبه بزرگی کاهش در ویسکوزیته و کاهش انرژی فعالسازی آن میشود.[۱۶۵]
در پرتودرمانی، از شتابدهندههای خطی ذرات برای تولید پرتوهای الکترونی در درمان تومورهای سطحی استفاده میشود. با الکترون درمانی میتوان بیماریهای پوستی مانند سرطان سلول پایهای را درمان نمود زیرا الکترون پیش از جذب شدن تنها تا عمق محدودی (معمولاً برای الکترونهایی با انرژی ۵–۲۰ مگاالکترونولت، تا عمق ۵ سانتیمتر) میتواند نفوذ کند. از پرتو الکترون میتوان برای تکمیل درمان در نواحی که مورد تابش پرتو ایکس قرارگرفتهاند استفاده نمود.[۱۶۶][۱۶۷]
شتابدهندههای ذرات از میدانهای الکتریکی برای راندن الکترونها و پادذراتشان در انرژیهای بالا استفاده میکنند. این ذرات در هنگام گذر از میدانهای مغناطیسی تابش سینکروترون منتشر میکنند. وابستگی شدت این تابش به اسپین، باعث قطبش پرتو الکترونی میشود (فرایندی که با نام اثر اسکولوف-ترنوف شناخته میشود).[note ۸] پرتوهای الکترونی تابیدهشده میتواند در آزمایشهای مختلفی سودمند واقع شود. تابش سینکروترون همچنین میتواند باعث سرد شدن پرتوهای الکترونی شود و بدین ترتیب، پخش تکانه میان ذرات را کاهش دهد. وقتی الکترون و پوزیترون طوری شتاب بگیرند که به انرژی مورد نیاز برسند، پرتوهای الکترونی و پوزیترونی با هم برخورد میکنند؛ آشکارسازهای ذرات انرژیهای منتشره ناشی از برخوردها را که موضوع مطالعه فیزیک ذرات است، مشاهده میکنند.[۱۶۸]
تصویربرداری[ویرایش]
پراش الکترونی کمانرژی (LEED) شیوهای برای بمباران یک ماده کریستالی با یک پرتو الکترونی موازیشده و سپس مشاهده الگوهای پراکندگی حاصله برای تعیین ساختار ماده است. انرژی مورد نیاز برای الکترون معمولاً در محدوده ۲۰–۲۰۰ الکترونولت است.[۱۶۹] تکنیک پراش الکترونی پرانرژی بازتابی (RHEED) از بازتاب یک پرتو از الکترونهایی که از زوایای پایین مختلف پرتاب میشوند تا ویژگیهای سطحی مواد کریستالی را مشخص کند. انرژی پرتو مورد استفاده در این روش معمولاً ۸–۲۰ کیلو الکترونولت و زوایای پرتاب ۱–۴ درجه است.[۱۷۰][۱۷۱]
میکروسکوپ الکترونی یک پرتو متمرکز را به سوی یک نمونه هدایت میکند. در نتیجه برهمکنش پرتو با ماده، برخی از الکترونها ویژگیهایشان مانند حرکت، جهت، زاویه، فاز نسبی و انرژی تغییر میکند. میکروسکوپیستها میتوانند این تغییرات را ثبت کنند تا تصاویر با دقت اتمی از ماده تولید کنند.[۱۷۲] در نور آبی، دقت میکروسکوپهای نوری متعارف به دلیل پراکندگی معمولاً محدود به ۲۰۰ نانومتر است.[۱۷۳] در مقایسه، میکروسکوپهای الکترونی محدود به طول موج دوبروی الکترون هستند. این طول موج مثلاً برای الکترونهایی که توسط یک پتانسیل ۱۰۰۰۰۰ ولتی شتاب گرفتهاند، برابر با ۰٫۰۰۳۷ نانومتر است.[۱۷۴] میکروسکوپ انحراف-اصلاحشده الکترونی عبوری تا دقت ۰٫۰۵ نانومتر را ارائه میدهد که برای مشاهده اتمها حتی بیش از حد نیاز است.[۱۷۵] این ویژگی سبب میشود که میکروسکوپ الکترونی وسیله آزمایشگاهی مفیدی برای تصویربرداری با دقت بالا باشد؛ هرجند که میکروسکوپهای الکترونی وسایل گرانقیمتی هستند و نگهداری آنها پرهزینه است.
دو نوع اصلی از میکروسکوپهای الکترونی وجود دارد: عبوری و روبشی. میکروسکوپهای الکترونی عبوری مانند پروژکتور آموزشی (اورهد) عمل میکنند، بدین صورت که پرتوی از الکترونها را از برشی از ماده عبور میدهند و سپس آن را توسط لنزهایی روی اسلاید عکاسی یا یک دستگاه بارجفتشده تصویر میکنند. میکروسکوپهای الکترونی روبشی، مانند یک دستگاه تلویزیون، یک پرتو الکترون بسیار متمرکز را در گستره نمونه مورد مطالعه، روبش شطرنجی (اسکن) میکنند تا تصویر را تولید کنند. بزرگنمایی برای هر دونوع میکروسکوپ در محدوده ۲۰۰ تا ۱۰۰۰۰۰۰ برابر یا بیشتر تغییر میکند. میکروسکوپ تونلی روبشی، از تونلزنی کوانتومی الکترونها از یک نوک تیز فلزی به نمونه مورد مطالعه استفاده میکند تا تصاویری با دقت اتمی از سطح آن تهیه کند.[۱۷۶][۱۷۷][۱۷۸]
سایر کاربردها[ویرایش]
در لیزر الکترون آزاد (FEL) یک پرتو الکترون نسبیتی از میان یک جفت دستگاه نوسانساز میگذرد که شامل آرایهای از آهنرباهای دوقطبی هستند که جهت میدانهایشان متناوباً تغییر میکند. الکترونها تابش سینکروترون منتشر میکنند که به شکل همدوسی با همان الکترونها برهمکنش میکند تا میدان تابش را به شدت در بسامد تشدید تقویت کنند. لیزر الکترون آزاد میتواند یک تابش پرتلالو همدوس الکترومغناطیسی، با دامنه گستردهای از بسامدها، از ریزموجها تا پرتو ایکس منتشر کند. این دستگاه میتوانند در ارتباطات، تولید و پزشکی کاربردهای مختلفی داشته باشند که از جمله آنها میتوان به جراحی بافتهای نرم اشاره نمود.[۱۷۹]
الکترونها نقش بسیار مهمی در لامپهای پرتو کاتدی که به گستردگی در دستگاههای نمایش در تجهیزات آزمایشگاهی، نمایشگرهای رایانهها و ست تلویزیون استفاده میشوند، دارند.[۱۸۰] دریک لامپ افزاینده فوتوالکتریک، هر فوتونی که فوتوکاتد برخورد میکند بارانی از الکترونها را آغاز میکند که پالس جریانی قابل ردیابی تولید میکنند.[۱۸۱] لامپهای خلاء از جریان الکترونها برای دستکاری سیگنالهای الکتریکی استفاده میکنند و نقش بسیار مهمی در گسترش فناوری الکترونیک داشتند. هرچند که جای خود را به دستگاههای حالت جامد مانند ترانزیستورها دادند.[۱۸۲]
جستارهای وابسته[ویرایش]
- آنیون
- الکتراید
- حباب الکترون
- انتشار اگزوالکترون
- فاکتور جی (فیزیک)
- سامانههای تناوبی مولکولهای کوچک
- اسپینترونیک
- آزمایش اشترن-گرلاخ
- تخلیه بار تاونسند
- اثر زیمان
- فهرست ذرات بنیادی
- لپتون
- ترکیبات الکترونی
- پراکندگی الکترونی
- الکترونگاتیوی
- الکترونخواهی
- عدد کوانتومی الکترون
- تابع موج
- اوربیتال اتمی
- اوربیتال مولکولی
- مولکول
- اتم
- الکترونگاتیوی
یادداشتها[ویرایش]
- ↑ در شکل کسری آن مخرج برابر با معکوس مقدار اعشاری آن است (که عدم قطعیت استاندارد نسبی برابر با ۴٫۲×۱۰−۱۳ u دارد).
- ↑ بار الکترون برابر با بار بنیادی است که علامت آن برای الکترون منفی و برای پروتون مثبت است.
- ↑ این مقدار از عدد کوانتومی اسپین به شکل زیر به دست میآید
رجوع کنید به: Gupta, M.C. (2001). Atomic and Molecular Spectroscopy. New Age Publishers. p. 81. ISBN 81-224-1300-5. - ↑ مگنتون بور:
- ↑ شعاع کلاسیک الکترون بدین صورت نتیجهگیری میشود که در ادامه خواهد آمد. فرض کنید بار الکترون به شکل یکنواخت در یک حجم کروی پراکنده شدهاست. از آنجا که یک بخش از کره بخشهای دیگر را دفع میکند، کره شامل انرژی پتانسیل الکترواستاتیک است. فرض میشود که این انرژی برابر با انرژی سکون الکترون است که توسط نسبیت خاص تعریف میشود (E = mc2).
طبق نظریه الکترواستاتیک، انرژی پتانسیل کرهای به شعاع r و بار e توسط رابطه زیر به دست میآید:
See: Haken, H.; Wolf, H.C.; Brewer, W.D. (2005). The Physics of Atoms and Quanta: Introduction to Experiments and Theory. Springer. p. 70. ISBN 3-540-67274-5. - ↑ تابش الکترونهای غیر نسبیتی را گاهی با نام تابش سیکلوترون میشناسند.
- ↑ تغییر در طول موج، Δλ, بستگی به زاویه سیمپیچ θ دارد، به این صورت:
- ↑ The polarization of an electron beam means that the spins of all electrons point into one direction. In other words, the projections of the spins of all electrons onto their momentum vector have the same sign.
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ Farrar, W.V. (1969). "Richard Laming and the Coal-Gas Industry, with His Views on the Structure of Matter". Annals of Science. 25: 243–۲۵۴. doi:10.1080/00033796900200141.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. pp. 70–۷۴. ISBN 0-226-02421-0.
- ↑ Buchwald, J.Z.; Warwick, A. (2001). Histories of the Electron: The Birth of Microphysics. MIT Press. pp. 195–203. ISBN 0-262-52424-4.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ ۴٫۴ ۴٫۵ Thomson, J.J. (1897). "Cathode Rays". Philosophical Magazine. 44 (269): 293. doi:10.1080/14786449708621070.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ ۵٫۳ P.J. Mohr, B.N. Taylor, and D.B. Newell (2011), "The 2010 CODATA Recommended Values of the Fundamental Physical Constants" (Web Version 6.0). This database was developed by J. Baker, M. Douma, and S. Kotochigova. Available: http://physics.nist.gov/constants [Thursday, 02-Jun-2011 21:00:12 EDT]. National Institute of Standards and Technology, Gaithersburg, MD 20899.
- ↑ «الکترون» [شیمی، فیزیک] همارزِ «electron»؛ منبع: گروه واژهگزینی. جواد میرشکاری، ویراستار. دفتر اول. فرهنگ واژههای مصوب فرهنگستان. تهران: انتشارات فرهنگستان زبان و ادب فارسی. شابک ۹۶۴-۷۵۳۱-۳۱-۱ (ذیل سرواژهٔ الکترون)
- ↑ "JERRY COFF". Retrieved 10 September 2010.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. p. 74. ISBN 0-521-53635-9.
- ↑ ۹٫۰ ۹٫۱ Eichten, E.J.; Peskin, M.E.; Peskin, M. (1983). "New Tests for Quark and Lepton Substructure". Physical Review Letters. 50 (11): 811–814. Bibcode:1983PhRvL..50..811E. doi:10.1103/PhysRevLett.50.811.
- ↑ ۱۰٫۰ ۱۰٫۱ "CODATA value: proton-electron mass ratio". 2006 CODATA recommended values. National Institute of Standards and Technology. Retrieved 2009-07-18.
- ↑ Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. pp. 236–237. ISBN 0-691-13512-6.
- ↑ ۱۲٫۰ ۱۲٫۱ Pauling, L.C. (1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry (3rd ed.). Cornell University Press. pp. 4–10. ISBN 0-8014-0333-2.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ Dahl (1997:122–185).
- ↑ ۱۴٫۰ ۱۴٫۱ Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. p. 138. ISBN 0-7484-0748-0.
- ↑ Shipley, J.T. (1945). Dictionary of Word Origins. The Philosophical Library. p. 133. ISBN 0-88029-751-4.
- ↑ Baigrie, B. (2006). Electricity and Magnetism: A Historical Perspective. Greenwood Press. pp. 7–۸. ISBN 0-313-33358-0.
- ↑ Keithley, J.F. (1999). The Story of Electrical and Magnetic Measurements: From 500 B.C. to the 1940s. Institute of Electrical and Electronics Engineers. ISBN 0-7803-1193-0.
- ↑ "Benjamin Franklin (۱۷۰۶–۱۷۹۰)". Eric Weisstein's World of Biography. Wolfram Research. Retrieved 2010-12-16.
- ↑ Myers, R.L. (2006). The Basics of Physics. Greenwood Publishing Group. p. 242. ISBN 0-313-32857-9.
- ↑ Barrow, J.D. (1983). "Natural Units Before Planck". Quarterly Journal of the Royal Astronomical Society. 24: 24–۲۶. Bibcode:1983QJRAS..24...24B.
- ↑ Stoney, G.J. (1894). "Of the "Electron," or Atom of Electricity". Philosophical Magazine. 38 (5): 418–۴۲۰.
- ↑ Sōgo Okamura (1994). History of Electron Tubes. IOS Press. p. 11. ISBN 978-90-5199-145-1. Retrieved 29 May 2015.
In 1881, Stoney named this electromagnetic 'electrolion'. It came to be called 'electron' from 1891. [...] In 1906, the suggestion to call cathode ray particles 'electrions' was brought up but through the opinion of Lorentz of Holland 'electrons' came to be widely used.
- ↑ Stoney, G.J. (1894). "Of the "Electron," or Atom of Electricity". Philosophical Magazine. 38 (5): 418–420. doi:10.1080/14786449408620653.
- ↑ "electron, n.2". OED Online. March 2013. Oxford University Press. Accessed 12 April 2013 [۱]
- ↑ Soukhanov, A.H. (1986). Word Mysteries & Histories. Houghton Mifflin Company. p. 73. ISBN 0-395-40265-4.
- ↑ Guralnik, D.B. (1970). Webster's New World Dictionary. Prentice Hall. p. 450.
- ↑ Born, M.; Blin-Stoyle, R.J.; Radcliffe, J.M. (1989). Atomic Physics. Courier Dover. p. 26. ISBN 0-486-65984-4.
- ↑ Dahl (۱۹۹۷:55–58).
- ↑ DeKosky, R.K. (1983). "William Crookes and the quest for absolute vacuum in the 1870s". Annals of Science. 40 (1): 1–۱۸. doi:10.1080/00033798300200101.
- ↑ ۳۰٫۰ ۳۰٫۱ ۳۰٫۲ Leicester, H.M. (1971). The Historical Background of Chemistry. Courier Dover. pp. 221–222. ISBN 0-486-61053-5.
- ↑ Dahl (1997:64–78).
- ↑ Zeeman, P. (1907). "Sir William Crookes, F.R.S." Nature. 77 (1984): 1–۳. Bibcode:1907Natur..77....1C. doi:10.1038/077001a0.
- ↑ Dahl (۱۹۹۷:99).
- ↑ Frank Wilczek: "Happy Birthday, Electron" Scientific American, June 2012.
- ↑ Thomson, J.J. (1906). "Nobel Lecture: Carriers of Negative Electricity" (PDF). The Nobel Foundation. Archived from the original (PDF) on 10 October 2008. Retrieved 2008-08-25.
- ↑ Trenn, T.J. (1976). "Rutherford on the Alpha-Beta-Gamma Classification of Radioactive Rays". Isis. 67 (1): 61–۷۵. doi:10.1086/351545. JSTOR ۲۳۱۱۳۴.
- ↑ Becquerel, H. (1900). "Déviation du Rayonnement du Radium dans un Champ Électrique". Comptes Rendus de l'Académie des Sciences. 130: 809–۸۱۵. (فرانسوی)
- ↑ Buchwald and Warwick (۲۰۰۱:90–91).
- ↑ Myers, W.G. (1976). "Becquerel's Discovery of Radioactivity in ۱۸۹۶". ژورنال آو نوکلیر مدیسین. 17 (7): 579–۵۸۲. PMID 775027.
- ↑ Kikoin, I.K.; Sominskiĭ, I.S. (1961). "Abram Fedorovich Ioffe (on his eightieth birthday)". Soviet Physics Uspekhi. 3: 798–۸۰۹. Bibcode:1961SvPhU...3..798K. doi:10.1070/PU1961v003n05ABEH005812. Original publication in Russian: Кикоин, И. К.; Соминский, М. С. (1960). "Академик А. Ф. Иоффе" (PDF). Успехи Физических Наук. 72 (10): 303–۳۲۱.
- ↑ Millikan, R.A. (1911). "The Isolation of an Ion, a Precision Measurement of its Charge, and the Correction of Stokes' Law". Physical Review. 32 (2): 349–۳۹۷. Bibcode:1911PhRvI..32..349M. doi:10.1103/PhysRevSeriesI.32.349.
- ↑ Das Gupta, N.N.; Ghosh, S.K. (1999). "A Report on the Wilson Cloud Chamber and Its Applications in Physics". Reviews of Modern Physics. 18: 225–۲۹۰. Bibcode:1946RvMP...18..225G. doi:10.1103/RevModPhys.18.225.
- ↑ ۴۳٫۰ ۴۳٫۱ ۴۳٫۲ Smirnov, B.M. (2003). Physics of Atoms and Ions. Springer. pp. 14–۲۱. ISBN 0-387-95550-X.
- ↑ Bohr, N. (1922). "Nobel Lecture: The Structure of the Atom" (PDF). The Nobel Foundation. Retrieved 2008-12-03.
- ↑ Lewis, G.N. (1916). "The Atom and the Molecule". جکس (ژورنال). 38 (4): 762–۷۸۶. doi:10.1021/ja02261a002.
- ↑ ۴۶٫۰ ۴۶٫۱ Arabatzis, T.; Gavroglu, K. (1997). "The chemists' electron". European Journal of Physics. 18: 150–۱۶۳. Bibcode:1997EJPh...18..150A. doi:10.1088/0143-0807/18/3/005.
- ↑ Langmuir, I. (1919). "The Arrangement of Electrons in Atoms and Molecules". جکس (ژورنال). 41 (6): 868–۹۳۴. doi:10.1021/ja02227a002.
- ↑ Scerri, E.R. (2007). The Periodic Table. Oxford University Press. pp. 205–۲۲۶. ISBN 0-19-530573-6.
- ↑ Massimi, M. (2005). Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. انتشارات دانشگاه کمبریج. pp. 7–۸. ISBN 0-521-83911-4.
- ↑ Uhlenbeck, G.E.; Goudsmith, S. (1925). "Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons". Die Naturwissenschaften. 13 (47). Bibcode:1925NW.....13..953E. doi:10.1007/BF01558878. (آلمانی)
- ↑ Pauli, W. (1923). "Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes". انجمن فیزیک آلمان. 16 (1): 155–۱۶۴. Bibcode:1923ZPhy...16..155P. doi:10.1007/BF01327386. (آلمانی)
- ↑ ۵۲٫۰ ۵۲٫۱ de Broglie, L. (1929). "Nobel Lecture: The Wave Nature of the Electron" (PDF). The Nobel Foundation. Retrieved 2008-08-30.
- ↑ Falkenburg, B. (2007). Particle Metaphysics: A Critical Account of Subatomic Reality. Springer. p. 85. ISBN 3-540-33731-8.
- ↑ Davisson, C. (1937). "Nobel Lecture: The Discovery of Electron Waves" (PDF). The Nobel Foundation. Retrieved 2008-08-30.
- ↑ Schrödinger, E. (1926). "Quantisierung als Eigenwertproblem". Annalen der Physik. 385 (13): 437–۴۹۰. Bibcode:1926AnP...385..437S. doi:10.1002/andp.19263851302. (آلمانی)
- ↑ Rigden, J.S. (2003). Hydrogen. Harvard University Press. pp. 59–۸۶. ISBN 0-674-01252-6.
- ↑ Reed, B.C. (2007). Quantum Mechanics. Jones & Bartlett Publishers. pp. 275–۳۵۰. ISBN 0-7637-4451-4.
- ↑ Dirac, P.A.M. (1928). "The Quantum Theory of the Electron". Proceedings of the Royal Society of London A. 117 (778): 610–۶۲۴. Bibcode:1928RSPSA.117..610D. doi:10.1098/rspa.1928.0023.
- ↑ Dirac, P.A.M. (1933). "Nobel Lecture: Theory of Electrons and Positrons" (PDF). The Nobel Foundation. Retrieved 2008-11-01.
- ↑ Kragh, H. (2002). Quantum Generations: A History of Physics in the Twentieth Century. Princeton University Press. p. 132. ISBN 0-691-09552-3.
- ↑ Gaynor, F. (1950). Concise Encyclopedia of Atomic Energy. The Philosophical Library. p. 117.
- ↑ خ "The Nobel Prize in Physics ۱۹۶۵". The Nobel Foundation. Retrieved 2008-11-04.
- ↑ Panofsky, W.K.H. (1997). "The Evolution of Particle Accelerators & Colliders" (PDF). Beam Line. Stanford University. 27 (1): 36–۴۴. Retrieved 2008-09-15.
- ↑ Elder, F.R. (1947). "Radiation from Electrons in a Synchrotron". Physical Review. 71 (11): 829–۸۳۰. Bibcode:1947PhRv...71..829E. doi:10.1103/PhysRev.71.829.5.
- ↑ Hoddeson, L. (1997). The Rise of the Standard Model: Particle Physics in the 1960s and 1970s. Cambridge University Press. pp. 25–۲۶. ISBN 0-521-57816-7.
- ↑ Bernardini, C. (2004). "AdA: The First Electron–Positron Collider". Physics in Perspective. 6 (2): 156–۱۸۳. Bibcode:2004PhP.....6..156B. doi:10.1007/s00016-003-0202-y.
- ↑ "Testing the Standard Model: The LEP experiments". CERN. 2008. Retrieved 2008-09-15.
- ↑ "LEP reaps a final harvest". CERN Courier. 40 (10). 2000. Retrieved 2008-11-01.
- ↑ Prati, E.; De Michielis, M.; Belli, M.; Cocco, S.; Fanciulli, M.; Kotekar-Patil, D.; Ruoff, M.; Kern, D. P.; Wharam, D. A.; Verduijn, J.; Tettamanzi, G. C.; Rogge, S.; Roche, B.; Wacquez, R.; Jehl, X.; Vinet, M.; Sanquer, M. (2012). "Few electron limit of n-type metal oxide semiconductor single electron transistors". Nanotechnology. 23 (21): 215204. arXiv:1203.4811. Bibcode:2012Nanot..23u5204P. doi:10.1088/0957-4484/23/21/215204. PMID 22552118.
- ↑ Frampton, P.H.; Hung, P.Q.; Sher, Marc (2000). "Quarks and Leptons Beyond the Third Generation". Physics Reports. 330 (5–6): 263–348. arXiv:hep-ph/9903387. Bibcode:2000PhR...330..263F. doi:10.1016/S0370-1573(99)00095-2.
- ↑ ۷۱٫۰ ۷۱٫۱ ۷۱٫۲ Raith, W.; Mulvey, T. (2001). Constituents of Matter: Atoms, Molecules, Nuclei and Particles. CRC Press. pp. 777–781. ISBN 0-8493-1202-7.
- ↑ ۷۲٫۰ ۷۲٫۱ ۷۲٫۲ ۷۲٫۳ ۷۲٫۴ ۷۲٫۵ ۷۲٫۶ ۷۲٫۷ ۷۲٫۸ The original source for CODATA is Mohr, P.J.; Taylor, B.N.; Newell, D.B. (2006). "CODATA recommended values of the fundamental physical constants". Reviews of Modern Physics. 80 (2): 633–730. arXiv:0801.0028. Bibcode:2008RvMP...80..633M. doi:10.1103/RevModPhys.80.633.
- Individual physical constants from the CODATA are available at: "The NIST Reference on Constants, Units and Uncertainty". National Institute of Standards and Technology. Retrieved 2009-01-15.
- ↑ Zombeck, M.V. (2007). Handbook of Space Astronomy and Astrophysics (3rd ed.). Cambridge University Press. p. 14. ISBN 0-521-78242-2.
- ↑ Murphy, M.T.; et al. (2008). "Strong Limit on a Variable Proton-to-Electron Mass Ratio from Molecules in the Distant Universe". Science. 320 (5883): 1611–1613. arXiv:0806.3081. Bibcode:2008Sci...320.1611M. doi:10.1126/science.1156352. PMID 18566280.
- ↑ Zorn, J.C.; Chamberlain, G.E.; Hughes, V.W. (1963). "Experimental Limits for the Electron-Proton Charge Difference and for the Charge of the Neutron". Physical Review. 129 (6): 2566–2576. Bibcode:1963PhRv..129.2566Z. doi:10.1103/PhysRev.129.2566.
- ↑ ۷۶٫۰ ۷۶٫۱ Odom, B.; et al. (2006). "New Measurement of the Electron Magnetic Moment Using a One-Electron Quantum Cyclotron". Physical Review Letters. 97 (3): 030801. Bibcode:2006PhRvL..97c0801O. doi:10.1103/PhysRevLett.97.030801. PMID 16907490.
- ↑ Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. pp. 261–262. ISBN 0-691-13512-6.
- ↑ Gabrielse, G.; et al. (2006). "New Determination of the Fine Structure Constant from the Electron g Value and QED". فیزیکال ریویو لترز. 97 (3): 030802(1–4). Bibcode:2006PhRvL..97c0802G. doi:10.1103/PhysRevLett.97.030802.
- ↑ Eduard Shpolsky, Atomic physics (Atomnaia fizika),second edition, 1951
- ↑ Dehmelt, H. (1988). "A Single Atomic Particle Forever Floating at Rest in Free Space: New Value for Electron Radius". Physica Scripta. T22: 102–10. Bibcode:1988PhST...22..102D. doi:10.1088/0031-8949/1988/T22/016.
- ↑ Meschede, D. (2004). Optics, light and lasers: The Practical Approach to Modern Aspects of Photonics and Laser Physics. Wiley-VCH. p. 168. ISBN 3-527-40364-7.[پیوند مرده]
- ↑ Steinberg, R.I.; et al. (1999). "Experimental test of charge conservation and the stability of the electron". Physical Review D. 61 (2): 2582–2586. Bibcode:1975PhRvD..12.2582S. doi:10.1103/PhysRevD.12.2582.
- ↑ J. Beringer (Particle Data Group); et al. (2012). "Review of Particle Physics: [electron properties]" (PDF). Physical Review D. 86 (1): 010001. Bibcode:2012PhRvD..86a0001B. doi:10.1103/PhysRevD.86.010001.
- ↑ Back, H. O.; et al. (2002). "Search for electron decay mode e → γ + ν with prototype of Borexino detector". Physics Letters B. 525: 29–40. Bibcode:2002PhLB..525...29B. doi:10.1016/S0370-2693(01)01440-X.
- ↑ ۸۵٫۰ ۸۵٫۱ ۸۵٫۲ ۸۵٫۳ ۸۵٫۴ Munowitz, M. (2005). Knowing, The Nature of Physical Law. Oxford University Press. ISBN 0-19-516737-6.>
- ↑ Kane, G. (October 9, 2006). "Are virtual particles really constantly popping in and out of existence? Or are they merely a mathematical bookkeeping device for quantum mechanics?". ساینتیفیک آمریکن. Retrieved 2008-09-19.
- ↑ Taylor, J. (1989). "Gauge Theories in Particle Physics". In Davies, Paul (ed.). The New Physics. Cambridge University Press. p. 464. ISBN 0-521-43831-4.
- ↑ ۸۸٫۰ ۸۸٫۱ Genz, H. (2001). Nothingness: The Science of Empty Space. Da Capo Press. pp. 241–243, 245–247. ISBN 0-7382-0610-5.
- ↑ Gribbin, J. (January 25, 1997). "More to electrons than meets the eye". New Scientist. Retrieved 2008-09-17.
- ↑ Levine, I.; et al. (1997). "Measurement of the Electromagnetic Coupling at Large Momentum Transfer". Physical Review Letters. 78 (3): 424–427. Bibcode:1997PhRvL..78..424L. doi:10.1103/PhysRevLett.78.424.
- ↑ Murayama, H. (March 10–17, 2006). Supersymmetry Breaking Made Easy, Viable and Generic. Proceedings of the XLIInd Rencontres de Moriond on Electroweak Interactions and Unified Theories. La Thuile, Italy. arXiv:0709.3041.—lists a 9% mass difference for an electron that is the size of the Planck distance.
- ↑ Schwinger, J. (1948). "On Quantum-Electrodynamics and the Magnetic Moment of the Electron". Physical Review. 73 (4): 416–417. Bibcode:1948PhRv...73..416S. doi:10.1103/PhysRev.73.416.
- ↑ Huang, K. (2007). Fundamental Forces of Nature: The Story of Gauge Fields. World Scientific. pp. 123–125. ISBN 981-270-645-3.
- ↑ Foldy, L.L.; Wouthuysen, S. (1950). "On the Dirac Theory of Spin 1/2 Particles and Its Non-Relativistic Limit". Physical Review. 78: 29–36. Bibcode:1950PhRv...78...29F. doi:10.1103/PhysRev.78.29.
- ↑ Sidharth, B.G. (2008). "Revisiting Zitterbewegung". International Journal of Theoretical Physics. 48 (2): 497–506. arXiv:0806.0985. Bibcode:2009IJTP...48..497S. doi:10.1007/s10773-008-9825-8.
- ↑ Elliott, R.S. (1978). "The History of Electromagnetics as Hertz Would Have Known It". IEEE Transactions on Microwave Theory and Techniques. 36 (5): 806–823. Bibcode:1988ITMTT..36..806E. doi:10.1109/22.3600.
- ↑ Crowell, B. (2000). Electricity and Magnetism. Light and Matter. pp. 129–152. ISBN 0-9704670-4-4.
- ↑ Mahadevan, R.; Narayan, R.; Yi, I. (1996). "Harmony in Electrons: Cyclotron and Synchrotron Emission by Thermal Electrons in a Magnetic Field". The Astrophysical Journal. 465: 327–337. arXiv:astro-ph/9601073. Bibcode:1996ApJ...465..327M. doi:10.1086/177422.
- ↑ Rohrlich, F. (1999). "The Self-Force and Radiation Reaction". American Journal of Physics. 68 (12): 1109–1112. Bibcode:2000AmJPh..68.1109R. doi:10.1119/1.1286430.
- ↑ Georgi, H. (1989). "Grand Unified Theories". In Davies, Paul (ed.). The New Physics. Cambridge University Press. p. 427. ISBN 0-521-43831-4.
- ↑ Blumenthal, G.J.; Gould, R. (1970). "Bremsstrahlung, Synchrotron Radiation, and Compton Scattering of High-Energy Electrons Traversing Dilute Gases". Reviews of Modern Physics. 42 (2): 237–270. Bibcode:1970RvMP...42..237B. doi:10.1103/RevModPhys.42.237.
- ↑ Staff (2008). "The Nobel Prize in Physics 1927". The Nobel Foundation. Retrieved 2008-09-28.
- ↑ Chen, S. -Y.; Maksimchuk, A.; Umstadter, D. (1998). "Experimental observation of relativistic nonlinear Thomson scattering". Nature. 396 (6712): 653–655. arXiv:physics/9810036. Bibcode:1998Natur.396..653C. doi:10.1038/25303.
- ↑ Beringer, R.; Montgomery, C.G. (1942). "The Angular Distribution of Positron Annihilation Radiation". Physical Review. 61 (5–6): 222–224. Bibcode:1942PhRv...61..222B. doi:10.1103/PhysRev.61.222.
- ↑ Buffa, A. (2000). College Physics (4th ed.). Prentice Hall. p. 888. ISBN 0-13-082444-5.
- ↑ Eichler, J. (2005). "Electron–positron pair production in relativistic ion–atom collisions". Physics Letters A. 347 (1–3): 67–72. Bibcode:2005PhLA..347...67E. doi:10.1016/j.physleta.2005.06.105.
- ↑ Hubbell, J.H. (2006). "Electron positron pair production by photons: A historical overview". Radiation Physics and Chemistry. 75 (6): 614–623. Bibcode:2006RaPC...75..614H. doi:10.1016/j.radphyschem.2005.10.008.
- ↑ Quigg, C. (June 4–30, 2000). The Electroweak Theory. TASI 2000: Flavor Physics for the Millennium. Boulder, Colorado. p. 80. arXiv:hep-ph/0204104.
- ↑ Mulliken, R.S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science. 157 (3784): 13–24. Bibcode:1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ↑ Burhop, E.H.S. (1952). The Auger Effect and Other Radiationless Transitions. انتشارات دانشگاه کمبریج. pp. 2–3. ISBN 0-88275-966-3.
- ↑ ۱۱۱٫۰ ۱۱۱٫۱ Grupen, C. (2000). "Physics of Particle Detection". AIP Conference Proceedings. 536: 3–34. arXiv:physics/9906063. doi:10.1063/1.1361756.
- ↑ Jiles, D. (1998). Introduction to Magnetism and Magnetic Materials. CRC Press. pp. 280–287. ISBN 0-412-79860-3.
- ↑ Löwdin, P.O.; Erkki Brändas, E.; Kryachko, E.S. (2003). Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per- Olov Löwdin. Springer. pp. 393–394. ISBN 1-4020-1290-X.
- ↑ McQuarrie, D.A.; Simon, J.D. (1997). Physical Chemistry: A Molecular Approach. University Science Books. pp. 325–361. ISBN 0-935702-99-7.
- ↑ Daudel, R.; et al. (1973). "The Electron Pair in Chemistry". Canadian Journal of Chemistry. 52 (8): 1310–1320. doi:10.1139/v74-201. Archived from the original on 8 January 2014. Retrieved 13 October 2015.
- ↑ Rakov, V.A.; Uman, M.A. (2007). Lightning: Physics and Effects. Cambridge University Press. p. 4. ISBN 0-521-03541-4.
- ↑ Freeman, G.R.; March, N.H. (1999). "Triboelectricity and some associated phenomena". Materials Science and Technology. 15 (12): 1454–1458. doi:10.1179/026708399101505464.
- ↑ Forward, K.M.; Lacks, D.J.; Sankaran, R.M. (2009). "Methodology for studying particle–particle triboelectrification in granular materials". Journal of Electrostatics. 67 (2–3): 178–183. doi:10.1016/j.elstat.2008.12.002.
- ↑ Weinberg, S. (2003). The Discovery of Subatomic Particles. انتشارات دانشگاه کمبریج. pp. 15–16. ISBN 0-521-82351-X.
- ↑ Lou, L. -F. (2003). Introduction to phonons and electrons. World Scientific. pp. 162, 164. ISBN 978-981-238-461-4.
- ↑ Guru, B.S.; Hızıroğlu, H.R. (2004). Electromagnetic Field Theory. Cambridge University Press. pp. 138, 276. ISBN 0-521-83016-8.[پیوند مرده]
- ↑ Achuthan, M.K.; Bhat, K.N. (2007). Fundamentals of Semiconductor Devices. Tata McGraw-Hill. pp. 49–67. ISBN 0-07-061220-X.
- ↑ Ziman, J.M. (2001). Electrons and Phonons: The Theory of Transport Phenomena in Solids. Oxford University Press. p. 260. ISBN 0-19-850779-8.
- ↑ Main, P. (June 12, 1993). "When electrons go with the flow: Remove the obstacles that create electrical resistance, and you get ballistic electrons and a quantum surprise". New Scientist. 1887: 30. Retrieved 2008-10-09.
- ↑ Blackwell, G.R. (2000). The Electronic Packaging Handbook. انتشارات سیآرسی. pp. 6.39–6.40. ISBN 0-8493-8591-1.
- ↑ Durrant, A. (2000). Quantum Physics of Matter: The Physical World. CRC Press. pp. 43, 71–78. ISBN 0-7503-0721-8.
- ↑ Staff (2008). "The Nobel Prize in Physics 1972". The Nobel Foundation. Retrieved 2008-10-13.
- ↑ Kadin, A.M. (2007). "Spatial Structure of the Cooper Pair". Journal of Superconductivity and Novel Magnetism. 20 (4): 285–292. arXiv:cond-mat/0510279. doi:10.1007/s10948-006-0198-z.
- ↑ "Discovery About Behavior Of Building Block Of Nature Could Lead To Computer Revolution". ScienceDaily. July 31, 2009. Retrieved 2009-08-01.
- ↑ Jompol, Y.; et al. (2009). "Probing Spin-Charge Separation in a Tomonaga-Luttinger Liquid". Science. 325 (5940): 597–601. arXiv:1002.2782. Bibcode:2009Sci...325..597J. doi:10.1126/science.1171769. PMID 19644117.
- ↑ Staff (2008). "The Nobel Prize in Physics 1958, for the discovery and the interpretation of the Cherenkov effect". The Nobel Foundation. Retrieved 2008-09-25.
- ↑ Staff (August 26, 2008). "Special Relativity". Stanford Linear Accelerator Center. Retrieved 2008-09-25.
- ↑ Adams, S. (2000). Frontiers: Twentieth Century Physics. CRC Press. p. 215. ISBN 0-7484-0840-1.
- ↑ Lurquin, P.F. (2003). The Origins of Life and the Universe. Columbia University Press. p. 2. ISBN 0-231-12655-7.
- ↑ Silk, J. (2000). The Big Bang: The Creation and Evolution of the Universe (3rd ed.). Macmillan. pp. 110–112, 134–137. ISBN 0-8050-7256-X.
- ↑ Christianto, V. (2007). "Thirty Unsolved Problems in the Physics of Elementary Particles" (PDF). Progress in Physics. 4: 112–114. Archived from the original (PDF) on 10 September 2008. Retrieved 13 October 2015.
- ↑ Kolb, E.W.; Wolfram, Stephen (1980). "The Development of Baryon Asymmetry in the Early Universe". Physics Letters B. 91 (2): 217–221. Bibcode:1980PhLB...91..217K. doi:10.1016/0370-2693(80)90435-9.
- ↑ Sather, E. (Spring–Summer 1996). "The Mystery of Matter Asymmetry" (PDF). Beam Line. University of Stanford. Retrieved 2008-11-01.
- ↑ Burles, S.; Nollett, K.M.; Turner, M.S. (1999). "Big-Bang Nucleosynthesis: Linking Inner Space and Outer Space". arXiv:astro-ph/9903300.
- ↑ Boesgaard, A.M.; Steigman, G. (1985). "Big bang nucleosynthesis – Theories and observations". Annual Review of Astronomy and Astrophysics. 23 (2): 319–378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535.
- ↑ ۱۴۱٫۰ ۱۴۱٫۱ Barkana, R. (2006). "The First Stars in the Universe and Cosmic Reionization". Science. 313 (5789): 931–934. arXiv:astro-ph/0608450. Bibcode:2006Sci...313..931B. doi:10.1126/science.1125644. PMID 16917052.
- ↑ Burbidge, E.M.; et al. (1957). "Synthesis of Elements in Stars". Reviews of Modern Physics. 29 (4): 548–647. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ↑ Rodberg, L.S.; Weisskopf, V. (1957). "Fall of Parity: Recent Discoveries Related to Symmetry of Laws of Nature". Science. 125 (3249): 627–633. Bibcode:1957Sci...125..627R. doi:10.1126/science.125.3249.627. PMID 17810563.
- ↑ Fryer, C.L. (1999). "Mass Limits For Black Hole Formation". The Astrophysical Journal. 522 (1): 413–418. arXiv:astro-ph/9902315. Bibcode:1999ApJ...522..413F. doi:10.1086/307647.
- ↑ Parikh, M.K.; Wilczek, F. (2000). "Hawking Radiation As Tunneling". Physical Review Letters. 85 (24): 5042–5045. arXiv:hep-th/9907001. Bibcode:2000PhRvL..85.5042P. doi:10.1103/PhysRevLett.85.5042. PMID 11102182.
- ↑ Hawking, S.W. (1974). "Black hole explosions?". Nature. 248 (5443): 30–31. Bibcode:1974Natur.248...30H. doi:10.1038/248030a0.
- ↑ Halzen, F.; Hooper, D. (2002). "High-energy neutrino astronomy: the cosmic ray connection". Reports on Progress in Physics. 66 (7): 1025–1078. arXiv:astro-ph/0204527. Bibcode:2002astro.ph..4527H. doi:10.1088/0034-4885/65/7/201.
- ↑ Sutton, C. (August 4, 1990). "Muons, pions and other strange particles". New Scientist. Retrieved 2008-08-28.
- ↑ Wolpert, S. (July 24, 2008). "Scientists solve 30-year-old aurora borealis mystery". University of California. Archived from the original on 17 August 2008. Retrieved 2008-10-11.
- ↑ Gurnett, D.A.; Anderson, R. (1976). "Electron Plasma Oscillations Associated with Type III Radio Bursts". Science. 194 (4270): 1159–1162. Bibcode:1976Sci...194.1159G. doi:10.1126/science.194.4270.1159. PMID 17790910.
- ↑ Martin, W.C.; Wiese, W.L. (2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology. Retrieved 2007-01-08.
- ↑ Fowles, G.R. (1989). Introduction to Modern Optics. Courier Dover. pp. 227–233. ISBN 0-486-65957-7.
- ↑ ۱۵۳٫۰ ۱۵۳٫۱ Staff (2008). "The Nobel Prize in Physics 1989". The Nobel Foundation. Retrieved 2008-09-24.
- ↑ Ekstrom, P.; Wineland, David (1980). "The isolated Electron" (PDF). Scientific American. 243 (2): 91–101. doi:10.1038/scientificamerican0880-104. Retrieved 2008-09-24.
- ↑ Mauritsson, J. "Electron filmed for the first time ever" (PDF). دانشگاه لوند. Archived from the original (PDF) on March 25, 2009. Retrieved 2008-09-17.
- ↑ Mauritsson, J.; et al. (2008). "Coherent Electron Scattering Captured by an Attosecond Quantum Stroboscope". Physical Review Letters. 100 (7): 073003. arXiv:0708.1060. Bibcode:2008PhRvL.100g3003M. doi:10.1103/PhysRevLett.100.073003. PMID 18352546.
- ↑ Damascelli, A. (2004). "Probing the Electronic Structure of Complex Systems by ARPES". Physica Scripta. T109: 61–74. arXiv:cond-mat/0307085. Bibcode:2004PhST..109...61D. doi:10.1238/Physica.Topical.109a00061.
- ↑ Staff (April 4, 1975). "Image # L-1975-02972". Langley Research Center, NASA. Archived from the original on 7 December 2008. Retrieved 2008-09-20.
- ↑ Elmer, J. (March 3, 2008). "Standardizing the Art of Electron-Beam Welding". Lawrence Livermore National Laboratory. Archived from the original on 20 September 2008. Retrieved 2008-10-16.
- ↑ Schultz, H. (1993). Electron Beam Welding. Woodhead Publishing. pp. 2–3. ISBN 1-85573-050-2.
- ↑ Benedict, G.F. (1987). Nontraditional Manufacturing Processes. Manufacturing engineering and materials processing. Vol. 19. CRC Press. p. 273. ISBN 0-8247-7352-7.
- ↑ Ozdemir, F.S. (June 25–27, 1979). Electron beam lithography. Proceedings of the 16th Conference on Design automation. San Diego, CA, USA: IEEE Press. pp. 383–391. Retrieved 2008-10-16.
- ↑ Madou, M.J. (2002). Fundamentals of Microfabrication: the Science of Miniaturization (2nd ed.). CRC Press. pp. 53–54. ISBN 0-8493-0826-7.
- ↑ Jongen, Y.; Herer, A. (May 2–5, 1996). Electron Beam Scanning in Industrial Applications. APS/AAPT Joint Meeting. American Physical Society. Bibcode:1996APS..MAY.H9902J.
- ↑ Mobus G. et al. (2010). Journal of Nuclear Materials, v. 396, 264–271, doi:10.1016/j.jnucmat.2009.11.020
- ↑ Beddar, A.S.; Domanovic, Mary Ann; Kubu, Mary Lou; Ellis, Rod J.; Sibata, Claudio H.; Kinsella, Timothy J. (2001). "Mobile linear accelerators for intraoperative radiation therapy". AORN Journal. 74 (5): 700. doi:10.1016/S0001-2092(06)61769-9.
- ↑ Gazda, M.J.; Coia, L.R. (June 1, 2007). "Principles of Radiation Therapy" (PDF). Retrieved 2013-10-31.
- ↑ Chao, A.W.; Tigner, M. (1999). Handbook of Accelerator Physics and Engineering. World Scientific. pp. 155, 188. ISBN 981-02-3500-3.
- ↑ Oura, K.; et al. (2003). Surface Science: An Introduction. Springer. pp. 1–45. ISBN 3-540-00545-5.
- ↑ Ichimiya, A.; Cohen, P.I. (2004). Reflection High-energy Electron Diffraction. Cambridge University Press. p. 1. ISBN 0-521-45373-9.
- ↑ Heppell, T.A. (1967). "A combined low energy and reflection high energy electron diffraction apparatus". Journal of Scientific Instruments. 44 (9): 686–688. Bibcode:1967JScI...44..686H. doi:10.1088/0950-7671/44/9/311.
- ↑ McMullan, D. (1993). "Scanning Electron Microscopy: 1928–1965". University of Cambridge. Retrieved 2009-03-23.
- ↑ Slayter, H.S. (1992). Light and electron microscopy. Cambridge University Press. p. 1. ISBN 0-521-33948-0.
- ↑ Cember, H. (1996). Introduction to Health Physics. McGraw-Hill Professional. pp. 42–43. ISBN 0-07-105461-8.
- ↑ Erni, R.; et al. (2009). "Atomic-Resolution Imaging with a Sub-50-pm Electron Probe". فیزیکال ریویو لترز. 102 (9): 096101. Bibcode:2009PhRvL.102i6101E. doi:10.1103/PhysRevLett.102.096101. PMID 19392535.
- ↑ Bozzola, J.J.; Russell, L.D. (1999). Electron Microscopy: Principles and Techniques for Biologists. Jones & Bartlett Publishers. pp. 12, 197–199. ISBN 0-7637-0192-0.
- ↑ Flegler, S.L.; Heckman Jr., J.W.; Klomparens, K.L. (1995). Scanning and Transmission Electron Microscopy: An Introduction (Reprint ed.). Oxford University Press. pp. 43–45. ISBN 0-19-510751-9.
- ↑ Bozzola, J.J.; Russell, L.D. (1999). Electron Microscopy: Principles and Techniques for Biologists (2nd ed.). Jones & Bartlett Publishers. p. 9. ISBN 0-7637-0192-0.
- ↑ Freund, H.P.; Antonsen, T. (1996). Principles of Free-Electron Lasers. Springer. pp. 1–30. ISBN 0-412-72540-1.
- ↑ Kitzmiller, J.W. (1995). Television Picture Tubes and Other Cathode-Ray Tubes: Industry and Trade Summary. DIANE Publishing. pp. 3–5. ISBN 0-7881-2100-6.
- ↑ Sclater, N. (1999). Electronic Technology Handbook. McGraw-Hill Professional. pp. 227–228. ISBN 0-07-058048-0.
- ↑ Staff (2008). "The History of the Integrated Circuit". The Nobel Foundation. Retrieved 2008-10-18.







