بیماری پارکینسون
| پارکینسون | |
|---|---|
 | |
| تصویر رسمشده از پارکینسون توسط ویلیام گوئرز | |
| تخصص | عصبشناسی |
| فراوانی | 0.2% (کانادا) |
| طبقهبندی و منابع بیرونی | |
| آیسیدی-۱۰ | G20, F02.3 |
| آیسیدی-۹-سیام | 332 |
| اُمیم | ۱۶۸۶۰۰ 556500 |
| دادگان بیماریها | 9651 |
| مدلاین پلاس | 000755 |
| ئیمدیسین | neuro/۳۰۴ neuro/635 in young pmr/99 rehab |
| مرور ژن | |
بیماری پارکینسون (به انگلیسی: Parkinson’s Disease) به اختصار PD، اختلال پیشرونده، مخرب و درازمدت دستگاه عصبی مرکزی است که عمدتاً سیستم حرکتی بدن را مختل میکند. نشانههای این بیماری معمولاً آرام و بهتدریج ظاهر میشوند و با پیشرفت بیماری، علائم غیرحرکتی نیز بروز میکنند. آشکارترین نشانههای زودرس این بیماری عبارتند از لرزش، خشکی در حرکت بدن، آرامشدن حرکات و دشواری در راهرفتن. نشانههای شناختی و رفتاری این بیماری نیز در اغلب افراد معمولاً به شکل افسردگی، اضطراب و فقدان علاقه و هیجان بروز میکند. در مراحل پیشرفتهٔ بیماری پارکینسون، بعضاً زوال عقل نیز شایع است. فرد مبتلا به پارکینسون ممکن است مشکلاتی در خوابیدن و سیستم حواس خود نیز تجربه کند.
نشانههای حرکتی این بیماری به علت از بین رفتن سلولها در تودهٔ سیاه مغز و در نتیجه کاهش دوپامین (که یک انتقالدهندهٔ عصبی است) رخ میدهد. دوپامین برای حفظ الگوهای حرکتی طبیعی بدن اهمیت زیادی دارد و دقیقاً به همین دلیل است که بسیاری از درمانهای پارکینسون با هدف افزایش سطح دوپامین در مغز انجام میشوند. در بیماری پارکینسون، از بین رفتن نورونها (یاختههای عصبی) در سایر بخشهای مغز هم رخ میدهد و زمینهساز برخی علائم غیرحرکتی این بیماری میشود. علاوه بر کاهش دوپامین و سلولهایی که دوپامین میسازند، پروتئینی به نام آلفا-ساینوکلین هم در بیماری پارکینسون نقش دارد. آلفا-سینوکلئین در حالت عادی به برقراری ارتباط نورونها با یکدیگر کمک میکند اما در بیماری پارکینسون، این پروتئین در تودههای میکروسکوپی به نام جسم لویی کپهکپه جمع میشود. محققان بر این باورند که آلفا-سینوکلئین در پیشرفت پارکینسون نقش دارد و شاید بتوان درمانهای جدیدی ایجاد کرد که جلوی جمعشدن این پروتئین را بگیرد.[۱]
اگرچه علت بروز بیماری پارکینسون کاملاً مشخص نیست، اما میدانیم که هر دو فاکتور ژنتیکی و محیطی در بروز آن نقش دارند.[۲] از این میان میتوان به فاکتورهایی مانند افزایش سن، پیشینهٔ خانوادگی ابتلا به بیماری پارکینسون، جهشهای ژنتیکی، جنسیت، قرار گرفتن در معرض سموم دفع آفات، مصرف برخی داروها و پیشینهٔ آسیب و جراحت مغز بهعنوان عوامل بروز این بیماری اشاره کرد. مصرفکنندگان تنباکو و قهوه و چای، ریسک کمتری برای ابتلا به پارکینسون دارند.[۳][۴]
تشخیص کیسهای معمول پارکینسون عمدتاً بر اساس نشانههای این بیماری بهخصوص نشانههای حرکتی انجام میشود. از آزمایشهایی مانند تصویربرداری عصبی میتوان برای تشخیص قطعی و کنار گذاشتن سایر بیماریها استفاده کرد.[۵] پارکینسون معمولاً در افراد بالای ۶۰ سال بروز میکند. مردان بیشتر از زنان به این بیماری مبتلا میشوند و نسبت ابتلای مردان به زنان ۳ به ۲ است.[۶] پارکینسون ممکن است در افراد زیر ۵۰ سال نیز ایجاد شود که در این صورت پارکینسون زودرس خوانده میشود.[۷] طبق آمار سال ۲۰۱۵، ۶/۲ میلیون فرد در جهان مبتلا به پارکینسون هستند و این بیماری سالانه به ۱۱۷٬۴۰۰ مرگ منجر میشود. امید به زندگی متوسط پس از تشخیص این بیماری، ۷ تا ۱۵ سال است.[۸]
تا کنون راهی برای علاج و رفع پارکینسون پیدا نشده،اما روشهایی برای درمان و کاهش عوارض این بیماری وجود دارد. درمان اولیه معمولاً با تجویز داروهای لوودوپا، داروهای بازدارندهٔ مونوآمین اکسیداز، یا داروهای آگونیست دوپامین شروع میشود. با پیشرفت بیماری، اثر این داروها کمتر میشود و عوارض جانبی مانند دیسکینزی (حرکات غیرارادی عضلات) بروز میکند.[۹] در این مرحله، ممکن است داروها به صورت ترکیبی استفاده و دوز آنها افزایش داده شود.[۱۰] مشخص شدهاست که رژیم غذایی و برخی اشکال کاردرمانی در بهبود این علائم تا حدی مؤثر است.[۱۱][۱۲] در مواردی که بیمار دچار علائم شدید حرکتی است و به دارو پاسخ نمیدهد، گاهی از جراحی برای قراردادن ریز الکترونیک و تحریک عمقی مغز استفاده میشود.[۱۳] درخصوص درمان علائم غیرحرکتی پارکینسون مثل اختلال خواب و مشکلات عاطفی، شواهد کمتری در دست است.[۶]
بیماری پارکینسون نخستین بار توسط یک دانشمند بریتانیایی به نام جیمز پارکینسون در سال ۱۸۱۷ میلادی توصیف شد و بنابراین نام او را روی این بیماری گذاشتند. کارزارهای افزایش آگاهی دربارهٔ این بیماری عبارتند از روز جهانی پارکینسون (۱۱ آوریل، روز تولد جیمز پارکینسون) و استفاده از گل لالهٔ سرخ به عنوان نماد و سمبل این بیماری. افراد مبتلا به پارکینسون که آگاهی عمومی دربارهٔ این بیماری را افزایش دادهاند عبارتند از محمدعلی کلی (بوکسور مشهور)، مایکل جی. فاکس (بازیگر)، دیویس فینی (دوچرخهسوار المپیک) و آلن آلدا (بازیگر).
ردهبندی
[ویرایش]بیماری پارکینسون شایعترین نوع پارکینسونیسم است و بعضاً «پارکینسونیسم ایدیوپاتیک» نامیده میشود که یعنی پارکینسونیسم بدون علت شناختهشده.[۱۴][۱۵] دانشمندان گاهی پارکینسون را نوعی بیماری زوال عصبی به نام سینوکلئینپاتی تلقی میکنند که بر اثر تجمع غیرطبیعی پروتئین آلفا-سینوکلئین در مغز ایجاد میشود.[۱۶] ردهبندی پارکینسون به عنوان سینوکلئینپاتی، این بیماری را از سایر بیماریهای زوال عصبی مانند آلزایمر متمایز میکند زیرا در آلزایمر، نوع دیگری از پروتئین به نام پروتئین تاو در مغز جمع میشود.[۱۶]
بین بیماریهای ردهٔ تاوپاتی و سینوکلئینپاتی، همپوشانیهای بالینی و پاتولوژیک قابلتوجهی وجود دارد اما تفاوتهایی نیز به چشم میخورد. مبتلایان به بیماری آلزایمر، برخلاف مبتلایان پارکینسون، اغلب دچار از دست رفتن حافظه میشوند. نشانههای اصلی و اساسی پارکینسون (کندی حرکات، لرزش، خشکی و بیثباتی وضعیت بدن) معمولاً جزو نشانههای آلزایمر نیستند.
تا کنون تلاشهایی برای ردهبندی پارکینسون در زیرشاخههای دیگر انجام شده، بهخصوص با تمرکز بر سن بروز بیماری، پیشرفت علائم و افزایش لرزش، اما هیچیک از این ردهبندیها به صورت قطعی پذیرفته نشدهاست.[۱۷]
نشانهها و علائم پارکینسون
[ویرایش]شناختهشدهترین علائم پارکینسون، علائم حرکتی هستند. علائم غیرحرکتی شامل اختلال در دستگاه عصبی خودمختار، مشکلات عصبی-روانی (تغییر خلقوخو، تواناییهای شناختی، رفتار یا فکر)، مشکلات حسّی (بهخصوص تغییر حس بویایی) و مشکلات مربوط به خواب نیز در مبتلایان این بیماری شایع هستند. برخی از این علائم غیرحرکتی ممکن است در زمان تشخیص بیماری نیز وجود داشته باشند.
علائم حرکتی
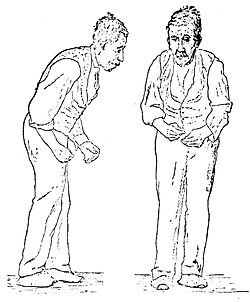
[ویرایش]پارکینسون بر پایهٔ چهار نشانهٔ اصلی بیماری مشخص میشود؛ ارتعاش و لرزش دست و پا در حال استراحت (ترمور)، کندی حرکات (برادی کنزی Bradikensi)، سختی و خشکشدن دست و پا و بدن (Regidity) و صورت ماسکیشکل (Flatface) چهار نشانهٔ اصلی پارکینسون هستند.[۱۸]
در مراحل اولیهٔ بیماری، ارتعاش اندام بهصورت ملایم و معمولاً در یک طرف بدن وجود دارد و احتیاجی به درمان نیست اما با پیشرفت بیماری، فرد دیگر قادر نیست لرزشهای شدید اندام خود را کنترل کند بهویژه هنگامی که میخواهد تمرکز بیشتری داشته باشد.
اگر دو یا بیشتر از این نشانهها در بیمار دیده شود، مخصوصاً وقتی که در یک سمت بدن بیشتر از سمت دیگر پدیدار شود، تشخیص پارکینسون داده میشود مگر اینکه نشانههای همزمان دیگری وجود داشته باشد که بیماری دیگری را نمایان کند. بیمار ممکن است در اوایل، بیماری را با لرزش دست و پا یا با ضعیف شدن حرکت احساس کند و دریابد که انجام هر کاری بیشتر از حد معمول طول میکشد یا اینکه سختی و خشکشدن حرکت دست و ضعف تعادل را تجربه میکند. نخستین نشانههای پارکینسون مجموعهای متفاوت از ارتعاش، برادیکنزیا، سفت شدن عضلات و تعادل ضعیف هستند.

تغییراتی در حالت صورت و چهره نیز روی میدهد، از جمله ثابتماندن (fixation) حالت صورت (ظاهراً احساسات کمی بر چهره نمایان میشود) یا حالت خیرگی چشم (به دلیل کاهش پلکزدن). علاوه بر اینها، خشک دن شانه یا لنگیدن پا در سمت تحت تأثیر قرار گرفته از عوارض دیگر این بیماری است. افراد مسن ممکن است نمایانشدن یک به یک این نشانههای پارکینسون را به افزایش سن ربط بدهند، ارتعاش را «لرزش» بدانند، برادیکنزیا را به «آرامشدن عادی» و سفتشدن عضلات را به «آرتروز» نسبت بدهند. حالت قوز (stooped) این بیماری را هم خیلی از این افراد به سن یا پوکی استخوان (osteoporosis) ربط میدهند. هم بیماران مسن و هم بیماران جوان ممکن است پس از بیش از یک سال که با این عوارض روبهرو بودهاند برای تشخیص به پزشک مراجعه کنند.
علائم عصبی-روانی
[ویرایش]پارکینسون میتواند منجر به مشکلات عصبی-روانی از سطح خفیف تا شدید بشود از جمله اختلالات خلقوخویی، شناختی، رفتاری و فکری.[۱۹] اختلالات شناختی ممکن است در مراحل اولیهٔ بیماری بروز کند، گاهی قبل از تشخیص، و طی روند بیماری شدیدتر شود.[۱۹] شایعترین نقص شناختی در پارکینسون، اختلال کارکردهای اجرایی است که میتواند شامل مشکل در برنامهریزی، انعطافپذیری شناختی، تفکر انتزاعی، کنترل تکانه، حافظهٔ کاری و کنترل توجه باشد.[۲۰][۲۱] دیگر مشکلات شناختی در پارکینسون عبارتند از کاهش سرعت پردازش شناختی، اختلال در بازیابی (حافظه)، اختلال در ادراک و تخمین زمان.[۲۰][۲۱] البته بازیابی اطلاعات معمولاً با دادن سرنخ به فرد، بهبود مییابد.[۲۰] اختلال در ادراک دیداری-فضایی نیز بخشی از این بیماری است و برای مثال هنگام تشخیص چهره یا فهم جهتگیری خطوط دیده میشود.[۲۰][۲۱]
فرد مبتلا به پارکینسون، دو تا شش برابر بیش از سایر افراد ریسک ابتلا به زوال عقل دارد.[۱۹][۲۰] تا ۷۸ درصد مبتلایان پارکینسون، دچار زوال عقل مربوط به این بیماری میشوند.[۲۲] شیوع زوال عقل با افزایش سن، و تا حد کمتری با طیشدن مدت بیشتری از آغاز بیماری، افزایش پیدا میکند. زوال عقل منجر به کاهش کیفیت زندگی بیمار و مراقبتکنندگان وی، افزایش مرگ و افزایش احتمال نیاز به بستریشدن در آسایشگاه میشود.[۲۰]
اختلالات کنترل تکانه از جمله اختلال قماربازی، رفتارهای جنسی افراطی و جبری، پرخوری افراطی، خرید افراطی و جبری، و سخاوت افراطی و بیپروا، همگی ممکن است بر اثر داروهای پارکینسون ایجاد شود بهخصوص داروهای خوردنی آگونیست دوپامین.[۲۳]
رفتار تکراری (Punding) که در آن رفتارهای یکسانِ پیچیده، مکرر و بیهدف برای ساعتها انجام میشود نیز مشکل دیگری است که ممکن است بر اثر مصرف داروهای پارکینسون بروز کند.
روانپریشی
[ویرایش]روانپریشی، علامتی است که بازهای بین ۲۶ تا ۸۳ درصد مبتلایان پارکینسون دچار آن میشوند.[۲۴][۲۵]حدود ۵۰ درصد مبتلایان پارکینسون طی روند پیشرفت بیماری، دچار توهم و هذیان میشوند که ممکن است حاکی از آغاز زوال عقل باشد. توهمات بیمار ممکن است خفیف باشد (مثلاً حس میکند کسی بهسرعت از کنارش رد میشود یا کسی/چیزی کنار یا پشت سرش ایستاده) اما در موارد شدید، بیمار دچار توهمات کاملاً واضح دیداری و افکار پارانویا میشود. توهمات شنوایی در پارکینسون چندان شایع نیست. روانپریشی اکنون بخشی جداییناپذیر از بیماری پارکینسون محسوب میشود. روانپریشی همراه با توهم و روانآشفتگی، یکی از مشکلات شناختهشده ناشی از داروهای ضدپارکینسون است و البته ممکن است ناشی از عفونتهای ادراری هم باشد (بهخصوص در سنین بالاتر)، اما دارو و عفونت تنها عوامل ایجاد این مشکل نیستند. دانشمندان بر این باورند که پاتولوژی نهفتهٔ مغز یا تغییر در ناقلهای عصبی یا گیرندههای آنها (مثل استیلکولین و سروتونین) نیز میتواند در ایجاد روانپریشی در پارکینسون سهیم باشد.[۲۶][۲۷]
رفتار و خلقوخو
[ویرایش]تغییر رفتار و خلقوخو در میان افراد مبتلا به پارکینسون شایعتر از سایرین است و معمولاً در پارکینسون همراه با زوال عقل دیده میشود. رایجترین مشکلات خلقوخویی عبارتند از افسردگی، بیتفاوتی و اضطراب.[۱۹]
طبق تخمینهای موجود، افسردگی در ۲۰ تا ۳۵ درصد مبتلایان پارکینسون رخ میدهد و ممکن است در هر مرحلهای از بیماری ایجاد شود. افسردگی ممکن است علائمی مثل خود پارکینسون داشته باشد (مثل خستگی، بیخوابی و مشکل تمرکز) و همین امر بعضاً تشخیص آن را دشوار میکند. عدمتعادل و تغییر در سطح دوپامین، سروتونین و هورمونهای نوراپینفرین، بهعنوان علت اصلی افسردگی در مبتلایان پارکینسون شناخته شدهاست.[۲۴] علت دیگر، ناتوانی و مشکلات جسمی است که به خاطر خود بیماری ایجاد میشود.[۲۸] علائم افسردگی ممکن است به شکل ازدستدادن علاقه، احساس غم، احساس گناه، حس بیپناهی و ناامیدی، و افکار خودکشی بروز کند. فکر خودکشی در مبتلایان پارکینسون بیش از سایرین است اما تلاش برای خودکشی در میان آنها پایینتر از افراد افسردهٔ بدون پارکینسون است.[۲۴][۲۸] برخی از عواملی که ریسک بروز افسردگی در بیماران پارکینسون را افزایش میدهد عبارتست از بروز بیماری در سن زیر ۵۰ سال، زن بودن، سابقهٔ افسردگی، مشکلات حرکتی شدید و غیره.[۲۴]
تخمین زده میشود که ۳۰ تا ۴۰ درصد (در برخی منابع ۶۰ درصد) مبتلایان پارکینسون دچار اضطراب هستند.[۲۴][۲۸] اضطراب اغلب طی دورههای OFF بیماری (یعنی اوقاتی که داروها به خوبیِ قبل جواب نمیدهند) بروز میکند. افراد مبتلا به پارکینسون بیش از سایرین دچار حملهٔ پانیک میشوند. علائم اضطراب طیف گستردهای دارند: از علائم خفیف و موردی گرفته تا علائم شدید و مزمن؛ و علل بالقوهٔ آن عبارتند از سطح غیرطبیعی گاما آمینوبوتیریک اسید و شرم یا ترس به خاطر خود بیماری یا علائم آن.[۲۴][۲۹] برخی عوامل که ریسک بروز اضطراب در بیماران پارکینسون را افزایش میدهد عبارتست از بروز بیماری در سن زیر ۵۰ سال، زن بودن و دورههای OFF بیماری.[۲۴]
بیتفاوتی و آنهدونیا را میتوان به ازدستدادن انگیزه و ناتوانی از تجربهکردن لذت تعریف کرد. این دو جزو علائم کلاسیک همراه با افسردگی هستند اما مداوا و مکانیسم آنها در بیماران پارکینسون متفاوت است و همیشه همراه با افسردگی بروز نمیکند. بیتفاوتی در حدود ۱۶/۵ تا ۴۰ درصد مبتلایان پارکینسون دیده میشود. علائم بیتفاوتی عبارتست از کاهش ابتکار و انگیزه برای فعالیتهای جدید یا نسبت به جهان پیرامون، بیتفاوتی عاطفی و ازدستدادن محبت یا دغدغه نسبت به سایرین.[۲۴] نقص در کارکردهای شناختی از جمله حافظهٔ اجرایی و زبانی نیز معمولاً با بیتفاوتی همراه است.[۲۸]
سایر علائم
[ویرایش]اختلال خواب یکی از شاخصههای بیماری پارکینسون است و ممکن است بر اثر مصرف دارو بدتر شود.[۱۹] علائم اختلال خواب ممکن است به صورت خوابآلودگی در روز (از جمله حملات ناگهانی خواب شبیه به نارکولپسی)، اختلال در حرکت تند چشم در خواب، یا بیخوابی ظاهر شود.[۱۹] اختلال رفتاری حرکت سریع چشم در خواب در مبتلایان پارکینسون گاهی باعث میشود به خودشان یا کسی که کنارشان میخوابد آسیب بزنند و ممکن است سالها پیش از ایجاد علائم حرکتی یا شناختی پارکینسون یا دمانس لویبادی آغاز شود.[۳۰]
تغییر در دستگاه عصبی خودمختار میتواند به افت فشار خون وضعیتی (کاهش فشار خون هنگام ایستادن)، چربشدن پوست، افزایش شدید تعریق، بیاختیاری ادرار و تغییر عملکرد جنسی منجر شود.[۱۹] یبوست و اختلال تخلیهٔ معده در بیماران پارکینسون ممکن است شدید باشد و بیمار را دچار ناراحتی کرده یا حتی سلامت او را به خطر بیندازد.[۱۱] تغییر در ادراک ممکن است شامل نقص حس بویایی، مشکل در حس بینایی، درد و خوابرفتگی (سوزنسوزنشدن و بیحسی) باشد. تمامی این علائم میتواند سالها پیش از تشخیص پارکینسون ظاهر شود.[۱۹]
علل بیماری
[ویرایش]عوامل ریسک بسیاری برای پارکینسون پیشنهاد شدهاند اما تا کنون هیچیک بهطور قطعی اثبات نشدهاست.[۳۱] دو عامل بیش از همه تکرار شدهاند: افزایش ریسک در کسانی که در معرض حشرهکشها و آفتکشها قرار گرفتهاند، و کاهش ریسک در سیگاریها.[۳۱][۳۲] احتمالاً ارتباطی بین پارکینسون و عفونت هلیکوباکتر پیلوری وجود دارد. به اعتقاد پژوهشگران هلیکوباکتر پیلوری موادی شیمیایی تولید میکند که برای مغز مسموم کننده است. همچنین این باکتری میتواند از جذب داروهای پارکینسون از جمله لوودوپا پیشگیری کند، از این رو با درمان این عفونت در بیماران مبتلا به پارکینسون جذب این دارو بهتر صورت میگیرد.[۳۳][۳۴][۳۵][۳۶]
عوامل محیطی
[ویرایش]قرار گرفتن در معرض سموم حشرهکش و آفتکش و استثناً در بعضی موارد سابقه آسیب دیدن مقطعی سر، با پارکینسون مرتبط شدهاند اما ریسک آنها متوسط است. کسانی که هرگز سیگار نکشیده و هرگز نوشیدنی کافئیندار نخوردهاند کمی بیش از سایرین ریسک ابتلا به پارکینسون دارند.[۲۳]
پارکینسونیسم ناشی از دارو
[ویرایش]برخی داروهای پزشکی در مواردی از پارکینسونیسم دخیل شناخته شدهاند. پارکینسونیسم ناشی از دارو، معمولاً با توقف استفاده از داروی موردنظر، قابل برگشت است. برخی از این داروها عبارتند از:
- فنوتیازین (کلرپرومازین، پرومازین و غیره)
- بوتیروفنون (هالوپریدول، بنپریدول و غیره)
- متوکلوپرامید
- تترابنازین
امپیتیپی دارویی است که میدانیم باعث پارکینسونیسم برگشتناپذیر میشود و معمولاً در تحقیقات مدلهای حیوانی به کار میرود.[۳۷]
برخی توکسینها ممکن است باعث پارکینسونیسم شوند از جمله منگنز و کربن دیسولفید.[۳۸][۳۷]
عوامل ژنتیک
[ویرایش]
تحقیقات نشان دادهاست که پارکینسون، حاصل تعاملی پیچیده میان عوامل ژنتیک و عوامل محیطی است.[۲] حدود ۱۵ درصد افراد مبتلا به پارکینسون، خویشاوند درجه اول مبتلا به پارکینسون دارند[۱۴] و ۵ تا ۱۰ درصد افراد مبتلا به پارکینسون بیماریهایی دارند که به خاطر جهش در یکی از چند ژن مشخص ایجاد میشوند.[۳۹][۴۰] داشتن یکی از این جهشهای ژنتیکی ممکن است بهتنهایی منجر به بیماری نشود و عوامل ریسکزای دیگر بر شانس ابتلای فرد به پارکینسون، سن بروز بیماری، شدت و پیشرفت آن موثرند.[۳۹]
تا کنون، جهش ژنتیکی در حداقل ۱۱ اتوزوم غالب و ۹ اتوزوم مغلوب شناخته شده که در ایجاد پارکینسون موثرند. ژنهای غالب اتوزومال شامل SNCA, PARK3، UCHL1، LRRK2، GIGYF2، HTRA2، EIF4G1، TMEM230، CHCHD2، RIC3 و VPS35 هستند. ژنهای مغلوب اتوزومال عبارتند از PRKN, PINK1, PARK7, ATP13A2, PLA2G6, FBXO7, DNAJC6, SYNJ1 و VPS13C. برخی ژنها مربوط به ژنهای جنسی هستند یا الگوهای وراثتی ناشناخته دارند از جمله PARK10, PARK12 و PARK16. حذف ژن 22q11 نیز با بیماری پارکینسون مرتبط است.[۴۱][۴۰] شکلی از اتوزوم غالب را با جهشهای ژن LRP10 همراه دانستهاند.[۴۲][۴۳]
حدود ۵ درصد مبتلایان پارکینسون، دچار جهش در ژن GBA1 هستند.[۴۴] این جهش در افراد عادی کمتر از ۱ درصد است. در صورت وجود این جهش، ریسک ابتلا به پارکینسون ۲۰ تا ۳۰ برابر است. پارکینسون مرتبط با این جهش، همان مشخصات بالینی شناختهشده را دارد اما در سن پایینتر بروز میکند و افت شناختی و حرکتی سریعتری را رقم میزند. این ژن، تولیدکننده آنزیم گلوکوسربروزیداز است. سطح پایین این آنزیم منجر به بروز بیماری گوشه (یکی از بیماریهای ذخیرهای لیزوزومال) میشود.
جهش ژن SNCA نیز در ابتلا به پارکینسون مهم است زیرا پروتئین مرتبط با آن یعنی آلفا-سینوکلئین، ماده اصلی تشکیلدهنده جسم لویی است که در مغز مبتلایان پارکینسون جمع میشود.[۳۹]
جهش در برخی ژنها از جمله SNCA, LRRK2 و GBA جزو عوامل ریسکزا در ایجاد پارکینسون انفرادی (یعنی غیرخانوادگی) شناخته شدهاست.[۳۹] جهش در ژن LRRK2، شایعترین دلیل شناختهشده در ابتلا به پارکینسون خانوادگی و انفرادی است: ۵ درصد در افراد دارای تاریخچه خانوادگی پارکینسون، و ۳ درصد در موارد انفرادی.[۴۵][۳۹] جهش در ژن GBA بزرگترین ریسک ژنتیک در ابتلا به پارکینسون است.[۴۶]
چندین ژن مربوط به بیماری پارکینسون، در عملکرد لیزوزومها (اندامکهایی که محصولات زائد سلولی را هضم میکنند) نقش دارند. برخی موارد پارکینسون ممکن است به دلیل بیماریهای ذخیرهای لیزوزومال که توانایی سلول برای شکستن آلفا-سینوکلئین را کاهش میدهد، ایجاد شوند.[۴۷]
پارکینسونیسم عروقی
[ویرایش]در پارکینسونیسم عروقی، علائم پارکینسون در ترکیب با حوادث عروقی (مانند سکته مغزی) حاضرند. آسیبدیدگی مسیرهای دوپامینرژیک هم در پارکینسونیسم عروقی دیده میشود و هم در پارکینسون نهانزاد، بنابراین ممکن است علائم مشابهی ایجاد کنند. تمایز این دو با معاینه دقیق بالینی، ارزیابی تاریخچه بیمار و تصویربرداری ممکن است.[۴۸][۳۷][۴۹]
سایر علل شناختهشده پارکینسونیسم عبارتند از عفونت و اختلال متابولیک. چندین بیماری زوال عصبی نیز ممکن است همراه با پارکینسونیسم ظاهر شوند و گاهی به آنها «پارکینسونیسم غیرمعمول» یا «پارکینسون پلاس» گفته میشود، از جمله آتروفی سیستم چندگانه، فلج فوقهستهای پیشرونده، کورتیکوبازال دژنراسیون و دمانس لویبادی.[۱۴][۵۰] دمانس لویبادی یک بیماری سینوکلئینپاتی دیگر است و شباهتهای پاتولوژیک نزدیکی با پارکینسون دارد بهخصوص با یکی از زیرمجموعههای پارکینسون یعنی زوال عقل پارکینسون. ارتباط میان پارکینسون و دمانس لویبادی پیچیدهاست و هنوز بهطور کامل فهمیده نشده. این دو بیماری ممکن است نمایانگر بخشهایی از یک زنجیره واحد باشند که مشخصات بالینی و پاتولوژیک متمایزکننده دارند، یا در نهایت اثبات شود که دو بیماری جداگانه هستند.[۵۱]
پاتوفیزیولوژی
[ویرایش]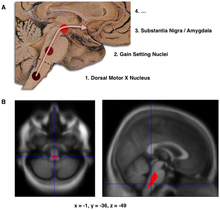
مشخصه پاتولوژیک اصلی در بیماری پارکینسون، مرگ سلولهای عقدههای قاعدهای مغز است که تا ۷۰ درصد نورونهای تولیدکننده دوپامین در توده سیاه مغز را تا پایان زندگی بیمار نابود میکند.[۵۳] در بیماری پارکینسون، آلفا-سینوکلئین دچار تاشدگی اشتباه میشوند و به دیگر آلفا-سینوکلئینها چسبیده و کپهکپه میشوند. سلولهای مغز قادر به حذف این کپهها نیستند، بنابراین آلفا-سینوکلئینها دچار سمیت سلولی شده و به سلولهای مغز آسیب میزنند.[۵۴][۵۵] این کپههای چسبیده به نورونها را میتوان زیر میکروسکوپ مشاهده کرد و به آنها جسم لویی گفته میشود. از دست رفتن نورونها همراه است با مرگ آستروسیتها (سلولهای گلیال ستارهشکل در مغز) و افزایشی چشمگیر در تعداد میکروگلیا (نوع دیگری از سلولهای گلیال) در توده سیاه مغز.[۵۶] روند پیشرفت بیماری پارکینسون در مغز را میتوان با مرحلهبندی براک توضیح داد. طبق این توضیح، پیشروی پارکینسون در بصلالنخاع و پیاز بویایی آغاز میشود و پس از آن به توده سیاه و بقیه میانمغز/مغز جلویی میرسد. شروع علائم حرکتی پارکینسون وقتی اتفاق میافتد که بیماری به توده سیاه میرسد.[۱۰]
پنج مسیر عمده در مغز وجود دارند که سایر بخشهای مغز را به عقدههای قاعدهای متصل و فعالیتهای مختلف را هدایت میکنند. هر پنج مسیر در بیماری پارکینسون متأثر میشوند و انسداد آنها میتواند علائم مختلف پارکینسون را توضیح بدهد زیرا این پنج مسیر در بخش عمدهای از کارکردهای مغز از جمله حرکت، توجه و یادگیری تأثیر دارند.[۵۷]
تشخیص
[ویرایش]تشخیص اولیه بیماری پارکینسون مستلزم بررسی دقیق شرح حال پزشکی و آزمایش نورولوژی توسط پزشک است. در این مرحله، تمرکز بر تأیید علائم حرکتی (برادیکنزیا، لرزش در حال استراحت و غیره) و آزمایشهای تکمیلی برای تشخیص بالینی است. یافتن جسم لویی در میانمغز معمولاً اثبات نهایی و قطعی برای تأیید ابتلا به پارکینسون است. ممکن است طی مسیر درمان روشن شود که بیماری پارکینسون نیست بنابراین لازم است معاینات پزشکی منظم و دورهای برای تأیید دقت تشخیص انجام شود.[۱۹][۵۸]
پارکینسونیسم یا بیماریهای شبیه به آن ممکن است علل دیگری داشته باشد. سکته، مصرف برخی داروها و مواد سمی میتواند موجب «پارکینسونیسم ثانویه» بشود و باید طی معاینه مورد ارزیابی قرار بگیرد.[۱۰][۵۹] سندرومهای پارکینسونپلاس مانند فلج فوقهستهای پیشرونده و آتروفی سیستم چندگانه نیز باید مورد توجه قرار گرفته و کنار گذاشته شوند زیرا درمان و روند پیشرفت آنها متفاوت است (داروهای ضدپارکینسون معمولاً در کنترل علائم سندرومهای پارکینسونپلاس اثر کمتری دارند).[۱۹] سرعت پیشرفت بالا، اختلالات شناختی اولیه یا عدم تعادل بدن، لرزش خفیف یا تقارن در ابتدای ظهور بیماری ممکن است نشاندهنده پارکینسونپلاس باشد و نه خود پارکینسون.[۶۰]
نهادهای پزشکی اکنون معیارهای تشخیصی مشخصی را برای تسهیل و استانداردسازی روند تشخیص پارکینسون تهیه کردهاند، بهخصوص برای تشخیص بیماری در مراحل اولیه. شناختهشدهترین معیارهای تشخیص از سوی UK Queen Square Brain Bank for Neurological Disorders و مؤسسه ملی اختلالات عصبی و سکته مغزی آمریکا ارائه شدهاند. در معیار نخست، تشخیص پارکینسون مستلزم کندی حرکات (برادیکینزیا) بهعلاوه خشکی بدن، لرزش در حال استراحت یا عدم تعادل بدن است. سایر علل احتمالی این علائم باید بررسی شده و کنار گذاشته شود. در نهایت سه مورد یا بیشتر از این خصوصیات در ظهور یا تکامل بیماری ضروری هستند: ظهور یکجانبه علائم، لرزش در هنگام استراحت، پیشروی طی زمان، عدم تقارن در علائم حرکتی، پاسخ به لوودوپا برای حداقل پنج سال، مسیر درمانی حداقل ده ساله و ظهور دیسکینزی ناشی از مصرف بیش از اندازه لوودوپا.[۶۱]
تصویربرداری
[ویرایش]سیتی اسکن افراد مبتلا به پارکینسون معمولاً طبیعی به نظر میرسد.[۶۲] ام آر آی روش دقیقتری برای تشخیص این بیماری در طی زمان است، بهخصوص از طریق T2 و تصویربرداری مغناطیسپذیرشده در میدان مغناطیسی با قدرت حداقل 3T، که هردو آنها میتوانند عدم وجود الگوی تصویری «دم پرستو» در توده سیاه پشتی را نشان بدهند.[۶۳] در یک متاآنالیز، عدم وجود این الگو، حساسیت و ویژگی بالایی در بیماری پارکینسون داشتهاست.[۶۴] یک متاآنالیز در سال ۲۰۲۰ نیز نشان داد که ام آر آی حساس به نوروملانین، عملکرد تشخیصی مطلوبی در افتراق افراد مبتلا به پارکینسون از افراد سالم داشتهاست.[۶۵] تصویربرداری پخش وزنی هم نشان داده که توان بالقوه خوبی برای افتراق میان پارکینسون و سندرومهای پارکینسونپلاس دارد، هرچند توان تشخیصی آن هنوز در حال بررسی است.[۶۲] سیتی اسکن و ام آر آی برای کنارگذاشتن بیماریهای دیگری که ممکن است علل ثانوی پارکینسونیسم باشند هم به کار میرود، بیش از همه در مورد انسفالیت و سکته مغزی، و در برخی موارد عواملی مانند تومور عقدههای قاعدهای و هیدروسفالی.[۶۲]
فعالیت متابولیک ناقلهای دوپامین در عقدههای قاعدهای را میتوان به صورت مستقیم با برشنگاری با گسیل پوزیترون و مقطعنگاری رایانهای تکفوتونی اندازهگیری کرد. DaT scan ورژن رایج دیگری از این تحقیق است. این آزمایش، سازگاری بالایی با تشخیص بالینی پارکینسون نشان دادهاست.[۶۶] کاهش فعالیت مربوط به دوپامین در عقدههای قاعدهای میتواند به کنارگذاشتن پارکینسونیسم ناشی از دارو کمک کند. این یافته هنوز کاملاً مشخص نیست اما ممکن است همراه پارکینسون و اختلالات پارکینسون پلاس دیده شود.[۶۲] در ایالات متحده آمریکا، DaT scan تنها شیوه مورد تأیید سازمان غذا و داروی آمریکا برای افتراق پارکینسون یا سندرومهای پارکینسونی از لرزش اساسی (رعشه یا ترمور اسنشیال) است.[۶۷]
جرقهنگاری میوکارد Iodine-123-meta-iodobenzylguanidine میتواند به یافتن عصبزدایی عضلات پیرامون قلب کمک کند که به نوبه خود در تشخیص پارکینسون مفید است.[۱۰]
تشخیص افتراقی
[ویرایش]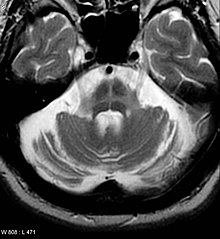
پارکینسونیسم ثانوی - علل مختلف پارکینسونیسم را میتوان با بررسی دقیق شرح حال بیمار، معاینه جسمی و تصویربرداری متناسب از یکدیگر افتراق داد.[۳۷][۱۰][۶۸]
سندروم پارکینسونپلاس - چندین بیماری میتواند بخشی از گروه پارکینسونپلاس قلمداد شود از جمله سندروم کورتیکوبازال، آتروفی سیستم چندگانه، فلج فوقهستهای پیشرونده و دمانس لویبادی. تشخیص افتراقی را میتوان با بررسی دقیق سابقه بیمار و وضع جسمی (به خصوص با تمرکز بر ظهور علائم مشخص)، پیشرفت بیماری و پاسخ به دارو انجام داد.[۶۹][۶۸] برخی مشخصات کلیدی میان آنها عبارتند از:[۳۷][۶۸]
- سندروم کورتیکوبازال - مقاومت به لوودوپا، میوکلونوس (پرش عضلانی)، دیستونی، ضعف کورتیکوسنسوری، آپراکسی و زبانپریشی بیانی.
- آتروفی سیستم چندگانه - مقاومت به لوودوپا، پیشروی سریع، ضعف حرکات خودمختار، سوت تنفسی، وجود رفلکس کف پا، آتاکسی مخچهای و یافتههای مشخص در ام آر آی.
- فلج فوقهستهای پیشرونده - مقاومت به لوودوپا، نگاه عمودی محدود، یافتههای مشخص در ام آر آی، و مشکلات تعادلی متفاوت و زودرس.
- دمانس لویبادی - مقاومت به لوودوپا، غلبه علائم شناختی قبل از بروز علایم حرکتی و علائم شناختی دارای نوسان (توهمات دیداری در این بیماری بسیار شایع است اما بیماران پارکینسون هم دچار این توهمات میشوند).
- لرزش اساسی (رعشه یا ترمور اسنشیال) - این بیماری در ابتدا ممکن است شبیه به پارکینسونیسم باشد اما تفاوتهای متمایزکننده و کلیدی دارد. در این بیماری، لرزش در زمان حرکت بدتر میشود (در حالی که در پارکینسون بهتر میشود) و علائم مشترک چندانی با پارکینسون ندارد. DaT scan نرمال است.[۶۸][۳۷]
برخی بیماریهای دیگر که ممکن است نشانههایی شبیه به پارکینسون داشته باشند عبارتند از:[۷۰][۳۷]
- آرتروز
- بیماری کروتزفلد جاکوب
- دیستونی
- افسردگی
- سندروم آتاکسی
- دمانس پیشانیگیجگاهی و پارکینسونیسم مربوط به کروموزوم ۱۷
- بیماری هانتینگتون
- انباشتگی نهانزاد کلسیم در عقدههای قاعدهای
- تخریب عصبی با تجمع آهن در مغز
- هیدروسفالی با فشار طبیعی
- آهستگی وسواسی
- پارکینسونیسم سایکوژنیک (دارای ریشه روانی)
- بیماری ویلسون
پیشگیری
[ویرایش]ورزش در میانسالی ممکن است ریسک ابتلا به پارکینسون در سالهای بعد را کاهش بدهد.[۱۲] به نظر میرسد که کافئین و مصرف نوشیدنیهای کافئیندار مانند قهوه نیز ریسک ابتلا به پارکینسون را کاهش میدهد.[۷۱] کسانی که از سیگار یا تنباکوی بدون دود استفاده میکنند نیز نسبت به افراد غیرسیگاری ریسک کمتری برای ابتلا به پارکینسون دارند و هرچه مصرف تنباکو بیشتر بوده باشد، احتمال ابتلای آنها به پارکینسون نیز کمتر است. علت اصلی این تأثیر هنوز ناشناخته است. مصرف تنباکو ممکن است واقعاً فرد را از پارکینسون محافظت کند یا شاید عاملی ناشناخته وجود داشته باشد که هم ریسک پارکینسون را افزایش بدهد و هم بیزاری از تنباکو یا آسانکردن ترک آن را.[۷۲][۷۳]
گفته میشود که آنتیاکسیدانهایی از قبیل ویتامین ث و ویتامین ئی برای محافظت در مقابل پارکینسون مفید است اما نتایج تحقیقات در این زمینه ضدونقیض بوده و تاکنون اثر مثبت این مواد اثبات نشدهاست.[۳۱] نتایج تحقیقات درخصوص اثر چربی و اسیدهای چرب در پیشگیری از پارکینسون نیز ضدونقیض بودهاست.[۳۱] نشانههای اولیهای در دست است که استفاده از داروهای ضدالتهاب و داروهای مسدودکننده کانال کلسیم ممکن است از پارکینسون پیشگیری کنند.[۲] در یک متاآنالیز در سال ۲۰۱۰ مشخص شد که داروهای ضدالتهاب غیراستروئیدی (به غیر از آسپیرین) همراه بودهاست با کاهش حداقل ۱۵درصدی (در مصرفکنندگان منظم و درازمدت، درصد بالاتر) در موارد ابتلا به پارکینسون.[۷۴]
مدیریت و کنترل بیماری
[ویرایش]تا کنون هیچ علاجی برای بیماری پارکینسون پیدا نشدهاست. مصرف دارو، جراحی و مداوای جسمی میتواند بیمار را تسکین داده و کیفیت زندگی او را بهبود بخشد و نسبت به مداواهای موجود برای سایر اختلالات نورولوژیک (مانند بیماری آلزایمر، بیماری نورون حرکتی و سندرومهای پارکینسونپلاس) به مراتب موثرتر است. خانوادههای دارویی مفید برای مداوای علائم حرکتی پارکینسون، عبارتند از لوودوپا که همیشه با یک بازدارنده دوپا دکربوکسیلاز، و گاهی با یک بازدارنده COMT، ترکیب میشود، آگونیستهای دوپامین، و بازدارندههای مونوآمین اکسیداز. مرحله بیماری و سن ظهور بیماری تعیین میکند که کدام گروه دارویی برای بیمار مفیدتر است.[۷۵]

مرحلهبندی براک در بیماری پارکینسون، از شش مرحله استفاده میکند که میتوان به ابتدایی، میانه و انتهایی تقسیمشان کرد.[۷۶] در مراحل ابتدایی برخی ناتوانیها ایجاد شده و بیماز نیار به مداوای دارویی دارد، پس از آن مراحل بعدی از راه میرسد که با ایجاد مشکلات مربوط به مصرف لوودوپا همراه است، و در نهایت مرحله سوم که علائم غیرمرتبط با کمبود دوپامین یا مداوا با لوودوپا ممکن است غالب شوند.[۷۶]
هدف از مداوا در مراحل اولیه بیماری، برقرارکردن یک بدهبستان بهینه میان کنترل علائم بیماری و مداوای عوارض جانبی است. ممکن است پزشک تصمیم بگیرد که آغاز مداوا با لوودوپا را میتوان عقب انداخت و به جای آن از داروهای دیگری مانند بازدارندههای مونوآمین اکسیداز و آگونیستهای دوپامین استفاده کرد به امید آنکه ظهور مشکلات ناشی از مصرف لوودوپا به تعویق بیفتد.[۷۷] با وجود این، لوودوپا کماکان موثرترین مداوا برای علائم حرکتی پارکینسون است و مصرف آن را نباید برای کسانی که کیفیت زندگیشان لطمه خورده به تأخیر انداخت. دیسکینزی مربوط به لوودوپا، با مدت و شدت بیماری همبستگی قویتری دارد تا با مدت مصرف لوودوپا، بنابراین عقبانداختن درمان با لوودوپا ممکن است زمان بدون دیسکینزی چندان طولانیتری برای بیمار فراهم نکند.[۷۸]
در مراحل پیشرفته بیماری، هدف کاهش علائم پارکینسون است و در کنار آن کنترل نوسانهای موجود در اثربخشی دارو. ترک ناگهانی دارو یا استفاده بیش از حد آن باید کنترل و مدیریت شود.[۵۸] اگر داروهای خوردنی برای کنترل علائم کافی نباشد، جراحی، تحریک عمقی مغز، تزریق زیرجلدی آپومرفین در بیداری روز، و پمپاژ رودهای دوپا میتواند مفید باشد.[۷۹] مراحل انتهایی پارکینسون چالشها و مشکلات زیادی ایجاد میکند که مستلزم انواع مختلفی از مداواست، از جمله بروز علائم روانی خصوصاً افسردگی، افت فشارخون وضعیتی، اختلال مثانهای و اختلال نعوظ.[۷۹] در مراحل نهایی بیماری، مراقبت تسکینی برای بهبود کیفیت زندگی فرد تأمین میشود.[۸۰]
تحقیقی در سال ۲۰۲۰ نشان داد که هیچ شواهدی مبنی بر مفیدبودن آموزش شناختی (cognitive training) برای افراد مبتلا به پارکینسون، دمانس یا آسیب خفیف شناختی وجود ندارد.[۸۱] یافتههای پیشین در این خصوص، مبتنی بر شواهد دارای قطعیت پایین در هفت پژوهش بود.
درمان دارویی
[ویرایش]لوودوپا
[ویرایش]علائم حرکتی پارکینسون، نتیجه کاهش تولید دوپامین در عقدههای قاعدهای مغز است. دوپامین از سد خونی مغزی عبور نمیکند، بنابراین نمیتواند به عنوان دارو برای افزایش سطح پایین دوپامین در مغز استفاده شود، اما یک پیشماده دوپامین یعنی لوودوپا میتواند عبور کند، به مغز برسد و در آنجا بلافاصله به دوپامین تبدیل شود. مصرف لوودوپا علائم حرکتی پارکینسون را موقتاً از بین میبرد. لوودوپا طی ۴۰ سال گذشته شایعترین درمان پارکینسون بودهاست.[۵۸]
فقط ۵ تا ۱۰ درصد لوودوپا از سد خونی مغزی عبور میکند. بخش زیادی از لوودوپای باقیمانده در بخشهای دیگر بدن متابولیز و باعث طیف مختلفی از عوارض جانبی میشود از جمله تهوع، استفراغ و افت فشارخون وضعیتی.[۸۲] کاربیدوپا و بنسرازید، بازدارندههای دوپا دکاربوکسیلاس هستند که از سد خونی مغزی عبور نمیکنند و مانع از تبدیل لوودوپا به دوپامین در خارج از مغز میشوند که باعث کاهش عوارض جانبی و ارتقای دسترسی به لوودوپا برای عبور به مغز میشود. معمولاً یکی از این داروها همراه با لوودوپا (اغلب در یک قرص همراه لوودوپا) مصرف میشود.[۸۳]
مصرف لوودوپا در درازمدت منجر به ایجاد مشکلاتی مانند حرکات غیرارادی (دیسکینزی) و نوسان در اثربخشی دارو میشود.[۵۸] پس از بروز این نوسانات، فرد به صورت چرخهوار بین فاز پاسخدهی خوب به دارو و کاهش علائم پارکینسون (حالت «روشن» یا ON)، و فاز پاسخ ضعیف به دارو و علائم زیاد پارکینسون (حالت «خاموش» یا OFF) قرار میگیرد.[۵۸] استفاده از دوزهای پایینتر لوودوپا میتواند ریسک و شدت این مشکلات را کاهش بدهد.[۸۴] راهکار سابق برای کاهش دیسکینزی مربوط به لوودوپا و نوساناتش این بود که داروی لوودوپا را مدتی قطع میکردند اما پزشکان اکنون از این کار منع میشوند زیرا چون ممکن است عوارض جانبی خطرناکی مانند نشانگان نورولپتیک بدخیم را ایجاد کند.[۵۸] اغلب بیماران پارکینسون در نهایت نیاز به لوودوپا پیدا میکنند و پس از آن دچار نوسانات و دیسکینزی ناشی از لوودوپا میشوند.[۵۸]
انواعی از لوودوپا که دارای رهش کنترلشده هستند (CR) نیز در دسترس است. داروهای لوودوپا-CR قدیمیتر، جذب و فراهمی زیستی ضعیف و نامطمئنی داشتند و نسبت به داروهای رهش فوری، کنترل بهتری بر علائم حرکتی پارکینسون یا کاهش مشکلات مربوط به لوودوپا نشان ندادند. به نظر میرسد که نوع جدیدتر پیوستهرهش از لوودوپا در کاهش نوسانات موثرتر است اما در بسیاری از افراد، مشکلات به قوت خود باقی میمانند. اگر نوسانات بیماری که قرص میخورد بهخاطر جذب ناکافی ناشی از گاستروپارزی (فلج معدهای) باشد، تزریق رودهای لوودوپا (Duodopa) میتواند منجر به بهبود چشمگیر نوسانات شود. فرمولاسیونهای خوردنی و دارای آثار درازمدت دیگری هم تحت مطالعه هستند. شیوههای رسانش جدیدی مانند استنشاقی و زیرجلدی نیز در حال ایجاد و توسعه است.[۸۵]
بازدارندههای COMT
[ویرایش]
طی روند پارکینسون، بیمار ممکن است حالتی را تجربه کند که به نام «پدیده زائلشدن» (wearing off phenomenon) شناخته میشود. در این حالت، بیمار درست قبل از مصرف دوز بعدی لوودوپا، دچار بازگشت علائم بیماری میشود. COMT پروتئینی است که لوودوپا را پیش از عبور از سد خونی مغزی تضعیف میکند و این بازدارندهها باعث میشوند مقدار بیشتری از لوودوپا بتواند عبور کند و به مغز برسد. این بازدارندهها معمولاً در کنترل علائم اولیه به کار نمیروند اما اگر بیماری درخصوص علائم حرکتی خود دچار «پدیده زائلشدن» باشد، بازدارندههای COMT میتوانند در ترکیب با لوودوپا/کاربیدوپا استفاده شوند.
سه بازدارنده COMT برای درمان بیماران بزرگسالی که در پایان هر دوز دچار نوسانات حرکتی میشوند در دسترس است - اوپیکاپون، انتاکاپون و تولکاپون. تولکاپون چندین سال در دسترس بودهاست اما به کبد آسیب میزند بنابراین در صورت مصرف، عملکرد کبد بیمار باید زیر نظر باشد. تا کنون اثر منفی انتاکاپون و اوپیکاپون بر کبد اثبات نشدهاست. داروهای تحتلیسانس انتاکاپون، حاوی انتاکاپون یا ترکیب آن با کاربیدوپا و لوودوپا هستند. اوپیکاپون یک بار در روز مصرف میشود.
آگونیستهای دوپامین
[ویرایش]چند نوع از آگونیستهای دوپامین که به گیرندههای دوپامین در مغز میچسبند، تأثیری مشابه لوودوپا دارند.[۵۸] آگونیستهای دوپامین در ابتدا به عنوان درمانی تکمیلی در کنار لوودوپا و برای افرادی که مشکلاتی در مصرف لوودوپا داشتند (نوسانهای «خاموش» و «روشن» و دیسکینزی) به کار میرفت؛ اما در حال حاضر عمدتاً به تنهایی و به عنوان اولین درمان برای علایم حرکتی پارکینسون به کار میروند. هدف از این کار به تأخیر انداختن آغاز درمان با لوودوپا و به تبع آن عقب افتادن ظهور مشکلات مصرف لوودوپا است.[۵۸][۸۶] آگونیستهای دوپامین عبارتند از بروموکریپتین، پرگولید، پرامیپکسول، روپینیرول، کابرگولین، آپومرفین و لیسوراید.
هرچند آگونیستهای دوپامین نسبت به لوودوپا اثربخشی کمتری در کنترل علائم حرکتی پارکینسون دارند اما در سالهای نخست درمان معمولاً به قدر کافی اثربخشی دارند.[۱۴] دیسکینزی ناشی از مصرف آگونیستهای دوپامین در مبتلایان جوانتر نادر است اما در صورتی که بیماری در سنین بالاتر ظاهر شده باشد بروز دیسکینزی شایعتر میشود؛ بنابراین در مراحل ابتدایی درمان پارکینسون، اگر بیمار نسبتاً جوان باشد آگونیستهای دوپامین مرجح هستند و اگر بیمار سن بالاتری داشته باشد لوودوپا.[۱۴]
آگونیستهای دوپامین عوارض جانبی چشمگیر اما معمولاً خفیفی ایجاد میکنند از جمله خوابآلودگی، توهم، بیخوابی، تهوع و یبوست.[۵۸] گاهی اوقات این عوارض جانبی حتی با مصرف حداقل دوز مؤثر تجویزشده هم ظاهر میشوند که در اینصورت پزشک به دنبال دارویی دیگر میرود.[۵۸] آگونیستها، نسبت به لوودوپا، ارتباط بیشتری با بروز اختلالات کنترل تکانه (مانند رفتارهای افراطی و جبری در زمینه سکس، خوردن، قمار و خرید) دارند.[۸۷] قیمت آنها نیز معمولاً از لوودوپا بیشتر است.[۱۴]
آپومرفین که یکی از آگونیستهای دوپامین است، ممکن است برای کاهش دورههای «خاموش» (OFF) و دیسکینزی در مراحل انتهایی پارکینسون استفاده شود.[۵۸] این دارو فقط با تزریق متناوب یا تزریق زیرجلدی مداوم استفاده میشود.[۵۸] مصرف این دارو آثار ثانوی شایعی مانند سردرگمی و توهم دارد بنابراین مصرفکنندگان این دارو باید از نزدیک تحت نظر باشند.[۵۸] دو نوع آگونیست دوپامین (لیسوراید و روتیگوتین) را میتوان به صورت چسبهای پوستی استفاده کرد که در مراحل ابتدایی بیماری یا برای کنترل دورههای خاموش (OFF) در مراحل پیشرفته بیماری مفید است.[۸۸]
بازدارندههای MAO-B
[ویرایش]بازدارندههای MAO-B (سافینامید، سلژیلین و راساگیلین) با جلوگیری از فعالیت مونوآمین اکسیداز B (آنزیمی که دوپامین را میشکند) باعث افزایش میزان دوپامین در عقدههای قاعدهای مغز میشوند.[۵۸] یافتهها نشان دادهاست که این ماده وقتی به عنوان تکدارو (به تنهایی) استفاده میشود برای کمک به بهبود علائم حرکتی مفید است و وقتی همراه با لوودوپا استفاده شود، طول دورههای خاموش (OFF) بیمار را کاهش میدهد. تحقیقات نشان داده که سلژیلین باعث میشود نیاز به شروع لوودوپا عقب بیفتد و این امر حاکی از آن است که این ماده ممکن است محافظ نورونها باشد و سرعت پیشرفت بیماری را کاهش بدهد (که البته هنوز اثبات نشدهاست).[۸۹] یکی از تحقیقات ابتدایی نشان داده بود که سلژیلین در ترکیب با لوودوپا باعث افزایش ریسک مرگ میشود اما نتایج این تحقیق بعدها مردود اعلام شد.[۹۰]
عوارض جانبی این دارو عبارتست از تهوع، سرگیجه، بیخوابی، خوابآلودگی و (درخصوص سلژیلین و راساگیلین) افت فشار خون وضعیتی.[۸۹][۱۰] مصرف بازدارندههای MAO-B همراه با لوودوپا باعث افزایش سروتونین میشود بنابراین ممکن است در ترکیب با برخی داروهای ضدافسردگی خطرناک باشد و باعث ایجاد سندرم سروتونین شود.[۸۹]
سایر داروها
[ویرایش]داروهای دیگر از قبیل آمانتادین و آنتیکولینرژیکها ممکن است برای درمان علائم حرکتی مفید باشند اما شواهد اثرگذاری آنها فاقد کیفیت لازم است بنابراین به عنوان نخستین انتخاب در درمان استفاده نمیشوند.[۵۸][۹۱] علاوه بر علائم حرکتی، پارکینسون طیف متنوعی از علائم دیگر هم دارد و چندین دارو برای درمان برخی از این مشکلات استفاده شدهاند، از جمله کوئتیاپین برای سایکوسیس، بازدارندههای کولیناستراز برای دمانس، و مدافینیل برای خوابآلودگی شدید روزانه.[۹۲][۹۳] در سال ۲۰۱۶، پیماوانسرین برای کنترل سایکوسیس در پارکینسون به تأیید سازمان غذا و دارو (آمریکا) رسید.[۹۴] دوکسپین و رازاگلین ممکن است در کاهش خستگی جسمی در پارکینسون مؤثر باشند.[۹۵]
جراحی
[ویرایش]درمان علائم حرکتی با جراحی در زمان خود روش بسیار رایجی بود اما پس از کشف لوودوپا، تعداد جراحیها کاهش یافتهاست.[۹۶] تحقیقات دهههای اخیر باعث پیشرفتهای بزرگی در تکنیکهای جراحی شده، بنابراین جراحی دوباره برای کمک به افراد مبتلا به پارکینسون پیشرفته که دارودرمانی دیگر برایشان کافی نیست به کار میرود.[۹۶] جراحی برای پارکینسون را میتوان به دو گروه اصلی تقسیم کرد: ضایعهای (lesional) و تحریک عمقی مغز (DBS).[۹۶] مناطق هدف در جراحی DBS و ضایعهای عبارتست از تالاموس، گلوبوس پالیدوس یا هستهٔ زیر تالاموسی. در جراحی DBS، الکترودهایی در داخل مغز بیمار قرار داده میشوند. این الکترودها پس از کاشته شدن در مغز به یک دستگاه مولد پالس الکتریکی (به انگلیسی: Pulse Generator) متصل میشوند. پالس الکتریکی تولیدشده توسط دستگاه پالس ژنراتور از طریق الکترودهای کاشتهشده در مغز به بافتهای عمقی مغز انتقال یافته و از این طریق اثر درمانی خود را اعمال مینماید. جراحی DBS برای بیمارانی توصیه میشود که دچار نوسانات حرکتی و لرزش زیاد هستند که با دارو به قدر کافی کنترل نمیشود، یا بیمارانی که به دارو حساسیت دارند البته به شرطی که مشکلات روانپزشکی-عصبی جدی نداشته باشند.[۹۷] جراحیهای دیگری هم انجام میشوند که چندان شایع نیستند مثلاً ایجاد عمدی ضایعه برای سرکوب فعالیت بیش از اندازه قسمتهای خاصی از بخش زیرقشری مغز، برای مثال جراحی پالیدوتومی.[۹۶]
تا کنون چهار بخش از مغز با استفاده از تحریککنندههای عصبی مورد درمان قرار گرفتهاند: گلوبوس پالیدوس، تالاموس، هستهٔ زیر تالاموسی و PPN.[۹۸] جراحی DBS در گلوبوس پالیدوس باعث بهبود عملکرد حرکتی بیمار میشود در حالی که جراحی DBS در تالاموس لرزش را کاهش میدهد اما تأثیر چندانی بر برادیکینزی یا خشکی بدن ندارد. اگر بیمار سابقه افسردگی یا آسیب شناختی-عصبی داشته باشد، معمولاً از جراحی DBS در هستهٔ زیر تالاموسی خودداری میشود. جراحی DBS در هستهٔ زیر تالاموسی همراه با کاهش مصرف دارو است. جراحی DBS در بخش PPN مغز در حال حاضر در مرحله آزمایشی است.
توانبخشی
[ویرایش]طبق آمار موجود مبتلایان به پارکینسون سه برابر کمتر از همسالان خود که به این بیماری مبتلا نیستند، فعالیت ورزشی دارند.[۹۹]پیشنهاد میشود که بیماران پارکینسون برنامه ورزش داشته باشند.[۱۲] برخی شواهد نشان دادهاند که مشکلات گفتاری یا حرکتی میتواند با توانبخشی بهبود یابد، البته تحقیقات در این زمینه نادر و کمکیفیت هستند.[۱۰۰] ورزش و تمرین بدنی منظم، با یا بدون طب فیزیکی، میتواند برای حفظ و بهبود تحرک، انعطافپذیری، قدرت، سرعت راهرفتن و کیفیت زندگی مفید باشد.[۱۰۰] در صورتی که برنامه ورزش زیر نظر یک فیزیوتراپیست انجام شود، بهبود بیشتری در علایم حرکتی، عملکردهای ذهنی و عاطفی، فعالیتهای روزمره و کیفیت زندگی مشاهده میشود تا اینکه بیمار به تنهایی و در خانه ورزش کند. ورزشهای بالینی هم میتوانند مؤثر باشند و باعث بهبود عملکرد حرکتی و افسردگی بیمار شوند.[۱۰۱]
برای افزایش انعطافپذیری و بازه حرکتی در بیمارانی که دچار مشکل خشکی بدن هستند، تکنیکهای ریلکسسازی کلی بدن مانند تکانتکان خوردنهای آرام مفیدند و باعث کاهش تنش عضلانی شدید میشوند. تکنیکهای مؤثر دیگر برای افزایش ریلکسبودن بدن عبارتند از حرکات چرخشی دستها و پاها و بالاتنه، حرکات ریتمیک، تنفس شکمی و تکنیکهای مدیتیشن.[۱۰۲] درخصوص راهرفتن و مشکلاتی مانند هیپوکینزی، کشیدن پاها و کاهش قدرت چرخش بازوها، فیزیوتراپیستها قادرند راهکارهای مختلفی برای بهبود توان حرکت و ایمنی فرد ارائه کنند از جمله استفاده از تجهیزات کمکی (پیادهروی با میله یا تردمیل)، گراهای کلامی (دستی، دیداری و شنیداری)، تمرین بدنی (راهپیمایی و تمرینهای کششی PNF)، تغییر محیط (تغییر در سطوح، دروندادها، بسته و باز بودن).[۱۰۲] تحقیقات نشان داده که تمرینهای قدرتی برای بهبود قدرت و عملکرد حرکتی بیمارانی که به خاطر پارکینسون دچار ضعف عضلانی میشوند مفید است، البته تعامل چشمگیری بین میزان قدرت و زمان مصرف دارو مشاهده شدهاست؛ بنابراین بیماران پارکینسون باید تمرینهای بدنی خود را ۴۵ دقیقه تا یک ساعت پس از مصرف دارو انجام بدهند تا بدنشان در بهترین حالت ممکن باشد.[۱۰۲] به خاطر خمیدگی بدن و اختلالات تنفسی که در پارکینسون پیشرفته ایجاد میشود، تمرینهای تنفس عمیق شکمی برای بهبود حرکت قفسه سینه و ظرفیت حیاتی مفیدند.[۱۰۲] ورزش میتواند برای بهبود یبوست نیز مفید باشد.[۱۱] هنوز مشخص نیست که ورزش به کاهش خستگی جسمی در پارکینسون کمک میکند یا خیر.[۹۵]
تحقیقات نشان داده که تمرینهای قدرتی باعث افزایش مهارتهای دستی بیماران پارکینسون میشود. استفاده از وسایلی مانند خمیر تمرینی (putty) قدرت پنجههای دست را افزایش داده و کیفیت زندگی روزمره فرد را بالا میبرد.[۱۰۳]
یکی از رایجترین درمانها برای اختلالات گفتاری همراه با پارکینسون، «تمرینهای صدایی لی سیلورمن» (LSVT) است.[۵۸][۱۰۴] گفتاردرمانی و خصوصاً LSVT میتوانند به بهبود گفتار در افراد مبتلا به پارکینسون کمک کنند. کاردرمانی با هدف ارتقای سلامت و کیفیت زندگی نیز مفید است و به بیماران پارکینسون کمک میکند تا حد امکان تمام فعالیتهای روزمرهشان را خودشان انجام بدهند.[۵۸] تحقیقات درخصوص اثربخشی کاردرمانی بر پارکینسون معدود است اما نشانههایی در دست داریم که کاردرمانی باعث بهبود مهارتهای حرکتی و کیفیت زندگی فرد طی دوره درمان میشود.[۵۸][۱۰۵]
مراقبت تسکینی
[ویرایش]مراقبت تسکینی نوعی مراقبت پزشکی خاص برای افراد مبتلا به بیماریهای شدید از جمله پارکینسون است. هدف از این نوع مراقبت، ارتقای کیفیت زندگی بیمار مبتلا به پارکینسون و خانواده او، و تسکین علائم، درد و استرس بیماری است.[۱۰۶] از آنجا که پارکینسون علاجی ندارد، تمام درمانهای این بیماری با تمرکز بر کاهش افت بدن و افزایش کیفیت زندگی فرد انجام میشوند و در واقع ماهیت تسکینی دارند.[۱۰۷]
مراقبت تسکینی نباید به مراحل انتهایی بیماری محدود شود. متخصصان مراقبت تسکینی میتوانند در بهبود علائم جسمی، مشکلات احساسی مانند ازدسترفتن توان فیزیکی و شغل، ترس و دغدغههای وجودی به فرد کمک کنند.[۱۰۸][۱۰۹][۱۱۰]
در کنار کمک و حمایت عاطفی از بیمار و خانواده او، مراقبت تسکینی میتواند نقش مهمی در تحقق اهداف مراقبت داشته باشد. مبتلایان پارکینسون ممکن است در جریان پیشرفت بیماری مجبور شوند تصمیمات دشواری بگیرند، مثلاً استفاده از لوله تغذیه، تهویه غیر تهاجمی یا تراکستومی، تصمیم فرد درخصوص انجام یا عدم انجام احیای قلبی ریوی، و زمان استفاده از مراقبت در مراحل آخر زندگی (hospice).[۱۰۷] اعضای تیم مراقبت تسکینی میتوانند به این سوالات پاسخ بدهند و به بیماران پارکینسون کمک کنند تا بتوانند بر اساس ارزشهای خود، درخصوص این مسائل پیچیده و احساسی تصمیم بگیرند.[۱۰۹][۱۱۱]
عضلات و اعصابی که روند گوارش را کنترل میکنند هم ممکن است تحت تأثیر بیماری پارکینسون قرار بگیرند که باعث یبوست و فلج معده (باقی ماندن غذا در معده بیش از حد طبیعی) میگردد.[۱۱] توصیه میشود بیماران پارکینسون، بر اساس ارزیابیهای تغذیهای دورهای، رژیم غذایی متعادلی داشته باشند به نحوی که جلوی کاهش یا افزایش وزن گرفته شده و پیامدهای اختلالات معدهای به حداقل برسد.[۱۱] با پیشروی بیماری ممکن است دشواری در بلع (دیسفاژی) ایجاد شود. در این موارد، استفاده از مواد غلظتدهنده و صاف نشستن هنگام غذاخوردن میتواند مفید باشد و جلوی پریدن غذا در گلو را بگیرد. در موارد حاد، میتوان با گاسترکتومی غذا را مستقیماً به معده رساند.[۱۱]
لوودوپا و پروتئینها، سیستم جابجایی مشابهی در روده و سد خونی مغزی دارند بنابراین برای دسترسی با یکدیگر رقابت میکنند.[۱۱] مصرف همزمان این دو باعث کاهش اثربخشی دارو میشود؛ بنابراین وقتی بیمار مصرف لوودوپا را شروع میکند از مصرف بیش از حد پروتئین منع میشود و توصیه میشود رژیم غذایی مدیترانهای متعادل را پیش بگیرد.[۱۱] به همین دلیل، در مراحل پیشرفته بیماری، مصرف بیشتر مواد کمپروتئین مثل نان یا پاستا توصیه میشود. برای به حداقل رساندن تعامل لوودوپا با پروتئینها، لوودوپا باید ۳۰ دقیقه قبل از هر وعده غذایی مصرف شود. در عین حال، رژیمهای غذایی بیماران پارکینسون، مصرف پروتئین در صبحانه و ناهار را محدود کرده و اجازه مصرف پروتئین برای شام را میدهند.[۱۱]
پارکینسون بلااستثناء با گذشت زمان پیشروی میکند. یکی از شیوههای درجهبندی شدت بیماری که به نام «معیار واحد درجهبندی بیماری پارکینسون» (UPDRS) شناخته میشود، رایجترین استاندارد برای مطالعه بالینی است. نسخه اصلاحشده این استاندارد که MDS-UPDRS نامیده میشود نیز گاهی مورد استفاده قرار میگیرد. شیوه درجهبندی قدیمیتری به نام Hoehn and Yahr که در سال ۱۹۶۷ منتشر شده بود، و همچنین نسخه اصلاحشده آن به نام Modified Hoehn and Yahr هم سالها مورد استفاده بودهاند. مقیاس Hoehn and Yahr، پنج مرحله اساسی را در پیشرفت پارکینسون مشخص میکند.[۱۱۲]
علائم حرکتی پارکینسون اگر درمان نشوند، در مراحل اولیه بیماری با سرعتی بسیار زیاد و در مراحل بعدی با سرعت کمتری پیشروی میکنند. اگر بیمار پارکینسونی درمان نشود، انتظار میرود که بهطور متوسط ۸ سال پس از شروع بیماری، توان مستقل راهرفتن را از دست داده و ۱۰ سال پس از شروع بیماری، زمینگیر شود.[۶۰] البته امروزه تعداد بیمارانی که به دنبال درمان نمیروند بسیار کم است. داروها توانستهاند پروگنوسیس علائم حرکتی بیمار را بهبود ببخشند اما در عین حال خود لوودوپا بعد از چند سال مصرف مداوم، منبع ایجاد مشکلات و عوارض جانبی ناخواسته میشود.[۶۰] در بیمارانی که لوودوپا مصرف میکنند، زمان پیشروی علائم تا رسیدن به مرحله وابستگی بالا به مراقب، میتواند حدود ۱۵ سال باشد. پیشبینی مسیری که این بیماری در هر فرد طی خواهد کرد کار دشواری است.[۶۰] سن، بهترین ملاک برای پیشبینی روند بیماری است.[۵۷] میزان افت حرکتی برای کسانی که در زمان تشخیص پارکینسون اختلالات کمتری داشتهاند بالاتر است. اختلال شناختی در کسانی که هنگام ظهور علائم بیماری بالای ۷۰ سال سن داشتهاند شایعتر است.[۵۷]
پانویس
[ویرایش]- ↑ «APDA Parkinson's Handbook».
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/s0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ↑ Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/s0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ↑ Barranco Quintana JL, Allam MF, Del Castillo AS, Navajas RF (February 2009). "Parkinson's disease and tea: a quantitative review". Journal of the American College of Nutrition. 28 (1): 1–6. doi:10.1080/07315724.2009.10719754. PMID 19571153. S2CID 26605333.
- ↑ Armstrong MJ, Okun MS (February 2020). "Diagnosis and Treatment of Parkinson Disease: A Review". JAMA. 323 (6): 548–560. doi:10.1001/jama.2019.22360. PMID 32044947.
- ↑ ۶٫۰ ۶٫۱ Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/s0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ↑ Mosley AD (2010). The encyclopedia of Parkinson's disease (2nd ed.). New York: Facts on File. p. 89. ISBN 978-1-4381-2749-1. Archived from the original on 8 September 2017.
- ↑ Sveinbjornsdottir S (October 2016). "The clinical symptoms of Parkinson's disease". Journal of Neurochemistry. 139 Suppl 1: 318–24. doi:10.1111/jnc.13691. PMID 27401947.
- ↑ Sveinbjornsdottir S (October 2016). "The clinical symptoms of Parkinson's disease". Journal of Neurochemistry. 139 Suppl 1: 318–24. doi:10.1111/jnc.13691. PMID 27401947.
- ↑ ۱۰٫۰ ۱۰٫۱ ۱۰٫۲ ۱۰٫۳ ۱۰٫۴ ۱۰٫۵ Armstrong MJ, Okun MS (February 2020). "Diagnosis and Treatment of Parkinson Disease: A Review". JAMA. 323 (6): 548–560. doi:10.1001/jama.2019.22360. PMID 32044947.
- ↑ ۱۱٫۰ ۱۱٫۱ ۱۱٫۲ ۱۱٫۳ ۱۱٫۴ ۱۱٫۵ ۱۱٫۶ ۱۱٫۷ ۱۱٫۸ Barichella M, Cereda E, Pezzoli G (October 2009). "Major nutritional issues in the management of Parkinson's disease". Movement Disorders. 24 (13): 1881–92. doi:10.1002/mds.22705. hdl:2434/67795. PMID 19691125. S2CID 23528416.
- ↑ ۱۲٫۰ ۱۲٫۱ ۱۲٫۲ Ahlskog JE (July 2011). "Does vigorous exercise have a neuroprotective effect in Parkinson disease?". Neurology. 77 (3): 288–94. doi:10.1212/wnl.0b013e318225ab66. PMC 3136051. PMID 21768599.
- ↑ «"Parkinson's Disease Information Page". NINDS. 30 June 2016. Retrieved 18 July 2016».
- ↑ ۱۴٫۰ ۱۴٫۱ ۱۴٫۲ ۱۴٫۳ ۱۴٫۴ ۱۴٫۵ Samii A, Nutt JG, Ransom BR (May 2004). "Parkinson's disease". Lancet. 363 (9423): 1783–93. doi:10.1016/S0140-6736(04)16305-8. PMID 15172778. S2CID 35364322.
- ↑ Schrag A (2007). "Epidemiology of movement disorders". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Hagerstown, Maryland: Lippincott Williams & Wilkins. pp. 50–66. ISBN 978-0-7817-7881-7.
- ↑ ۱۶٫۰ ۱۶٫۱ Galpern WR, Lang AE (March 2006) [17 February 2006]. "Interface between tauopathies and synucleinopathies: a tale of two proteins". Annals of Neurology. 59 (3): 449–58. doi:10.1002/ana.20819. PMID 16489609. S2CID 19395939.
- ↑ Marras C, Lang A (April 2013). "Parkinson's disease subtypes: lost in translation?". Journal of Neurology, Neurosurgery, and Psychiatry. 84 (4): 409–15. doi:10.1136/jnnp-2012-303455. PMID 22952329.
- ↑ داروشناسی بالینی؛ دکتر منصور رحمانی ص ۴۱.
- ↑ ۱۹٫۰۰ ۱۹٫۰۱ ۱۹٫۰۲ ۱۹٫۰۳ ۱۹٫۰۴ ۱۹٫۰۵ ۱۹٫۰۶ ۱۹٫۰۷ ۱۹٫۰۸ ۱۹٫۰۹ Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery, and Psychiatry. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392. Archived from the original on 19 August 2015.
- ↑ ۲۰٫۰ ۲۰٫۱ ۲۰٫۲ ۲۰٫۳ ۲۰٫۴ ۲۰٫۵ Caballol N, Martí MJ, Tolosa E (September 2007). "Cognitive dysfunction and dementia in Parkinson disease". Movement Disorders. 22 Suppl 17 (Suppl 17): S358–66. doi:10.1002/mds.21677. PMID 18175397. S2CID 3229727.
- ↑ ۲۱٫۰ ۲۱٫۱ ۲۱٫۲ Parker KL, Lamichhane D, Caetano MS, Narayanan NS (October 2013). "Executive dysfunction in Parkinson's disease and timing deficits". Frontiers in Integrative Neuroscience. 7: 75. doi:10.3389/fnint.2013.00075. PMC 3813949. PMID 24198770.
- ↑ Gomperts SN (April 2016). "Lewy Body Dementias: Dementia With Lewy Bodies and Parkinson Disease Dementia". Continuum (Minneap Minn) (Review). 22 (2 Dementia): 435–63. doi:10.1212/CON.0000000000000309. PMC 5390937. PMID 27042903.
- ↑ ۲۳٫۰ ۲۳٫۱ Noyce AJ, Bestwick JP, Silveira-Moriyama L, et al. (December 2012). "Meta-analysis of early nonmotor features and risk factors for Parkinson disease". Annals of Neurology (Review). 72 (6): 893–901. doi:10.1002/ana.23687. PMC 3556649. PMID 23071076.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ ۲۴٫۳ ۲۴٫۴ ۲۴٫۵ ۲۴٫۶ ۲۴٫۷ Han JW, Ahn YD, Kim WS, Shin CM, Jeong SJ, Song YS, et al. (November 2018). "Psychiatric Manifestation in Patients with Parkinson's Disease". Journal of Korean Medical Science. 33 (47): e300. doi:10.3346/jkms.2018.33.e300. PMC 6236081. PMID 30450025.
- ↑ Ffytche DH, Creese B, Politis M, Chaudhuri KR, Weintraub D, Ballard C, Aarsland D (February 2017). "The psychosis spectrum in Parkinson disease". Nature Reviews. Neurology. 13 (2): 81–95. doi:10.1038/nrneurol.2016.200. PMC 5656278. PMID 28106066.
- ↑ Shergill SS, Walker Z, Le Katona C (October 1998). "A preliminary investigation of laterality in Parkinson's disease and susceptibility to psychosis". Journal of Neurology, Neurosurgery, and Psychiatry. 65 (4): 610–1. doi:10.1136/jnnp.65.4.610. PMC 2170290. PMID 9771806.
- ↑ Friedman JH (November 2010). "Parkinson's disease psychosis 2010: a review article". Parkinsonism & Related Disorders. 16 (9): 553–60. doi:10.1016/j.parkreldis.2010.05.004. PMID 20538500.
- ↑ ۲۸٫۰ ۲۸٫۱ ۲۸٫۲ ۲۸٫۳ Weintraub D, Mamikonyan E (September 2019). "The Neuropsychiatry of Parkinson Disease: A Perfect Storm". The American Journal of Geriatric Psychiatry. 27 (9): 998–1018. doi:10.1016/j.jagp.2019.03.002. PMC 7015280. PMID 31006550.
- ↑ Goetz CG (2010). "New developments in depression, anxiety, compulsiveness, and hallucinations in Parkinson's disease". Movement Disorders. 25 Suppl 1 (S1): S104-9. doi:10.1002/mds.22636. PMID 20187250. S2CID 35420377.
- ↑ Kim YE, Jeon BS (1 January 2014). "Clinical implication of REM sleep behavior disorder in Parkinson's disease". Journal of Parkinson's Disease. 4 (2): 237–44. doi:10.3233/jpd-130293. PMID 24613864.
- ↑ ۳۱٫۰ ۳۱٫۱ ۳۱٫۲ ۳۱٫۳ de Lau LM, Breteler MM (June 2006). "Epidemiology of Parkinson's disease". The Lancet. Neurology. 5 (6): 525–35. doi:10.1016/S1474-4422(06)70471-9. PMID 16713924. S2CID 39310242.
- ↑ Barreto GE, Iarkov A, Moran VE (January 2015). "Beneficial effects of nicotine, cotinine and its metabolites as potential agents for Parkinson's disease". Frontiers in Aging Neuroscience. 6: 340. doi:10.3389/fnagi.2014.00340. PMC 4288130. PMID 25620929.
- ↑ Çamcı G, Oğuz S (April 2016). "Association between Parkinson's Disease and Helicobacter Pylori". Journal of Clinical Neurology. 12 (2): 147–50. doi:10.3988/jcn.2016.12.2.147. PMC 4828559. PMID 26932258.
- ↑ McGee DJ, Lu XH, Disbrow EA (2018). "Stomaching the Possibility of a Pathogenic Role for Helicobacter pylori in Parkinson's Disease". Journal of Parkinson's Disease. 8 (3): 367–74. doi:10.3233/JPD-181327. PMC 6130334. PMID 29966206.
- ↑ «باکتری مربوط به بیماری پارکینسون 'شناسایی' شد». BBC News فارسی. ۲۰۱۱-۰۵-۲۳. دریافتشده در ۲۰۲۱-۰۹-۳۰.
- ↑ اکونومیست، اخبار اقتصادی | ایران (۲۶ خرداد ۱۳۹۸). «میکروبهای معده دارو میخورند!». fa. دریافتشده در ۲۰۲۱-۰۹-۳۰.
- ↑ ۳۷٫۰ ۳۷٫۱ ۳۷٫۲ ۳۷٫۳ ۳۷٫۴ ۳۷٫۵ ۳۷٫۶ Simon RP, Greenberg D, Aminoff MJ (2017). Clinical Neurology (10th ed.). The United States of America: McGraw-Hill. ISBN 978-1-259-86172-7.
- ↑ Guilarte TR, Gonzales KK (August 2015). "Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence". Toxicological Sciences. 146 (2): 204–12. doi:10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508.
- ↑ ۳۹٫۰ ۳۹٫۱ ۳۹٫۲ ۳۹٫۳ ۳۹٫۴ Lesage S, Brice A (April 2009). "Parkinson's disease: from monogenic forms to genetic susceptibility factors". Human Molecular Genetics. 18 (R1): R48-59. doi:10.1093/hmg/ddp012. PMID 19297401.
- ↑ ۴۰٫۰ ۴۰٫۱ Deng H, Wang P, Jankovic J (March 2018). "The genetics of Parkinson disease". Ageing Research Reviews. 42: 72–85. doi:10.1016/j.arr.2017.12.007. PMID 29288112. S2CID 28246244.
- ↑ Puschmann A (September 2017). "New Genes Causing Hereditary Parkinson's Disease or Parkinsonism". Current Neurology and Neuroscience Reports. 17 (9): 66. doi:10.1007/s11910-017-0780-8. PMC 5522513. PMID 28733970.
- ↑ Quadri M, Mandemakers W, Grochowska MM, Masius R, Geut H, Fabrizio E, et al. (July 2018). "LRP10 genetic variants in familial Parkinson's disease and dementia with Lewy bodies: a genome-wide linkage and sequencing study". The Lancet. Neurology. 17 (7): 597–608. doi:10.1016/s1474-4422(18)30179-0. PMID 29887161. S2CID 47009438.
- ↑ Chen Y, Cen Z, Zheng X, Pan Q, Chen X, Zhu L, et al. (June 2019). "LRP10 in autosomal-dominant Parkinson's disease". Movement Disorders. 34 (6): 912–916. doi:10.1002/mds.27693. PMID 30964957. S2CID 106408549.
- ↑ Stoker TB, Torsney KM, Barker RA (2018). "Pathological mechanisms and clinical aspects of GBA1 mutation-associated Parkinson's disease.". In Stoker TB, Greenland JC (eds.). Parkinson's Disease: Pathogenesis and clinical aspects. Brisbane: Codon Publications.
- ↑ Davie CA (2008). "A review of Parkinson's disease". British Medical Bulletin. 86 (1): 109–27. doi:10.1093/bmb/ldn013. PMID 18398010.
- ↑ Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/S0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ↑ Gan-Or Z, Dion PA, Rouleau GA (2 September 2015). "Genetic perspective on the role of the autophagy-lysosome pathway in Parkinson disease". Autophagy. 11 (9): 1443–57. doi:10.1080/15548627.2015.1067364. PMC 4590678. PMID 26207393.
- ↑ Gupta D, Kuruvilla A (December 2011). "Vascular parkinsonism: what makes it different?". Postgraduate Medical Journal. 87 (1034): 829–36. doi:10.1136/postgradmedj-2011-130051. PMID 22121251. S2CID 29227069.
- ↑ Miguel-Puga A, Villafuerte G, Salas-Pacheco J, Arias-Carrión O (22 September 2017). "Therapeutic Interventions for Vascular Parkinsonism: A Systematic Review and Meta-analysis". Frontiers in Neurology. 8: 481. doi:10.3389/fneur.2017.00481. PMC 5614922. PMID 29018399.
- ↑ Nuytemans K, Theuns J, Cruts M, Van Broeckhoven C (July 2010) [18 May 2010]. "Genetic etiology of Parkinson disease associated with mutations in the SNCA, PARK2, PINK1, PARK7, and LRRK2 genes: a mutation update". Human Mutation. 31 (7): 763–80. doi:10.1002/humu.21277. PMC 3056147. PMID 20506312.
- ↑ Aarsland D, Londos E, Ballard C (April 2009) [28 January 2009]. "Parkinson's disease dementia and dementia with Lewy bodies: different aspects of one entity". International Psychogeriatrics. 21 (2): 216–9. doi:10.1017/S1041610208008612. PMID 19173762. S2CID 5433020.
- ↑ Jubault T, Brambati SM, Degroot C, Kullmann B, Strafella AP, Lafontaine AL, Chouinard S, Monchi O (December 2009). Gendelman HE (ed.). "Regional brain stem atrophy in idiopathic Parkinson's disease detected by anatomical MRI". PLOS ONE. 4 (12): e8247. Bibcode:2009PLoSO...4.8247J. doi:10.1371/journal.pone.0008247. PMC 2784293. PMID 20011063.
- ↑ Davie CA (2008). "A review of Parkinson's disease". British Medical Bulletin. 86 (1): 109–27. doi:10.1093/bmb/ldn013. PMID 18398010.
- ↑ Villar-Piqué A, Lopes da Fonseca T, Outeiro TF (October 2016). "Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies". Journal of Neurochemistry. 139 Suppl 1: 240–255. doi:10.1111/jnc.13249. PMID 26190401. S2CID 11420411.
- ↑ Burré J, Sharma M, Südhof TC (March 2018). "Cell Biology and Pathophysiology of α-Synuclein". Cold Spring Harbor Perspectives in Medicine. 8 (3): a024091. doi:10.1101/cshperspect.a024091. PMC 5519445. PMID 28108534.
- ↑ Dickson DV (2007). "Neuropathology of movement disorders". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Hagerstown, MD: Lippincott Williams & Wilkins. pp. 271–83. ISBN 978-0-7817-7881-7.
- ↑ ۵۷٫۰ ۵۷٫۱ ۵۷٫۲ Obeso JA, Rodríguez-Oroz MC, Benitez-Temino B, Blesa FJ, Guridi J, Marin C, Rodriguez M (2008). "Functional organization of the basal ganglia: therapeutic implications for Parkinson's disease". Movement Disorders. 23 Suppl 3 (Suppl 3): S548–59. doi:10.1002/mds.22062. PMID 18781672. S2CID 13186083.
- ↑ ۵۸٫۰۰ ۵۸٫۰۱ ۵۸٫۰۲ ۵۸٫۰۳ ۵۸٫۰۴ ۵۸٫۰۵ ۵۸٫۰۶ ۵۸٫۰۷ ۵۸٫۰۸ ۵۸٫۰۹ ۵۸٫۱۰ ۵۸٫۱۱ ۵۸٫۱۲ ۵۸٫۱۳ ۵۸٫۱۴ ۵۸٫۱۵ ۵۸٫۱۶ ۵۸٫۱۷ ۵۸٫۱۸ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Diagnosing Parkinson's Disease". Parkinson's Disease. London: Royal College of Physicians. pp. 29–47. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Diagnosing Parkinson's Disease". Parkinson's Disease. London: Royal College of Physicians. pp. 29–47. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ ۶۰٫۰ ۶۰٫۱ ۶۰٫۲ ۶۰٫۳ Poewe W, Wenning G (November 2002). "The differential diagnosis of Parkinson's disease". European Journal of Neurology. 9 Suppl 3 (Suppl 3): 23–30. doi:10.1046/j.1468-1331.9.s3.3.x. PMID 12464118.
- ↑ Gibb WR, Lees AJ (June 1988). "The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson's disease". Journal of Neurology, Neurosurgery, and Psychiatry. 51 (6): 745–52. doi:10.1136/jnnp.51.6.745. PMC 1033142. PMID 2841426.
- ↑ ۶۲٫۰ ۶۲٫۱ ۶۲٫۲ ۶۲٫۳ Brooks DJ (April 2010). "Imaging approaches to Parkinson disease". Journal of Nuclear Medicine. 51 (4): 596–609. doi:10.2967/jnumed.108.059998. PMID 20351351.
- ↑ Schwarz ST, Afzal M, Morgan PS, Bajaj N, Gowland PA, Auer DP (2014). "The 'swallow tail' appearance of the healthy nigrosome – a new accurate test of Parkinson's disease: a case-control and retrospective cross-sectional MRI study at 3T". PLOS ONE. 9 (4): e93814. Bibcode:2014PLoSO...993814S. doi:10.1371/journal.pone.0093814. PMC 3977922. PMID 24710392.
- ↑ Schwarz ST, Afzal M, Morgan PS, Bajaj N, Gowland PA, Auer DP (2014). "The 'swallow tail' appearance of the healthy nigrosome – a new accurate test of Parkinson's disease: a case-control and retrospective cross-sectional MRI study at 3T". PLOS ONE. 9 (4): e93814. Bibcode:2014PLoSO...993814S. doi:10.1371/journal.pone.0093814. PMC 3977922. PMID 24710392.
- ↑ Cho SJ, Bae YJ, Kim JM, et al. (September 2020). "Diagnostic performance of neuromelanin-sensitive magnetic resonance imaging for patients with Parkinson's disease and factor analysis for its heterogeneity: a systematic review and meta-analysis". European Radiology. 30 (10): 1268–1280. doi:10.1007/s00330-020-07240-7. PMID 32886201. S2CID 221478854.
- ↑ Suwijn SR, van Boheemen CJ, de Haan RJ, Tissingh G, Booij J, de Bie RM (2015). "The diagnostic accuracy of dopamine transporter SPECT imaging to detect nigrostriatal cell loss in patients with Parkinson's disease or clinically uncertain parkinsonism: a systematic review". EJNMMI Research. 5: 12. doi:10.1186/s13550-015-0087-1. PMC 4385258. PMID 25853018.
- ↑ «"DaTSCAN Approval Letter" (PDF). FDA.gov. Food and Drug Administration. Retrieved 22 March 2019» (PDF).
- ↑ ۶۸٫۰ ۶۸٫۱ ۶۸٫۲ ۶۸٫۳ Stoker TB, Greenland JC, Barker RA (December 2018). The Differential Diagnosis of Parkinson's Disease. Codon Publications. pp. 109–128. doi:10.15586/codonpublications.parkinsonsdisease.2018.ch6. ISBN 978-0-9944381-6-4. PMID 30702835.
- ↑ Levin J, Kurz A, Arzberger T, Giese A, Höglinger GU (February 2016). "The Differential Diagnosis and Treatment of Atypical Parkinsonism". Deutsches Ärzteblatt International. 113 (5): 61–9. doi:10.3238/arztebl.2016.0061. PMC 4782269. PMID 26900156.
- ↑ Greenland J, Stoker TB (2018). Parkinson's Disease: Pathogenesis and Clinical Aspects. Codon Publications. pp. 109–28. ISBN 978-0-9944381-6-4.
- ↑ Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A (2010). "Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies". Journal of Alzheimer's Disease. 20 Suppl 1 (Suppl 1): S221–38. doi:10.3233/JAD-2010-091525. PMID 20182023.
- ↑ Ma C, Liu Y, Neumann S, Gao X (2017). "Nicotine from cigarette smoking and diet and Parkinson disease: a review". Translational Neurodegeneration. 6: 18. doi:10.1186/s40035-017-0090-8. PMC 5494127. PMID 28680589.
- ↑ Dorsey ER, Sherer T, Okun MS, Bloem BR (2018). "The Emerging Evidence of the Parkinson Pandemic". J Parkinsons Dis (Review). 8 (s1): S3–8. doi:10.3233/JPD-181474. PMC 6311367. PMID 30584159.
- ↑ Gagne JJ, Power MC (March 2010). "Anti-inflammatory drugs and risk of Parkinson disease: a meta-analysis". Neurology. 74 (12): 995–1002. doi:10.1212/WNL.0b013e3181d5a4a3. PMC 2848103. PMID 20308684.
- ↑ Connolly BS, Lang AE (30 April 2014). "Pharmacological treatment of Parkinson disease: a review". JAMA. 311 (16): 1670–83. doi:10.1001/jama.2014.3654. PMID 24756517. S2CID 205058847.
- ↑ ۷۶٫۰ ۷۶٫۱ Olanow CW, Stocchi F, Lang AE (2011). "The non-motor and non-dopaminergic features of PD". Parkinson's Disease: Non-Motor and Non-Dopaminergic Features. Wiley-Blackwell. ISBN 978-1-4051-9185-2. OCLC 743205140.
- ↑ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 59–100. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ Zhang J, Tan LC (2016). "Revisiting the Medical Management of Parkinson's Disease: Levodopa versus Dopamine Agonist". Current Neuropharmacology. 14 (4): 356–63. doi:10.2174/1570159X14666151208114634. PMC 4876591. PMID 26644151.
- ↑ ۷۹٫۰ ۷۹٫۱ Pedrosa DJ, Timmermann L (2013). "Review: management of Parkinson's disease". Neuropsychiatric Disease and Treatment (Review). 9: 321–40. doi:10.2147/NDT.S32302. PMC 3592512. PMID 23487540.
- ↑ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Palliative care in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 147–51. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ Orgeta V, McDonald KR, Poliakoff E, Hindle JV, Clare L, Leroi I (February 2020). "Cognitive training interventions for dementia and mild cognitive impairment in Parkinson's disease". The Cochrane Database of Systematic Reviews. 2020 (2): CD011961. doi:10.1002/14651858.cd011961.pub2. PMC 7043362. PMID 32101639.
- ↑ Maria N (2017). Levodopa pharmacokinetics – from stomach to brain A study on patients with Parkinson's disease. Linköping: Linköping University Electronic Press. p. 10. ISBN 978-9176855577. OCLC 993068595.
- ↑ Oertel WH (13 March 2017). "Recent advances in treating Parkinson's disease". F1000Research (Review). 6: 260. doi:10.12688/f1000research.10100.1. PMC 5357034. PMID 28357055.
- ↑ Aquino CC, Fox SH (January 2015). "Clinical spectrum of levodopa-induced complications". Movement Disorders. 30 (1): 80–89. doi:10.1002/mds.26125. PMID 25488260. S2CID 22301199.
- ↑ Oertel WH (13 March 2017). "Recent advances in treating Parkinson's disease". F1000Research (Review). 6: 260. doi:10.12688/f1000research.10100.1. PMC 5357034. PMID 28357055.
- ↑ Goldenberg MM (October 2008). "Medical management of Parkinson's disease". P & T. 33 (10): 590–606. PMC 2730785. PMID 19750042.
- ↑ Ceravolo R, Frosini D, Rossi C, Bonuccelli U (December 2009). "Impulse control disorders in Parkinson's disease: definition, epidemiology, risk factors, neurobiology and management". Parkinsonism & Related Disorders. 15 Suppl 4 (Suppl 4): S111–15. doi:10.1016/S1353-8020(09)70847-8. PMID 20123548.
- ↑ Tolosa E, Katzenschlager R (2007). "Pharmacological management of Parkinson's disease". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 110–45. ISBN 978-0-7817-7881-7.
- ↑ ۸۹٫۰ ۸۹٫۱ ۸۹٫۲ Alborghetti M, Nicoletti F (2019). "Different Generations of Type-B Monoamine Oxidase Inhibitors in Parkinson's Disease: From Bench to Bedside". Current Neuropharmacology. 17 (9): 861–873. doi:10.2174/1570159X16666180830100754. PMC 7052841. PMID 30160213.
- ↑ Ives NJ, Stowe RL, Marro J, Counsell C, Macleod A, Clarke CE, et al. (September 2004). "Monoamine oxidase type B inhibitors in early Parkinson's disease: meta-analysis of 17 randomised trials involving 3525 patients". BMJ. 329 (7466): 593. doi:10.1136/bmj.38184.606169.AE. PMC 516655. PMID 15310558.
- ↑ Crosby N, Deane KH, Clarke CE (2003). "Amantadine in Parkinson's disease". The Cochrane Database of Systematic Reviews (1): CD003468. doi:10.1002/14651858.CD003468. PMID 12535476.
- ↑ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Non-motor features of Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 113–33. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ Hasnain M, Vieweg WV, Baron MS, Beatty-Brooks M, Fernandez A, Pandurangi AK (July 2009). "Pharmacological management of psychosis in elderly patients with parkinsonism". The American Journal of Medicine. 122 (7): 614–22. doi:10.1016/j.amjmed.2009.01.025. PMID 19559160.
- ↑ «FDA approved».
- ↑ ۹۵٫۰ ۹۵٫۱ Elbers RG, Verhoef J, van Wegen EE, Berendse HW, Kwakkel G (October 2015). "Interventions for fatigue in Parkinson's disease". The Cochrane Database of Systematic Reviews (Review) (10): CD010925. doi:10.1002/14651858.CD010925.pub2. PMID 26447539.
- ↑ ۹۶٫۰ ۹۶٫۱ ۹۶٫۲ ۹۶٫۳ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Surgery for Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 101–11. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ↑ Bronstein JM, Tagliati M, Alterman RL, et al. (February 2011). "Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues". Archives of Neurology. 68 (2): 165. doi:10.1001/archneurol.2010.260. PMC 4523130. PMID 20937936.
- ↑ Dallapiazza RF, Vloo PD, Fomenko A, et al. (2018). "Considerations for Patient and Target Selection in Deep Brain Stimulation surgery for Parkinson's disease". In Stoker TB, Greenland JC (eds.). Parkinson's disease: Pathogenesis and clinical aspects. Brisbane: Codon Publications.
- ↑ جم، جدیدترین اخبار ایران و جهان خبرگزاری جام (۹ مرداد ۱۳۹۸). «فیزیوتراپی پارکینسون: توانبخشی به بیماران پارکینسون با ورزش». fa. دریافتشده در ۲۰۲۱-۱۲-۱۱.
- ↑ ۱۰۰٫۰ ۱۰۰٫۱ Goodwin VA, Richards SH, Taylor RS, Taylor AH, Campbell JL (April 2008). "The effectiveness of exercise interventions for people with Parkinson's disease: a systematic review and meta-analysis". Movement Disorders. 23 (5): 631–40. doi:10.1002/mds.21922. hdl:10871/17451. PMID 18181210. S2CID 3808899.
- ↑ Jin X, Wang L, Liu S, Zhu L, Loprinzi PD, Fan X (December 2019). "The Impact of Mind-body Exercises on Motor Function, Depressive Symptoms, and Quality of Life in Parkinson's Disease: A Systematic Review and Meta-analysis". International Journal of Environmental Research and Public Health. 17 (1): 31. doi:10.3390/ijerph17010031. PMC 6981975. PMID 31861456.
- ↑ ۱۰۲٫۰ ۱۰۲٫۱ ۱۰۲٫۲ ۱۰۲٫۳ O'Sullivan SB, Schmitz TJ (2007). "Parkinson's Disease". Physical Rehabilitation (5th ed.). Philadelphia: F.A. Davis. pp. 856–57.
- ↑ Ramazzina I, Bernazzoli B, Costantino C (31 March 2017). "Systematic review on strength training in Parkinson's disease: an unsolved question". Clinical Interventions in Aging. 12: 619–628. doi:10.2147/CIA.S131903. PMC 5384725. PMID 28408811.
- ↑ Fox CM, Ramig LO, Ciucci MR, Sapir S, McFarland DH, Farley BG (November 2006). "The science and practice of LSVT/LOUD: neural plasticity-principled approach to treating individuals with Parkinson disease and other neurological disorders". Seminars in Speech and Language. 27 (4): 283–99. doi:10.1055/s-2006-955118. PMID 17117354.
- ↑ Dixon L, Duncan D, Johnson P, et al. (July 2007). "Occupational therapy for patients with Parkinson's disease". The Cochrane Database of Systematic Reviews (3): CD002813. doi:10.1002/14651858.CD002813.pub2. PMC 6991932. PMID 17636709.
- ↑ Ferrell B, Connor SR, Cordes A, et al. (June 2007). "The national agenda for quality palliative care: the National Consensus Project and the National Quality Forum". Journal of Pain and Symptom Management. 33 (6): 737–44. doi:10.1016/j.jpainsymman.2007.02.024. PMID 17531914.
- ↑ ۱۰۷٫۰ ۱۰۷٫۱ Lorenzl S, Nübling G, Perrar KM, Voltz R (2013). "Palliative treatment of chronic neurologic disorders". Ethical and Legal Issues in Neurology. Handbook of Clinical Neurology. 118. pp. 133–39. doi:10.1016/B978-0-444-53501-6.00010-X. ISBN 978-0-444-53501-6. PMID 24182372.
- ↑ Ghoche R (December 2012). "The conceptual framework of palliative care applied to advanced Parkinson's disease". Parkinsonism & Related Disorders. 18 Suppl 3 (Suppl 3): S2–5. doi:10.1016/j.parkreldis.2012.06.012. PMID 22771241.
- ↑ ۱۰۹٫۰ ۱۰۹٫۱ Wilcox SK (January 2010). "Extending palliative care to patients with Parkinson's disease". British Journal of Hospital Medicine. 71 (1): 26–30. doi:10.12968/hmed.2010.71.1.45969. PMID 20081638.
- ↑ Moens K, Higginson IJ, Harding R (October 2014). "Are there differences in the prevalence of palliative care-related problems in people living with advanced cancer and eight non-cancer conditions? A systematic review". Journal of Pain and Symptom Management. 48 (4): 660–77. doi:10.1016/j.jpainsymman.2013.11.009. PMID 24801658.
- ↑ Casey G (August 2013). "Parkinson's disease: a long and difficult journey". Nursing New Zealand. 19 (7): 20–24. PMID 24195263.
- ↑ «Parkinson's disease - Wikipedia».
منابع
[ویرایش]- Twelves, D. , Perkins, K.S. and Counsell, C. , 2003. Systematic review of incidence studies of Parkinson's disease. Movement disorders: official journal of the Movement Disorder Society, 18(1), pp. 19–31.
- Daher, J.P. , Abdelmotilib, H.A. , Hu, X. , Volpicelli-Daley, L.A. , Moehle, M.S. , Fraser, K.B. , Needle, E. , Chen, Y. , Steyn, S.J. , Galatsis, P. and Hirst, W.D. , 2015. Leucine-rich repeat kinase 2 (LRRK2) pharmacological inhibition abates α-synuclein gene-induced neurodegeneration. Journal of Biological Chemistry, 290(32), pp. 19433–19444.
- امید تازه برای تشخیص ابتلا به پارکینسون در مراحل نخستین، خبرگزاری جمهوری اسلامی
- درمان پارکینسون با داروی مالاریا، خبرگزاری جمهوری اسلامی، ایرنا
- سایت پزشکان بدون مرز
- پایگاه جامع اطلاعرسانی پزشکان ایران
- سیمای جمهوری اسلامی ایران
