هلیوم
| هلیوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /ˈhiːliəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۴٫۰۰۲۶۰۲(۲)[۱] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| هلیوم در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | ۱۸ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره ۱ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | گاز نجیب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | 1s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | گاز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | ۰٫۹۵ K (۲۷۲٫۲۰− °C, ۴۵۷٫۹۶− °F) (در ۲٫۵ مگاپاسکال) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | ۴٫۲۲۲ K (۲۶۸٫۹۲۸− °C, −۴۵۲٫۰۷۰ °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (در STP) | ۰٫۱۷۸۶ g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | ۰٫۱۴۵ g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (در نقطه جوش) | ۰٫۱۲۵ g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | ۲٫۱۷۷ K, ۵٫۰۴۳ kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه بحرانی | ۵٫۱۹۵۳ K, ۰٫۲۲۷۴۶ MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | ۰٫۰۱۳۸ kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | ۰٫۰۸۲۹ kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | ۲۰٫۷۸ J/(mol·K)[۲] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار (براساس ITS-90)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: بدون اطلاعات | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm ۲۸ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | ۱۴۰ pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | hexagonal close-packed (hcp) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت | ۹۷۲ m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | ۰٫۱۵۱۳ W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | دیامغناطیس[۳] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پذیرفتاری مغناطیسی | ۱۰−۶×۱٫۸۸− cm3/mol (۲۹۸ کلوین)[۴] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | ۷۴۴۰-۵۹-۷ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نامگذاری | از واژهٔ یونانی هلیوس به معنای «ایزد خورشید» گرفته شدهاست | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | ژول ژانسن، نورمن لاکیر (۱۸۶۸) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انزوا اول | ویلیام رمزی، پر تئودر کلیو، نیلز آبراهام لانگلت (۱۸۹۵) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای هلیوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
هِلیوم یا هلیُم (به انگلیسی: Helium، با نشان شیمیایی He) یک عنصر شیمیایی با عدد اتمی ۲ و جرم اتمی ۴٫۰۰۲۶۰۲ است. این عنصر، بیبو، بیرنگ، بیمزه، غیرسمّی و از دیدگاه شیمیایی بیاثر و تک اتمی است که در جدول تناوبی در بالای گروه گازهای نجیب جا دارد.[الف] دمای ذوب و جوش این ماده در میان دیگر عنصرها بسیار پایین است، بههمین دلیل در دمای اتاق و البته در بیشتر موارد به صورت گازی است مگر اینکه تحت شرایط بسیار ویژهای قرار داشته باشد.
واژهٔ هلیوم از واژهٔ یونانی هلیوس، به معنای «ایزد خورشید» گرفته شده است. زمانی که هنوز هلیوم شناخته نشده بود، ستارهشناس فرانسوی ژول ژانسن در جریان خورشیدگرفتگی سال ۱۸۶۸ برای نخستین بار در طیفبینی نور خورشید، خط زرد طیفی هلیوم را دید. در جریان همان خورشیدگرفتگی، نورمن لاکیر پیشنهاد کرد این خط زرد میتواند به دلیل یک عنصر تازه باشد. دو شیمیدان سوئدی با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت در سال ۱۸۹۵ این عنصر را شناسایی و اعلام کردند. آنها هلیوم را از سنگ کلویت که کانی اورانیوم است، بهدست آوردند. در سال ۱۹۰۳ منابع بزرگ هلیوم در میدانهای گازی ایالات متحده پیدا شد.
هلیوم، بعد از هیدروژن، هم از نظر سبکی و هم از نظر فراوانی، دومین عنصر کیهان است، گرچه با وجود کاربردهای بسیار مهم و حیاتی که دارد، بر روی زمین بسیار کمیاب است. نزدیک به ۲۴٪ از جرم گیتی، سهم این عنصر است که این مقدار بیش از ۱۲ برابر ترکیب تمام عنصرهای سنگین است. هلیوم به همان صورت که در خورشید و مشتری یافت میشود، در جهان پیدا میشود و این به دلیل انرژی بستگی (به ازای هر هسته) بسیار بالای هلیوم-۴ نسبت به سه عنصر دیگر پس از آن، در جدول تناوبی است. بیشتر هلیوم موجود در کیهان، هلیوم-۴ است و گمان میرود که در جریان مهبانگ پدید آمده باشد. امروزه با کمک واکنشهای همجوشی هستهای در ستارهها، گونههای تازهای از هلیوم ساخته شده است.
هلیوم در هواکُرهٔ زمین بسیار کمیاب است و بیشتر هلیومی که در خاک زمین پیدا میشود، در اثر واپاشی هستهای طبیعی در عنصرهای سنگین پرتوزا مانند اورانیوم و توریوم پدید آمده است؛ به این ترتیب که در اثر واپاشی، ذرههای بتا از عنصر تابیده شده و هستهٔ هلیوم-۴ بهدست آمده است. هلیومِ بهدست آمده از واپاشی، بهآسانی به صورت فشرده با درصدی نزدیک به ۷٪ حجمی، در دام گاز طبیعی گرفتار میشود. سپس میتوان با روشهای صنعتی و به صورت تجاری با کاهش دمای آمیختهٔ هلیوم و گاز طبیعی، آن را از دیگر گازها به روش تقطیر جزء به جزء جدا ساخت.
هلیوم در بسیاری از صنایع در سطح جهانی استفاده میشود و استفاده از آن در همه زمینههای تحقیقات علمی و محیطهای تجاری، از جمله داروسازی، پزشکی، جوشکاری، علوم رایانه، اکتشافات فضایی وجود دارد. یکی از کاربردهای مهم هلیوم در سرماشناسی است و نزدیک به یک-چهارم هلیوم تولیدی در این زمینه بکار میرود. در مواردی که دمای زیر ۲۶۱٫۱- درجه سانتیگراد (۴۲۹- درجه فارنهایت) مورد نیاز باشد هیچ جایگزینی برای آن وجود ندارد. قدرت خنککنندگی هلیوم مایع به این معنی است که این عنصر یک عنصر حیاتی و غیرقابل تعویض در بسیاری از اجزای مهم و مدرن است. عمدهترین مصرفکنندگان صنعتی جهانی هلیوم مایع، صنایع پزشکی، هوافضا و الکترونیک هستند. صنعت پزشکی بزرگترین مصرفکننده است و عمدتاً از هلیوم برای حفظ خواص ابررسانایی آهنربا در کاربردهایی مانند تصاویر تشدید مغناطیسی (MRI) و تجهیزات طیفسنجی تشدید مغناطیسی هستهای (NMR) استفاده میکند.
تاریخچه
[ویرایش]اکتشافات علمی
[ویرایش]

نخستین نشانهٔ هلیوم در ۱۸ اوت سال ۱۸۶۸ به صورت یک میلهٔ زرد رنگ در طول موج ۵۸۷٫۴۹ نانومتر در طیفسنجی فامسپهر خورشید دیده شد. این خط زرد رنگ را ستارهشناس فرانسوی ژول ژانسن در هنگام یک خورشیدگرفتگی کامل در گونتور هند شناسایی کرد.[۱۲][۱۳] نخست گمان برده شد که شاید این خط زرد، سدیم است. در ۲۰ اکتبر همان سال، ستارهشناس انگلیسی، نورمن لاکیر یک خط زرد رنگ در طیفسنجی نور خورشید پیدا کرد و چون این خط نزدیک به خطهای شناخته شدهٔ D۱ و D۲ سدیم بود، آن را D۳ خطهای فرانهوفر نامید.[۱۴] او حدس زد که این خط باید توسط یک عنصر درون خورشید که در زمین ناشناخته است، پدید آمده باشد. لاکیر و شیمیدان انگلیسی ادوارد فرانکلند واژهٔ یونانی ایلیوس[a] (یا هلیوس) به معنی «خورشید» را برای این عنصر برگزیدند.[۱۵][۱۶] در ۱۸۸۱، فیزیکدان ایتالیایی، لوئیجی پالمیری، هنگامی که خطهای طیفی D۳ گدازههای آتشفشان وزوو را پردازش میکرد توانست برای نخستین بار هلیوم را در زمین شناسایی کند.[۱۷]
در ۲۶ مارس ۱۸۹۵ شیمیدان اسکاتلندی ویلیام رمزی توانست، هلیوم کانی کلویت را با کمک اسیدهای معدنی به دام اندازد. کلویت، آمیختهای از اورانینیت و دست کم ۱۰٪ عنصرهای خاکی کمیاب است. رمزی در جستجوی آرگون بود، اما پس از جداسازی نیتروژن و اکسیژن از گاز آزاد شده با کمک اسید سولفوریک، در طیفسنجی خود به یک خط زرد روشن رسید که با خط D۳ دیده شده در طیفسنجی خورشید هماهنگ بود.[۱۴][۱۸][۱۹][۲۰] این نمونهها از سوی لاکیر و فیزیکدان بریتانیایی، ویلیام کروکز به عنوان هلیوم شناسایی شد. در همان سال به صورت مستقل، دو شیمیدان با نامهای پر تئودر کلیو و نیلز آبراهام لانگلت، در اوپسالای سوئد توانستند هلیوم کلویت را به دام اندازند. اندازه گازی که آنها جمعآوری کردند، برای اندازهگیری دقیق وزن اتمی آن کافی بود.[۱۳][۲۱][۲۲] دانشمند آمریکایی زمینشیمی، ویلیام فرانسیس هیلهبراند پیش از دستآورد رمزی، هنگام طیفسنجی نمونه کانیهای اورانینیت دریافته بود که خطهای طیفی غیرمعمولی در نتیجههایش پیدا میشود. اما هیلبرند گمان کرد که این خطهای طیفی مربوط به نیتروژن است. نامهٔ تبریک او به رمزی چیزی نزدیک به یک کشف علمی در نظر گرفته میشود.[۲۳] در سال ۱۹۰۷ ارنست رادرفورد و توماس رویدز نشان دادند که ذرههای آلفا همان هستهٔ هلیوماند. آنها برای این کار، اجازه دادند تا ذرهها در دیوار شیشهای نازک یک لولهٔ تهی نفوذ کند. سپس لوله را تخلیه کردند تا گاز تازهٔ جمع شده در آن را طیفسنجی کنند. در سال ۱۹۰۸ یک فیزیکدان هلندی به نام هایک کامرلینگ اونس توانست دمای هلیوم را به زیر یک کلوین برساند و آن را مایع کند.[۲۴] او در ادامه تلاش کرد تا دمای هلیوم را پایینتر آورد و آن را جامد کند، اما کامیاب نشد. دلیل ناکامی او این بود که هلیوم دارای نقطهٔ سهگانه نیست؛ یعنی دارای دمایی نیست که در آن حالتهای جامد، مایع و گازی در تعادل باشند. پس از چند سال، در ۱۹۲۶ ویلم هندریک کیزوم که دانشجوی اونس بود توانست 1 cm۳ هلیوم را با افزودن فشار، جامد کند.[۲۵]
در ۱۹۳۸، فیزیکدان روس، پیوتر کاپیتسا دریافت که در دمای نزدیک به صفر مطلق، هلیوم-۴ تقریباً هیچ میزان گرانروی ندارد که امروزه به این پدیده ابرشارگی گفته میشود.[۲۶] این پدیده با چگالش بوز-اینشتین مرتبط است. در سال ۱۹۷۲ همین پدیده در هلیوم-۳ اما این بار در دمایی بسیار نزدیکتر به صفر مطلق، دیده شد. دانشمندان آمریکایی داگلاس اوشروف، دیوید موریس لی و رابرت کلمن ریچاردسون کسانی بودند که به ابرروانروی در هلیوم-۳ پی بردند. با در نظر گرفتن جفتهای کوپر الکترونها که پدیدآورندهٔ ابررسانایی هستند، گمان میرود که ابرگرانروی دیده شده در هلیوم-۳ نیز بهصورت قابل مقایسهای به جفتشدن فرمیونهای هلیوم-۳ در جهت تولید بوزونها مرتبط است.[۲۷]
ویژگیها
[ویرایش]

هلیوم یک گاز سبک، بیبو، بیرنگ، بی اثر، بدون سمیت و تک هستهای است که میتواند مولکولهای دواتمی ضعیف و در دمای نزدیک به صفر مطلق ایجاد کند. هلیوم کمترین نقطه ذوب را در بین عناصر دارد و نقطه جوش آن نزدیک به صفر مطلق و گرانرویش ۲۵ میکروپواز (آب = ۱۰ هزار) است. برخلاف هر عنصر دیگر، هلیوم جامد نمیشود اما تحت فشارهای معمولی به صورت مایع تا صفر مطلق باقی میماند.[۲۸]
در دمای حدود منفی ۲۷۱ درجه سانتیگراد (۴۵۶- درجه فارنهایت)، هلیوم دچار یک تغییر غیرمعمول میشود و به صورت یک مایع باقی میماند که دارای ویژگیهای منحصر به فردی است. اشکال هلیوم به قدری متفاوت است که به آنها نامهای مختلفی داده میشود. بالاتر از ۲۷۱- درجه سانتیگراد، هلیوم مایع را هلیوم I و زیر آن دما، هلیوم II نامیده میشود.[۲۹] از هوا سبکتر است. قابل اشتعال نیست و فقط کمی در آب قابل حل است.[۳۰] هلیوم (He۲) با داشتن انحلالپذیری ۰٫۰۷۰۷۹۷ مول از هلیوم در هر ۵-۱۰ از مجموع مول هلیوم (حل شونده) و آب (حلال)، بهعنوان یکی از گازهایی شناخته میشود که دارای کمترین میزان انحلال در آب است (بهعنوان مقایسه کسر مولی حلالیت برای گازهای CF۴ و SF۶ و C۴F۸ به ترتیب برابر با ۰٫۳۸۰۲، ۰٫۴۳۹۴ و ۰٫۲۳۷۲ به ازای هر ۵-۱۰ مول گاز حل شونده و حلال آب است).[۳۱] از نظر شیمیایی بیاثر است. هنگامی که به صورت مایع حمل میشود، بسیار سرد است و تمام گازهای دیگر را جامد میکند. تماس با مایع باعث یخ زدگی شدید میشود. هلیوم مایع دارای خصوصیات ترمودینامیکی منحصر به فردی است و مایع کوانتومی نامیده میشود زیرا خصوصیات اتمی را در مقیاس ماکروسکوپی از خود نشان میدهد.[۳۲][۳۳]
هلیوم، پس از نئون، کم واکنشترین گاز نجیب و البته دومین عنصر کم واکنش پذیر در میان همه عنصرهاست.[۳۴] این گاز کم واکنش در همهٔ شرایط استاندارد به صورت تکاتمی باقی میماند. هلیوم به دلیل داشتن جرم مولی نسبتاً پایین، دارای رسانش گرمایی و ظرفیت گرمایی بالایی است و سرعت صدا هم در آن، در حالت گازی، از هر گاز دیگری به جز هیدروژن، بالاتر است. همچنین به دلیل کوچکی اندازهٔ اتم هلیوم، نرخ واپخش در اجسام جامد، سه برابر بیشتر از نرخ واپخش هوا و برابر با ۶۵٪ نرخ واپخش هیدروژن است.[۱۴]
ضریب شکست هلیوم بیش از هر گاز دیگری به یک نزدیک است.[۳۵] ضریب ژول-تامسون[b] هلیوم در دمای معمولی پیرامونش، منفی است به این معنی که اگر اجازه دهیم این گاز آزادانه افزایش حجم پیدا کند، گرمتر میشود. اما اگر هلیوم در زیر دمای وارونگی ژول-تامسون[c] (در حدود ۳۲ تا ۵۰ کلوین در یک اتمسفر) باشد، اگر آزادانه افزایش حجم پیدا کند، دمای آن پایین میآید. با توجه به این ویژگی اگر دمای هلیوم از این دما پایینتر آمده باشد، میتوان با افزایش حجم، آن را خنک و مایع کرد.[۱۴]
بیشتر هلیوم فرازمینی در حالت پلاسما یافت میشود. در این حالت، ویژگیهای ماده از ویژگیهای حالت اتمی آن بسیار متفاوت است. در حالت پلاسما، الکترونها دیگر در بند هسته نیستند در نتیجه دارای رسانایی الکتریکی بسیار بالایی خواهد بود حتی اگر تنها بخشی از آن یونی شده باشد. ذرههای باردار به شدت از میدان مغناطیسی و الکتریکی پیرامون تأثیر میپذیرند. برای نمونه در بادهای خورشیدی با هیدروژن یونی، ذرهها با مغناطیسسپهر اندرکنش پیدا میکند و باعث پدید آمدن شفق قطبی و جریان برکلند میشود.[۳۶]
هلیوم مایع
[ویرایش]
برخلاف دیگر عنصرها، هلیوم در فشار معمولی تا دمای صفر مطلق، مایع باقی میماند. دلیل این پدیده را میتوان با مکانیک کوانتوم توضیح داد: انرژی نقطهٔ صفر بسیار بالای این سامانه اجازه نمیدهد هلیوم جامد شود. هلیوم برای جامد شدن باید به دمایی بین ۱ تا ۱٫۵ کلوین (۴۵۷- فارنهایت یا ۲۷۲- سلسیوس) و فشاری نزدیک به ۲٫۵ مگاپاسکال برسد.[۳۷] معمولاً شناسایی هلیوم جامد از مایع کمی دشوار است؛ چون ضریب شکست هر دو بسیار نزدیک است. هلیوم در حالت جامد دارای نقطهٔ ذوب دقیق است، ساختار بلوری دارد و بسیار تراکم پذیر است تا حدی که با وارد کردن فشار بر آن میتوان تا بیش از ۳۰ درصد حجم آن را کاهش داد.[۳۸] مدول حجمی آن نزدیک به ۲۷ مگاپاسکال است؛[۳۹] یعنی تقریباً ۱۰۰ برابر بیشتر از آب تراکمپذیر است. چگالی هلیوم جامد در دمای ۱٫۱ کلوین و فشار ۶۶ اتمسفر، ۰٫۲۱۴ ± ۰٫۰۰۶ g/cm۳ و در دمای صفر کلوین و فشار ۲۵ بار (۲٫۵ مگاپاسکال)، ۰٫۱۸۷ ± ۰٫۰۰۹ g/cm۳ است.[۴۰]
هلیوم I
[ویرایش]ایزوتوپ هلیوم-۴ بهصورت یک مایع بیرنگ در زیر دمای نقطه جوش در ۴٫۲۲ درجه کلوین و بالای نقطه لاندا در دمای ۲٫۱۷۶۸ درجه کلوین وجود دارد که به آن هلیوم I گفته میشود.[۱۴] همانند دیگر مایعات سرمازا،[d] هلیوم I نیز زمانی که گرم شود، به جوش میآید و زمانی دمایش کاهش پیدا کند، دچار انقباض میشود. در زیر نقطه لاندا، با اینحال، هلیوم نمیجوشد و هرچه دما کاهش پیدا کند، منبسط میشود. هلیوم I دارای ضریب شکست برابر با ۱٫۰۲۶ است که موجب میشود سطح آن بهقدری سخت شود که شناوری یونولیت بر روی آن ممکن شود و اغلب از این روش، بهعنوان روشی برای پیدا کردن سطح هلیوم I بهکار میرود.[۱۴]
هلیوم I گرانروی بسیار کمی دارد و چگالی آن در گستره دمایی صفر تا چهار درجه کلوین بین ۰٫۱۴۵ تا ۰٫۱۲۵ گرم بر میلیلیتر است[۴۱] که این مقدار، یک چهارم مقداری است که توسط فیزیک کلاسیک پیشبینی میشود.[۱۴] برای توضیح این خاصیت هلیوم I، به مکانیک کوانتومی نیاز است و در نتیجه هر دو حالت هلیوم مایع شناخته شده (هلیوم I و هلیوم II)، مایعات کوانتومی نامیده میشوند؛ به این معنی که آنها در سطح ماکروسکوپی، خواص اتمی از خود نشان میدهند. این موضوع ممکن است بهخاطر نزدیکی بیش از حد نقطه جوش هلیوم به صفر مطلق باشد که موجب میشود جنبش تصادفی مولکولی نتواند بر روی ویژگی اتمی سایه افکند و مانع از بروز آنها شود.[۱۴]
هلیوم II
[ویرایش]
هلیوم مایع در دمای پایینتر از نقطه لاندا هلیوم II نامیده میشود، رفتار بسیار عجیب و غیرمعمولی از خود نشان میدهد. بهعلت هدایت گرمایی بالا، زمانیکه به نقطه جوش میرسد، بهجای این که شروع به جوشیدن و تولید حباب کند، مستقیماً از سطح خود تبخیر میشود. هلیوم-۳، دارای یک فاز ابرشارگی اما فقط در دماهای خیلی کمتر است. در نتیجه، اطلاعات کمی در مورد خواص ایزوتوپ شناخته شده است.[۱۴]
هلیوم II یک ابرشاره است؛ حالتی از ماده در مکانیک کوانتومی (برای اطلاعات بیشتر به پدیدههای کوانتومی در مقیاس ماکروسکوپی رجوع کنید) که دارای خواص غیرمعمول و عجیبی است. بهعنوان مثال زمانی که درون یک لوله موئین به ضخامت ۷-۱۰ تا ۸-۱۰ متر جاری میشود، هیچ میزان گرانروی قابل اندازهگیری از خود نشان نمیدهد.[۱۳] با اینحال، موقعیکه اندازهگیری گرانروی هلیوم قرار گرفته میان دو دیسک متحرک انجام میشود، مقدار گرانروی بهدست آمده با مقدار گرانروی برای هلیوم گازی، قابل مقایسه است. با استفاده از مدل دوجریانی[e] برای هلیوم II این پدیده را میتوان بهطور نظری توضیح داد. در این مدل، در نظر گرفته میشود که هلیوم مایع در زیر نقطه لاندا دارای نسبتی از اتمهای هلیوم در حالت پایه است که ابرشاره هستند و دقیقاً با گرانروی صفر جریان پیدا میکنند و همچنین دارای نسبتی از اتمهای هلیوم در حالت برانگیخته است که مانند یک سیال معمولی رفتار میکنند.[۴۲]
در اثر چشمه،[f][توضیح ۱] محفظهای ساخته میشود که به یک مخزن هلیوم II متصل است و از طریق یک دیسک تفجوش شده[g] هلیوم ابرشاره بهآسانی از آن چکیده میشود، اما هلیوم غیرشاره نمیتواند از آن عبور کند. اگر قسمت داخلی محفظه حرارت داده شود، هلیوم ابرشاره به هلیوم غیرابرشاره تبدیل میشود. بهمنظور حفظ کسر تعادل هلیوم ابرشاره، آن را از محفظه عبور داده و فشار افزایش داده میشود که موجب ایجاد یک چشمه به سمت بیرون محفظه نگهدارنده میشود.[۴۳]
رسانش گرمایی آن بیشتر از هر نوع ماده شناخته شده دیگری است، بهطوری که مقدار به یک میلیون برابر هدایت گرمایی هلیوم I و چندصد برابر فلزی مانند مس میرسد.[۱۴] این ویژگی به این دلیل رخ میدهد که هدایت گرمایی از طریق سازوکارهای کوانتومی انجام میشود. اغلب موادی که رسانای خوب گرما هستند، دارای یک نوارهای هدایت و ظرفیت از الکترونهای آزادند که به انتقال گرما کمک میکنند. هلیوم II فاقد چنین لایه ظرفیتی است، اما با اینحال، گرما را بهخوبی هدایت میکند. جریان گرما از معادلهای پیروی میکند که مشابه معادله موجی است که برای توصیف نحوه انتشار صوت در هوا استفاده میشود. زمانی که گرما آغاز میشود، با سرعتی برابر با ۲۰ متر بر ثانیه در دمای ۱٫۸ کلوین در هلیوم II، همانند انتقال امواج در پدیدهای معروف بهنام موج دوم[h][توضیح ۲] منتقل میشود.[۱۴]
زمانیکه سطح هلیوم II از تراز آن پیشی بگیرد برخلاف نیروی جاذبه وارده به نمونه، در امتداد سطح حرکت میکند. چنانچه ظرف نمونه روباز باشد بهشکل عجیبی از کنارهها از ظرف خارج میشود تا اینکه خود را به نواحی با دمای بالاتر برساند و در آنجا شروع به تبخیر شدن میکند. نمونه هلیوم II فارغ از سطح ماده، در یک فیلم دارای ضخامت ۳۰ نانومتری حرکت میکند. به این فیلم، اصطلاحاً فیلم رولین[i] گفته میشود و به افتخار برنارد وی. رولین،[j] کسی که برای اولینبار این ویژگی را شرح داد، نامگذاری شده است.[۱۴][۴۴][۴۵] در نتیجه این رفتار هلیوم میتواند به سرعت از طریق روزنههای کوچک تراوش کند و بر همین مبنا، نگهداری هلیوم مایع بسیار دشوار است. اگر محفظههای نگهداری هلیوم با دقت بالایی ساخته نشوند و دارای روزنه حتی در ابعاد کوچک باشند، هلیوم میتواند از طریق آنها خارج شود تا به سطوح گرمتر برسد و در آنجا تبخیر شود. امواج منتشر شونده در طول فیلم رولینگ از همان معادلهای که برای توصیف موج گرانشی در آب کم عمق بهکار میرود، پیروی میکنند، اما برخلاف جاذبه، عامل پیشبرنده نیروی واندروالسی است.[۴۶] این امواج به صوت سوم[k] معروفند.[۴۷]
حالت اتمی
[ویرایش]
از نقطه نظر مکانیک کوانتومی، هلیوم دومین اتم ساده پس از هیدروژن، برای ساخت مدل کوانتومی است. هلیوم متشکل از دو الکترون در حال چرخش در اوربیتالهای اتمی است که حول یک هسته دارای دو پروتون و (معمولاً) دو نوترون قرار دارند. در مکانیک نیوتونی، برای سیستمهای بیش از دو ذره، امکان یافتن آنالیز دقیق ریاضی وجود ندارد (برای این موضوع به مسئله سه جسم رجوع کنید) و هلیوم نیز با داشتن دو الکترون و یک هسته، یک سیستم سهذرهای محسوب میشود و در نتیجه امکان انجام محاسبات ریاضی با کمک مکانیک کلاسیک برای آن وجود ندارد؛ بنابراین، روشهای عددی ریاضی برای آنالیز آن مورد نیاز است. روشهای محاسباتی متداول در شیمی که برای ایجاد تصویری کوانتومی از الکترون استفاده میشوند، در برخی از مراحل محاسبه نسبت به مقادیر واقعی، خطایی کمتر از دو درصد دارند. چنین مدلهایی نشان میدهند که هر الکترون در اتم هلیوم بخشی از هسته را پوشش میدهد که در نتیجه چنین پوششی، بار مؤثر هستهای که هر الکترون با آن مواجه است، حدود ۱٫۶۹ واحد است و نه دو واحد؛ که بهطور کلاسیک از یک هسته نپوشیده هلیوم انتظار میرود.[۴۸]
پایداری هسته هلیوم-۴
[ویرایش]هسته اتم هلیوم-۴ برابر یک ذره آلفا است.[۴۹] آزمایشهای انرژی بالای تفرق الکترونی[l] نشان میدهد که بار هسته همانند چگالی ابر الکترون هرچه از مرکز اتم دور شویم کمتر میشود. این تقارن در توزیع بار نمایانگر یکی از اصول زیربنایی فیزیک است. اصلی که میگوید دو نوترون و دو پروتون موجود در هسته اتم هلیوم همانند دو الکترونی که به دور هسته میچرخند، از قواعد یکسان کوانتومی پیروی میکنند اگرچه نوع پتانسیل پیوندی هستهای برای ذرههای هستهای متفاوت است، بهطوری که همه این فرمیونها بهشکل کامل اوربیتالهای 1s را اشغال میکنند و هیچکدام دارای ممان زاویهای اوربیتالی نیستند، چراکه هر یک اسپین ذاتی دیگری را خنثی میکنند. افزودن به هر کدام از این ذرهها، نیازمند ممان زاویهای است و در نتیجه آن، انرژی کمتری آزاد میکند در حقیقت، هیچ هستهای با پنج ذره هستهای پایدار نیست. این آرایش از لحاظ انرژی برای همه این ذرهها بسیار پایدار است و این پایداری عامل حقایق بسیار مهمی در مورد ذات و طبیعت هلیوم است. برای مثال پایداری و انرژی کم ابر الکترونی در هلیوم عامل بیمیلی و واکنش پذیری بسیار کم این اتم است. همچنین، عدم برهمکنش اتمهای هلیوم با یکدیگر، موجب میشود که هلیوم دارای پایینترین نقطه ذوب و جوش در بین تمامی عناصر باشد.[۵۰]
بهصورت مشابهی، پایداری ویژه ذرههای هستهای هلیوم-۴ از لحاظ انرژی، موجب ایجاد اثرات مشابهی میشود که در نتیجه آن، تولید هلیوم-۴ بر اثر واکنشهای اتمی در فرایندهای همجوشی یا شکافت ذرههای سنگین آسان میشود. برخی از اتمهای پایدار هلیوم-۳ (۲ پروتون و ۱ نوترون)، در واکنش همجوشی هیدروژن تولید میشوند. با اینحال، مقدار تولید شده در مقایسه با هلیوم-۴ که محصول بسیار مطلوبتری به حساب میآید، بسیار کم است و کسر بسیار کوچکی را شامل میشود.[۵۱] پایداری غیرمعمولی هسته هلیوم-۴ از لحاظ کیهانشناسی دارای اهمیت است، چراکه این پایداری، این حقیقت را توضیح میدهد که در چند دقیقه اول پس از مهبانگ، مخلوط اولیه کیهانی مملو از پروتونها و نوترونها با نسبت شش به یک، تا دمایی سرد شد که امکان تشکیل پیوندهای هستهای فراهم شد و تقریباً تمامی ترکیبهای اتمی اولیه مصرف شدند تا هسته هلیوم-۴ تشکیل شود.[۵۲]
قدرت اتصال اجزای هلیوم-۴ و میزان پایداری کلی آن به قدری زیاد بود که موجب شد تقریباً تمامی نوترونهای آزاد ظرف همان چند دقیقه ابتدایی و قبل از اینکه بتوانند دچار فروپاشی بتا شوند، مصرف شوند. علاوهبر این، مقدار کمی از نوترونهای باقی مانده در تولید اتمهای سنگینتر مانند لیتیم، بریلیوم یا بور مصرف شدند. انرژی بستگی هسته هلیوم-۴ برای هر ذره هستهای قویتر از هرکدام از این عناصر سنگینتر تولید شده است (برای مقایسه به هستهزایی و انرژی بستگی رجوع کنید) که این پایداری موجب شد اتمهای هلیوم تشکیل شده در دقایق اولیه شکلگیری کیهان، انرژی کافی برای همجوشی اتمهای هلیوم و ساخته شدن اتمهای سنگینتر مانند لیتیم، بریلیم و بور در دسترس قرار نداشته باشد. انجام همجوشی هستهای و تبدیل هلیوم به عنصری سنگینتر مانند کربن که در مقایسه با هلیوم دارای انرژی کمتری بهازای هر ذره هستهای است، واکنشی نامطلوب و نیازمند انرژی زیاد است.[۵۳]
با اینحال، بهعلت نبود فلز واسطه، این فرایند نیازمند این است که سه هسته هلیوم طی فرایند آلفا سهگانه تقریباً بهطور همزمان با یکدیگر برخورد کنند. در دقایق اولیه تشکیل کیهان و قبل از اینکه دما و فشار کیهان بر اثر انبساط بهحدی کاهش یابد که دیگر امکان تبدیل هلیوم به کربن وجود نداشته باشد، زمان زیادی برای شکلگیری مقدار زیادی کربن وجود نداشته است. این موضوع موجب شد که نسبت هیدروژن به هلیوم در اوایل شکلگیری کیهان عددی بسیار نزدیک باشد، همان عددی که امروزه نیز مشاهده میشود. مجموع جرم هیدروژن سه برابر مجموع جرم هلیوم-۴ موجود در کیهان است. تمام عناصر سنگینتر از جمله آنهایی که برای تشکیل سیارههای سنگی مانند زمین و تشکیل حیات کربنی لازم هستند پس از مهبانگ در ستارگان ساخته میشوند؛ مکانی که میزان هلیوم، دما و فشار کافی وجود دارد. تمامی عناصر دیگر بهجز هیدروژن و هلیوم، امروزه مجموعاً تنها دو درصد از کل جرم اتمی مواد موجود در کیهان را تشکیل میدهند هلیوم-۴ تشکیل دهنده ۲۳ درصد از جرم ماده معمولی (بهجز هیدروژن) موجود در کیهان است.[۵۳]
ایزوتوپها
[ویرایش]
انرژی بستگی برای هر نوکلئون هلیوم-۴، بهصورت قابل ملاحظهای بزرگتر از نوکلئونهای نزدیک است.


تا کنون ۹ ایزوتوپ برای هلیوم پیدا شده است که از میان آنها هلیوم-۳ و هلیوم-۴ تنها ایزوتوپهای پایدار آناند. در هواکرهٔ زمین در برابر هر یک اتم هلیوم-۳، یک میلیون هلیوم-۴ وجود دارد.[۵۴] برخلاف بیشتر عنصرها، فراوانی ایزوتوپهای هلیوم بسته به منبع تولید و فرایند پدیداری شان بسیار متفاوت است. فراوانترین ایزوتوپ آن، هلیوم-۴ در زمین از راه واپاشی آلفای عنصرهای پرتوزای سنگین تر تولید میشود. پرتوهای آلفای تابیده شده همگی هستههای یونیزه شدهٔ هلیوم-۴اند. هلیوم-۴ به طرز غیرمعمولی هستهٔ پایداری دارد چون ذرههای هستهای آن از آرایش الکترونی پایداری برخوردارند. این ایزوتوپها در جریان هستهزایی مهبانگ به فراوانی تولید شدند.[۵۵]
هلیوم-۳ به مقدار بسیار ناچیز یافت میشود که بیشتر آن از هنگامهٔ ساخت زمین به جای مانده است. گاهی هلیومِ گیر افتاده در گرد و غبار کیهانی هم وارد زمین شده است.[۵۶] همچنین در اثر واپاشی بتای تریتیوم هم اندکی هلیوم-۳ تولید میشود.[۵۷] در سنگهای پوستهٔ زمین ایزوتوپهایی از هلیوم پیدا میشود که نسبت یک به ده دارد. با توجه به این نسبتها میتوان دربارهٔ منشأ سنگها و ساختار گوشتهٔ زمین پژوهش کرد.[۵۶] هلیوم بیش از همه به عنوان محصول واکنشهای همجوشی در ستارهها پیدا میشود؛ بنابراین در محیطهای میان ستارهای نسبت هلیوم-۳ به هلیوم-۴ نزدیک به صد برابر بیشتر از نسبت آن در زمین است.[۵۸] در مادههای فرازمینی مانند سنگهای موجود در ماه یا سیارکها میتوان ردّ پای هلیوم-۳ را از هنگامی که در اثر بادهای خورشیدی پرتاب شدند، پیدا کرد. غلظت هلیوم-۳ موجود در ماه، ۰٫۰۱ ppm است که بسیار بالاتر از مقدار آن، ۵ ppt (یک بخش در تریلیون) در هواکرهٔ زمین است.[۵۹][۶۰] دستهای از دانشمندان از جملهٔ آنها جرالد کالسینسکی[m] در سال ۱۹۸۶ پیشنهاد دادند که در سطح ماه جستجو شود و از معدنهای هلیوم-۳ آن برای واکنش همجوشی هستهای بهرهبرداری شود.[۶۱]
هلیوم-۴ مایع را میتوان با کمک خنککننده تبخیر ویژه تا نزدیک به ۱ درجه کلوین سرد کرد. روش سردسازی هلیوم-۳ مانند هلیوم-۴ است؛ با این تفاوت که هلیوم-۳ نقطهٔ جوش پایینتری (نزدیک به ۰٫۲ کلوین) دارد و این فرایند در سردساز هلیوم-۳[n] روی میدهد. اگر بخواهیم مخلوطی از هلیوم-۳ و هلیوم-۴ با نسبتهای برابر در زیر ۰٫۸ کلوین داشته باشیم این دو به به دلیل ناهمانندی، به صورت دو بخش مخلوط نشدنی از هم جدا میشوند. اتمهای هلیوم-۴ را بوزونها تشکیل میدهد در حالی که در هلیوم-۳ فرمیونها سازندهٔ اتمها هستند. این ویژگی هلیوم در یخچالهای رقیقسازی برای رسیدن به دمای چند میلیکلوین به کار میآید.[۱۴]
میتوان به صورت آزمایشگاهی هم ایزوتوپ هلیوم درست کرد، اما این ایزوتوپها خیلی زود به دیگر مادهها دگرگون میشوند. برای نمونه، میتوان از هلیوم-۵ یاد کرد که دارای کوتاهترین نیمهعمر، ۷٫۶×۱۰−۲۲ ثانیه است. پس از آن هلیوم-۶ است که تابش بتا و نیمه عمر ۰٫۸ ثانیه دارد. هلیوم-۷ ذرات بتا و پرتوی گاما میتاباند. هلیوم-۷ و هلیوم-۸ هر دو در شرایط ویژهٔ واکنشهای هستهای پدید میآیند.[۱۴] معلوم شده است که هم هلیوم-۶ و هم هلیوم-۸ از خود پدیدهای بهنام هاله هستهای[o][توضیح ۳] نشان میدهند. این موضوع به این معنی است که شعاع بهدست آمده برای آنها بسیار بیشتر از مقدار پیشبینی شده توسط مدلهای اندازهگیری مانند مدل سقوط مایع[p] است.[۱۴]
ترکیبات
[ویرایش]
هلیوم دارای ظرفیت صفر است و درنتیجه از لحاظ شیمیایی در شرایط معمول، یک عنصر واکنشناپذیر است.[۳۸] هلیوم یک عایق الکتریسیته محسوب میشود، مگر اینکه یونیزه شود. همانند سایر گازهای نجیب، هلیوم نیز دارای سطوح انرژی شبهپایدار[r] است که موجب میشود این عنصر در صورت وجود بار الکتریکی با ولتاژی کمتر از پتانسیل یونیزاسیون خود، یونیزه باقی بماند.[۱۴] هلیوم میتواند در زمانی که تحت تخلیه تابشی، بمباران الکترونی یا تبدیل شدن به پلاسما تحت شرایط دیگر، قرار میگیرد، با عناصری مانند تنگستن، فلورید، گوگرد و فسفر ترکیبات ناپایداری موسوم به برانگیختهپار تشکیل دهد. ترکیبات مولکولی مانند هلیوم نئون (HeNe)، جیوه هلیوم (HgHe۱۰)، تنگستن هلیوم (WHe۲) و گونههای مولکولی یونی مانند He۲+ ،He۲+ ،HeH و +HeD بهاین صورت ساخته میشوند.[۶۲] ترکیب +HeH دارای حالت پایه پایدار است، اما فوقالعاده واکنشپذیر است؛ بهطوری که قویترین اسید برونستدی است که تاکنون شناخته شده است؛ بنابراین میتواند تنها به صورت جداشده وجود داشته باشد، زیرا هرنوع مولکول یا یون مخالفی که در مجاورت آن قرار بگیرد، پروتوندار میشود. این روش همچنین موجب تولید مولکول هلیوم گازی (He۲) و مولکول جیوه هلیوم (HgHe) شده است.[۱۴] ترکیبات واندروالسی هلیوم مانند لیتیم هلیوم (LiHe) و مولکول هلیوم (He۲)، میتوانند با سرد کردن گاز هلیوم و اتمهای برخی دیگر از مواد، تولید شوند.[۶۳]
وجود ترکیبات واقعی دیگری مانند هلیوم فلوئوروهیدرید (HHeF) که مشابه آرگون فلوروهیدرید است و در سال ۲۰۰۰ کشف شد نیز به صورت نظری نیز ممکن است.[۶۴] محاسبات نشان میدهد که دو ترکیب جدید حاوی پیوند هلیوم-اکسیژن میتواند پایدار باشد. دو گونه جدید مولکولی CsFHeO و N(CH۳)۴FHeO که بهصورت نظری پیشبینی شدند، مشتقهایی از یک آنیون −FHeO ناپایدار هستند که برای اولینبار در سال ۲۰۰۵ به صورت نظری توسط یک گروه تحقیقاتی تایوانی وجود آن پیشبینی شد. اگر تحقیقات آن را تأیید نماید، تنها عنصری که هنوز هیچ ترکیب پایداری از آن گزارش نشده، عنصر نئون خواهد بود.[۶۵]
اتمهای هلیوم میتوانند با اعمال حرارت و تحت فشار زیاد به درون ساختار توخالی قفس کربنی مولکول فولرن وارد شوند. به این نوع مولکولهای فولرن که دارای گونه خارجی مانند اتم، یون یا خوشه مولکولی در داخل ساختار قفسمانند خود هستند، اصطلاحاً فولرن اندوهدرال[s] گفته میشود که در دماهای بالا نیز پایدارند. زمانیکه مشتقهای این نوع فولرنها تشکیل میشوند، هلیوم در داخل ساختار قفس مانند فولرن باقی میماند.[۶۶] اگر هلیوم-۳ برای این منظور استفاده شود، بهآسانی میتوان حضور آن را با کمک طیفسنجی تشدید مغناطیسی هستهای مشخص کرد.[۶۷]
بسیاری از فولرنهای حاوی هلیوم-۳ گزارش شدهاند. اگرچه، اتمهای هلیوم به صورت کووالانسی یا یونی به ساختار فولرن متصل نشدهاند، با اینحال ترکیب فولرن حاصل، مانند تمامی ترکیبهای شیمیایی استوکیومتری دارای خواص و ترکیب منحصر بهفرد و مشخص است. تحت فشار زیاد، هلیوم میتواند ترکیباتی با عناصر مختلف را تشکیل دهد. کریستالهای ترکیب کلاترات هلیوم-نیتروژن (۱۱(N۲)He) در دمای اتاق و تحت فشار ۱۰ گیگاپاسکال درون یک سلول سندان الماس رشد داده شدهاند.[۶۸] مشخص شده است که ترکیب الکترید[t][توضیح ۴] سدیم هلیوم (Na۲He) که یک عایق الکتریسیته است، در فشار بالای ۱۱۳ گیگاپاسکال، بهصورت ترمودینامیکی پایدار است. این مولکول دارای ساختاری فلئوریتی است.[۶۹]
فراوانی و تولید
[ویرایش]هلیوم دومین عنصر فراوان بعد از هیدروژن در کیهان و در منظومه شمسی است و حدود ۱۱٫۳ درصد از کل اتمهای جهان را تشکیل میدهد. حدود ۸۸٫۶ درصد از کل اتمهای جهان هیدروژن هستند؛ بنابراین، حداقل ۹۹٫۹ درصد از کل اتمها شامل اتمهای هیدروژن یا هلیوم هستند. در مقابل، هلیوم در زمین بسیار نایاب است. این گاز پس از نیتروژن، اکسیژن، آرگون، دیاکسید کربن و نئون ششمین گاز فراوان در جو است که تقریباً ۰٫۰۰۰۵۲۴ درصد هوا را تشکیل میدهد. تخمین میزان هلیوم در پوسته زمین غیرممکن است. این گاز هنگام خراب شدن اورانیوم و سایر عناصر رادیواکتیو تولید میشود. اما اغلب تقریباً بلافاصله به جو فرار میکند[۲۹] بهطوریکه قیمت هلیوم در ۱۵ سال اخیر ۵۰۰ درصد افزایش پیدا کرده است. در ژوئن ۲۰۱۶ مقادیر بزرگی از هلیوم در صحرای موسوم به کافت شرق آفریقا در تانزانیا کشف شد. براساس برآوردها، میزان ذخیره این میدان ۵۴ میلیارد متر مکعب است که میتواند نیاز چندین سال بشر را تأمین کند. فعالیت آتشفشانی در کافت شرق آفریقا باعث انتشار گاز هلیوم در صخرههای کهن میشود که در نهایت در میدانهای کمعمقتر گاز به تله میافتد.[۷۰]
منابع طبیعی
[ویرایش]
حدود ۲۳ درصد از جرم باریونی کیهان از هلیوم تشکیل شده است.[۱۳] مقدار زیادی از هلیوم طی فرایندهای هستهزایی در زمان مهبانگ در ۱–۳ دقیقه آغازین ایجاد شد. از همینرو، اندازهگیری میزان فراوانی هلیوم به مدلهای کیهانشناسی کمک میکند. در ستارهها، تشکیل هلیوم توسط واکنش همجوشی هستهای هیدروژن در واکنشهای زنجیرهای پروتون پروتون و چرخه پروتون پروتون بخشی از هستهزایی ستارهای را تشکیل میدهد.[۵۵]
در جو زمین، غلظت هلیوم تنها ۵٫۲ قسمت در میلیون است.[۷۱][۷۲] غلظت هلیوم موجود در جو، با وجود تولید مداوم و پیوسته، کم و تقریباً ثابت است، چون بیشتر هلیوم جو زمین، طی چندین فرایند از جو خارج شده و وارد فضا میشود.[۷۳][۷۴][۷۵] در هتروسفر[u] زمین که در قسمت بالایی جو قرار دارد، هلیوم و سایر گازهای سبکتر، فروانترین عناصر موجود هستند.
اغلب هلیوم موجود بر روی زمین درنتیجه یک واپاشی هستهای است. هلیوم در مقادیر زیادی در کانیهای اورانیوم و توریوم مانند اورانینیت و انواع آن مانند کلویت، اورانینیت سیاه،[v]کارنوتیت و مونازیت یافت میشود.[۷۶][۷۷][۷۸] علت فراوانی هلیوم در این نوع کانیها این است که عناصر پرتوزایی مانند اورانیوم و توریوم ذرات آلفا (هسته اتم هلیوم دارای دوبار مثبت: He+۲) از خود منتشر میکنند و این ذرات در زمان برخورد با سنگها، با دریافت الکترون لازم، موجب تولید هلیوم میشود. تخمین زده میشود تنها از این طریق، حدود ۳۰۰۰ تن متریک هلیوم در هر سال در سرتاسر سنگکره تولید شود.[۷۹][۸۰][۸۱] در پوسته زمین، غلظت هلیوم برابر با ۸ ppb است. در آب دریا، غلظت هلیوم کمتر شده و به ۴ ppt میرسد. همچنین، مقادیر کمی از هلیوم در چشمههای آب معدنی، گازهای آتشفشانی و شهاب سنگهای حاوی آهن[w] وجود دارد. به اینعلت که هلیوم در سطح زیر زمین و در شرایطی مشابه با گاز طبیعی بهدام افتاده است، بزرگترین منابع طبیعی هلیوم روی زمین، که بیشترین هلیوم استخراج شده تجاری از آنجا تهیه میشود، در محل منابع گازهای طبیعی است. غلظت هلیوم در این منابع متغیر و از چند قسمت در میلیون تا بیش از ۷ درصد در میدان گازی واقع در سن خوآن، نیومکزیکو است.[۸۲][۸۳]
ذخایر جهانی
[ویرایش]| کشور | ذخایر | ذخایر پایه |
| ایالات متحده آمریکا | ۱۵۳ | ۳۵۰ |
| الجزایر | ۶۴ | ۳۰۰ |
| استرالیا | NA | ۶٫۹ |
| کانادا | NA | ۷۲ |
| چین | — | ۴۰ |
| اندونزی | NA | ۱۴ |
| لهستان | ۰٫۹ | ۱۰ |
| قطر | ۳۶۰ | ۳۶۰ |
| روسیه | ۶۰ | ۲۵۰ |
| دیگر کشورها | NA | ۸٫۱ |
| کل | ۶۳۸ | ۱٬۴۱۰ |
با روی کار آمدن تأسیسات مایعسازی گاز طبیعی، مقدار هلیوم قابل بازیافت افزایش یافته است، زیرا یکی از پیامدهای مایع شدن گاز طبیعی افزایش غلظت نسبی هلیوم و در نتیجه، مقرون به صرفه بودن استخراج آن است. هر ساله دفتر مدیریت سرزمین[x] به نمایندگی از سازمان زمینشناسی ایالات متحده[y] منابع جهانی هلیوم را گزراش میکند. جدول ۱ برآورد ذخایر هلیوم و پایه ذخیره هلیوم در سال ۲۰۰۸ را نشان میدهد. ذخایر منابعی هستند که میتوانند در زمان تعیین از نظر اقتصادی استخراج یا تولید شوند.[۸۴]
توجه به این نکته حائز اهمیت است که کلیه ذخایر ذکر شده تخمین زده میشوند و به استثنای تعداد کمی از ذخایر هیچکدام توسط مؤسسات معتبر تأیید نشدهاند. کل ذخایر تخمین زده شده بر اساس پالایش ۶٫۲ میلیارد فوت مکعب در سال ۶۳۸ میلیارد فوت مکعب است که با توجه به میزان مصرف برای ۱۰۰ سال پیشبینی میشود. با این حال، اگر مصرف با نرخهای اخیر رشد کند (۴ درصد در سال)، این ذخایر به ۴۰ سال کاهش مییابد، افزون بر این توجه به این نکته مهم است که این برآورد فقط در صورتی معتبر است که کل مقدار گاز طبیعی تولید شده از هر مخزن برای هلیوم پردازش شود.[۸۴]
تا سال ۲۰۱۱، تخمین زده شده است که ذخایر هلیوم دنیا در حدود ۴۰ میلیارد متر مکعب باشد، که یک چهارم از این ذخایر در میدان گازی پارس جنوبی که میان ایران و قطر مشترک است، قرار دارد.[۸۵] در سال ۲۰۱۵ و ۲۰۱۶، ذخایر احتمالی جدیدی در رشته کوههای راکی در آمریکای شمالی[۸۶] و در کافت شرق آفریقا اعلام شده است.[۸۷]
بازار هلیوم در سالهای اخیر با کمبود جهانی بین سالهای ۲۰۰۶ و ۲۰۰۷ و ۲۰۱۱ و ۲۰۱۳ کاملاً متعادل شده است. ایالات متحده با ۴۰٪ از تولید هلیوم بزرگترین تولیدکننده جهان است. با این حال، ذخیره ملی هلیوم ایالات متحده در آماریلو، تگزاس، بزرگترین منبع هلیوم در جهان طی ۷۰ سال گذشته، اکنون به حداقل سطح خود ۳ میلیارد فوت مکعب رسیده است. این ذخیره در سال ۱۹۶۰ به عنوان مخزن استراتژیک هلیوم راه اندازی شد. در سال ۱۹۹۶ لایحه ای برای فروش بخش عمده ای از عرضه و پرداخت بدهیهای کارخانه توسط دولت آمریکا تصویب شد که منجر به کاهش قیمت هلیوم شد. بسته شدن ذخیره ملی هلیوم ایالات متحده، بخش قابل توجهی از عرضه هلیوم را از بازار خارج کرد. در تاریخ ۳۱ دسامبر ۲۰۱۸، دفتر مدیریت سرزمین حدود ۲۲۳۰۰ نمونه گاز از ۲۶ کشور و ایالات متحده را در برنامه ای برای شناسایی منابع هلیوم جهان تجزیه و تحلیل کرده است.[۸۸]
حامیان حفاظت از منابع
[ویرایش]براساس گفتههای رابرت کلمن ریچاردسون فیزیکدان و برنده جایزه نوبل، در سال ۲۰۱۰ قیمت بازار آزاد هلیوم موجب استفادههای بیهوده مانند استفاده از آن برای بالنهای هلیوم کمک کرده است. قیمتها در دهه ۲۰۰۰ با تصمیم کنگره ایالات متحده برای فروش سهام بزرگ هلیوم این کشور تا سال ۲۰۱۵ کاهش یافته بود.[۸۹] ارزش تخمینی هلیوم درجه A (با خلوص ۹۹٫۹۹۷٪ یا بیشتر) که در سال ۲۰۱۹ توسط صنایع خصوصی استخراج شد حدود ۷۱۷ میلیون دلار بود. به باور ریچاردسون برای از بین بردن هدر رفت بیش از حد هلیوم، قیمتها باید ۲۰ برابر شود. او به همراه همکارانش در کتابشان، آینده هلیوم به عنوان یک منبع طبیعی[z] همچنین پیشنهاد ایجاد آژانس بینالمللی هلیوم[aa] برای ایجاد بازار پایدار برای این کالای گرانبها را داده است.[۹۰]
استخراج
[ویرایش]استخراج و استفاده
[ویرایش]




در یک عملیات حفاری نفت در سال ۱۹۰۳ در دکستر، کانزاس، فوران گازی مشاهده شد که فاقد قابلیت اشتعال بود. زمینشناسی بهنام اراسموس هاورث[ab] نمونههایی از این گاز تهیه کرد و آنها را به دانشگاه کانزاس برد و با کمک شیمیدانانهایی به نامهای همیلتون کدی و دیوید مکفارلاند[ac] پی برد که گاز مورد نظر، مخلوطی از ۷۲ درصد نیتروژن، ۱۵ درصد متان (گازی که در صورت وجود اکسیژن کافی، قابلیت اشتعال دارد)، ۱ درصد هیدروژن و ۱۲ درصد گازی غیرقابل شناسایی است.[۱۳][۹۱] با انجام تجزیه و تحلیلهای بیشتر، کادی و مکفارلاند کشف کردند که ۱٫۸۴ درصد از مخلوط گازی جمعآوری شده، متشکل از هلیوم است.[۹۲][۹۳] این کشف نشان داد که با وجود فراوانی بسیار اندک هلیوم بر روی زمین، هلیوم میتواند در مقادیر زیادی در زیر مناطق مربوط به دشت بزرگ (آمریکا) وجود داشته باشد و در زمان استخراج گاز طبیعی بهصورت محصول جانبی بهدست بیاید.[۹۴]
این کشف موجب شد که ایالات متحده آمریکا به بزرگترین تأمین کننده هلیوم دنیا تبدیل شود. بعد از پیشنهاد ریچارد ترلفال،[ad] نیروی دریایی ایالات متحده، سه کارخانه آزمایشی هلیوم را در طول جنگ جهانی اول راهاندازی کرد. هدف از آغاز چنین پروژهای تأمین گازی غیرقابل اشتعال و سبکتر از هوا برای بالنهای دفاعی[ae] مورد استفاده در جنگ بود. مقداری از این هلیوم تولید شده نیز برای پرکردن اولین کشتی هوایی پرشده با هلیوم، کشتی هوایی بادکنکی غیرصلب کلاس سی، مورد استفاده قرار گرفت. اولین پرواز این کشتی هوایی در تاریخ ۱ دسامبر ۱۹۲۱، از همپتون رودز[af] در ویرجینیا به پایگاه نیروی هوایی بولینگ[ag] در واشینگتن، دی.سی. بود.[۹۵] حدود دو سال بعد و در سپتامبر ۱۹۲۳، پرواز اولین کشتی هوایی بادکنکی صلب و پرشده با هلیوم که توسط شرکت هواپیماسازی نیروی دریایی ساخته شده بود و نامش یواساس[ah] بود، انجام شد. اگرچه فرایند استخراج با استفاده از مایعسازی گاز در دمای پایین در آن زمان حساس در جنگ جهانی اول هنوز توسعه نیافته بود، با اینحال تولید هلیوم ادامه داشت. هلیوم در ابتدا بهعنوان گازی بالابرنده[ai][توضیح ۵] در کشتیهای هوایی مورد استفاده قرار گرفت. در طول جنگ جهانی دوم، تقاضا برای هلیوم بهعنوان گاز بالابرنده و همچنین برای جوشکاری قوس پوششدار[aj] افزایش یافت. طیفسنجی جرمی هلیوم[ak] نقشی حیاتی در تولید بمب اتمی در پروژه منهتن داشت.[۹۶]
در سال ۱۹۲۵ دولت ایالات متحده در آماریلو، تگزاس، با هدف تأمین گاز مورد نیاز برای کشتیهای هوایی نظامی در زمان جنگ و کشتیهای هوایی تفریحی در زمان صلح، محلی را برای ذخیره راهبردی هلیوم با عنوان ذخیره هلیوم ملی[al] احداث کرد.[۱۴] در آن زمان که آمریکا تنها تولیدکننده هلیوم بود، هلیوم خیلی گران بود و مصوبه کنگره موسوم به مصوبه همیلتون ۱۹۲۵[am] نیز صادرات آن را ممنوع میکرد؛ بنابراین، کشتی هیندنبورگ الزد ۱۲۹ و سایر کشتیهای هوایی آلمان زپلین مجبور بودند بهجای هلیوم از هیدروژن استفاده کنند.
بازار هلیوم پس از جنگ جهانی دوم دچار رکود شد. اما ذخایر هلیوم در دهه ۱۹۵۰ میلادی توسعه داده شد تا از تأمین هلیوم بهعنوان یک خنککننده برای تولید اکسیژن و هیدروژن مورد نیاز برای سوخت موشک (و همچنین سایر اهداف) در طول دوران رقابت فضایی و جنگ سرد اطمینان حاصل شود. میزان هلیوم مورد استفاده در آمریکا در سال ۱۹۶۵ بیش از هشت برابر بیشینه مصرف در زمان جنگ بود.[۹۷]
پس از اصلاح مصوبه کنگره در مورد هلیوم در سال ۱۹۶۰ (قانون عمومی ۸۶–۷۷۷)، اداره معادن ایالات متحده آمریکا[an] طرح تأسیس پنج کارخانه خصوصی برای بازیابی هلیوم از منابع گاز طبیعی را تصویب کرد. براساس این برنامه حفظ منابع هلیوم، اداره معادن یک خط لوله به طول ۴۲۵ مایل (۶۸۴ کیلومتر) احداث کرد تا کارخانههای دولتی میدان گازی کلیفساید[ao] از شهر بوشتون، کانزاس به آماریلو، تگزاس متصل شوند. مخلوط هلیوم-نیتروژن تزریق شد و میدان گازی کلیفساید ذخیره شد تا زمان نیاز به هلیوم، این مخلوط تحت خالصسازی بیشتر قرار بگیرد.[۹۸]
تا سال ۱۹۹۵، یک میلیارد متر مکعب از این گاز ذخیره شده بود و مجموعه ۱٫۴ میلیارد دلار بدهی داشت؛ بنابراین، کنگره ایالات متحده آمریکا در سال ۱۹۹۶ طرح ذخیره هلیوم را متوقف کرد.[۱۳][۹۹] مصوبه خصوصیسازی هلیوم سال ۱۹۹۶ (قانون عمومی ۱۰۴–۲۷۳)،[۱۰۰] وزارت کشور ایالات متحده آمریکا را بر آن داشت که ذخایر هلیوم را تخلیه کند و فروش از سال ۲۰۰۵ آغاز شد.[۱۰۱]
هلیوم تولیدشده بین سالهای ۱۹۳۰ تا ۱۹۴۵ دارای خلوص حدود ۹۸٫۳ درصد بود (۲ درصد نیتروژن) که این میزان خلوص برای کشتیهای هوایی کافی بود. در سال ۱۹۴۵، مقدار کمی از هلیوم ۹۹٫۹ درصد برای استفاده در جوشکاری تولید شد. تا سال ۱۹۴۹، تولید هلیوم در مقیاس تجاری با خلوص ۹۹٫۹۵ درصد از نوع درجه آ[ap] ممکن بود.[۱۰۲]
برای سالهای زیادی، ایالات متحده آمریکا، بیش از ۹۰ درصد هلیوم تولیدی دارای قابلیت استفاده بهصورت تجاری در دنیا را تولید میکرد، در حالیکه ۱۰ درصد باقیمانده توسط کارخانههای موجود در کانادا، هلند، روسیه و دیگر کشورها تولید میشد. در اواسط دهه ۱۹۹۰ میلادی، یک کارخانه جدید در ارزیو در الجزایر، تولید بیش از ۱۷ میلیون متر مکعب (۶۰۰ میلیون فوت مکعب) را آغاز کرد که این مقدار برای تأمین تمام نیاز اروپا کافی بود. در همینحال، تا سال ۲۰۰۰، مصرف هلیوم درون ایالات متحده آمریکا، به ۱۵ میلیون کیلوگرم در سال افزایش یافت.[۱۰۳] بین سالهای ۲۰۰۴–۲۰۰۶، کارخانههای بیشتری در راس لفان، قطر و سکیکده، الجزایر ساخته شد. الجزایر بهسرعت به دومین تولیدکننده هلیوم دنیا تبدیل شد.[۱۰۴] در این زمان، هم مصرف هلیوم و هم هزینه تولید هلیوم افزایش یافت.[۱۰۵] از سال ۲۰۰۲ تا ۲۰۰۷، قیمت هلیوم دو برابر شد.[۱۰۶] تا سال ۲۰۱۲، ذخیره ملی هلیوم ایالات متحده آمریکا، برابر با ۳۰ درصد کل هلیوم دنیا بوده است.[۱۰۷] انتظار میرفت که این ذخیره هلیوم، تا سال ۲۰۱۸ به اتمام برسد،[۱۰۷] با اینحال، یک لایحه پیشنهادی در سنای ایالات متحده آمریکا، اجازه ادامه فروش هلیوم موجود در ذخیره ملی آمریکا را صادر کرد. دیگر ذخایر بزرگ هلیوم آمریکا در میدان گازی هیوگوتون[aq] در کانزاس، تگزاس و اوکلاهاما قرار داشتند. کارخانههای جدی هلیوم بر اساس برنامه قرار بود که در سال ۲۰۱۲ در قطر، روسیه و ایالت وایومینگ آمریکا شروع به کار کنند، اما انتظار نمیرفت که این کارخانهها به موضوع کمبود هلیوم، کمک زیادی کنند.[۱۰۷]
در سال ۲۰۱۳، قطر شروع به ساخت بزرگترین واحد هلیوم دنیا نمود،[۱۰۸] بااینحال بحران دیپلماتیک قطر در سال ۲۰۱۷، بهطور شدیدی تولید هلیوم در این کشور را تحت تأثیر قرار داد.[۱۰۹] غالباً گفته میشود که پس از سالها کمبود هلیوم، در سال ۲۰۱۴ میزان تولید هلیوم بیشتر از تقاضای آن بوده است.[۱۱۰] بازار سهام بورس نزدک در سال ۲۰۱۵ گزارش کرد که برای شرکتی مانند ایر پروداکتز اند کمیکالز که شرکتی بینالمللی و فروشنده گاز با کاربردهای صنعتی است، میزان هلیوم به دلیل محدودیت عرضه مواد اولیه، تحت فشار اقتصادی قرار دارد.[۱۱۱]
استخراج و توزیع
[ویرایش]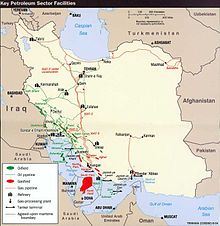
برای استفاده در مقادیر زیاد، هلیوم بهوسیله تقطیر جزء به جزء گاز طبیعی که حاوی ۷ درصد هلیوم است، تهیه میشود.[۱۱۲] بهعلت اینکه هلیوم دارای نقطه جوش پایینتری در مقایسه با دیگر عناصر است، دمای پایین و فشار زیاد مورد استفاده موجب مایع شدن تقریباً تمامی گازهای دیگر (غالباً نیتروژن و متان) میشود. گاز هلیوم ناخالص تولید شده بهوسیله قرار گرفتن در دماهای پایین بهصورت متوالی، خالص میشود و تقریباً تمامی نیتروژن و بقیه گازهای موجود از مخلوط گازی خارج میشوند. از کربن فعال برای خالص سازی هلیوم در آخرین مرحله استفاده میشود که معمولاً منجر به تولید هلیومی با کیفیت درجه آ و خلوص ۹۹٫۹۹۵ درصد میشود.[۱۴] اصلیترین ماده ناخالص موجود در هلیوم دارای درجه آ، نئون است. در مرحله نهایی تولید، اغلب هلیوم تولید شده از طریق فرایند سرد کردن، مایع میشود. این کار برای استفاده از هلیوم مایع ضروری است و موجب میشود که هزینه تمام شده برای حمل و نقل هلیوم کاهش پیدا کند، چراکه بزرگترین مخزن هلیوم مایع دارای حجمی بیش از پنج برابر بزرگترین مخزن هلیوم گازی است.[۱۰۴][۱۱۳]
در سال ۲۰۰۸، تقریباً ۱۶۹ میلیون متر مکعب استاندارد[ar] هلیوم از منابع استخراج یا از ذخایر برداشته شده است که از این میان، ۷۸ درصد سهم ایالات متحده، ۱۰ درصد سهم الجزایر و ۱۲ درصد باقی مانده، سهم عمده برای کشورهای روسیه، لهستان و قطر بوده است.[۱۱۴] تا سال ۲۰۱۳، افزایش تولید هلیوم قطر (توسط شرکت راسگس، به مدیریت ایر لیکوئید) موجب شد سهم قطر از هلیوم تولیدی دنیا به ۲۵ درصد افزایش یابد و این کشور را به دومین تولیدکننده هلیوم دنیا، پس از آمریکا تبدیل کرد.[۱۱۵] در سال ۲۰۱۶، ذخیرهای از هلیوم در تانزانیا کشف شد که تخمین زده میشود حاوی ۵۴ میلیارد متر مکعب هلیوم است.[۱۱۶][۱۱۷]
در ایالات متحده آمریکا، اغلب هلیوم استخراج شده از منابع گاز طبیعی در هیوگوتون و نزدیک میدان گازی در کانزاس، اوکلاهاما و میدان پنهندل[as] در تگزاس است.[۱۰۴][۱۱۸] قبلاً اغلب گاز هلیوم تولیدی با کمک خط لوله ذخیره ملی هلیوم[at] فرستاده میشد، اما از سال ۲۰۰۵، فروش ذخیره ملی شروع شد و انتظار میرود که تحت مصوبه مسئولیت مدیریت و نظارت بر هلیوم[au] در سال ۲۰۱۳،[۱۱۹] تا ۲۰۲۱ مقداری زیادی از آن مصرف شود.[۱۱۵] نفوذ گاز طبیعی ناخالص به درون غشاهای نیمهتراوا و دیگر موانع یکی از روشهای بازیابی و خالصسازی هلیوم است.[۱۲۰] در سال ۱۹۹۶، ایالات متحده آمریکا دارای ذخایر اثبات شده هلیوم بالغ بر ۱۴۷ میلیارد فوت مکعب استاندارد (۴٫۲ میلیارد متر مکعب استاندارد) در مجموعه چاههای گازی این چنینی بود.[۱۲۱]
هلیوم باید از گاز طبیعی استخراج شود، چرا که مقدار آن در هوا، تنها به اندازه کسر کوچکی از نئون است. با اینحال، تقاضا برای آن بسیار بیشتر از این میزان است. تخمین زده میشود که اگر تمامی تجیهزات فعلی مورد استفاده در تولید نئون برای تولید هلیوم استفاده شود، ۰٫۱ درصد از نیاز دنیا به هلیوم تأمین میشود. بهصورت مشابهی، ۱ درصد نیاز دنیا به هلیوم تأمین میشود.[۱۰۱] هلیوم میتواند از طریق بمباران کردن لیتیم یا بور با کمک فوتونهای پرسرعت یا بمباران لیتیم با دوتریوم سنتز شود، اما این فرایندها بسیار هزینهبر و فاقد صرفه اقتصادی هستند.[۱۲۲]
هلیوم بهصورت متداول، یا بهشکل مایع یا گاز در دسترس است. در شکل مایع، میتواند در مخزنهای عایق کوچک موسوم به فلاسک یا دمابان نگهداری شوند. این محفظهها میتوانند حجمی تا ۱۰۰۰ لیتر داشته باشند. هلیوم مایع همچنین میتواند در محفظههای بزرگ ایزو[av] که ظرفیت اسمی آنها ۴۲ متر مکعب (حدود ۱۱٬۰۰۰ گالن آمریکایی) است، نیز نگهداری شود. بهصورت گازی، هلیوم میتواند در مقادیر کم در سیلندرهای تحت فشار بالا و با ظرفیت ۸ متر مکعب (حدود ۳۰۰ فوت مکعب استاندارد) نگهداری شود، درحالیکه مقدار گاز نگهداری شده در تانکرهای تحت فشار زیاد به بیش از ۴٬۸۶۰ متر مکعب (حدود ۱۸۰٬۰۰۰ فوت مکعب استاندارد) میرسد.[۱۲۳]
کاربردها
[ویرایش]مصرف هلیوم تا فوریه ۲۰۱۹، نمای کلان توسط تحقیقات سرمایهگذاری ادیسون[۸۸]
هلیوم در بسیاری از صنایع در سطح جهانی استفاده میشود و استفاده از آن در همه زمینههای تحقیقات علمی و محیطهای تجاری، از جمله داروسازی، پزشکی، جوشکاری، علوم رایانه، اکتشافات فضایی وجود دارد. در سال ۲۰۱۴، تولید جهانی هلیوم حدود ۳۲ میلیون کیلوگرم (۱۸۰ میلیون متر مکعب استاندارد) بود. بیشترین میزان مصرف در این سال، مربوط به کاربردهای کرایوژنیک بود که حدوداً ۳۲٪ از کل مصرف هلیوم را شامل میشد. کاربردهای کرایوژنیک شامل خنک کردن آهنرباهای ابررسانا در اسکنرهای امآرآی پزشکی و طیفسنجهای انامآر است.[۱۲۴] رتبههای بعدی مصرف هلیوم در سال ۲۰۱۴، سیستمهای فشار و پاکسازی، نگهداری اتمسفرهای کنترلشده و تشخیص نشت بود. سایر حوزههای مصرف هلیوم، درصدهای کم و نسبتاً جزئی داشتند. از دیگر کاربردهای مهم، ایجاد فشار، هوای پیرامونی کنترل شده و جوشکاری است که ۷۸ درصد از کل مصرف هلیوم در سال ۱۹۹۶ را تشکیل داده است. از گاز هلیوم در فضاپیماها، تلسکوپها و دستگاه نظارت بر پرتونگاری هستهای استفاده میشود.[۱۲۵]
کروژنیک
[ویرایش]
مخلوط هلیوم با گازهای سنگینتر مانند زنون، نسبت ظرفیت حرارتی[aw] بالا و عدد پرنتل پایینی دارد و برای سردسازی ترموآکوستیک[ax] استفاده میشود.[۱۲۶] هلیوم به دلیل اینکه نقطه ذوب و جوش بسیار کمی دارد و در فشار جو جامد نمیشود و در صفر درجه کلوین و از نظر شیمیایی بی اثر است به عنوان خنککننده فوقالعاده استفاده میشود. علاوه بر این، دمای هلیوم فوق مایع زیر ۲٫۲ کلوین است. تاکنون از ویژگی فوق رواناب منحصر به فرد آن در هیچ کاربرد صنعتی استفاده نمیشود. استفاده هلیوم در سیستمهای سردسازی، نسبت به روشهای قدیمی، دارای مزیت زیستمحیطی است؛ چون اثرات مخربی مانند تخریب لایه ازون و گرمایش جهانی بر جای نمیگذارد.[۱۲۷] هلیوم به عنوان یک خنککننده فوقالعاده برای کاربردهای برودتی مانند تصویربرداری تشدید مغناطیسی (MRI),[۱۲۵] طیفسنجی تشدید مغناطیسی هسته ای (NMR)، شتابدهندههای ذرات، برخورد دهنده بزرگ هادرونی، دستگاه تداخل کوانتومی ابررسانا (SQUID),[ay][۱۲۸] طیفسنجی رزونانس چرخش الکترون (ESR)، ذخیره انرژی مغناطیسی ابررسانا (SMES),[az][۱۲۹][۱۳۰] ژنراتورهای ابررسانا مغناطیسی ، انتقال قدرت ، انتقال نیروی جذب مغناطیسی، سنسورهای ابررسانا، طیفسنجهای جرمی، آهنرباهای ابررسانا، جداکننده مغناطیسی میدان قوی، آهنرباهای ابررسانای میدان تورویی برای راکتورهای همجوشی و سایر تحقیقات برودتی استفاده میشود. هلیوم مواد ابررسانا را تا دمای نزدیک به صفر مطلق سرد میکند، به طوری که مقاومت الکتریکی ابررساناها ناگهان به صفر میرسد. مقاومت الکتریکی بسیار کم ابررساناها باعث میشود که میدانهای مغناطیسی قدرتمندتری ایجاد شود. در مورد تجهیزات MRI در بیمارستانها، میدان مغناطیسی قدرتمندتر جزئیات بیشتری را در اسکن عکس رادیولوژی به دست میدهد.[۱۲۵] برخورددهنده هادرونی بزرگ در سرن از ۹۶ تن هلیوم مایع برای حفظ دما در ۱٫۹ کلوین استفاده میکند.[۱۳۱]
ایروستاتیک
[ویرایش]
از آنجا که این عنصر از هوا سبکتر و دارای چگالی کمتری است، از زمان جنگ جهانی اول از هلیوم به عنوان گاز بالابر برای بالنها، بالنهای هواشناسی، کشتیهای هوایی و چشمک زدن استفاده میشود و برای پرواز کشتیهای هوایی به گاز هلیوم رو آوردهاند. استفاده از هلیوم به عنوان گاز بالابرنده اولین کاربرد هلیوم از زمان کشف آن بر روی زمین بود. در حالی که گاز هیدروژن بسیار شناور است و با سرعت کمتری از نفوذ به درون غشاء فرار میکند، هلیوم این مزیت را دارد که قابل اشتعال نیست و در واقع پیشگیرنده آتش است. کاربرد هلیوم در بالونها بسیار شناختهشده است، اما این کاربرد، بخش کوچکی از مصرف این گاز است.[۱۳۲]
هوافضا
[ویرایش]کاربرد دیگر هلیوم، در ساخت راکت است. در این فرایند، هلیوم به عنوان یک ماده تخلیه کننده برای جابجایی سوخت و اکسید کنندهها در مخازن ذخیرهسازی و چگالش کردن هیدروژن و اکسیژن برای ساختن پیشران راکت استفاده میشود. فضای خالی بالای مخزن سوخت از هلیوم پر میشود تا هم جابجایی سوخت و اکسیدکنندهها آسانتر شود و هم بتوان با آن هیدروژن و اکسیژن را فشرده کرد تا سوخت موشک بهدست آید. همچنین برای پاک کردن سوخت و اکسیدکننده از تجهیزات پشتیبانی زمین قبل از پرتاب و برای خنک کردن هیدروژن مایع در وسایل نقلیه فضایی توسط آژانسهای فضایی مانند آریاناسپاس و ناسا استفاده میشود. بهعنوان مثال، موشک سترن ۵ که در برنامه آپولو مورد استفاده قرار گرفت، حدود ۳۷۰٬۰۰۰ متر مکعب هلیوم نیاز داشت.[۳۸] همچنین در موشکهای دلتا IV از هلیوم برای حفظ فشار در مخازن سوخت اکسیژن مایع استفاده میشد.[۱۳۳]
جوشکاری
[ویرایش]هلیوم، به دلیل دارا بودن بالاترین پتانسیل یونیزاسیون در بین عناصر در فرایند جوشکاری با قوس الکتریکی و جوشکاری قوس پلاسما بر روی موادی که در دمای جوشکاری در اثر تماس با هوا یا نیتروژن دچار آسیب میشوند، به عنوان لایهٔ محافظ یا پوشش عمل میکند.[۱۳] جو محافظ هلیوم در اطراف محل جوشکاری از اکسید شدن فلز در حالت مذاب جلوگیری میکند. همچنین پتانسیل یونیزاسیون بالای هلیوم امکان جوشکاری قوس پلاسما را برای فلزاتی مانند تیتانیوم، زیرکونیوم، منیزیم و آلیاژهای آلومینیوم مورد استفاده در کشتیسازی و هوافضا فراهم میکند. تعدادی از گازهای محافظ بی اثر در جوش قوس الکتریکی تنگستن گازی استفاده میشود، اما هلیوم به جای گاز ارزانتر آرگون به خصوص برای جوشکاریهایی که رسانندگی گرمایی بیشتری دارند؛ مانند آلومینیوم یا مس استفاده میشود. از آنجا که هلیوم میتواند توسط آرگون یا هیدروژن جایگزین شود، اما برای جوشکاری قوس پلاسما برخی مواد مانند تیتانیوم نمیتواند جایگزین شود، زیرا هلیوم تنها گازی است که دارای فعالیت حرارتی به اندازه کافی بالا است تا ایمن باشد.[۱۳۴][۱۳۵]
انتخاب یک گاز محافظ به عوامل مختلفی از جمله نوع ماده در حال جوشکاری، طراحی اتصالات و شکل ظاهری نهایی جوش بستگی دارد. مخلوطهای آرگون-هلیوم اغلب در جوشکاری تیگ مورد استفاده قرار میگیرند، زیرا میتوانند کنترل ورودی حرارتی را افزایش دهند در حالی که مزایای استفاده از آرگون را حفظ میکنند. بهطور معمول، این مخلوطها در درجه اول با هلیوم (غالباً حدود ۷۵٪ یا بالاتر) و تعادل آرگون ساخته میشوند. این مخلوط سرعت و کیفیت جوشکاری متناوب آلومینیوم و نفوذ جوش در یک اتصال را افزایش میدهند و همچنین برخورد با قوس را آسان میکنند. این نوع جوشکاری با عنوان جوشکاری هلیارک[ba] شناخته میشود.[۱۳۶]
تشخیص نشت
[ویرایش]
یکی از کاربردهای صنعتی هلیوم، تشخیص نشت است زیرا هلیوم کمترین اندازه مولکولی را دارد و به همین ترتیب یک مولکول تک اتمی است و از طریق کوچکترین نشتی به راحتی عبور میکند. از آنجا که هلیوم سه برابر سریعتر از هوا از طریق مواد جامد واپخش میشود، از آن به عنوان گاز ردیاب برای تشخیص نشت در تجهیزات با خلاء بالا (مانند مخازن کرایوژنیک) و ظروف با فشار بالا استفاده میشود.[۱۳۷] شی مورد آزمایش در محفظهای قرار میگیرد و سپس از هوا تخلیه و با هلیوم پر میشود. هلیوم که از طریق نشتی فرار میکند، توسط یک دستگاه حساس (طیفسنج جرمی هلیوم) شناسایی میشود. دقت این ابزار بسیار زیاد است و به ۹-۱۰ میلیبار در لیتر برثانیه (mbar×L/s) یا ۱۰-۱۰ پاسکال. مترمکعب بر ثانیه (Pa×m۳/s) هم میرسد. روش اندازهگیری معمولاً اتوماتیک است و تست انتگرال هلیوم[bb] نامیده میشود. یک روش سادهتر، پر کردن جسم آزمایش شده با هلیوم و جستجوی دستی نشتها با یک وسیله دستی است.[۱۳۸]
هلیومی که از ترکهای یک وسیله میگذرد را نباید با نفوذ گاز از بدنهٔ ماده اشتباه گرفت. ثابت نفوذ[bc] هلیوم از درون بدنهٔ موادی مانند شیشه، سرامیک و مواد آزمایشگاهی، مشخص و ضریب گذر آن قابل محاسبه است با اینحال، بیشتر گازهای بیاثر مانند هلیوم، نمیتوانند از بدنهٔ اغلب فلزات عبور کنند. هلیوم برای تشخیص نشت در موشکها، مخازن سوخت، مبادلات حرارتی، خطوط گاز، دستگاههای الکترونیکی مختلف، لولههای تلویزیون و سایر اجزای تولید شده فراهم میکند. هلیوم برای تشخیص نشت برای اولین بار در طی پروژه منهتن برای یافتن نشت در غنیسازی اورانیوم استفاده شد.[۱۳۹]
مخلوطهای تنفسی
[ویرایش]هلیوم به دلیل حلالیت بسیار کم در آب و خون به عنوان گاز غواصی در عمق آب زیر ۳۰ متر استفاده میشود. بهعنوان یک گاز استنشاقی، هلیوم فاقد اثرات خوابآلودگی است و برای جلوگیری تجمع نیتروژن در خون، به جای مخلوطهای تنفسی ازت-اکسیژن از مخلوط گازهای حاوی هلیوم مانند تریمیکس،[bd] هلیوکس و هلیایر،[be] برای غواصی در آبهای عمیق[bf] استفاده میشود که به موجب آن خوابآلودگی غواص در اعماق بیشترِ آب، کنترل میشود. علاوه بر این هلیوم باعث خوردگی تجهیزات نمیشود و سمی نیست.[۱۴۰][۱۴۱] هرچه با افزایش عمق، فشار آب افزایش مییابد، چگالی گاز تنفسی نیز افزایش مییابد. برای حل این مشکل و تنفس آسانترِ مخلوطِ گاز تنفسی، حضور هلیوم با جرم مولکولی کم، بهطور قابل ملاحظهای مؤثر است. اضافه شدن هلیوم به مخلوط گاز تنفسی، موجب کاهش عدد رینولدز میشود که در نتیجه جریان آشفتگی کاهش و جریان آرام افزایش مییابد و تنفس آسان میگردد.[۱۴۲][۱۴۳] غواصانی که در عمقهای بیشتر از ۱۵۰ متر (۴۹۰ فوت) از سطح دریا، مخلوطی از هلیوم-اکسیژن را تنفس میکنند، دچار لرزش و کاهش عملکرد حرکتی میشوند که از نشانههای سندرم عصبی فشار بالا[bg] است.[۱۴۴] این اثر ممکن است تا حدی با استفاده از افزودن مقداری از گازهای خوابآور مانند هیدروژن یا نیتروژن به مخلوط هلیوم-اکسیژن، کاهش یابد.[۱۴۵]
راکتورهای هستهای
[ویرایش]هلیوم به عنوان واسطه انتقال گرما در راکتورهای هستهای نسل جدید استفاده میشود و دارای چندین مزیت به عنوان محیط انتقال گرما است. هلیوم بهعلت واکنش ناپذیری و هدایت گرمایی بالا، شفافیت نوترونی و همچنین بهاین علت که در رآکتورها موجب تشکیل ایزوتوپهای پرتوزا نمیشود، بهعنوان یک محیط انتقال حرارت در برخی از رآکتورهای هستهای سرد شده با گاز[bh] استفاده میشود به طوری که یکی از کارآمدترین گاز انتقال گرما است. علاوه بر این هلیوم باعث خوردگی نمیشود و از نظر رادیولوژی بی اثر است (بدون ایزوتوپ رادیواکتیو) و بر ضریب ضریب نوترون تأثیر نمیگذارد. نیروگاههای هستهای با هلیوم به عنوان محیط انتقال گرما دارای بازده و دمای عملیاتی بالاتر هستند.[۱۳۷]
لیزر و روشنایی
[ویرایش]
هلیوم در لیزرها و روشنایی استفاده میشود. هلیوم به گاز تشدیدگر در لیزرهای گازی مانند لیزر هلیوم-نئون و لیزر CO۲ و لیزرهای بخار فلز مانند لیزر بخار فلز هلیوم-کادمیوم اعمال میشود. لیزرهای مختلف با هلیوم برای کاربردهای مختلف مانند تحقیقات علمی، تداخلسنجی، هولوگرافی، طیفسنجی، اسکن بارکد، ترازبندی، جراحی لیزر چشم، نمایشهای نوری، برنامههای چاپ و حروفچینی، جوشکاری و برش استفاده میشود. بهعلاوه از هلیوم به عنوان گاز فعال در لامپهای تخلیه گاز استفاده میشود. هلیوم رنگهایی طیف سفید تا نارنجی منتشر میکند. لامپهای تخلیه گاز هلیوم توسط هنرمندان برای روشنایی با اهداف خاص استفاده میشود.[۱۴۶] لیزرهای هلیوم-نئون، لیزرهایی با توان کم و پرتویی قرمز رنگند که کاربردهای عملی متنوعی مانند بارکدخوان و اشارهگر لیزری دارند. البته امروزه این لیزرها، تقریباً در سراسر دنیا با لیزر ارزانتری با نام لیزر دیودی جایگزین شدهاند.[۱۳]
دیگر کاربردها
[ویرایش]هلیوم به دلیل ویژگی واکنشناپذیری و هدایت گرمایی بالا به عنوان گاز محافظ برای رشد کریستالهای سیلیسیم و ژرمانیوم، در تولید تیتانیوم و زیرکونیوم مورد استفاده قرار میگیرد.[۳۸] همچنین به دلیل داشتن ویژگیهای نزدیک به طبیعت گاز ایدهآل، سرعت بالای صدا در آن و نسبت ظرفیت گرمایی بالا، در تونل باد فراصوتی و آزمون افزایش ناگهانی آنتالپی[bj][توضیح ۶] کاربرد دارد.[۱۴۷][۱۴۸] سن سنگها و ترکیب معدنی حاوی اورانیوم و توریوم را میتوان با اندازهگیری سطح هلیوم با فرایندی موسوم به تاریخگذاری هلیوم تخمین زد.[۱۳][۱۴] هلیوم یک گاز حامل متداول برای کروماتوگرافی گازی است.[۱۴۹] کروماتوگرافی اصطلاحی است که برای تکنیکهای آزمایشگاهی در جداسازی مواد بهطور گستردهای برای تجزیه و تحلیل کمی و کیفی در فرایندها به کار میرود.[۱۵۰][۱۵۱]
هلیوم در ساخت صفحههای LCD و در حین پردازش تراشههای نیمهرسانا به عنوان گاز محافظ،[۱۵۲][۱۵۳] و در هنگام تولید کابل فیبر نوری به عنوان خنککننده کاربرد دارد.[۱۵۴][۱۵۵][۱۵۶] استفاده از هلیوم به دلیل ضریب شکست بسیار پایین، اثرات تحریف کننده تغییرات دما در فضای بین لنزها را در بعضی از تلسکوپها کاهش میدهد.[۱۴] این روش به ویژه در تلسکوپهای خورشیدی که در آن لوله تلسکوپ خلاء خیلی سنگین است استفاده میشود.[۱۵۷][۱۵۸][۱۵۹] از آن به عنوان گاز حامل پودر برای پاشش حرارتی و پاشش سرما استفاده میشود. پاشش حرارتی و پاشش سرما که به آن سمپاشی فلزی نیز گفته میشود، فرآیندهای پوشش سطحی است که میتوان طیف وسیعی از فلزات و سرامیکها را با سرعت زیاد بر روی سطح ماده دیگر پاشید تا پوششهای فلزی ایجاد شود.[۱۶۰][۱۶۱]
هلیوم در آوریل ۲۰۲۰ برای استفادههای پزشکی در ایالات متحده برای انسان و حیوانات مورد تأیید قرار گرفت.[۱۶۲][۱۶۳] استنشاق گاز هلیوکس (ترکیبی از گازهای اکسیژن و هلیوم) موجب کاهش مقاومت در مقابل عبور جریان هوا در زمان تنفس میشود. اثرات مفید این موضوع در بیماران مبتلا به آسم، مشکلات حاد تنفسی و برونشیت ملاحظه شده است.[۱۶۴] همچنین از آن در رآکتور فلورید مایع توریم،[۱۶۵][۱۶۶] پمپ حرارتی ترموآکوستیک،[۱۶۷][۱۶۸] ساخت برخی از هارد دیسکها استفاده میشود.[۱۶۹][۱۷۰][۱۷۱]
ایمنی و احتیاط
[ویرایش]تنفس
[ویرایش]هلیوم طبیعی در شرایط استاندارد، آسیبرسان نیست. مقادیر بسیار اندکی از این ماده در خون انسان پیدا میشود. تنفس هلیوم بهجای اکسیژن، میتواند منجر به خفگی شود.[۳۸] سرعت صوت در هلیوم نزدیک به سه برابر سرعت آن در هوا است. از طرفی بسامد پایه طبیعی مجرای پر شده با گاز، با سرعت صوت در آن گاز متناسب است؛ بنابراین، هنگامی که فرد گاز هلیوم را تنفس میکند، به علت سرعت بیشتر حرکت صدا در گاز هلیوم در مقایسه با هوای معمولی، بسامد تولیدی توسط مجرای صوتی فرد تشدید میشود که این خود موجب تقویت فرکانس صدای فرد میشود.[۱۳][۱۷۲] در صورت استنشاق گازهای سنگینتر از هوا مانند هگزا فلوراید گوگرد یا زنون، عکس حالت فوق رخ میدهد؛ بهطوری که از فرکانس صدای فرد بهخاطر کاهش سرعت صوت در این گازها، کاسته میشود. اگرچه این عنصر از نظر شیمیایی بی اثر است، اما آلودگی هلیوم باعث اختلال در عملکرد سامانه میکرو الکترومکانیکی میشود.[۱۷۳]
تنفس بیش از حد هلیوم میتواند خطرناک باشد؛ زیرا هلیوم یک آسفیکسی[bk][توضیح ۷] ساده است و اکسیژن مورد نیاز برای تنفس طبیعی را جابجا میکند. در پی غیرعادی شدن تنفس، رسیدن اکسیژن به بدن با دشواریِ بسیار جدی روبهرو میشود.[۱۳][۱۷۴] گزارشهایی از مرگ میر بر اثر تنفس هلیوم وجود دارد مثلاً در سال ۲۰۰۳ در ونکوور یک جوان و در سال ۲۰۰۶ در فلوریدای جنوبی دو بزرگسال به همین دلیل مردند.[۱۷۵][۱۷۶] در سال ۱۹۹۸ در ویکتوریا، استرالیا دختری به دلیل تنفس کل محتوای یک بادکنک مهمانی حاوی هلیوم بیهوش شد و بهطور موقت دچار کبودی شد.[۱۷۷][۱۷۸][۱۷۹] تنفس هلیوم بهطور مستقیم از سیلندرهای تحت فشار یا حتی شیرهای پر کننده بادکنک بسیار خطرناک است، زیرا سرعت و فشار زیاد جریان میتواند منجر به باروتروما و پارگی کشنده بافت ریه شود.[۱۸۰]
مرگ ناشی از هلیوم نادر است. اولین پرونده ثبت شده در رسانهها مربوط به یک دختر ۱۵ ساله و اهل تگزاس بود که در سال ۱۹۹۸ در اثر تنفس هلیوم در مهمانی یکی از دوستانش درگذشت. نوع دقیق مرگ هلیوم مشخص نیست.[۱۷۷][۱۷۸][۱۷۹] در ایالات متحده بین سالهای ۲۰۰۰ تا ۲۰۰۴ مرگ دو نفر گزارش شده است، از جمله مردی که در سال ۲۰۰۲ در کارولینای شمالی در اثر باروتروما درگذشت.[۱۷۵][۱۸۰] در سال ۲۰۰۳ در ونکوور، جوانی دچار آسپیراسیون ریوی شد و یک مرد ۲۷ ساله نیز در استرالیا بعد از تنفس از یک کپسول هلیوم در سال ۲۰۰۰ دچار آمبولی شد.[۱۸۱][۱۸۲][۱۸۳] سال ۲۰۱۳ در میشیگان نیز دختری بر اثر هیپوکسی درگذشت.[۱۸۴] در ۲۸ ژانویه، یکی از اعضای یک گروه موزیک ژاپنی، هنگام ضبط برنامه تلویزیونی پس از تنفس هلیوم در حین ضبط دچار آمبولی هوا شد و به کما رفت. این حادثه تا یک هفته بعد؛ یعنی ۴ فوریه ۲۰۱۵ علنی نشد.[۱۸۵][۱۸۶]
سوختگی و انفجار
[ویرایش]موارد ایمنی هلیوم کرایوژنیک مشابه موارد با نیتروژن مایع است. دمای بسیار پایین آن میتواند منجر به سوختگی سرما شود و در صورت عدم نصب وسایل فشارسنج، نسبت انبساط مایع به گاز میتواند باعث انفجار شود. ظروف گاز هلیوم در دمای ۵ تا ۱۰ کلوین به دلیل انبساط حرارتی سریع و قابل توجه که هنگام گرم شدن گاز هلیوم در کمتر از ۱۰ کلوین به دمای اتاق میرسد باید به گونهای به کار گرفته شوند که گویی حاوی هلیوم مایع هستند.[۳۸] اوت ۲۰۲۰ یک مخزن هلیوم که درون کیسه زباله خانگی گذاشته شده بود هنگام ورود به دستگاه جمعکننده زباله در اثر برخورد منفجر و بقایای مخزن تا ۱۰۰ فوت دورتر از کمپکتور پراکنده شده بود.[۱۸۷]
دیگر
[ویرایش]در فشارهای بالا (بیش از حدود ۲۰ اتمسفر یا دو مگاپاسکال)، مخلوطی از هلیوم و اکسیژن (هلیوکس) میتواند منجر به سندرم عصبی با فشار بالا، نوعی اثر بیحس کننده معکوس شود. اضافه کردن مقدار کمی ازت به مخلوط میتواند مشکل را کاهش دهد.[۱۸۸][۱۴۴]
در ژوئیه ۲۰۱۲، در دانشگاه نبراسکا، یک ابزار تشدید مغناطیسی هستهای ۶۰۰ مگاهرتزی را که برای مطالعه ساختارهای مولکولی استفاده میشد به دلیل نشت هلیوم از دست داد. با کاهش مقدار هلیوم و تأمین نشدن مقدار از دست رفته، باقیمانده آن ناگهان جوشید و یک آهنربای پیچیده ۵۰۰٬۰۰۰ دلاری به انبوهی از آشغال تبدیل شد. برای دانشمندان شیمی تجزیه که به هلیوم به عنوان گاز حامل کروماتوگرافی گازی و طیفسنجی جرمی وابسته هستند، استفاده از هیدروژن و اتخاذ استراتژیهای حفاظت از هلیوم در حال تبدیل شدن به رویکردهای عملی هستند.[۱۸۹]
جستارهای وابسته
[ویرایش]پانویس
[ویرایش]- ↑ برخی از پژوهشگران معتقدند که بهتر است هلیوم بهجای اینکه روی گروه گازهای نجیب قرار داده شود، بالای عنصر بریلیوم و گروه فلزات قلیایی خاکی قرار داده شود. آرایش الکترونی، روند پتانسیل یونش و الکترون خواهی، واکنشپذیری، مقایسه ترکیبات شیمیایی و ساختار بلوری آن از دلایلی است که برای این ایده برشمرده میشود.[۵][۶][۷][۸][۹] با اینحال، اغلب شیمیدانها، ترجیح میدهند که هلیوم بهخاطر داشتن بیمیلی شیمیایی عجیب و فوقالعاده نزدیکش به گازهای نجیبی مانند نئون و آرگون، بر روی نئون و گروه گازهای نجیب قرار داشته باشد.[۱۰]
توضیحات
[ویرایش]- ↑ زمانی که یک ماده ابرشاره توسط امواج گرم میشود، انبساط موجب افزایش و توسعه سطح مایع و در نتیجه ایجاد یک چشمه میشود.
- ↑ پدیدهای در مکانیک کوانتومی که در آن انتقال گرما، برخلاف روش معمول و متداول واپخش، بهصورت موجمانند انجام میشود.
- ↑ هسته دارای هاله، به هستهای گفته میشود که توسط ابری هاله مانند از پروتون یا نوترون احاطه شده است و درنتیجه بزرگتر از یک هسته معمولی و فاقد هاله دیده میشود.
- ↑ ترکیبی یونی که الکترون بهعنوان یون منفی آن است. ترکیب [Na(NH۳)۶]+,e− یک الکترید است.
- ↑ گازی که بهخاطر داشتن چگالی کمتر از گازهای موجود در جو زمین، در جو زمین به بالا میرود.
- ↑ آزمون افزایش ناگهانی آنتالپی، آزمونی برای بررسی شرایط جریان آیرودینامیک، حرارتدهی آیرودینامیک، ورود مجدد به جو زمین، احتراق، سینتیک شیمیایی، بالستیک و دیگر اثرات است.
- ↑ گاز آسیفیکس، گازی است غیرسمی یا دارای سمیت کم که موجب کاهش غلظت یا جایگزینی اکسیژن موجود در هوای مورد تنفس است.
واژهنامه
[ویرایش]- ↑ ἥλιος
- ↑ Joule–Thomson coefficient
- ↑ Joule–Thomson inversion temperature
- ↑ Cryogenic liquids
- ↑ Two-fluid model
- ↑ Fountain effect
- ↑ Sintered disc
- ↑ Second sound
- ↑ Rollin film
- ↑ Bernard V. Rollin
- ↑ Third sound
- ↑ High-energy electron-scattering experiments
- ↑ Gerald Kulcinski
- ↑ Helium-3 refrigerator
- ↑ Nuclear halo
- ↑ Liquid drop model
- ↑ Fluoroheliate
- ↑ Metastable
- ↑ Endohedral fullerene
- ↑ Electride
- ↑ Heterosphere
- ↑ Pitchblende
- ↑ Meteoric iron
- ↑ Bureau of Land Management’s
- ↑ U.S. Geological Survey
- ↑ Future of helium as a natural resource
- ↑ International Helium Agency
- ↑ Erasmus Haworth
- ↑ David McFarland
- ↑ Richard Threlfall
- ↑ Barrage Balloon
- ↑ Hampton Roads
- ↑ Bolling Air Force Base
- ↑ USS Shenandoah
- ↑ Lifting gas
- ↑ Shielded Arc Welding
- ↑ Helium mass spectrometer
- ↑ National Helium Reserve
- ↑ Helium Act of 1925
- ↑ United States Bureau of Mines
- ↑ Cliffside
- ↑ Grade A
- ↑ Hugoton Gas Field
- ↑ Standard cubic meter
- ↑ Panhandle Field
- ↑ National Helium Reserve
- ↑ Responsible Helium Administration and Stewardship Act
- ↑ ISO
- ↑ Heat capacity ratio
- ↑ Thermoacoustic refrigeration
- ↑ superconducting quantum interference device
- ↑ Superconducting Magnetic Energy Storage
- ↑ heliarc welding
- ↑ Helium integral test
- ↑ Permeation constant
- ↑ Trimix
- ↑ Heliair
- ↑ Deep diving
- ↑ High-pressure nervous syndrome
- ↑ Gas-cooled nuclear reactors
- ↑ Helium–neon laser
- ↑ Impulse facility
- ↑ Asphyxiant gas
منابع
[ویرایش]- ↑ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). "Noble Gases". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ↑ Grochala, Wojciech (1 November 2017). "On the position of helium and neon in the Periodic Table of Elements". Foundations of Chemistry. 20 (2018): 191–207. doi:10.1007/s10698-017-9302-7.
- ↑ Bent Weberg, Libby (18 January 2019). ""The" periodic table". Chemical & Engineering News. 97 (3). Archived from the original on 1 February 2020. Retrieved 27 March 2020.
- ↑ Grandinetti, Felice (23 April 2013). "Neon behind the signs". Nature Chemistry. 5 (2013): 438. Bibcode:2013NatCh...5..438G. doi:10.1038/nchem.1631. PMID 23609097. Archived from the original on 13 April 2018. Retrieved 27 March 2019.
- ↑ Kurushkin, Mikhail (2020). "Helium's placement in the Periodic Table from a crystal structure viewpoint". IUCrJ. 7 (4): 1–2. doi:10.1107/S2052252520007769. Archived from the original on 4 December 2020. Retrieved 19 June 2020.
- ↑ Labarca, Martín; Srivaths, Akash (2016). "On the Placement of Hydrogen and Helium in the Periodic System: A New Approach". Bulgarian Journal of Science Education. 25 (4): 514–530. Archived from the original on 4 December 2020. Retrieved 19 June 2020.
- ↑ Lewars, Errol G. (5 دسامبر 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. pp. 69–71. ISBN 978-1-4020-6973-4. Archived from the original on 19 May 2016.
- ↑ Kirk, Wendy L. "Cleveite [not Clevite] and helium". Museums & Collections Blog. University College London. Archived from the original on 18 October 2018. Retrieved 18 August 2017.
- ↑ Kochhar, R. K. (1991). "French astronomers in India during the 17th – 19th centuries". Journal of the British Astronomical Association. 101 (۲): 95–100. Bibcode:1991JBAA..101...95K.
- ↑ ۱۳٫۰۰ ۱۳٫۰۱ ۱۳٫۰۲ ۱۳٫۰۳ ۱۳٫۰۴ ۱۳٫۰۵ ۱۳٫۰۶ ۱۳٫۰۷ ۱۳٫۰۸ ۱۳٫۰۹ ۱۳٫۱۰ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 175–179. ISBN 978-0-19-850341-5.
- ↑ ۱۴٫۰۰ ۱۴٫۰۱ ۱۴٫۰۲ ۱۴٫۰۳ ۱۴٫۰۴ ۱۴٫۰۵ ۱۴٫۰۶ ۱۴٫۰۷ ۱۴٫۰۸ ۱۴٫۰۹ ۱۴٫۱۰ ۱۴٫۱۱ ۱۴٫۱۲ ۱۴٫۱۳ ۱۴٫۱۴ ۱۴٫۱۵ ۱۴٫۱۶ ۱۴٫۱۷ ۱۴٫۱۸ ۱۴٫۱۹ ۱۴٫۲۰ Hampel, Clifford A. (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256–268. ISBN 978-0-442-15598-8.
- ↑ "helium (n.)". Archived from the original on 27 August 2020. Retrieved 27 August 2020.
1868, coined from Greek hēlios "sun" (from PIE root *sawel- "the sun")
- ↑ Thomson, William (August 3, 1871). "Inaugural Address of Sir William Thomson". Nature. 4 (92): 261–278 [268]. Bibcode:1871Natur...4..261.. doi:10.1038/004261a0. PMC 2070380. Archived from the original on December 2, 2016. Retrieved February 22, 2016.
Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium
- ↑ Stewart, Alfred Walter (2008). Recent Advances in Physical and Inorganic Chemistry. BiblioBazaar, LLC. p. ۲۰۱. ISBN 0-554-80513-8.
- ↑ William Ramsay (1895). "On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note". Proceedings of the Royal Society of London. 58 (347–352): 65–67. doi:10.1098/rspl.1895.0006.
- ↑ Ramsay, William (1895). "Helium, a Gaseous Constituent of Certain Minerals. Part I". Proceedings of the Royal Society of London. 58 (347–352): 80–89. doi:10.1098/rspl.1895.0010.
- ↑ Ramsay, William (1895). "Helium, a Gaseous Constituent of Certain Minerals. Part II--". Proceedings of the Royal Society of London. 59 (1): 325–330. doi:10.1098/rspl.1895.0097.
- ↑ (آلمانی) Langlet, N. A. (1895). "Das Atomgewicht des Heliums". Zeitschrift für anorganische Chemie (به آلمانی). 10 (1): 289–292. doi:10.1002/zaac.18950100130.
- ↑ Weaver, E.R. (1919). "Bibliography of Helium Literature". Industrial & Engineering Chemistry.
- ↑ Pat Munday (1999). John A. Garraty and Mark C. Carnes (ed.). Biographical entry for W.F. Hillebrand (1853–1925), geochemist and U.S. Bureau of Standards administrator in American National Biography. Vol. 10–11. Oxford University Press. pp. 808–809, 227–228.
- ↑ van Delft, Dirk (2008). "Little cup of Helium, big Science" (PDF). Physics today: 36–42. Archived from the original (PDF) on 25 June 2008. Retrieved 20 July 2007.
- ↑ "Coldest Cold". Time Inc. 10 June 1929. Archived from the original on 21 July 2013. Retrieved 27 July 2007.
- ↑ Kapitza, P. (1938). "Viscosity of Liquid Helium below the λ-Point". Nature. 141 (3558): 74. Bibcode:1938Natur.141...74K. doi:10.1038/141074a0.
- ↑ Osheroff, D. D. ; Richardson, R. C. ; Lee, D. M. (1972). "Evidence for a New Phase of Solid He۳". Phys. Rev. Lett. 28 (14): 885–888. Bibcode:1972PhRvL..28..885O. doi:10.1103/PhysRevLett.28.885.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Stewart, Dr. Doug (2012-10-17). "Helium – expert written, user friendly element information". Periodic Table of Elements and Chemistry (به انگلیسی). Archived from the original on 9 February 2021. Retrieved 2021-02-20.
- ↑ ۲۹٫۰ ۲۹٫۱ "structure, uses, elements, metal, gas, number, name, symbol". Helium, Chemical Element (به انگلیسی). 2015-12-09. Archived from the original on 23 April 2021. Retrieved 2021-02-20.
- ↑ Weiss, Ray F. (1971). "Solubility of helium and neon in water and seawater". J. Chem. Eng. Data. 16 (2): 235–241. doi:10.1021/je60049a019.
- ↑ Scharlin, P. ; Battino, R. Silla, E. ; Tuñón, I. ; Pascual-Ahuir, J. L. (1998). "Solubility of gases in water: Correlation between solubility and the number of water molecules in the first solvation shell". Pure & Appl. Chem. 70 (10): 1895–1904. doi:10.1351/pac199870101895.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ PubChem. "Helium". PubChem (به انگلیسی). Archived from the original on 2 February 2021. Retrieved 2021-02-20.
- ↑ "Get Facts About the Element Helium". ThoughtCo (به انگلیسی). 2010-01-01. Archived from the original on 25 February 2021. Retrieved 2021-02-20.
- ↑ Lewars, Errol G. (2008). Modelling Marvels. Springer. pp. ۷۰–۷۱. ISBN 1-4020-6972-3. Archived from the original on 13 May 2020. Retrieved 19 April 2014.
- ↑ Stone, Jack A. ; Stejskal, Alois (2004). "Using helium as a standard of refractive index: correcting errors in a gas refractometer". Metrologia. 41 (3): 189–197. Bibcode:2004Metro..41..189S. doi:10.1088/0026-1394/41/3/012.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Buhler, F. ; Axford, W. I. ; Chivers, H. J. A. ; Martin, K. (1976). "Helium isotopes in an aurora". J. Geophys. Res. 81 (1): 111–115. Bibcode:1976JGR....81..111B. doi:10.1029/JA081i001p00111.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ "Solid Helium". Department of Physics, University of Alberta. 5 October 2005. Archived from the original on 31 May 2008. Retrieved 20 July 2008.
- ↑ ۳۸٫۰ ۳۸٫۱ ۳۸٫۲ ۳۸٫۳ ۳۸٫۴ ۳۸٫۵ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Grilly, E. R. (1973). "Pressure-volume-temperature relations in liquid and solid 4He". Journal of Low Temperature Physics. 11 (1–2): 33–52. Bibcode:1973JLTP...11...33G. doi:10.1007/BF00655035.
- ↑ Henshaw, D. B. (1958). "Structure of Solid Helium by Neutron Diffraction". Physical Review Letters. 109 (2): 328–330. Bibcode:1958PhRv..109..328H. doi:10.1103/PhysRev.109.328.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 6-120. ISBN 0-8493-0486-5.
- ↑ Hohenberg, P. C.; Martin, P. C. (2000). "Microscopic Theory of Superfluid Helium". Annals of Physics. 281 (1–2): 636–705 12091211. Bibcode:2000AnPhy.281..636H. doi:10.1006/aphy.2000.6019.
- ↑ Warner, Brent. "Introduction to Liquid Helium". NASA. Archived from the original on 2005-09-01. Retrieved 2007-01-05.
- ↑ Fairbank, H. A.; Lane, C. T. (1949). "Rollin Film Rates in Liquid Helium". Physical Review. 76 (8): 1209–1211. Bibcode:1949PhRv...76.1209F. doi:10.1103/PhysRev.76.1209.
- ↑ Rollin, B. V.; Simon, F. (1939). "On the 'film' phenomenon of liquid helium II". Physica. 6 (2): 219–230. Bibcode:1939Phy.....6..219R. doi:10.1016/S0031-8914(39)80013-1.
- ↑ Ellis, Fred M. (2005). "Third sound". Wesleyan Quantum Fluids Laboratory. Archived from the original on 2007-06-21. Retrieved 2008-07-23.
- ↑ Bergman, D. (1949). "Hydrodynamics and Third Sound in Thin He II Films". Physical Review. 188 (1): 370–384. Bibcode:1969PhRv..188..370B. doi:10.1103/PhysRev.188.370.
- ↑ Watkins, Thayer. "The Old Quantum Physics of Niels Bohr and the Spectrum of Helium: A Modified Version of the Bohr Model". San Jose State University. Archived from the original on 2009-05-26. Retrieved 2009-06-24.
- ↑ "Radioactivity in the Environment". Sciencedirect.com. 2012. p. 9. doi:10.1016/B978-0-08-045016-2.00001-1. Archived from the original on 4 December 2020. Retrieved 28 August 2020.
- ↑ "Helium". Los Alamos National Laboratory. Archived from the original on 2020-10-18. Retrieved 27 August 2020.
- ↑ McCracken, Garry; Stott, Peter (2013). Fusion in the Sun and Stars (به انگلیسی). Elsevier. p. 15–29. doi:10.1016/b978-0-12-384656-3.00003-9.
- ↑ "Big Bang Nucleosynthesis". University of California, Los Angeles. 26 September 2012. Archived from the original on 13 January 2018. Retrieved 27 August 2020.
- ↑ ۵۳٫۰ ۵۳٫۱ "Origin of the Elements". Berkeley Lab — Lawrence Berkeley National Laboratory (به انگلیسی). 2000-08-09. Archived from the original on 2020-10-21. Retrieved 2020-08-28.
- ↑ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. ۱۷۵–۱۷۹. ISBN 0-19-850341-5.
- ↑ ۵۵٫۰ ۵۵٫۱ Weiss, Achim. "Elements of the past: Big Bang Nucleosynthesis and observation". Max Planck Institute for Gravitational Physics. Archived from the original on 2010-07-29. Retrieved 2008-06-23.; Coc, Alain; Vangioni-Flam, Elisabeth; Descouvemont, Pierre; Adahchour, Abderrahim; Angulo, Carmen (2004). "Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements". Astrophysical Journal. 600 (2): 544–552. arXiv:astro-ph/0309480. Bibcode:2004ApJ...600..544C. doi:10.1086/380121.
- ↑ ۵۶٫۰ ۵۶٫۱ Anderson, Don L. ; Foulger, G. R. ; Meibom, A. (۲۰۰۶-۰۹-۰۲). "Helium Fundamentals". MantlePlumes.org. Archived from the original on 8 February 2007. Retrieved 2008-07-20.
{{cite web}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Novick, Aaron (1947). "Half-Life of Tritium". Physical Review. ۷۲ (۱۰): ۹۷۲–۹۷۲. Bibcode:1947PhRv...72..972N. doi:10.1103/PhysRev.72.972.2.
- ↑ Zastenker G. N. et al. (2002). "Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements". Astrophysics. ۴۵ (۲): ۱۳۱–۱۴۲. Bibcode:2002Ap.....45..131Z. doi:10.1023/A:1016057812964. Archived from the original on 1 October 2007. Retrieved 2008-07-20.
- ↑ "Lunar Mining of Helium-3". Fusion Technology Institute of the University of Wisconsin-Madison. ۲۰۰۷-۱۰-۱۹. Archived from the original on 9 June 2010. Retrieved 2008-07-09.
- ↑ Slyuta, E. N. ; Abdrakhimov, A. M. ; Galimov, E. M. (2007). "The estimation of helium-3 probable reserves in lunar regolith" (PDF). Lunar and Planetary Science XXXVIII. Archived from the original (PDF) on 5 July 2008. Retrieved 2008-07-20.
{{cite web}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Hedman, Eric R. (۲۰۰۶-۰۱-۱۶). "A fascinating hour with Gerald Kulcinski". The Space Review. Archived from the original on 9 January 2011. Retrieved 2008-07-20.
- ↑ Hiby, Julius W. (1939). "Massenspektrographische Untersuchungen an Wasserstoff- und Heliumkanalstrahlen (H+
3, H−
2, HeH+
, HeD+
, He−
)". Annalen der Physik. 426 (5): 473–487. Bibcode:1939AnP...426..473H. doi:10.1002/andp.19394260506. - ↑ Friedrich, Bretislav (8 April 2013). "A Fragile Union Between Li and He Atoms". Physics. 6: 42. Bibcode:2013PhyOJ...6...42F. doi:10.1103/Physics.6.42. hdl:11858/00-001M-0000-000E-F3CF-5. Archived from the original on 29 August 2017. Retrieved 24 August 2019.
- ↑ Wong, Ming Wah (2000). "Prediction of a Metastable Helium Compound: HHeF". Journal of the American Chemical Society. 122 (26): 6289–6290. doi:10.1021/ja9938175.
- ↑ "Collapse of helium's chemical nobility predicted by Polish chemist" (PDF). Archived from the original (PDF) on 2009-03-19. Retrieved 2009-05-15.
- ↑ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Poreda, Robert J. (1993). "Stable Compounds of Helium and Neon: He@C60 and Ne@C60". Science. 259 (5100): 1428–1430. Bibcode:1993Sci...259.1428S. doi:10.1126/science.259.5100.1428. PMID 17801275.
- ↑ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Freedberg, Darón I.; Anet, Frank A. L. (1994). "Probing the interior of fullerenes by 3He NMR spectroscopy of endohedral 3He@C60 and 3He@C70". Nature. 367 (6460): 256–258. Bibcode:1994Natur.367..256S. doi:10.1038/367256a0.
- ↑ Vos, W. L.; Finger, L. W.; Hemley, R. J.; Hu, J. Z.; Mao, H. K.; Schouten, J. A. (1992). "A high-pressure van der Waals compound in solid nitrogen-helium mixtures". Nature. 358 (6381): 46–48. Bibcode:1992Natur.358...46V. doi:10.1038/358046a0.
- ↑ Dong, Xiao; Oganov, Artem R.; Goncharov, Alexander F.; Stavrou, Elissaios; Lobanov, Sergey; Saleh, Gabriele; Qian, Guang-Rui; Zhu, Qiang; Gatti, Carlo; Deringer, Volker L.; Dronskowski, Richard; Zhou, Xiang-Feng; Prakapenka, Vitali B.; Konôpková, Zuzana; Popov, Ivan A.; Boldyrev, Alexander I.; Wang, Hui-Tian (2017). "A stable compound of helium and sodium at high pressure". Nature Chemistry. 9 (5): 440–445. arXiv:1309.3827. Bibcode:2017NatCh...9..440D. doi:10.1038/nchem.2716. ISSN 1755-4330. PMID 28430195.
- ↑ Tom Metcalfe (27 June 2016). "Huge Cache of Ancient Helium Discovered in Africa's Rift Valley". Livescience.com. Archived from the original on 4 December 2020. Retrieved 31 August 2020.
- ↑ Oliver, B. M.; Bradley, James G. (1984). "Helium concentration in the Earth's lower atmosphere". Geochimica et Cosmochimica Acta. 48 (9): 1759–1767. Bibcode:1984GeCoA..48.1759O. doi:10.1016/0016-7037(84)90030-9.
- ↑ "The Atmosphere: Introduction". JetStream – Online School for Weather. National Weather Service. 2007-08-29. Archived from the original on January 13, 2008. Retrieved 2008-07-12.
- ↑ Lie-Svendsen, Ø.; Rees, M. H. (1996). "Helium escape from the terrestrial atmosphere: The ion outflow mechanism". Journal of Geophysical Research. 101 (A2): 2435–2444. Bibcode:1996JGR...101.2435L. doi:10.1029/95JA02208.
- ↑ Strobel, Nick (2007). "Atmospheres". Nick Strobel's Astronomy Notes. Archived from the original on 2010-09-28. Retrieved 2007-09-25.
- ↑ G. Brent Dalrymple. "How Good Are Those Young-Earth Arguments?". Archived from the original on 2011-06-07. Retrieved 2011-02-13.
- ↑ Hobart M. King. "Uraninite". Geology.com. Archived from the original on 21 September 2020. Retrieved 1 September 2020.
- ↑ R. J. Strutt. "Helium and Radio-Activity in Rare and Common Minerals". Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 80 (542): 572–594. Archived from the original on 4 December 2020. Retrieved 1 September 2020.
- ↑ "Popular Mechanics". March 1931. p. 460. Archived from the original on 1 November 2020. Retrieved 1 September 2020.
- ↑ Cook, Melvine A. (1957). "Where is the Earth's Radiogenic Helium?". Nature. 179 (4552): 213. Bibcode:1957Natur.179..213C. doi:10.1038/179213a0.
- ↑ Aldrich, L. T.; Nier, Alfred O. (1948). "The Occurrence of He3 in Natural Sources of Helium". Phys. Rev. 74 (11): 1590–1594. Bibcode:1948PhRv...74.1590A. doi:10.1103/PhysRev.74.1590.
- ↑ Morrison, P.; Pine, J. (1955). "Radiogenic Origin of the Helium Isotopes in Rock". Annals of the New York Academy of Sciences. 62 (3): 71–92. Bibcode:1955NYASA..62...71M. doi:10.1111/j.1749-6632.1955.tb35366.x.
- ↑ Zartman, R. E.; Wasserburg, G. J.; Reynolds, J. H. (1961). "Helium Argon and Carbon in Natural Gases" (PDF). Journal of Geophysical Research. 66 (1): 277–306. Bibcode:1961JGR....66..277Z. doi:10.1029/JZ066i001p00277. Archived (PDF) from the original on 2017-08-09. Retrieved 2019-01-29.
- ↑ Broadhead, Ronald F. (2005). "Helium in New Mexico—geology distribution resource demand and exploration possibilities" (PDF). New Mexico Geology. 27 (4): 93–101. Archived from the original (PDF) on 2012-03-30. Retrieved 2008-07-21.
- ↑ ۸۴٫۰ ۸۴٫۱ "Read "Selling the Nation's Helium Reserve" at NAP.edu". The National Academies Press (به انگلیسی). 2010-06-30. doi:10.17226/12844. Archived from the original on 11 January 2021. Retrieved 2021-02-24.
- ↑ "PressTV". Archived from the original on 2016-03-03. Retrieved 2014-09-28.
- ↑ "Press release: The unbearable lightness of helium..." European Association of Geochemistry. Archived from the original on 2015-09-06. Retrieved 5 March 2017.
- ↑ Editor, Ian Sample Science (28 June 2016). "Huge helium gas find in east Africa averts medical shortage". The Guardian. Archived from the original on 22 February 2017. Retrieved 5 March 2017.
{{cite news}}:|last1=has generic name (help) - ↑ ۸۸٫۰ ۸۸٫۱ "Helium Market". Helium One Global (به لاتین). 2020-10-22. Archived from the original on 1 March 2021. Retrieved 2021-02-24.
- ↑ Connor, Steve (23 August 2010). "Richard Coleman campaigning against US Congress' decision to sell all helium supplies by 2015". London: Independent.co.uk. Archived from the original on 14 November 2010. Retrieved 2010-11-27.
- ↑ Nuttall, William J.; Clarke, Richard H.; Glowacki, Bartek A. (2012). "Resources: Stop squandering helium". Nature. 485 (7400): 573–575. Bibcode:2012Natur.485..573N. doi:10.1038/485573a. PMID 22660302.
- ↑ McFarland, D. F. (1903). "Composition of Gas from a Well at Dexter, Kan". Transactions of the Kansas Academy of Science. 19: 60–62. doi:10.2307/3624173. JSTOR 3624173.
- ↑ "Discovery of Helium in Natural Gas at the University of Kansas". National Historic Chemical Landmarks. American Chemical Society. Archived from the original on 2014-02-26. Retrieved 2014-02-21.
- ↑ Cady, H. P.; McFarland, D. F. (1906). "Helium in Natural Gas". Science. 24 (611): 344. Bibcode:1906Sci....24..344D. doi:10.1126/science.24.611.344. PMID 17772798. Archived from the original on 4 December 2020. Retrieved 30 June 2020.
- ↑ Cady, H. P.; McFarland, D. F. (1906). "Helium in Kansas Natural Gas". Transactions of the Kansas Academy of Science. 20: 80–81. doi:10.2307/3624645. JSTOR 3624645.
- ↑ Eugene Emme, ed. (1961). "Aeronautics and Astronautics Chronology, 1920–1924". Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915–1960. Washington, D.C.: NASA. pp. 11–19. Archived from the original on 14 July 2019. Retrieved 30 June 2020.
- ↑ Hilleret, N. (1999). "Leak Detection". In S. Turner (ed.). CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999. Geneva, Switzerland: CERN. pp. 203–212. Archived from the original (PDF) on 15 July 2019. Retrieved 30 June 2020.
At the origin of the helium leak detection method was the Manhattan Project and the unprecedented leak-tightness requirements needed by the uranium enrichment plants. The required sensitivity needed for the leak checking led to the choice of a mass spectrometer designed by Dr. A.O.C. Nier tuned on the helium mass.
- ↑ Williamson, John G. (1968). "Energy for Kansas". Transactions of the Kansas Academy of Science. 71 (4): 432–438. doi:10.2307/3627447. JSTOR 3627447.
- ↑ "Conservation Helium Sale" (PDF). Federal Register. 70 (193): 58464. 2005-10-06. Archived (PDF) from the original on 2008-10-31. Retrieved 2008-07-20.
- ↑ Albert Stwertka (1998). Guide to the Elements: Revised Edition. Oxford University Press. p. 24. ISBN 0-19-512708-0.
- ↑ "Public Law 104 - 273 - Helium Privatization Act of 1996". govinfo.gov. 9 October 1996. Archived from the original on 11 August 2020. Retrieved 27 August 2020.
- ↑ ۱۰۱٫۰ ۱۰۱٫۱ Executive Summary. nap.edu. 2000. doi:10.17226/9860. ISBN 978-0-309-07038-6. Archived from the original on 2008-03-27. Retrieved 2008-07-20.
- ↑ Mullins, P. V.; Goodling, R. M. (1951). Helium. Bureau of Mines / Minerals yearbook 1949. pp. 599–602. Archived from the original on 2008-12-06. Retrieved 2008-07-20.
- ↑ "Helium End User Statistic" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2008-09-21. Retrieved 2008-07-20.
- ↑ ۱۰۴٫۰ ۱۰۴٫۱ ۱۰۴٫۲ Smith, E. M.; Goodwin, T. W.; Schillinger, J. (2003). "Challenges to the Worldwide Supply of Helium in the Next Decade". Advances in Cryogenic Engineering. 49. A (710): 119–138. Bibcode:2004AIPC..710..119S. doi:10.1063/1.1774674. Archived from the original on 4 December 2020. Retrieved 30 June 2020.
- ↑ Kaplan, Karen H. (June 2007). "Helium shortage hampers research and industry". Physics Today. American Institute of Physics. 60 (6): 31–32. Bibcode:2007PhT....60f..31K. doi:10.1063/1.2754594.
- ↑ Basu, Sourish (October 2007). Yam, Philip (ed.). "Updates: Into Thin Air". Scientific American. Vol. 297, no. 4. Scientific American, Inc. p. 18. Archived from the original on 2008-12-06. Retrieved 2008-08-04.
- ↑ ۱۰۷٫۰ ۱۰۷٫۱ ۱۰۷٫۲ Newcomb, Tim (21 August 2012). "There's a Helium Shortage On—and It's Affecting More than Just Balloons". Time.com. Archived from the original on 29 December 2013. Retrieved 2013-09-16.
- ↑ "Air Liquide | the world leader in gases, technologies and services for Industry and Health". 19 February 2015. Archived from the original on 2014-09-14. Retrieved 2015-05-25. Air Liquide Press Release.
- ↑ "Middle East turmoil is disrupting a vital resource for nuclear energy, space flight and birthday balloons". washingtonpost.com. 26 June 2017. Archived from the original on 26 June 2017. Retrieved 26 June 2017.
- ↑ Rob Cockerill (25 December 2014). "2015 – What lies ahead? Part 1". gasworld.com. Archived from the original on 2015-01-17. Retrieved 27 August 2020.
{{cite web}}: Cite has empty unknown parameter:|1=(help) - ↑ "Will Air Products' (APD) Earnings Surprise Estimates in Q2? - Analyst Blog". NASDAQ.com. April 28, 2015. Archived from the original on July 15, 2019. Retrieved August 4, 2019.
- ↑ Winter, Mark (2008). "Helium: the essentials". University of Sheffield. Archived from the original on 2008-07-14. Retrieved 2008-07-14.
- ↑ Cai, Z.; et al. (2007). Modelling Helium Markets (PDF). University of Cambridge. Archived from the original (PDF) on 2009-03-26. Retrieved 2008-07-14.
- ↑ Helium (PDF). Mineral Commodity Summaries. U.S. Geological Survey. 2009. pp. 74–75. Archived (PDF) from the original on 2009-08-14. Retrieved 2009-12-19.
- ↑ ۱۱۵٫۰ ۱۱۵٫۱ "Air Liquide and Linde in Helium Hunt as Texas Reserves Dry Up". Bloomberg. 2014. Archived from the original on 2017-03-10. Retrieved 2017-03-07.
- ↑ Briggs, Helen (28 June 2016). "Helium discovery a 'game-changer'". BBC News. Archived from the original on 28 June 2016. Retrieved 2016-06-28.
- ↑ Sample, Ian (28 June 2016). "Huge helium gas find in east Africa averts medical shortage". The Guardian. Archived from the original on 29 June 2016. Retrieved 29 June 2016.
- ↑ Pierce, A. P. , Gott, G. B. , and Mytton, J. W. (1964). "Uranium and Helium in the Panhandle Gas Field Texas, and Adjacent Areas", Geological Survey Professional Paper 454-G, Washington:US Government Printing Office
- ↑ "Responsible Helium Administration and Stewardship Act (H.R. 527)". House Committee on Natural Resources. Committee on Natural Resources United States House of Representatives. Archived from the original on 2017-03-06. Retrieved 5 March 2017.
- ↑ Belyakov, V. P.; Durgar'yan, S. G.; Mirzoyan, B. A. (1981). "Membrane technology—A new trend in industrial gas separation". Chemical and Petroleum Engineering. 17 (1): 19–21. doi:10.1007/BF01245721.
- ↑ "Chapter: 4 Helium Supply, Present and Future". nap.edu. Archived from the original on 10 September 2014. Retrieved 27 August 2020.
- ↑ Dee, P. I.; Walton E. T. S. (1933). "A Photographic Investigation of the Transmutation of Lithium and Boron by Protons and of Lithium by Ions of the Heavy Isotope of Hydrogen" (PDF). Proceedings of the Royal Society of London. 141 (845): 733–742. Bibcode:1933RSPSA.141..733D. doi:10.1098/rspa.1933.0151. Archived from the original (PDF) on 8 February 2020. Retrieved 2 July 2020.
- ↑ "Helium". Lanzhou University. Archived from the original on 4 December 2020. Retrieved 1 September 2020.
- ↑ Michael Banks (27 January 2010). "Helium sell-off risks future supply". Physics World. Archived from the original on 10 June 2012. Retrieved 27 February 2010.
- ↑ ۱۲۵٫۰ ۱۲۵٫۱ ۱۲۵٫۲ Council, N.R.; Systems, C.E.T.; Board, N.M.A.; Commission on Physical Sciences, M.A.; Astronomy, B.P.; Reserve, C.I.S.F.H. (2000). The Impact of Selling the Federal Helium Reserve. Compass series (به انگلیسی). National Academies Press. p. 28. Retrieved 2021-01-03.
- ↑ Belcher, James R.; Slaton, William V.; Raspet, Richard; Bass, Henry E.; Lightfoot, Jay (1999). "Working gases in thermoacoustic engines". The Journal of the Acoustical Society of America. 105 (5): 2677–2684. Bibcode:1999ASAJ..105.2677B. doi:10.1121/1.426884. PMID 10335618.
- ↑ Makhijani, Arjun; Gurney, Kevin (1995). Mending the Ozone Hole: Science, Technology, and Policy. MIT Press. ISBN 978-0-262-13308-1.
- ↑ Fuller, M.; Goree, W. S.; Goodman, W. L. (1985). An Introduction to the Use of SQUID Magnetometers in Biomagnetism (به انگلیسی). Boston, MA: Springer US. p. 103–151. doi:10.1007/978-1-4613-0313-8_4. ISSN 0275-0120.
- ↑ Schoenung, Susan M.; Loyd, Robert J.; Nakamura, Takashi; Rogers, John D.; Purcell, John R. (1986). Liquid Helium Dump Concept for A Large Scale Superconducting Magnetic Energy Storage Plant (به انگلیسی). Boston, MA: Springer US. p. 121–129. doi:10.1007/978-1-4613-2213-9_13.
- ↑ Mcintosh, G. E.; Eyssa, Y. M.; Abdelsalam, M. K.; Boom, R. W.; Gallagher, T. A.; Poirier, R. N.; Shah, J. M.; Bilton, J. R.; Garrity, T. F.; Hilal, M. A. (1988). Protection System for Superconducting Magnetic Energy Storage (SMES) (به انگلیسی). Boston, MA: Springer US. p. 203–210. doi:10.1007/978-1-4613-9874-5_25. ISSN 0065-2482.
- ↑ "LHC: Facts and Figures" (PDF). CERN. Archived from the original (PDF) on 6 July 2011. Retrieved 30 April 2008.
- ↑ Melinda Rose (October 2008). "Helium: Up, Up and Away?". Archived from the original on 22 August 2010. Retrieved 27 August 2020.
- ↑ Council, N.R.; Sciences, D.E.P.; Board, N.M.A.; Astronomy, B.P.; Reserve, C.U.I.S.H. (2010). Selling the Nation's Helium Reserve (به انگلیسی). National Academies Press. p. 80. Retrieved 2021-01-03.
- ↑ Hasan, H. (2006). Helium. Understanding the Elements of the Periodic Table (به لیتوانیایی). Rosen Publishing Group. p. 36. Retrieved 2021-01-03.
- ↑ "What shielding gas should I use when welding aluminum?". AlcoTec Wire Corporation (به انگلیسی). 2021-01-03. Archived from the original on 13 February 2021. Retrieved 2021-01-03.
- ↑ (Minnick 1996، صص. 71–73)
- ↑ ۱۳۷٫۰ ۱۳۷٫۱ "Helium". Van Nostrand's Encyclopedia of Chemistry. Wiley-Interscience. 2005. pp. 764–765. ISBN 978-0-471-61525-5.
- ↑ Hablanian, M. H. (1997). High-vacuum technology: a practical guide. CRC Press. p. 493. ISBN 978-0-8247-9834-5.
- ↑ Ekin, Jack W. (2006). Experimental Techniques for Low-Temperature measurements. Oxford University Press. ISBN 978-0-19-857054-7.
- ↑ Fowler, B.; Ackles, K. N.; G, Porlier (1985). "Effects of inert gas narcosis on behavior—a critical review". Undersea Biomedical Research. 12 (4): 369–402. PMID 4082343. Archived from the original on 2010-12-25. Retrieved 2008-06-27.
- ↑ Thomas, J. R. (1976). "Reversal of nitrogen narcosis in rats by helium pressure". Undersea Biomed. Res. 3 (3): 249–59. PMID 969027. Archived from the original on 2008-12-06. Retrieved 2008-08-06.
- ↑ Butcher, Scott J.; Jones, Richard L.; Mayne, Jonathan R.; Hartley, Timothy C.; Petersen, Stewart R. (2007). "Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox". European Journal of Applied Physiology. 101 (6): 659–69. doi:10.1007/s00421-007-0541-5. PMID 17701048.
- ↑ "Heliox21". Linde Gas Therapeutics. 27 January 2009. Archived from the original on 10 September 2011. Retrieved 13 April 2011.
- ↑ ۱۴۴٫۰ ۱۴۴٫۱ Hunger, W. L. , Jr.; Bennett, P. B. (1974). "The causes, mechanisms and prevention of the high pressure nervous syndrome". Undersea Biomed. Res. 1 (1): 1–28. ISSN 0093-5387. OCLC 2068005. PMID 4619860. Archived from the original on 2010-12-25. Retrieved 2008-04-07.
- ↑ Rostain, J. C.; Gardette-Chauffour, M. C.; Lemaire, C.; Naquet, R. (1988). "Effects of a H2-He-O2 mixture on the HPNS up to 450 msw". Undersea Biomed. Res. 15 (4): 257–70. OCLC 2068005. PMID 3212843. Archived from the original on 2008-12-06. Retrieved 2008-06-24.
- ↑ Balhorn, R.; Kunzmann, H.; Lebowsky, F. (1972-04-01). "Frequency Stabilization of Internal-Mirror Helium–Neon Lasers". Applied Optics (به انگلیسی). The Optical Society. 11 (4). doi:10.1364/ao.11.000742. ISSN 0003-6935.
- ↑ Beckwith, I. E.; Miller, C. G. (1990). "Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley". Annual Review of Fluid Mechanics. 22 (1): 419–439. Bibcode:1990AnRFM..22..419B. doi:10.1146/annurev.fl.22.010190.002223.
- ↑ Morris, C.I. (2001). Shock Induced Combustion in High Speed Wedge Flows (PDF). Stanford University Thesis. Archived from the original (PDF) on 2009-03-04.
- ↑ Grob, Konrad (1997). "Carrier Gases for GC". Restek Advantage, Restek Corporation. Archived from the original on 6 August 2020. Retrieved March 9, 2016.
- ↑ Tsujita, Akira; Okazaki, Hidehiko; Nagasaka, Asami; Gohda, Akinaga; Matsumoto, Mitsushi; Matsui, Toshiro (2018-08-13). "A new and sensitive method for quantitative determination of helium in human blood by gas chromatography–mass spectrometry using naturally existing neon-21 as internal standard". Forensic Toxicology (به انگلیسی). Springer Science and Business Media LLC. 37 (1). doi:10.1007/s11419-018-0437-6. ISSN 1860-8965.
- ↑ West, D.L.; Savannah River Laboratory; U.S. Atomic Energy Commission (1959). Determination of Deuterium, Oxygen, and Nitrogen in Helium by Gas Chromatography. AEC research and development report (به انگلیسی). E.I. du Pont de Nemours & Company, Explosives Department, Atomic Energy Division, Technical Division, Savannah River Laboratory. p. 4. Retrieved 2021-01-03.
- ↑ "Helium is a Critical Part of the Electronics Supply Chain - Helium Investing". Summit Source Funding | Helium Investing (به انگلیسی). 2016-04-22. Archived from the original on 24 January 2021. Retrieved 2021-01-03.
- ↑ Helium, S. Hrg. 113-51, May 7, 2013, 113-1 Hearing, * (به لیتوانیایی). 2013. p. 25. Retrieved 2021-01-03.
- ↑ "HELIUM RECOVERY DURING FIBER DRAW - Fiber Optics". Rosendahl Nextrom Oy - Fiber Optics (به انگلیسی). 2015-08-12. Retrieved 2021-01-03.
- ↑ Kim, Dong Joo; Oh, Il Seok; Kwak, Ho Sang; Kim, Kyoung Jin (2012-02-12). "Helium-Injection Cooling of Hot Silica Glass Fiber in Optical Fiber Manufacturing System". Applied Mechanics and Materials (به انگلیسی). Trans Tech Publications, Ltd. 157–158. doi:10.4028/www.scientific.net/amm.157-158.1301. ISSN 1662-7482.
- ↑ Kim, Kyoungjin; Kwak, Ho Sang; Kim, Dongjoo (2012). "THE ROLE OF HELIUM/ARGON GAS FLOW IN A GLASS FIBER DRAWING FURNACE". Computational Thermal Sciences (به لیتوانیایی). Begell House. 4 (3). doi:10.1615/computthermalscien.2012004538. ISSN 1940-2503.
- ↑ Jakobsson, H. (1997). "Simulations of the dynamics of the Large Earth-based Solar Telescope". Astronomical & Astrophysical Transactions. 13 (1): 35–46. Bibcode:1997A&AT...13...35J. doi:10.1080/10556799708208113.
- ↑ Engvold, O.; Dunn, R.B.; Smartt, R. N.; Livingston, W. C. (1983). "Tests of vacuum VS. helium in a solar telescope". Applied Optics. 22 (1): 10–12. Bibcode:1983ApOpt..22...10E. doi:10.1364/AO.22.000010. PMID 20401118.
- ↑ Lemke, D.; Klipping, G.; Römisch, N. (1978). Liquid Helium-Cooled Infrared Telescope for Astronomical and Atmospherical Measurements from Spacelab (به انگلیسی). Boston, MA: Springer US. p. 628–633. doi:10.1007/978-1-4613-4039-3_77.
- ↑ Ogawa, Kazuhiro (2020-11-18). Cold Spray Technique (به فرانسوی). Singapore: Springer Singapore. p. 143–159. doi:10.1007/978-981-15-7910-3_10.
- ↑ Ozdemir, Ozan C.; Widener, Christian A.; Helfritch, Dennis; Delfanian, Fereidoon (2016-03-08). "Estimating the Effect of Helium and Nitrogen Mixing on Deposition Efficiency in Cold Spray". Journal of Thermal Spray Technology (به انگلیسی). Springer Science and Business Media LLC. 25 (4). doi:10.1007/s11666-016-0394-8. ISSN 1059-9630.
- ↑ "Helium, USP: FDA-Approved Drugs". U.S. Food and Drug Administration. Archived from the original on 3 September 2020. Retrieved 3 September 2020.
- ↑ "FDA approval letter" (PDF). 3 September 2020. Archived from the original (PDF) on 3 September 2020. Retrieved 30 April 2020.
- ↑ Jean-Claude Chevrolet (2001). "Helium oxygen mixtures in the intensive care unit". Critical Care. 5 (4): 179–181. doi:10.1186/cc1019. Archived from the original on 3 September 2020. Retrieved 3 September 2020.
- ↑ Peterson, Per F.; Zhao, H. & Fukuda, G. (5 December 2003). "Comparison of Molten Salt and High-Pressure Helium for the NGNP Intermediate Heat Transfer Fluid" (PDF). U.C. Berkeley Report UCBTH-03-004. Archived from the original (PDF) on 11 August 2014.
- ↑ Juhasz, Albert. High Effieciency Nuclear Power Plants Using Liquid Fluoride Thorium Reactor Technology. Reston, Virigina: American Institute of Aeronautics and Astronautics. doi:10.2514/6.2008-5699. ISBN 978-1-60086-996-9.
- ↑ "thermoacoustic heat pump: Topics by Science.gov". Science.gov (به انگلیسی). 2012-01-01. Retrieved 2021-01-03.
- ↑ Tijani, M.E.H.; Lycklama à Nijeholt, J.A. (2015). Bench scale electrically driven thermoacoustic heat pump. Enschede: University of Twente, Faculty of Engineering Technology, Laboratory of Thermal Engineering. doi:10.3990/2.310. ISBN 978-90-365-3974-6.
- ↑ Gallagher, Sean (November 4, 2013). "HGST balloons disk capacity with helium-filled 6TB drive". Ars Technica. Archived from the original on July 7, 2017. Retrieved June 14, 2017.
- ↑ Aruga, Keiji; Suwa, Masaya (2006). A Study on Positioning Error Caused by FIV using Helium Filled Hard Drives. IEEE. doi:10.1109/apmrc.2006.365888. ISBN 1-4244-0863-6.
- ↑ Aruga, K.; Suwa, M.; Shimizu, K.; Watanabe, T. (2007-09-12). "A Study on Positioning Error Caused by Flow Induced Vibration Using Helium-Filled Hard Disk Drives". IEEE Transactions on Magnetics (به انگلیسی). Institute of Electrical and Electronics Engineers (IEEE). 43 (9). doi:10.1109/tmag.2007.902983. ISSN 0018-9464.
- ↑ Ackerman MJ, Maitland G (1975). "Calculation of the relative speed of sound in a gas mixture". Undersea Biomed Res. 2 (4): 305–10. PMID 1226588. Archived from the original on 27 January 2011. Retrieved 2008-08-09.
- ↑ Oberhaus, Daniel (30 October 2018). "Why a Helium Leak Disabled Every iPhone in a Medical Facility". Motherboard. Vice Media. Archived from the original on 1 November 2018. Retrieved 31 October 2018.
- ↑ Grassberger, Martin; Krauskopf, Astrid (2007). "Suicidal asphyxiation with helium: Report of three cases Suizid mit Helium Gas: Bericht über drei Fälle". Wiener Klinische Wochenschrift (به آلمانی و انگلیسی). 119 (9–10): 323–325. doi:10.1007/s00508-007-0785-4. PMID 17571238.
- ↑ ۱۷۵٫۰ ۱۷۵٫۱ Montgomery B.; Hayes S. (2006-06-03). "2 found dead under deflated balloon". Tampa Bay Times. Archived from the original on 2013-12-30. Retrieved 2013-12-29.
- ↑ "Two students die after breathing helium". CBC. 4 June 2006. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ↑ ۱۷۷٫۰ ۱۷۷٫۱ "Helium inhalation – it's no laughing matter – Article courtesy of BOC Gases". Balloon Artists & Suppliers Association of Australasia Ltd. Archived from the original on 2014-01-14. Retrieved 2014-01-03.
- ↑ ۱۷۸٫۰ ۱۷۸٫۱ "Dangers of Helium Inhalation". Lou's Balloons. Archived from the original on 2014-01-04.
- ↑ ۱۷۹٫۰ ۱۷۹٫۱ "Helium Gas Safety & Data Sheet". bouncetime. Archived from the original on 2015-04-22. Retrieved 2014-01-03.
- ↑ ۱۸۰٫۰ ۱۸۰٫۱ Engber, Daniel (2006-06-13). "Stay Out of That Balloon!". Slate.com. Archived from the original on 2011-10-20. Retrieved 2008-07-14.
- ↑ Mather, Kate (24 February 2012). "Parents of Eagle Point girl who died from inhaling helium hope to save others from same fate". The Oregonian. Archived from the original on 6 December 2013. Retrieved 2013-06-08.
- ↑ Barnard, Jeff (22 February 2012). "Ashley Long, Oregon Teenager, Dies After Inhaling Helium at Wild Party (VIDEO)". Huffington Post. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ↑ Barnard, Jeff (23 February 2012). "Teen girl dies after inhaling helium at party". Today. AP. Archived from the original on 2013-12-30. Retrieved 2013-12-30.
- ↑ "The Oxford Leader Newspaper". Sherman Publications. 3 December 2012. Archived from the original on 2020-10-25. Retrieved 1 September 2020.
{{cite web}}: Cite has empty unknown parameter:|6=(help). - ↑ "テレ朝事故で分かったヘリウム変声缶の危険性 意識を失うケースの大半が子ども" (به ژاپنی). 5 February 2015. Archived from the original on 5 February 2015. Retrieved 2015-02-05.
- ↑ Rayman, Noah (5 February 2015). "J-Pop Teen Star Left in Coma After Inhaling Helium for TV Stunt". Time. Archived from the original on 5 February 2015. Retrieved 2015-02-06.
- ↑ Burgess, Molly (2020-08-05). "Helium tank explodes inside trash compactor". gasworld (به انگلیسی). Archived from the original on 25 January 2021. Retrieved 2021-01-03.
- ↑ Rostain J.C.; Lemaire C.; Gardette-Chauffour M.C.; Doucet J.; Naquet R. (1983). "Estimation of human susceptibility to the high-pressure nervous syndrome". J Appl Physiol. 54 (4): 1063–70. doi:10.1152/jappl.1983.54.4.1063. PMID 6853282.
- ↑ "Coping With The Helium Shortage". Chemical & Engineering News Archive (به انگلیسی). American Chemical Society (ACS). 91 (5). 2013-02-03. doi:10.1021/cen-09105-bus2. ISSN 0009-2347.
پیوند به بیرون
[ویرایش]عمومی
- It's Elemental – Helium
- Where is all the helium? Aga website
- U.S. Geological Survey publications on helium beginning 1996: Helium
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Helium
- U.S. Government's Bureau of Land Management: Sources, Refinement, and Shortage. With some history of helium.
- International Chemical Safety Cards – Helium; includes health and safety information regarding accidental exposures to helium
جزئیات بیشتر
- Helium at The Periodic Table of Videos (University of Nottingham)
- Lancaster University, Ultra Low Temperature Physics – includes a summary of some low temperature techniques
- Helium at the Helsinki University of Technology; includes pressure-temperature phase diagrams for helium-3 and helium-4
گوناگون
- Article about helium and other noble gases
- Physics in Speech with audio samples that demonstrate the unchanged voice pitch
کمبود هلیوم
- Richardson, Robert C.; Chan, Moses (2009). "Helium, when will it run out?" (PDF). Archived from the original (PDF) on 2015-06-14.
- Helium Program: Urgent Issues Facing BLM's Storage and Sale of Helium Reserves: Testimony before the Committee on Natural Resources, House of Representatives Government Accountability Office
- America’s Helium Supply: Options for Producing More Helium from Federal Land: Oversight Hearing before the Subcommittee on Energy and Mineral Resources of the Committee on Natural Resources, U.S. House Of Representatives, One Hundred Thirteenth Congress, First Session, Thursday, July 11, 2013
- Kramer, David (May 22, 2012). "Senate bill would preserve US helium reserve: Measure would give scientists first dibs on helium should a shortage develop. Physics Today web site". Archived from the original on October 27, 2012.
| جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



