مالاریا
| مالاریا | |
|---|---|
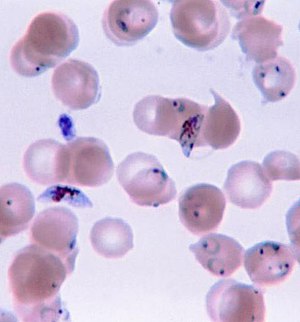 | |
| Plasmodium falciparumحلقهایشکل و سلولهای جنسی در خون انسان. | |
| تخصص | بیماری عفونی (تخصص پزشکی)، پزشکی حارهای، انگلشناسی |
| طبقهبندی و منابع بیرونی | |
| آیسیدی-۱۰ | B50 |
| آیسیدی-۹-سیام | 084 |
| اُمیم | ۲۴۸۳۱۰ |
| دادگان بیماریها | 7728 |
| مدلاین پلاس | 000621 |
| ئیمدیسین | med/۱۳۸۵ emerg/305 ped/1357 |
| پیشنت پلاس | مالاریا |
| سمپ | C03.752.250.552 |
مالاریا (به انگلیسی: Malaria) یک بیماری انگلی است. دستهای از انگلهای تکیاخته به نام پلاسمودیوم به وسیله نیش پشهٔ آنوفل ماده عامل انتقال بیماری به انسان هستند. نخست، تصور میشد که عامل مالاریا پشهٔ آنوفل است؛ اما پشهٔ آنوفل تنها ناقل است و عامل را منتقل میکند.
این بیماری به صورت عفونت حاد در بیشتر موارد وخیم و گاهی طولانی و با ویژگیهای تب متناوب و لرز، کمخونی و بزرگی طحال و گاه با ویژگیهای ساده یا کشندهٔ دیگر خودنمایی میکند. اهمیت این بیماری به خاطر شیوع زیاد و مرگومیر قابل توجهاست. انگل مالاریا توسط یک خانواده از پشه به نام آنوفل به انسان منتقل میشود که این خانواده شامل چندین گونه است.
واژهٔ مالاریا یک واژهٔ ایتالیایی و به معنای هوای بد (Mal-Aria) است و منظور از آن تعریف بیماری با ویژگیهای تب متناوب است که ایتالیاییها در گذشته وجود آن را ناشی از هوای بد و مناطق باتلاقی میدانستند. همواره با گرم شدن زمین، شیوع این بیماری افزایش مییابد.
در این بین نوع فالسی پاروم در موارد شدید میتواند علائمی مانند: هایپوگلایسمی، اسیدوز، اختلالات کبدی، اختلالات کلیوی، ادم ریوی غیر قلبی، کمخونی و ترومبوسایتوپنی و در موارد شدید انسفالوپاتی و کُما را باعث شود
تاریخچه[ویرایش]
تاریخچهٔ باستان[ویرایش]
علائم بیماری مالاریا در نوشتههای چین باستان توضیح داده شدهاست. ۲۷۰۰ سال پیش از میلاد چند علامت مشخص مالاریا که بعداً به نام بیماری مالاریا نام گرفت در نایجینگ (انگلیسی:Nei ching) (قانون پزشکی) توضیح داده شد. قانون نایچینگ توسط امپراتور هوانگتای (انگلیسی: Huang Ti) ویرایش شد. بیماری مالاریا در یونان باستان تا قرن چهارم قبل از میلاد به خوبی شناخته میشد. بخیلی خرییقراط علائم اولیهٔ این بیماری را شرح داد.
سوشروتا (انگلیسی:Susruta) فیلسوف هندی سده ۷ پیش از میلاد در مقالهٔ پزشکی نوشته شده به زبان سانسکریت به علائم تب مالاریا و نیش زدن حشرهٔ معینی در ایجاد تب اشاره کردهاست. تعدادی از نویسندگان رومی، باتلاق را در ایجاد بیماری دخیل میدانستند. در کشور چین در سدهٔ دوم پیش از میلاد به گیاه گندواش (به انگلیسی: Qinghao) در یک مقالهٔ پزشکی اشاره شده بود. همچنین در آرامگاه ماوانگدویی (به انگلیسی: Mawandui)، چینی: 馬王堆) واقع در شهر چانگشا کشور چین ۵۲ دارو برای درمان مالاریا پیدا شد. در سال ۳۴۰ پس از میلاد برای نخستین بار خواص ضد تب گیاه گندواش توسط جی هانگ (به انگلیسی: Ge Hong)، به چینی: 葛洪)از خاندان ین شرقی (به انگلیسی: Yin) توضیح داده شد. در سال ۱۹۷۱ مادهٔ مؤثرهٔ گیاه گندواش توسط دانشمندان چینی جداسازی شد که به نام آرتمیزینین (به انگلیسی: Artemisinin) نامیده شد. امروزه این ماده یک داروی قوی و مؤثر برای درمان مالاریا بهخصوص در ترکیب با داروهای دیگر ضد مالاریا محسوب میشود.
نخستین درمان[ویرایش]
ابوالعلاء شیرازی پزشک معاصر عضدالدوله دیلمی در یکی از لشکرکشیها که بیماری تب نوبه (مالاریا) بیداد میکرد بر حسب اتفاق به تأثیر مواد آرسنیکی در درمان مالاریا پی برد.[۱]
کینین (پوست درخت گنهگنه)[ویرایش]
در آمریکای جنوبی، یسوعیها (مبلغان مذهبی مذهب انجمن عیسی) خاصیت دارویی پوست درختی را از قبایل بومی یادگرفتند. به واسطهٔ همین پوست، درخت زن اشرافی (کنتس) چینکون کشور اسپانیا از تب نجات یافت. بعدها این پوست درخت به نام پوست درخت پرویی و درخت آن نیز به نام سینکونا (به انگلیسی: Cinchona) یا گنهگنه نامیده شد. مادهای که در پوست این درخت وجود دارد به نام کینین معروف است. کینین یکی از داروهای مؤثر ضد مالاریا است.
کشف انگل مالاریا (۱۸۸۰)[ویرایش]

شارل لاوران جراح فرانسوی ارتش بود که در شهر قسنطینه واقع در شمال شرقی الجزایر سکونت داشت. او برای اولین بار وجود انگل مالاریا را در خون افراد مبتلا به مالاریا توضیح داد. به خاطر این کشف او در سال ۱۹۰۷ جایزهٔ نوبل فیزیولوژی یا پزشکی را دریافت کرد.
فرقگذاری بین گونههای مالاریا (۱۸۸۶)[ویرایش]

کامیلو گلجی فیزیولوژیست اعصاب که اهل ایتالیا بود توضیح داد که بیماری مالاریا حداقل دارای دو شکل متفاوت است. یکی با دورهٔ تب سهروزه (تب بعد از ۲ روز) و دیگری دورهٔ چهار روزه (تب بعد از ۳ روز). همچنین او مشاهده کرد که هرکدام از اشکال بیماری شکلهای متفاوتی از مروزوییت را تولید میکنند که تب در اثر بلوغ و رها شدن آنها در خون اتفاق میافتد.
نامگذاری انگلهای مالاریا (۱۸۹۷–۱۸۹۰)[ویرایش]
دو نفر از محققان ایتالیایی به نامهای جووانی باتیستا گراسی و ریموندو فیلتی برای اولین بار نامهای پلاسمودیوم ویواکس و پلاسمودیوم مالاریه را برای دو انگلی که در سال ۱۸۹۰ باعث بیماری افراد میشدند معرفی کردند. لاوران معتقد بود که فقط یک نوع انگل مالاریا به نام اوسیلاریا مالاریه (Oscillaria malariae) وجود دارد. یک آمریکایی به نام ویلیام اچ. ولش این موضوع را دوباره بررسی کرد و در سال ۱۸۹۷ انگل مالاریای سهیک بدخیم را به نام پلاسمودیوم فالسیپاروم نامگذاری کرد. در مقابل این نامگذاری استدلالهای زیادی وجود داشت. اگرچه کاربرد این نام در نوشتهها آنقدر گسترش پیدا کرده بود که تغییر نام این انگل به نامی که لاوران انتخاب کرده بود، یک گمان ممکن بود. در سال ۱۹۲۲ جان ویلیام واتسون استیفنز (John William Watson Stephens) چهارمین انگل مالاریای انسان را به نام پلاسمودیوم اوال معرفی کرد.
نامهای بیماری مالاریا[ویرایش]
برای بیماریهایی که گونههای مالاریا به وجود آوردهاند نامهای متفاوتی در سراسر دنیا استفاده میشود از جمله: مالاریا، تب متناوب، تب و لرز، تب رومی، تب شاگرس، تب مارش، تب حاره، تب ساحلی و تب نوبه.
کشف انتقال انگل مالاریا توسط پشه (۱۸۹۸–۱۸۹۷)[ویرایش]

در اوت سال ۱۸۹۷ رونالد راس کارمند بریتانیایی خدمات پزشکی کشور هند توضیح داد که انگل مالاریا از افراد بیمار توسط پشهها به افراد سالم انتقال مییابد. در تحقیقات بعدی بر روی مالاریای پرندگان، راس نشان داد که پشهها میتوانند انگل مالاریا را از پرندهای به پرنده دیگر انتقال دهند که این کار مستلزم وجود چرخهٔ جنسی (اسپروگونی) در پشه بود. او به خاطر این کشف در سال ۱۹۰۲ جایزهٔ نوبل فیزیولوژی یا پزشکی را دریافت کرد.
کشف انتقال انگل مالاریای انسانی (پلاسمودیوم ۱۸۹۹–۱۸۹۸)[ویرایش]
رهبری یک گروه از محققان ایتالیایی را که آمیکو بینیامی و جوزپه باستیانلی نیز در آن حضور داشتند را جووانی باتیستا گراسی به عهده داشت. این گروه پشهٔ آنوفل به نام آنوفل کلاویگر را جمعآوری کردند و این پشهها از خون بیماران تغذیه میکردند. سپس چرخهٔ کامل جنسی (اسپروگونی) پلاسمودیوم فالسیپاروم، پلاسمودیوم ویواکس و پلاسمودیوم مالاریه شرح داده شد.
در سال ۱۸۹۹ پشههای آنوفل که با تغذیه از خون بیماران آلوده شده بودند به لندن فرستاده شدند تا از ۲ داوطلب این کار تغذیه کنند. این ۲ داوطلب در اثر تغذیهٔ این پشهها به مالاریای سهیک مبتلا شدند.
کانال پاناما (۱۹۱۰–۱۹۰۵)[ویرایش]
ساختمان کانال پاناما پس از کنترل تب زرد و مالاریا ساخته شد. این ۲ بیماری عامل مرگومیر کارگرانی بود که در این منطقه کار میکردند. در سال ۱۹۰۶ در این منطقه بیش از ۲۶۰۰۰ کارگر کار میکردند که از این تعداد بیش از ۲۱۰۰۰ نفر در بیمارستان بستری شدند. تا سال ۱۹۱۲ در این منطقه بیش از ۵۰۰۰۰ نفر مشغول کار بودند و تعداد کارگرانی که در اثر بیماری مالاریا در بیمارستان بستری شدند به حدود ۵۶۰۰ نفر کاهش یافت. به خاطر کوششها و رهبری ویلیام کراوفورد گورگاس، ژوزف آگوستین لپرینس و ساموئل تیلور دارلینگ بیماری تب زرد حذف و مالاریا بهطور چشمگیری کاهش یافت که این کنترل از طریق تکمیل برنامهٔ کنترل پشه و مالاریا صورت گرفت.
خدمات بهداشت عمومی آمریکا و مالاریا (۱۹۴۲–۱۹۱۴)[ویرایش]
زمان اشغال نظامی کوبا توسط آمریکا و ساختمان کانال پاناما به قرن بیستم برمیگردد. افسران آمریکایی قدمهای بلندی در جهت کنترل مالاریا برداشتند. در سال ۱۹۱۴ هانری راس کارتر و ردولف اچ فون ازدو
رف از خدمات بهداشت عمومی آمریکا درخواست پول کردند که این پول از طریق کنگرهٔ آمریکا در اختیار آنان قرار گرفت. خدمات بهداشت عمومی آمریکا فعالیتهایی را برای کنترل مالاریا در ارتش آمریکا به کار گرفت.
موافقتنامهٔ درهٔ تنسی آمریکا (TVA)- یکپارچگی کنترل مالاریا با فعالیتهای اقتصادی (۱۹۳۳)[ویرایش]
رئیسجمهور وقت آمریکا، فرانکلین دلانو روزولت لایحهٔ قانونی را امضا کرد که به موجب آن در ۱۸ مه۱۹۳۳ موافقتنامهٔ درهٔ تنسی به تصویب رسید. این قانون به دولت فدرال اجازه داد تا سازمان متمرکزی را برای کنترل و استفاده از پتانسیل رود تنسی در جهت تولید برق از بخار و اصلاح زمین و آبراه برای رشد این منطقه تشکیل دهد. برنامهٔ سازمانیافته و مؤثر کنترل مالاریا از زمان تصویب (TVA) پایهگذاری شد. بیماری مالاریا تا پیش از تصویب این قانون ۳۰ درصد از مردم منطقه را مبتلا میکرد. خدمات بهداشت عمومی آمریکا نقش حیاتی را در تحقیقات و کنترل مالاریا ایفا کرد و تا سال ۱۹۴۷ بیماری بهطور اساسی حذف شد. همچنین مکانهای تولیدمثل پشههای آنوفل از طریق کنترل سطح آب رودخانه و کاربرد حشرهکشها کاهش یافت.
کلروکین (۱۹۴۶–۱۹۳۴)[ویرایش]
کلروکین توسط یک آلمانی به نام هانس آندرزاک در سال ۱۹۳۴ در شهر ابرفلد آلمان کشف شد. او این ترکیب را به نام رزوکین نامگذاری کرد. به علت خطاهایی که در مدت جنگ جهانی به وجود آورده بود، در سال ۱۹۴۶ توسط دانشمندان انگلیسی و آمریکایی کلروکین به عنوان یک داروی مؤثر ضد مالاریایی معرفی شد.
کنترل مالاریا در مناطق جنگی (MCWA)(۱۹۴۵–۱۹۴۲)[ویرایش]
کنترل مالاریا در مناطق جنگی برای کنترل مالاریا در سراسر پایگاههای آموزش نظامی در مناطق آمریکای جنوبی و سرزمینهای آن که مالاریا هنوز مشکلساز بود، ایجاد شد.
بسیاری از این پایگاهها در مناطقی بودند که پشههای آنوفل به فراوانی یافت میشدند. هدف MCWA جلوگیری از شیوع دوباره مالاریا در مناطق شهری بود. MCWA همچنین دولت و کارمندان گروه بهداشت محلی را درزمینه روشها و سیاستهای کنترل مالاریا آموزش داد.
مرکز کنترل و پیشگیری از بیماریهای واگیر (CDC) و مالاریا (از سال ۱۹۴۶ تا کنون)[ویرایش]
فعالیتهای مرکز کنترل و پیشگیری از بیماریهای واگیر (CDC) برای مبارزه با مالاریا از ۱ ژوئیهٔ ۱۹۴۶ آغاز شد. ابتدا CDC با نام مرکز کنترل بیماریهای واگیر شناخته میشد؛ بنابراین بیشتر کارهایی که توسط CDC انجام میشد بر حذف و کنترل مالاریا در آمریکا متمرکز بود. با کاهش موفقیتآمیز مالاریا در آمریکا CDC تلاشهای خود را از حذف مالاریا به پیشگیری، مراقبت و پشتیبانی فنی بر روی حیوانات اهلی و بیماریهای بینالمللی تغییر داد. البته هنوز مالاریا مورد توجه CDC است.
حذف مالاریا در آمریکا (۱۹۵۱–۱۹۴۷)[ویرایش]
برنامهٔ حذف مالاریا یک شرکت تعاونی بود که توسط دولت و آژانسهای ۱۳ ایالت جنوب شرقی و CDC اداره میشد. پیشنهاد تأسیس این شرکت توسط لوییس لاوال ویلیامز مطرح شد. این شرکت فعالیت خود را در ۱ ژوئیهٔ ۱۹۴۷ آغاز کرد. تا پایان ۱۹۴۹ بیش از ۴۶۵۰۰۰۰ افشانهٔ حشرهکش تولید شد. در سال ۱۹۴۷ ۱۵۰۰۰ بیمار مبتلا به مالاریا گزارش شد. تا سال ۱۹۵۰ فقط ۲۰۰۰ بیمار مبتلا به مالاریا گزارش شد. تا سال ۱۹۵۱ مالاریا در آمریکا حذف شد.
تلاشهایی برای حذف مالاریا در دنیا- موفقیت و شکست (۱۹۷۸–۱۹۵۵)[ویرایش]

با موفقیت ددت، تولید داروهایی با سمیت کمتر، تولید داروهای ضد مالاریایی مؤثرتر و وجود پول موجب شد تا سازمان بهداشت جهانی (WHO) در سال ۱۹۵۵ تأسیس انجمن بهداشت جهانی را با هدف حذف مالاریا در دنیا، پیشنهاد کرد. تلاشهای حذف مالاریا با تمرکز و استفاده از حشرهکشهای ابقایی برای سمپاشی خانهها، درمان بیماران با داروهای ضدمالاریا و مراقبت انجام شد. این تلاشها در ۴ مرحله انجام شد:
- آمادهسازی
- حمله
- استحکام
- نگهداری
این موفقیتها شامل حذف مالاریا در مناطقی بود که دارای آبوهوای گرم بودند. بعضی از کشورها مانند هند و سریلانکا کاهش چشمگیری در موارد ابتلا به مالاریا داشتند. بعضی دیگر از کشورها مانند اندونزی، افغانستان، هائیتی و نیکاراگوئه پیشرفت ناچیزی در کاهش مالاریا داشتند. بیشتر بخشهای جنوب صحرا در آفریقا اصولاً در این زمینه توفیقی نداشتند. بروز مقاومت انگل نسبت به دارو، گسترش مقاومت آنوفلها به حشرهکشها، جابهجایی گستردهٔ جمعیت، مشکل جلب حمایت مالی کشورها، کمبود یا عدم مشارکت همهٔ آحاد اجتماع سبب طولانی شدن تلاشها برای حذف مالاریا گردید. سرانجام به علت مشکلات بالا عملیات حذف و ریشه کنی مالاریا به کنترل مالاریا تغییر یافت.
عامل بیماری[ویرایش]
عامل بیماری یک تکیاخته از سردهٔ پلاسمودیوم است. تاکنون بیش از ۱۰۰ گونهٔ پلاسمودیوم شناخته شده که فقط ۴ گونه از آنها در انسان ایجاد بیماری میکنند: 1-پلاسمودیوم فالسیپاروم که عامل تب سهیک بدخیم است. 2-پلاسمودیوم ویواکس که عامل تب سهیک یا مالاریای ویواکس است. 3-پلاسمودیوم مالاریه که عامل تب چهاریک است. 4-پلاسمودیوم اوال که عامل تب سهیک یا مالاریای اوال است. مالاریای اوال تاکنون در ایران دیده نشدهاست.
اگرچه این ۴ گونه بیماری مهمی را ایجاد میکنند اما بیماری ایجاد شده توسط پلاسمودیوم فالسیپاروم شدیدتر است و حتی گاهی منجر به مرگ میشود.
چرخهٔ زندگی انگل[ویرایش]
سیر تکاملی انگل در دو میزبان انجام میشود. در مورد مالاریای انسان میزبان اصلی انگل پشهٔ آنوفل جنس ماده است و دورهٔ جنسی (Sporogony) در این میزبان طی میشود و دورهٔ غیرجنسی (Schizogony) در بدن انسان طی میشود. علاوه بر این گامت جنسی (گامتوسیت) در انسان به وجود میآید که اصطلاحاً دوره گامتوگونی (Gametogony) میگویند. هنگامی که پشهٔ آنوفل مادهٔ آلوده به انگل مالاریا از انسان خونخواری میکند اسپروزوییتهای موجود در غدد بزاقی پشهٔ آنوفل به انسان منتقل میشود. اسپروزوییتها به سلولهای کبد وارد شده و پس از دو هفته رشد و تکثیر به شیزونت (Schizont) تبدیل میشوند. شیزونتها پس از بالغ شدن، مروزوییتها را آزاد و وارد جریان خون میکنند و سپس وارد گلبولهای قرمز میشوند و در آنجا پس از مرحلهٔ تشکیل حلقه به تروفوزوئیت تبدیل میشوند. تروفوزوئیت پس از بلوغ، گلبولهای قرمز را پاره کرده دستهای از این تروفوزوئیتها به جریان خون محیطی رفته و به سلولهای جنسی نر (Microgametocyte) و سلولهای جنسی ماده (Macrogametocyte) تبدیل میشوند و دستهٔ دیگر وارد گلبولهای قرمز سالم شده و در آنجا پس از تکثیر و رشد دوباره به شیزونت تبدیل میشوند و این شیزونتها، مروزوئیتها را آزاد میکنند و این مروزوئیتها وارد گلبولهای قرمز سالم شده و چرخه دوباره تکرار میشود.
بعضی از این مروزوئیتها تقسیم میشوند در گلبول قرمز و مرحلهٔ شیزوگونی را ادامه میدهند و گلبول قرمز میترکد و تب و لرز در انسان اتفاق میافتد و حالت تهوع و استفراغ به او دست میدهد.
چنانچه پشهٔ آنوفل مادهٔ سالم از خون بیمار تغذیه کند سلولهای جنسی وارد بدن پشه میشود و چرخهٔ جنسی انگل آغاز میشود. در معدهٔ پشه سلولهای جنسی نر و ماده با هم لقاح پیدا میکنند و تبدیل به سلول تخم (زیگوت) میشوند. سپس سلولهای تخم دراز و متحرک میشوند که در این حالت به آنها اووکینت (Ookinet) میگویند. اووکینتها در دیوارهٔ معدهٔ پشه رشد کرده به اووسیست (Oocyst) تبدیل میشوند. اووسیستها رشد کرده و بعد از پاره شدن، اسپروزوئیتها آزاد میشوند و این اسپروزوئیتها وارد غدد بزاقی پشه میشوند و چنانچه این پشه فرد سالمی را نیش بزند این اسپروزوئیتها وارد بدن فرد شده و چرخه دوباره تکرار میشود.
- چرخهٔ جنسی در پشه در حدود ۱۰ تا ۲۰ روز طول میکشد و پشه حدود ۱ تا ۲ ماه آلوده میماند. چنانچه پشه زودتر از ۷ تا ۱۰ روز شخصی را نیش بزند شخص به مالاریا مبتلا نمیشود.
- در مدت دورهٔ نهفتگی (کمون) شخص آلوده هیچگونه علامتی ندارد و اسپروزوئیتها حداقل ۸ روز و حداکثر چند ماه بعد از سلولهای کبدی خارج میشوند.
- علت بروز لرز در بیماران مبتلا به مالاریا پاره شدن گلبولهای قرمز است که اولین علامت در حملهٔ بیماری است. سپس بروز تب و ورود انگل به داخل خون و تعریق که در مرحلهٔ آخر و همزمان با ورود انگل به داخل گلبول قرمز اتفاق میافتد.
- چنانچه خون شخص مبتلا به مالاریا به بدن شخص سالمی تزریق شود فرد سالم مبتلا به مالاریا میشود چون دستهای از سلولهای جنسی میتوانند مستقیماً به اسپروزوئیت تبدیل شوند.
- مالاریا میتواند از مادر بیمار به جنین منتقل شود.
- در ابتلا به مالاریای فالسیپاروم در هر حمله حدود ۱۰ درصد از گلبولهای قرمز پاره میشود و به همین علت احتمال مرگ زیاد و ادرار به رنگ قهوهای یا سیاه دیده میشود.
- انگلهای پلاسمودیوم اوال و پلاسمودیوم ویواکس مرحلهٔ غیرفعال کبدی دارند، بهطوریکه میتوانند ماهها یا سالها به صورت نهفته باقی بمانند و چنانچه تشخیص داده نشوند ممکن است دوباره فعال شوند و وارد جریان خون بشوند. بدون اینکه شخص بیمار، علائمی داشته باشد. در علم پزشکی اصطلاحاً این دو انگل را هیپنوزوئیت (Hypnozoites) و مرحلهٔ نهفتگی آنها را فاز کریپتوبیوتیک (Cryptobiotic phase) میگویند.
دورهٔ کمون[ویرایش]
دورهٔ نهفتگی یا دورهٔ کمون مدتی است که بین گزش پشهٔ آلوده تا آشکار شدن نشانههای ظاهری بیماری و از همه شایعتر تب وجود دارد.
مدت دورهٔ کمون بسته به نوع انگل و طبیعت بیماری متفاوت است. این مدت در مالاریای فالسیپاروم بهطور متوسط ۱۲ (۹ تا ۱۴) روز، در مالاریای ویواکس ۱۴ (۸ تا ۱۷) روز، در مالاریای مالاریه ۲۸ (۱۸ تا ۴۰) روز و در مالاریای اوال ۱۷ (۱۶ تا ۱۸) روز است.
منبع عفونت[ویرایش]
منبع مهم بیماری افرادی هستند که اصول بهداشتی را رعایت نمیکنند و کمتر از دیگران درصدد درمان خود هستند، بیشتر کودکان ۲ تا ۹ ساله هستند که به علت عدم ایمنی و تعداد زیاد گامتوسیت (سلول جنسی) در خون محیطی، خوابیدن در اوایل شب و نداشتن پوشاک مناسب برای بیماری عوامل مناسبی هستند.
مسئلهٔ مالاریای انسانی با منبع حیوانی با کشف یک مورد پلاسمودیوم ناولزی (Pl.Knowlesi) که بهطور طبیعی در کشور مالزی منتقل شده و یک مورد پلاسمودیوم سیمیوم (Pl.Simium) که بهطور طبیعی نزد انسان در برزیل مشاهده شده، دوباره مطرح است. انتقال طبیعی بین مالاریای میمون و انسان یا برعکس بین انسان و میمون در دیگر مناطق نیز امکان دارد. مطالعههای جدید در آمریکا و مالزیا روی پلاسمودیوم سینومولژی (Pl.Cynomolgi) و پلاسمودیوم اینوی (Pl.Inui) و پلاسمودیوم برزیلی (Pl.Brazillianum) نشان داد که این پلاسمودیومها نه تنها از طریق خون آلوده، بلکه از طریق نیش پشهٔ آلوده به انسان منتقل میشوند؛ ولی نکتهٔ مهم این است که گمان نمیرود جهت ریشهکن کردن مالاریای انسانی مالاریای میمونی بتواند مانع این امر شود.
ناقل[ویرایش]
پشههای آنوفل ناقل و میزبان نهایی انگل مالاریا است. در زیر بعضی از ویژگیهای زیستشناسی پشهٔ آنوفل ذکر میشود:
انواع آنوفل: از بین ۴۸۳ گونه آنوفلی که در دنیا شناسایی شدهاست ۷۰ گونه قادر به انتقال بیماری مالاریا هستند که از این میان ۴۰ گونه در مناطق مختلف جهان به عنوان ناقل اصلی مالاریا شناخته شدهاند. در ایران ۲۹ گونه آنوفل انتشار دارد که تاکنون ۷ گونه از آنها به عنوان ناقلین قطعی بیماری مالاریا شناخته شدهاند. نام این ناقلین به شرح زیر است:
- آنوفل سوپرپیکتوس (A.superpictus): در تمام فلات مرکزی ایران همچنین در مناطق کوهستانی شمال و مناطق کوهستانی و تپه ماهورهای جنوب به میزان متغیر وجود دارد. همچنین در دشتهای ساحلی کنارهٔ دریای خزر و خلیج فارس به مقدار کم وجود دارد.
- آنوفل ماکولیپنیس (A.maculipennis): در تمام مناطق ساحلی دریای خزر و قسمت بزرگی از دشت و مناطق نیمهکوهستانی قسمتهای مرکزی و غربی و شرقی ایران فعال است.
- آنوفل ساکاروی (A.acharovi): این آنوفل در منطقهٔ جنوب شرقی ساحل دریای خزر، در آذربایجان کنارهٔ رود ارس و دریاچهٔ ارومیه، مناطق مرکزی (تهران، قزوین، همدان و اصفهان) مناطق غربی و جنوب غربی و مناطق جنوبی در استان فارس (شیراز و کازرون) پراکندهاست.
- آنوفل کولیسیفازیس (A.culicifacies): این آنوفل در مناطق مختلف استان سیستان و بلوچستان و قسمتهای شرقی استان هرمزگان و جنوب شرقی استان کرمان انتشار دارد.
- آنوفل استفنسی (A.stephensi): در تمام مناطق ساحلی دشت و تپه ماهورهای مناطق جنوبی ایران (از دامنهٔ جنوبی رشتهکوه زاگرس به پایین و درههای آن در استانهای خوزستان، فارس، بوشهر، کرمان، هرمزگان و سیستان و بلوچستان انتشار دارد. بهعلاوه، این آنوفل در ایلام و گیلانغرب وجود دارد.
- آنوفل فلوویاتیلیس (A.fluviatilis): در تمام مناطق تپه ماهوری جنوب ایران، دامنهٔ جنوبی زاگرس، از قصر شیرین و گیلانغرب تا شرقیترین منطقهٔ جنوبی ایران در سیستان و بلوچستان انتشار دارد.
- آنوفل دتالی (A.d'thali): انتشار آن تقریباً مشابه آنوفل فلوویاتیلیس است، بهاضافهٔ چند کانون محدود و مجزا، مانند یزد، محلات نزدیک همدان و حدود شرقی کویر نمک (منطقهٔ طبس) که در این مناطق نیز فعالیت دارند.
حساسیت آنوفل نسبت به انگل مالاریا و تطابق آن[ویرایش]
حساسیت آنوفل هر منطقه به زیرگونهٔ انگل همان منطقه بستگی دارد.
عادتهای مربوط به استراحت و خونخواری پشهها[ویرایش]
عادت خونخواری پشهها ترکیبی از دو عامل تکرر تغذیه و انتخاب میزبان است. تکرر تغذیه با نمو تخمکها ارتباط مستقیم دارد که به نوبهٔ خود به دمای محیط زیست آنها بستگی دارد و بهطور معمول هر دو یا سه روز یک بار انجام میشود.
تعداد زیادی از آنوفلها تمایل زیادی به خوردن خون جانوران دارند، یعنی حیواندوست (Zeophile) هستند و برحسب اتفاق از خون انسان تغذیه میکنند. در مناطق انتشار این آنوفلها وجود اغنام و احشام و کثرت آنها سبب جلب آنوفل به سمت احشام شده، در نتیجه بیماری در انسان کمتر دیده میشود. تعداد کمی از آنوفلها انساندوست (Anthropophilia) هستند و درصورتیکه خون انسان در اختیارشان باشد آن را ترجیح میدهند. این گروه در انتقال مالاریا توان چشمگیری دارند. تعدادی از پشهها خونخواری را درون اماکن انسانی انجام میدهند (Endophagous) و پس از خونخواری در همانجا استراحت میکنند (Endophil) و حال آنکه عدهای دیگر خارج از مکانهای انسانی عمل خونخواری را انجام میدهند (Exophagous) و در خارج از خانهٔ افراد و در پناهگاههای طبیعی مانند تنهٔ درختان، غارها، شکاف کوهها، دهانهٔ چاههای آب و زیر پل رودخانهها استراحت نموده یا خونخواری دارند. این گروه در عمل از نظر مبارزه با مالاریا و اجرای عملیات سمپاشی مشکلات را ایجاد میکنند، ولی خطر واقعی از نظر انتقال بیماری را آنوفلهایی دارند که در مکانهای انسانی استراحت و تغذیه میکنند.
طول عمر[ویرایش]

آنوفل ماده از نظر انتقال مالاریا زمانی خطرناک میشود که غدد بزاقی آن حاوی اسپروزوئیت باشد. سن خطرناک آنوفل به نوع آن، نوع انگل، دمای محیط و محل استراحت از چند روز تا چند هفته بستگی دارد. بدین ترتیب پیش از آنکه آنوفل به سن خطرناک برسد، هرچه بیشتر عمر کند خطر آن بیشتر خواهد بود و هرچه درصد پشهها با سن خطرناک زیادتر باشد، خطر انتقال بیماری بیشتر خواهد بود. طول عمر پشهای که به خواب زمستانی میرود، حدود ۹ ماه است. آنوفل گامبیاسهٔ ماده (ناقل مهم قارهٔ آفریقا) در حدود ۳ ماه، و آنوفل ماکولیپنیس ماده حدود ۱ تا ۳ ماه عمر میکند. طول عمر آنوفل نر کوتاه و حدود ۲ هفتهاست.
فراوانی آنوفل[ویرایش]
شکی نیست که میزان خطر هر آنوفل ناقل از نظر شدت انتقال مالاریا بستگی کامل به تعداد وفور نسبی آن دارد. وفور آنوفلها به یک سلسله عوامل محیطی مانند: دما و رطوبت کم و بسیار مناسب، وجود منابع کافی آب به عنوان محل لاروها و شرایط مناسب جهت جلوگیری از مرگ و میر زیاد بستگی دارد.
عادتهای تخمریزی[ویرایش]
بعضی از آنافلها در آبهای جاری تخمریزی میکنند (مانند آ. فلوویاتیلیس)، برخی در آبهای شورمزه (مانند آ. سومدایکوس) و گروهی در چاهها، آبگیرها، چشمهها، یا منابع آب که بر بلندی جاگذاری شده باشد (مانند آ. استفنسی). آگاهی از عادت تخمریزی پشهها برای انجام عملیات ضدلارو ضروری است.
توان ناقل بودن[ویرایش]
این اصطلاح به مجموع اثر تراکم ناقلان، حساسیت آنها به عفونت، طول عمر ناقل و احتمال تغذیه ناقل از انسان گفته میشود. توان ناقل بودن پشهها جدا از توان فیزیولوژی پشه برای انتشار بیماری است.
مقاومت در برابر حشرهکشها[ویرایش]
آگاهی از وضعیت مقاومت پشه در برابر حشرهکش لازم است؛ زیرا هرگاه حشرهٔ ناقل در برابر حشرهکش معینی مقاوم باشد، باید حشرهکش دیگری بهکار برد.
عوامل انسانی مؤثر بر انتقال بیماری[ویرایش]
نژاد[ویرایش]
سیاهپوستان کمتر از سفیدپوستان به مالاریای ویواکس حساس هستند و این مقاومت به روشنی در رابطه با فقدان عامل خونی دافی (انگلیسی: Duffy) در این افراد است. گلبولهای قرمز افرادی که گروه خونی دافی منفی (انگلیسی: fy.fy) در برابر پلاسمودیوم ویواکس و پلاسمودیوم ناولزی مقاوم بوده، درحالیکه گلبولهای قرمز دافی مثبت به سهولت آلودگی پیدا میکنند. در نواحی غرب آفریقا ، فنوتیپ دافی منفی در افراد بومی نود درصد است.
در یک بررسی که در سال ۱۹۸۰ توسط کاگان انجام شد، نشان داده شد که انگل مالاریا و گروه خونی آ در انسان آنتیبادیهای مشترک دارند و بنابراین در چنین افرادی عفونت مالاریایی توسط دستگاه ایمنی بهتر تحمل میشود. در مطالعهٔ دیگری که روی ۴۷۶ بیمار مالاریایی در هند انجام گرفت، معلوم شد که موارد بیماری در کسانی که گروه خونی آ دارند از دیگر گروههای خونی بیشتر است. با توجه به بررسی فراوانی گروههای خونی در ۱۳۰۰ فرد سالم در همان جامعه، کمترین موارد ابتلا در گروه خونی او (O) بود. همچنین مشاهده شدهاست که عدهای از افرادی که هموگلوبین غیرطبیعی دارند (هتروزیگوتهای حامل کمخونی داسیشکل) نسبت به پلاسمودیوم فالسیپاروم بهخصوص در ۲ سال اول زندگی مقاومت نسبی دارند. ژن این بیماری در سیاهپوستان آفریقا و ساکنان جنوب شرقی آسیا شیوع دارد. در این افراد مولکولهای غیرطبیعی هموگلوبین پس از آنکه اکسیژن خود را از دست دادند، به صورت تودهای متراکم و کمانیشکل در میآیند و در نتیجه گلبولهای قرمز به شکل داس درمیآیند. به نظر میرسد تروفوزوئیت پلاسمودیوم فالسیپاروم در مصرف این هموگلوبین غیرطبیعی دچار اشکال میشود، بنابراین رشد آن متوقف میشود. گمان میرود کمبود ژنتیکی آنزیم گلوکز ۶-فسفات دهیدروژناز (فاویسم) تا حدی سبب مقاومت در برابر عفونت ناشی از پلاسمودیوم فالسیپاروم میشود.
سن[ویرایش]
اگرچه در مناطقی که مالاریا شدید و زیاد است، ابتلای کودکان بیشتر از افراد بالغ است، اما وفور انگل در خون در کودکان کمتر از ۶ ماه کمتر از کودکان ۶ ماه و بزرگتر است که به دلیل پادتن رسیده از مادر یا به احتمالی در اثر هموگلوبین غیرطبیعی (دنبالهٔ هموگلوبین جنینی) یا تغذیه از پستان مادر است.
جنسیت و شغل[ویرایش]
جنسیت بهطور مستقیم و طبیعی در حساسیت یا مقاومت نسبت به مالاریا دخالت ندارد، ولی ممکن است از طریق شغل یا نوع پوشش تأثیر نماید، چراکه در بعضی مناطق دختران برخلاف پسران مجبور هستند که هنگام شب پوشش کامل داشته باشند یا اینکه مردان، شب در محیط باز (مانند نگهبانی مزارع برنج یا ماهیگیری) مشغول هستند، بنابراین بیشتر در معرض نیش پشهها هستند.
عوامل محیطی مؤثر بر انتقال بیماری[ویرایش]
شامل محیط فیزیکی، زیستشناسی، اجتماعی و اقتصادی است که در انتقال بیماری نقش دارد.
محیط فیزیکی[ویرایش]
شامل دما، رطوبت، مقدار بارش و میزان آبهای سطحی و غیرهاست و در همهگیرشناسی بیماری تأثیر دارد. دورهٔ جنسی پلاسمودیوم ویواکس در دمای پایینتر از ۱۶ درجهٔ سانتیگراد و دورهٔ جنسی پلاسمودیوم فالسیپاروم در دمای پایینتر از ۱۹ درجهٔ سانتیگراد انجام نمیشود. دما در مدت زمان دورهٔ جنسی نقش دارد. برای مثال دورهٔ جنسی پلاسمودیوم ویواکس در ۱۶ درجهٔ سانتیگراد ۵۰ روز و در ۲۶ درجهٔ سانتیگراد ۹ روز طول میکشد.
رطوبت نسبی بر طول عمر پشه و فعالیت آن تأثیر دارد، بهطوریکه اگر رطوبت نسبی در ساعت ۸ صبح کمتر از شصت درصد باشد احتمال قطع انتقال بیماری وجود دارد.
محیط زیستشناسی[ویرایش]
از قبیل وجود گیاهانی ویژه در لانهٔ لاروی یا بودن دام در منطقه، در تکثیر ناقل بیماری و خونخواری از انسان و انتقال مالاریا نقش بهسزایی دارد.
محیط اجتماعی- اقتصادی[ویرایش]
ویژگیهای اجتماعی- اقتصادی فعالیتهای مختلف مردم و عادتها و رسوم آنان در انتقال بیماری نقش دارد. انتخاب محل سکونت، نصب توری در و دریچهٔ اماکن و استفاده از پشهبند و غیره سبب کاهش خطر مالاریا میشود. بیسوادی و وضع اقتصادی ضعیف، عوامل مساعدی هستند که موارد بیماری را افزایش میدهند. بیماری با تغذیهٔ ناکافی یا بیکیفیت، قادر به دفع علائم بالینی نبوده، بیماری بیشتر عود میکند. جنگ سبب افزایش این بیماری میشود. مهاجرت، نقل و انتقال، منابع آب و طرز استفاده از آن و وضع مسکن و ساختمان عواملی هستند که در فراوانی بیماری اهمیت دارند.
انتشار[ویرایش]

پلاسمودیوم فالسیپاروم، یکی از کشندهترین انگلهای عامل مالاریا و از علل اصلی مرگومیر ناشی از ابتلا به مالاریا در سراسر دنیاست.
به گفته سازمان جهانی بهداشت، هر سال بیش از ۲۰۰ میلیون نفر به مالاریا مبتلا میشوند. این بیماری در سال ۲۰۱۶ موجب مرگ حدود نیم میلیون نفر در سراسر جهان شد و اکثر قربانیان کودکان زیر پنج سال بودند.[۲]
برای آنکه مالاریا در یک منطقه شایع و بومی گردد، سه عامل اصلی و اساسی و تعدادی عوامل ثانوی مورد نیاز است:
- زنجیره انتقال بیماری
از سه عامل (انگل، ناقل و انسان حساس و پذیرنده بیماری) و تعدادی عوامل ثانوی مشتمل بر ویژگیهای فردی و ذاتی (مربوط به انسان، انگل و ناقل) و عوامل محیطی (فیزیکی، شیمیایی، زیستشناسی، اجتماعی و اقتصادی) که تمام آنها روی عوامل سهگانه اصلی و در نتیجه پایداری و برقراری زنجیره انتقال و اپیدمیولوژی بیماری تأثیر دارد.
از نظر اپیدمیولوژی بیماری به دو نوع مالاریای پایدار و ناپایدار تقسیم میشود که با برنامه کنترل یا ریشهکنی مالاریا انطباق دارد، زیرا بهطور کلی ریشهکنی مالاریای پایدار از مالاریای ناپایدار مشکلتر است.
- ویژگیهای همهگیری شناختی مالاریای پایدار: ناقل بیماری با طول عمر متوسط یا زیاد در منطقه وجود دارد، عادت خونخواری ناقل از انسان زیاد است و جهت انتقال بیماری در اکثر ماههای سال حرارت محیط مناسب میباشد. بیماری بهطور معمول در شکل فرابومی (هیپرآندمیک) یا تمام بومی (هلوآندمیک) دیده میشود؛ بنابراین هنگام بروز همهگیری در منطقه بعید است افراد از ایمنی نسبی پایدار برخوردار شوند. به استثنای کودکان، تمام مردم نسبت به عفونت مجدد مقاوم هستند. انگل غالب منطقه، پلاسمودیوم فالسیپاروم است. کنترل بیماری مالاریا بسیار مشکل بوده، مبارزه با لارو مؤثر نمیباشد. با وجود آنکه کانونهای تکثیر لارو، کوچک است، انتقال بیماری ادامه مییابد.
- ویژگیهای همهگیری شناختی مالاریای ناپایدار: ناقل حیواندوست و طول عمر آن در منطقه کوتاه است، حرارت محیط برای سیر دوره جنسی در اکثر ایام سال نامناسب است، مالاریا در شکل فرابومی یا مزوآندمیک دیده میشود. تغییرهای فصلی بیماری بسیار محسوس است. انگل غالب منطقه پلاسمودیوم ویواکس میباشد. احتمال بروز همهگیری در منطقه زیاد است. کنترل بیماری خیلی آسانتر از مالاریای پایدار است. مبارزه با لارو با کیفیت مناسب خیلی مؤثر است.
در ایران مالاریا به شکل ناپایدار دیده میشود و فقط در مناطق انتشار آنوفل فلوویاتیلیس پایداری متوسط است، بنابراین مالاریای غالب در ایران پلاسمودیوم ویواکس است.
- مالاریای همهگیر: همهگیری بیماری بیشتر در مناطق مالاریای ناپایدار شایع است، یعنی در مناطقی که کوچکترین تغییرها در هریک از عوامل انتقال، تعادل را به هم میزند. در اینگونه مناطق، ایمنی مردم در مقابل بیماری ناچیز است. همچنین امکان دارد در ضمن یا تعقیب یک برنامه ناموفق، همهگیری روی دهد.
راه انتقال بیماری[ویرایش]
انتقال مستقیم و طبیعی
۱–۱انتقال بهطور طبیعی از طریق نیش پشه آلوده.
۱–۲ انتقال از طریق جفت مادر.
انتقال مستقیم مالاریا توسط انسان (Induced malaria) عفونت مالاریا ممکن است به روش مکانیکی و توسط انسان بهطور تجربی، اتفاقی یا به منظور درمانی صورت گیرد. این انتقال در تمام حالتهای تلقیح انگل از راه داخل پوستی، درون ماهیچهای یا داخل وریدی صورت گیرد.
۱–۲ مالاریای تجربی (Experimental malaria): این روش برای انجام مطالعههای ایمنیشناختی، ارزشیابی داروها، روشهای درمانی و بررسی دیگر ویژگیهای زیستشناختی انگل مالاریا به کار رود.
۲–۲ مالاریای اتفاقی: در این مورد حالتهای مختلفی مشاهده میشود:
۱-۲-۲ مالاریای اتفاقی در آزمایشگاه به وسیله نیش پشه آنوفل آلوده به پلاسمودیوم انسانی یا پلاسمودیوم میمون مشاهده میشود.
۲-۲-۲ مالاریای اتفاقی که در معتادان به هرویین یا مورفین و غیره عارض میشود و در آن آلودگی از راه سرنگ آلوده منتقل میشود.
۳-۲-۲ مالاریای اتفاقی از راه انتقال خون: مسئله ایجاد مالاریا از راه انتقال خون به علت توسعه برنامههای انتقال خون و همچنین مراحل نهایی برنامه ریشهکنی مالاریا در بعضی کشورها اهمیت بیشتری پیدا کردهاست.
۳–۲ مالاریای درمانی (Malaria therapy): پیش از این به عنوان وسیله ایجاد ش. ک در امراض روانی یا در درمان بعضی عفونتها به کار میرفت.
پیشگیری[ویرایش]
پیشگیری دارویی[ویرایش]
پیشگیری دارویی (پروفیلاکسی) برای پیشگیری از بیماری، سالهای زیادی استفاده شدهاست. پیشگیری قطعی بیماری نیاز به دارویی دارد که بعد از ورود اسپروزوییت به میزبان از سیر تکاملی و سریع آن جلوگیری کند. در حال حاضر چنین دارویی در دسترس نمیباشد. داروهایی مانند پریماکین (Primaquine)و پروگوانیل (Proguanil) مانع سیر تکاملی انگل در سلولهای کبدی قبل از ورود آن به مرحله خونی میشوند، ولی به علت اثر سمی دارو مقاومت به گونه، توزیع همگانی نمیشود. کلروکین (Chloroquine)مانع ادامه سیر تکاملی انگل در گلبولهای قرمز و پیدایش علایم بالینی بیماری میگردد و به عنوان پیشگیری و درمان به مقدار زیاد و بیرویه طی سالهای طولانی توزیع شد و اکنون مقاومت انگل در برابر این دارو را باعث شدهاست.
کینین(Quinine) جهت پیشگیری مصرف نمیشود. مفلوکین (انگلیسی: Mefloquine)برای پیشگیری همگانی توزیع نمیشود، بلکه جهت پیشگیری فردی به افرادی که به مناطق بومی به ویژه مناطق پلاسمودیوم فالسیپاروم مقاوم، مسافرت میکنند تجویز شدهاست.
کاربرد پیشگیری دارویی به موقعیت محلی، گونه انگل، حساسیت انگل در مقابل دارو، آندمیسیته بیماری، درصد پوشش مردم، نوع دارو، مدت توزیع و نظم آن بستگی دارد. از مشکلات دیگر پیشگیری دارویی، هزینه زیاد، مشکل توزیع و پذیرش مردم است. به علت وجود این مشکلها، پیشگیری دارویی همگانی در مناطق بومی در حال حاضر توصیه نمیشود. فقط در موارد استثنایی برای دو گروه آسیبپذیر (یعنی زنان آبستن، بهویژه آبستنی اول و کودکان سنین پایین) پیشگیری دارویی تجویز میشود و همچنین به افراد غیر ایمن که به مناطق آلوده مسافرت میکنند پیشگیری دارویی داده میشود.
بیش از ۲۰ سال است که جهت پیشگیری بیماری به تهیه واکسن اهمیت خاص داده میشود؛ ولی تهیه واکسن بسیار پیچیده و وقتگیر است. برای تهیه واکسن مفیدی جهت پیشگیری همگانی راه درازی در پیش است. واکسن مالاریا برای ۳ مرحله از سیر تکاملی انگل به ویژه برای پلاسمودیوم فالسیپاروم (به علت وخامت و شیوع زیاد آن) تهیه شدهاست که در زیر توضیح داده میشود:
یک واکسن برای مرحله اسپروزوییت، عفونت مالاریا به دنبال ورود اسپروزوییت از طریق نیش پشه آلوده صورت میگیرد. این نوع واکسن سبب میشود که عفونت متوقف شود و از پیدایش علایم بالینی و انتقال بعدی بیماری جلوگیری گردد. نوع دوم واکسن برای مراحل غیر جنسی انگل در خون تهیه شدهاست و سبب از بین رفتن مروزوییتها و مانع رسیدن آنان به گلبولهای قرمز خون میشود. سومین نوع واکسن سبب از بین رفتن سلولهای جنسی و مانع انتقال بیماری میشود؛ بنابراین بهطور مستقیم سبب حفاظت فرد واکسینه نمیشود.
سازمان پزشکی اروپا برای اولین بار واکسن مالاریا را مورد تأیید قرار داد. این واکسن که RTS.S نامیده میشود در سراسر جهان مؤثر نیست و توانایی آن برای محافظت از عفونت مالاریا پس از یکسال محو میشود. این امید وجود دارد که این واکسن در مبارزه با انگلی که سالانه جان نیم میلیون نفر را میگیرد، موفق عمل کند.[۳]
جلوگیری از تماس پشه با انسان[ویرایش]
- پشه بند:با توجه به اینکه فعالیت خونخواری پشه آنوفل از غروب آفتاب تا قبل از طلوع ادامه دارد، استراحت در درون پشهبند مانع نیش زدن پشهها میشود. در بررسیهای انجام شده در مناطق بومی مالاریا در سالهای اخیر مشاهده شدهاست که کاربرد پشهبند آغشته به حشرهکشهای گروه پیرترویید، مانند پرمترین مانع مفیدی است که از تماس پشهها با انسان جلوگیری میکند. در بعضی از این مطالعهها استفاده از پشهبند آغشته به حشرهکش سبب کاهش تعداد پشهها و میزان بروز بیماری شدهاست. حتی اگر پشهبند پاره یا ناقص هم نصب شده باشد، باعث میشود که از بیماریهایی که از طریق حشرهها مانند مگس، شپش و کَک منتقل میشود، جلوگیری کند. پشهبند بافته شده از نایلون یا پلیاتیلن را در محلول ۱۵ تا ۲۵ لیتر حشرهکش با غلظت ۱ تا ۲ درصد که در یک ظرف پلاستیک یا آلومینیوم تهیه شده باشد به مدت ۱ دقیقه خیس کرده، سپس آن را پهن میکنند تا خشک شود. اثر حشرهکشی آن ۶ تا ۱۲ ماه دوام دارد. بهترین روش آغشته کردن پشهبند در محل کاربرد آن در روستا است که بین مردم توزیع گردد.
در یک برنامه پیشگیری، بیش از ۲۰۰۰۰۰۰ پشهبند آغشته به سم در چند استان کشور چین توزیع شدهاست. در افرادی که از پشهبند استفاده کردند مالاریا ۸۷ درصد کاهش یافتهاست. در ویتنام این برنامه برای ۴۰۰۰ نفر اجرا شده و کاهش موارد مالاریا همزمان با استفاده از پشهبند آغشته به سم ۸۰ درصد بودهاست. کاهش بهای پشهبند و حشرهکش مصرفی، سبب مصرف بیشتر آن توسط گروههای کم درآمد جامعه خواهد شد.
- دفعکنندهها (انگلیسی:Repellents):مصرف دورکنندهها مانند DEET با قیمت ارزان و با اثر طولانی (تا ۱۰ ساعت) ضد حشرههای نیشزن مؤثر بودهاست. این مواد به صورت پماد برای استعمال پوستی در قسمتهای باز بدن مانند گردن، زانو و مچ دست و پا به صورت محلول برای آغشته کردن لباس و وسایل خواب و پشهبند به کار میروند. صابون محتوی پرمترین و DEET به تازگی در نقاطی از آسیا برای اثر حشرهکشی آن مورد بررسی قرار گرفتهاست. اسپری پیرتروم (انگلیسی: Pyrethrom) که یک حشرهکش طبیعی است، سبب نابودی پشههای اطراف شخص خوابیده میشود. روشهای تدخینی مانند استفاده از کویل (Coil) حشرهکش مؤثر است.
- نصب توری (انگلیسی:Screening): یک وسیله استحفاظی فردی و خانوادگی است. تمام منافذی که اجازه ورود به پشهها را میدهند، مانند در، پنجره، سوراخها و منافذ مختلف باید با توری پوشانده شود.
- البسه: البسه محافظ در شرایط اختصاصی و مواردی که افراد به علت حرفه خود مجبور هستند که در ساعتهای حمله و گزیدن پشهها در خارج منزل باشند (مانند سربازان و کارگران) ارزش نسبی دارد.
- انتخاب محل زندگی (انگلیسی:Site selecting): محل سکونت دایمی یا موقت نباید همجوار با محل تکثیر پشهها باشد. انتخاب مسکن اهمیت بسیار دارد.
- انحراف پشهها از انسان به طرف حیوانها (انگلیسی:Zoo prophylaxis): سبب کاهش تماس پشه با انسان میشود.
مبارزه با لارو پشهها و کاهش منابع لاروی[ویرایش]
- روشهای مکانیکی (انگلیسی:Mechanical methods):
روشهای مکانیکی یا فیزیکی از قدیمیترین روشهای مبارزه با لارو پشهها و کنترل مالاریا بهشمار میرود. بهطور کلی هدف روشهای مکانیکی عبارت است از: جلوگیری از ایجاد لانههای لاروی، از بین بردن لانههای موجود در اطراف اماکن انسانی از طریق زهکشی (انگلیسی: Drainage)، پرکردن و از بین بردن گودالها، حلبهای خالی، حوض و پوشش در یا سرپوش برای چاهها و مخزن آب خانهها.
- کاشتن درخت اکالیپتوس در نواحی باتلاقی سبب خشک شدن باتلاق میشود. عدم توجه به بهداشت محیط در هنگام توسعه شهر یا روستا، احداث جادهها، برقراری نظام آبیاری و حفر چاههای آب، مخاطرهآمیز میباشد. اینگونه برنامهها در مناطق مالاریاخیز خطر بیماری را دوچندان میکند و برای ناقلان شهری فرصت مناسبی به وجود میآورد.
- کنترل شیمیایی:
کنترل شیمیایی شامل کاربرد مواد نفتی در سطح لانههای لاروی و لاروکشهای شیمیایی از گروه ترکیبهای ارگانوفسفره مانند تمفوس (انگلیسی: Temphos abate) است.
- روشهای زیستشناسی (انگلیسی:Biological methods):
روشهای بیولوژیکی (زیستشناسی) شامل بهکارگیری شکارچیها (انگلیسی: Predators)مانند ماهیهای لاروخوار (ماهی گامبوزیا که از قدیم کاربرد آن معمول بودهاست و ماهی آ. فانیوس (انگلیسی: A.phanius) بومی جنوب ایران) و پاتوژنها مانند باسیلوس اسفاریکوس (انگلیسی: B.sphaericus)، باسیلوس تورنژنسیس (انگلیسی: B.thuringiensis H-۱۴)در مبارزه با لارو پشهها مؤثر بوده، به صورت تجاری در دسترس میباشد. نظر به اینکه کابرد حشرهکشها باعث بروز مقاومت ناقل در مقابل آنان و همچنین سبب آلودگی محیط زیست انسان و دیگر موجودات میشود، کاربرد پاتوژنها جهت جانشینی مورد تأکید است. کاربرد باسیل در مناطقی که دارای لانههای لاروی محدود میباشد، مؤثر بوده و تکرار آن در نوع پودر و تابل یا گرانول و غیره لازم است.
مبارزه با آنوفل بالغ[ویرایش]
- حشرهکشهای ابقایی (انگلیسی:Residul insecticides): در این روش از خاصیت حشرهکشی بعضی مواد شیمیایی که از راه تماس یا تدخین و تماس، سبب مرگ و میر پشهها و دیگر حشرهها میگردند، استفاده میشود. برای این منظور تمام سطوح اماکن و پناهگاههایی که در محل استراحت موقت یا دایم پشهها شناخته شدهاند (اعم از سطوح داخلی یا خارجی پناهگاههای دایم و موقت و غیره)، با ماده حشرهکش سمپاشی میشوند. بدین ترتیب حشرهکش، از یک طرف با تأثیر تدریجی و مستمر موجب مرگ پشهها و پایین آمدن یا به صفر رسیدن تعداد آنان میگردد و از طرف دیگر با کوتاه کردن طول عمر پشهها باعث میشود که سیر تکاملی انگل مالاریا در پشهها انجام نگیرید و در نتیجه انتقال مالاریا قطع شود. انتخاب نوع و مقدار حشرهکش و تناوب سمپاشی بستگی به حساسیت پشهها به مواد حشرهکش، حداقل مقدار مؤثر و غیر خطرناک و اثر ابقایی آن حشرهکش، فصل انتقال مالاریا در منطقه، شرایط جغرافیایی و ساختمانی آن نقطه و بالاخره امکانات مالی و اجرایی محلی دارد. در چند دهه اخیر حشرهکشهای ددت (DDT) و مالاتیون با اثر ابقایی طولانی مهمترین روش ضد مالاریایی در برنامههای مبارزه با مالاریا بودهاست.
- سمپاشی فضایی (انگلیسی:Space spraying): هدف از این روش کشتن پشههای در حال پرواز یا در حال استراحت با تأثیر از راه تدخین یا تماس است. سمپاشی فضایی را ممکن است در داخل اماکن مسدود یا در فضای خارج انجام داد. حالت اخیر زمانی است که مسئله اگزوفیلی و اگزوفاژی پشهها مطرح باشد.
- روشهای وراثتی (انگلیسی:Genetic manipulations): با اجرای این روشها حشره برای انهدام خود به کار گرفته میشود و تخریب و برهم زدن جمعیت طبیعی پشهها را باعث میشود. این عمل ممکن است با به کار بردن ژنهای مخرب صورت گیرد مانند روش عقیم کردن (انگلیسی: Sterilization) حشرهها یا تغییر نسبت جنسی حشره یا دیگر روشهای وراثتی.
پراکندگی انگل مالاریا در دنیا[ویرایش]
- پلاسمودیوم فالسیپاروم: در مناطق گرمسیری و نواحی زیر گرمسیری وجد دارد. این تنها گونه از پلاسمودیوم است که میتواند بیماری شدید و کشنده ایجاد کند. تخمین زده میشود سالیانه حدود ۷۰۰۰۰۰ تا ۲۷۰۰۰۰۰ نفر از مردم دنیا بر اثر بیماری با اینگونه پلاسمودیوم از بین میروند. پلاسمودیوم فالسیپاروم گونه غالب در قاره آفریقا میباشد. چون انگل پلاسمودیوم فالسیپاروم به سرعت تکثیر میشود در نتیجه منجر به کم خونی شدید میشود. به علاوه این انگل میتواند جلوی جریان خون در رگهای کوچک را بگیرد و چنانچه این عمل در مغز رخ دهد منجر به مرگ میشود.
- پلاسمودیوم ویواکس: که اکثراً در قاره آسیا و آمریکای لاتین و بعضی از قسمتهای آفریقا دیده میشود. پلاسمودیوم ویواکس زمانی باعث مرگ میشود که طحال ورم کرده و پاره شود.
- پلاسمودیوم اوال: که اکثراً در قاره آفریقا دیده میشود (بهخصوص در غرب آفریقا، جزایر واقع در غرب اقیانوس آرام). این انگل از لحاظ زیستشناسی و ریختشناسی شبیه پلاسمودیوم ویواکس است. تنها تفاوتی که با هم دارند این است که پلاسمودیوم اوال میتواند افراید را که دارای گروه خونی دافی منفی هستند را آلوده کند و همین امر باعث شیوع زیاد بیماری بر اثر پلاسمودیوم اوال در قاره آفریقا میشود. چون سیاهپوستان دارای گروه خونی دافی منفی هستند. در عوض چنین افرادی (یعنی کسانیکه دارای گروه خونی دافی منفی هستند) به پلاسمودیوم ویواکس مقاومت بیشتری دارند. خوشبختانه پلاسمودیوم اوال در ایران وجود ندارد.
- پلاسمودیوم مالاریه: که در تمام نقاط دنیا دیده میشود.
دستهبندی میزان شیوع مالاریا[ویرایش]
- مالاریا در منطقهای فرابومی محسوب میشود که میزان بزرگی طحال در کودکان ۲ تا ۹ ساله همیشه بیش از ۵۰٪ است و علاوه بر این، میزان بزرگی طحال در افراد بالغ هم از ۵۰٪ تجاوز میکند.
- مالاریا در منطقهای تمامبومی محسوب میشود که میزان بزرگی طحال در کودکان ۲ تا ۹ ساله همیشه بیش از ۷۵٪ است ولی در افراد بالغ، به علت داشتن ایمنی نسبی، از این حد پایینتر است.
بیماری مالاریا در ایران[ویرایش]
بیماری مالاریا از قدیم در ایران وجود داشته و پزشکان ایرانی با آن آشنایی داشتهاند. در کتاب اوستا به تب و لرز اشاره شدهاست. اصطلاح تب تایب، تب نوبه، تب و لرز در کتاب قانون در طب ابن سینا و ذخیره خوارزمشاهی بارها ذکر شدهاست. در ایران این بیماری به علت فراوانی فوقالعاده، موارد ایجاد ضعف، کمخونی، کاهش قدرت کارایی افراد، بروز بیماری در ایام کار کشاورزی و آمادگی بیشتر بیماران مالاریایی برای ابتلا به دیگر بیماریها مورد توجه بودهاست.
در سال ۱۳۰۳ بنا به تقاضای دولت ایران سازمان جهانی بهداشت دکتر ژیلمور را برای مطالعه بیماری مالاریا و بیماریهای عفونی به ایران اعزام کرد. این فرد گزارش جالبی راجع به انتشار بیماریهای عفونی در ایران تهیه کرد که در مجله جامعه ملل سال ۱۹۲۴ چاپ و منتشر شد.
دکتر ژیلمور در خصوص مالاریا مینویسد:
- مالاریا شایعترین بیماری کشور ایران بوده، هر ساله ۴ تا ۵ میلیون نفر از مردم ایران به این بیماری مبتلا میشوند. (در سال ۱۳۰۳ جمعیت ایران حدود ۱۳۰۰۰۰۰۰ نفر بودهاست).
- حداقل ۷۵ درصد جمعیت کشور در مناطقی زندگی میکنند که به شدت مالاریاخیز است.
- حدود ۴۱ درصد از کل مرگومیر سالانه کشور در اثر مالاریا است.
بهطور کلی در بررسیهای انجام شده آندمیسیته بیماری در مناطق مختلف ایران در شمال و جنوب کشور به صورت فرابومی (هیپرآندمیک) و در فلات مرکزی و شرق ایران مزوآندمیک یا زیربومی (هیپوآندمیک) بودهاست.
در سالهای قبل از جنگ جهانی دوم اقدامهای اولیه مبارزه با مالاریا به صورت توزیع قرصهای کینین و نفتپاشی روی آبهای راکد و در حد محدود، بهسازی محیط در مناطقی از کشور که میزان آلودگی در سطح بالاتری بوده، در دست اجرا قرار گرفتهاست، ولی به علت فقدان امکانات و کمبود تجربه عملی و بروز جنگ جهانی دوم این برنامه به حال رکود درآمد. پس از جنگ جهانی دوم در سال ۱۳۲۹ بار دیگر مبارزه با مالاریا با استفاده از حشرهکش ددت شروع شد. ابتدا قسمتهای کوچکی از نقاط آلوده کشور سمپاشی شد و در سالهای بعد به تدریج گسترش یافت. در سال ۱۳۳۶ برنامه ریشهکنی مالاریا طبق توصیه سازمان جهانی بهداشت با تصویب دولت و جهت خاتمه دادن به انتقال مالاریا و پاک کردن مخازن آلوده به صورت سمپاشی مکانهای استراحت آنوفل و از بین بردن محلهای تخمریزی آن، بیماریابی، درمان بیماران و دیگر اقدامهای جنبی شروع شد.
این برنامه تا سال ۱۳۴۰ ادامه یافت، ولی در این سال به علت بروز مقاومت مضاعف آنوفل استفنسی (ناقل مهم مناطق جنوبی کشور) به ددت و دیلدرین و دیگر مشکلات فنی، اجرایی واداری، عملیات ریشهکنی در مناطق جنوبی کشور قطع گردید. در سال ۱۳۴۷ برای اولین بار با انتخاب حشرهکش مالاتیون و استفاده عوامل کمکی، مانند اجرای عملیات لاروکشی، توزیع ماهی گامبوزیا و توزیع همگانی دارو تمام کشور تحت برنامه ریشهکنی مالاریا قرار گرفت. این اقدامها موجب گردید که در سال ۱۳۵۲ بیش از دوسوم جمعیت کل کشور ساکن در شمال رشته کوههای زاگرس به کلی از نظر ابتلا به مالاریا ایمن شوند و در قسمت جنوبی کشور نیز مهار گردد. در سال مذکور تعداد کل بیماران در کل کشور به ۱۶۰۰۰ نفر رسید. به علت وجود نقایص و رکودهایی در برنامه ریشهکنی مالاریا در سالهای ۱۳۵۳ و ۱۳۵۴ میزان آلودگی به مالاریا در قسمتی از مناطق جنوبی کشور، به ویژه استانهای هرمزگان، بلوچستان و قسمت گرمسیری کرمان افزایش یافت و بیماری به صورت همهگیر (اپیدمی) درآمد. علاوه بر این مسافرت افراد آلوده مناطق جنوب به نواحی پاک شده شمال کشور موجب شد که تعدادی کانون انتقال مالاریا در آن نقاط ایجاد شود.
با توجه به میزان بروز انگلی سالانه، وضعیت ناقلان و نحوه انتشار بیماری و آمارهای دریافتی و درجهبندیای که بین استانها صورت گرفت، کشور به سه منطقه از نظر شاخصهای پیشگفت تقسیم میشود:
- منطقه شمال رشته کوههای زاگرس.
- منطقه جنوب و جنوب غربی.
- منطقه جنوب شرقی کشور.
در یک جمعبندی کوتاه و با توجه به تقسیمبندی کشور از نظر میزان بروز انگلی سالانه میتوان اظهار داشت که در منطقه یک (شمال رشته کوههای زاگرس) حدود ۷۰ درصد جمعیت کشور زندگی میکنند و این منطقه به تقریب از مالاریا پاک شده و خطر آلودگی کم است. در سال ۷۶ در این منطقه تعداد ۵۸۳۹ مورد مالاریا گزارش شد که ۷۷ درصد آن وارده از کشورهای افغانستان، پاکستان، عراق، جمهوری ارمنستان و جمهوری آذربایجان بودهاست. در سال ۷۶ بروز سالانه انگلی در این منطقه ۱۳۷ در هزار نفر جمعیت بودهاست. بیماری مالاریا در جنوب و جنوب غربی کشور یعنی منطقه ۲ که ۲۵ درصد کل جمعیت کشور را داراست به صورت تحلیل رونده درآمده و به خوبی به عملیات مبارزه پاسخ دادهاست. در سال ۷۶ در این منطقه ۲۶۷۹ مورد بیمار مبتلا به مالاریا گزارش شده که ۴۸ درصد آن وارده از کشورهای افغانستان و عراق و کانونهای آلوده داخل کشور بودهاست. در این سال بروز سالانه انگلی در این منطقه ۱۷۶ مورد در هزار نفر بودهاست.
منطقه سوم یعنی جنوب شرقی کشور که منطقه مشکل کشور از نظر بیماری مالاریا محسوب میشود شامل استانهای سیستان و بلوچستان و هرمزگان و قسمت گرمسیری استان کرمان است و بنا به دلایل مختلف از جمله تعدد ناقلان، مقاومت ناقلان به حشرهکشها، ظهور و توسعه مقاومت انگل پلاسمودیوم فالسیپاروم به کلروکین، نبودن راههای ارتباطی مناسب، آب و هوای گرمسیری، فصل انتقال طولانی، ناپایداری وضع اکولوژیک منطقه و جغرافیایی انسانی، وجود ساختمانهای موقت و تغییرهای زیستمحیطی، مالاریا به عنوان یک مشکل بهداشتی باقی ماندهاست. در سال ۷۶ در این منطقه ۲۹۹۰۶ مورد مبتلا به مالاریا و بروز انگلی سالانه آن ۸۷۴۴ در هزار نفر جمعیت بودهاست. قابل ذکر است که تعداد ۲۲۲۲۴ مورد یعنی ۷۴ درصد موارد مذکور متعلق به استان سیستان بودهاست. به یقین کنترل بیماری در این مناطق بدون مشارکت مردمی امکانپذیر نیست، بنابراین استفاده از شوراهای بهداشت کشور، استان، شهرستان و بخش و روستا که تجسمی عینی از همکاریهای بین بخشی و مشارکتهای مردمی است، میتواند مسولان بهداشتی را در رفع یا دستکم کاهش معضلها و مشکلهای بهداشتی موجود یاری نماید.
در حال حاضر برنامه کنترل مالاریا در مناطق آلوده کشور با توجه به سه اصل عمده بنیان گذاشته شدهاست:
- استفاده هرچه کمتر از مواد حشرهکش.
- استفاده کنترل شده از دارو جهت درمان بیماران.
- حداکثر تلاش برای بیماریابی و درمان موارد آلوده.
سازمان بهداشت جهانی در گزارش سال ۲۰۱۴ خود اعلام کرده که ایران در آستانه ریشه کنی مالاریا قرار گرفتهاست. ایران در سال ۲۰۱۳ فقط ۵۱۹ مورد مالاریا را گزارش کرده که نسبت به سال ۲۰۱۲ پنجاه درصد کاهش نشان میدهد. ایران همچنین برای تمام افرادی که به مراکز بهداشتی عمومی مراجعه کردهاند داروی ضد مالاریا فراهم کردهاست. در ایران ویواکس بیش از هشتاد درصد موارد را تشکیل میدهد. درحالیکه در منطقه شرق مدیترانه شایعترین نوع مالاریا نوع خطرناکتر فالسی پارم است، در ایران، افغانستان و پاکستان شایعترین نوع مالاریا، ویواکس است.[۴]
مقاومت ذاتی[ویرایش]
بیماران مبتلا به تالاسمی و کمخونی داسیشکل در برابر مالاریا مقاومت ذاتی دارند. چون انگل پلاسمودیوم برای رشد و تکثیر خود به مقدار زیادی آهن نیاز دارد و در این بیماران به علت رسوب هموگلوبین یون آهن گلبول قرمز کاهش مییابد بنابراین این بیماران در برابر مالاریا مقاومترند و عده خیلی کمی از آنها مبتلا به مالاریا میشوند.
علائم[ویرایش]
علائم مالاریا به مدت ۶ تا ۱۰ ساعت دوام دارند و بهطور دورهای معمولاً هر دو روز یکبار بروز میکنند.
بیماری خفیف علائم زیر را خواهد داشت:
احساس سرما، لرز، تب، سر درد، استفراغ، تشنج در کودکان، تعریق و خستگی.
نوع شدید مالاریا که قابل درمان نیست علائم زیر را دارد:
تب و لرز
اختلال هوشیاری
تمایل به قرار گرفتن در حالت سجده
تشنجهای متعدد
تنفس عمیق ناشی از تنگی نفس
خونریزی غیرطبیعی و نشانههای کمخونی
زردی بالینی و نشانههایی از اختلال عملکرد اندامهای اصلی بدن
روز جهانی مالاریا[ویرایش]
روز ۲۵ آوریل، روز جهانی مالاریا است، هر سال در این روز بهخصوص محققان و متخصصین تلاشهای پیاپی خود را برای متوقف کردن رواج بیرویهٔ این بیماری با یکدیگر به اشتراک میگذارند، در اصل این روز را جهانی کردند تا یادآوری ای برای تمام مردم خصوصاً پزشکان و محققان باشد که دست از تلاش برای کنترل و جلوگیری از آن برندارند.
شعار این روز: برای بهتر زیستن به مالاریا پایان دهید.
بهطور جهانی ۳ میلیارد انسان در ۱۰۶ کشور در خطر ابتلا به مالاریا هستند. در سال ۲۰۱۲ این بیماری با از بین بردن ۶۲۷٬۰۰۰ تَن، صدمات جبرانناپذیری را به خانوادههای آفریقایی وارد نمود که اکثراً کودکان بودند.
مالاریا سالانه جان ۴۰۰٬۰۰۰ نفر را میگیرد. از سال ۲۰۰۰ جلوگیری و دفع این بیماری به صورت جدیتری دنبال شد و از اقدامات اولیهٔ آن در اختیار گذاشتن اسپریهای قوی حشرهکش در بین مردم بود تا در داخل منازل خود از آن استفاده کنند.
روز جهانی مالاریا یکی از ۸ روز جهانی سلامت همگانی میباشد که به رسمیت شناخته شدهاست. در مورد نتایجی که به آن دست پیدا کردند:
مقاومت انگلها در برابر داروها توسط پزشکان مشاهده شدهاست و ممکن است بسیاری از داروها مؤثر واقع نشوند. در حال حاضر محققان در پژوهش خود یک فرایند سلولی موسوم به «انتقال وزیکول» را که پشهها با آن به آزادسازی آنزیمهای هاضم در روده میپردازند، مسدود کردند. این امر باعث شد که این حشره طی دو روز پس از خوردن خون، بمیرد.
جستارهای وابسته[ویرایش]
- پلاسمودیوم مالاریه
- اطلس رنگی پلاسمودیوم اوال
- پلاسمودیوم
- پلاسمودیوم مالاریه
- پلاسمودیوم فالسیپاروم
- هموزویین
- پشهٔ آنوفل
منابع[ویرایش]
- ↑ میر، محمدتقی (۱۳۶۸). پزشکان نامی پارس. ج. اول. شیراز: انتشارات دانشگاه شیراز.
- ↑ مالاریا چگونه آدمکش شد؟، بیبیسی فارسی
- ↑ اولین واکسن مالاریا در جهان تأیید شد؛ سالانه نیم میلیون نفر قربانی . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- ↑ سازمان بهداشت جهانی: ایران در آستانه ریشه کنی مالاریا است بیبیسی فارسی، ۱۸ آذر ۱۳۹۳
- دکتر عزیزی، فریدون؛ دکتر خاتمی، حسین؛ دکتر جانقربانی، محسن؛ دکتر معتبر، منصور. اپیدمیولوژی و کنترل بیماریهای شایع در ایران- نشر اشتیاق- چاپ دوم ۱۳۷۹. شابک ۹۶۴-۹۰۷۲۲-۹-۲
- مهندس متولیان، سید علی. حشرهشناسی پزشکی و مبارزه با ناقلین. ۱۳۸۰
- دکتر آریانپور کاشانی، منوچهر. فرهنگ آریانپور کاشانی. انتشارات جهان رایانه ۱۳۸۴. شابک ۹۶۴-۶۷۱۵-۵۶-۷
- غفرانی، محییالدین. ترجمه. سرگذشت اکتشافات تصادفی در علم. مجله دانشمند. ۱۳۷۱
پیوند به بیرون[ویرایش]
Centers for Disease Control and Prevention http://www.cdc.gov/Malaria
https://web.archive.org/web/20061006064905/http://www.dpd.cdc.gov/dpdx/HTML/Malaria.htm
https://web.archive.org/web/20060927114705/http://en.wikipedia.org/wiki/Malaria
http://www.malariasite.com/malaria
National Library of Medicine. http://www.nlm.nih.gov/medlineplus/encyclopedia.html
- 'کشفی جدید' در مبارزه با مالاریا (بیبیسی فارسی، ۲۴ تیر ۱۳۸۷)


