جدول تناوبی
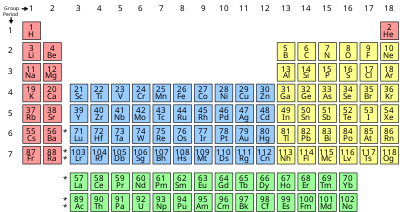
جدول تناوبی عنصرهای شیمیایی یا جدول دورهای عنصرهای شیمیایی یا جدول مَندَلیُف (به انگلیسی: Periodic table یا periodic table of elements)، نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد اتمی (شمار پروتونها) کمتر به سوی عدد اتمی بالاتر است. شکل استاندارد این جدول ۱۸ × ۷ است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار بلوک مستطیلی عبارتند از: بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی (فلزات واسطه) در وسط و بلوک اف (فلزات واسطهٔ داخلی) در پایین. ردیفهای این جدول، دوره و ستونهای آن، گروههای جدول تناوبی نام دارند. همچنین گاهی برخی از این گروهها نامهای ویژهای دارند. برای نمونه گروه هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی، چه به شکل مستطیلی و چه به شکلهای دیگر، بررسی بهتر ویژگیهای شیمیایی عنصرها بودهاست. این جدول، کاربرد زیادی در دانش شیمی و پردازش رفتار عنصرها دارد.
جدول تناوبی با نام دیمیتری مندلیف شناخته شدهاست، با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او جدولی مشابه جدول تناوبی امروزی را در سال ۱۸۶۹ منتشر کرد. این، نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را تهیه کرد تا ویژگیهای دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و جای آنها را خالی گذاشته بود.[۱] کمکم با پیشرفت دانش، عنصرهای تازهای شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیهسازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گستردهتر شدهاست.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (اوگانسون) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از اوگانسون هستند و البته این پرسش را پیش رو دارند که عنصرهای تازهتر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شدهاست.
ظاهر[ویرایش]
همهٔ نسخههای جدول تناوبی تنها دربردارندهٔ عنصرهای شیمیایی هستند و مخلوط، ترکیب یا ذرهٔ زیراتمی در آنها جایی ندارد.[پ ۱] هر عنصر شیمیایی یک عدد اتمی یکتا دارد و این عدد برابر با شمار پروتونها در هستهٔ اتم آن عنصر است. اتمهای گوناگون یک عنصر میتوانند شمار نوترونهای متفاوتی داشته باشند. در این حالت به آنها ایزوتوپ گفته میشود. برای نمونه کربن سه ایزوتوپ طبیعی دارد. همهٔ ایزوتوپهای کربن ۶ پروتون، و بیشتر آنها ۶ نوترون دارند؛ اما یک درصد آنها ۷ نوترون و شمار بسیار کمتری از آنها ۸ نوترون دارند. ایزوتوپها در جدول تناوبی به صورت جداگانه، نمایش داده نمیشوند؛ بلکه میانگین آنها به عنوان جرم اتمی در زیر عنصر درج میشود. برای عنصرهایی که هیچ ایزوتوپ پایداری ندارند، جرم اتمی پایدارترین یا متداولترین ایزوتوپ آنها درون پرانتز نوشته میشود.[۲]
در جدول تناوبی استاندارد عنصرها به ترتیب عدد اتمی (شمار پروتونها در هسته)، به صورت صعودی مرتب شدهاند. هر ردیف تازه در جدول، که یک دوره یا تناوب نامیده میشود، با افزوده شدن نخستین الکترون به یک لایهٔ الکترونی تازه آغاز میشود. عنصرهایی که در یک ستون جدول (گروه) جای گرفتهاند، همگی در لایهٔ آخر الکترونی خود دارای تعداد الکترونهای برابر هستند؛ به عبارت دیگر آرایش الکترونی لایهٔ آخر آنها یکسان است. مانند اکسیژن و سلنیم که هر دو در یک ستون هستند و هر دو چهار الکترون در لایهٔ بیرونی آرایش الکترونی خود یعنی تراز p دارند. عنصرهایی که ویژگیهای شیمیایی مشابه دارند، معمولاً در یک گروه از جدول قرار میگیرند. اما در بلوک f عنصرهایی که در یک دوره هستند نیز ویژگیهای مشابهی را نشان میدهند. در نتیجه به آسانی میتوان ویژگیهای شیمیایی یک عنصر را با آگاهی از عنصرهای پیرامونیاش پیشبینی کرد.[۳]
تا سال ۲۰۱۵، جدول تناوبی ۱۱۸ عنصر داشتهاست که ۱۱۴ عنصر به صورت رسمی از سوی اتحادیه بینالمللی شیمی محض و کاربردی پذیرفته و نامگذاری شدهاند. ۹۸ عنصر از مجموع ۱۱۸ عنصر در طبیعت یافت میشوند و از آن میان، ۸۴ مورد، عنصرهای پایدار یا دارای نیمعمر بیش از سن زمین هستند. در حالی که ۱۴ عنصر باقیمانده نیمعمر کوتاهی دارند یا به عبارت دیگر پرتوزا هستند. در حال حاضر، این عنصرها تنها بر اثر انجام واکنش هستهای در عنصرهای دیگر به وجود میآیند و فراوانی ناچیزی دارند.[۴] تمام عنصرهای با عدد اتمی ۹۹ تا ۱۱۲ (که مابین اینشتینیم و کوپرنیسیم قرار دارند) و نیز دو عنصر فلروویوم و لیورموریوم، در طبیعت پدید نیامدهاند، بلکه در آزمایشگاه ساخته شدهاند. سپس آیوپاک آنها را بهطور رسمی پذیرفتهاست. گزارش شده که عنصرهای ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ هم در آزمایشگاه ساخته شدهاند، اما هنوز آیوپاک آنها را تأیید نکردهاست. برای همین، این عنصرها هنوز بر پایهٔ عدد اتمیشان شناخته میشوند.[۵] تاکنون عنصری سنگینتر از کالیفرنیم (عنصر ۹۸) در طبیعت به صورت خالص در اندازهٔ قابل مشاهده، پیدا نشدهاست.[۶] تا سال ۲۰۱۸ هنوز عنصری با عدد اتمی بزرگتر از ۱۱۸ ساخته نشدهاست.[۷]
روش دستهبندی[ویرایش]
عنصرها در جدول تناوبی به صورت افقی (چپ به راست) در گروههای ۱ تا ۱۸ و به صورت عمودی (بالا به پایین) در دورههای ۱ تا ۷ دستهبندی میشوند. همچنین دستهبندی دیگری بر اساس لایهٔ الکترونی در حال پر شدن وجود دارد که بر اساس آن، عنصرها در بلوکهای s و p و d و f قرار میگیرند.
گروه[ویرایش]
یک گروه یا خانواده، یک ستون عمودی از جدول تناوبی است. عنصرهای یک گروه معمولاً ویژگیهای نزدیک به هم بیشتری نسبت به عنصرهای یک دوره یا بلوک دارند. دانش مکانیک کوانتوم که دربارهٔ ساختار اتمی پژوهش میکند، نشان میدهد که چون عنصرهای موجود در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی برخوردارند؛[۸] بنابراین ویژگیهای شیمیایی مشابهی از خود نشان میدهند و هرچه عدد اتمی آنها بالاتر میرود، این مشابهتها افزایش پیدا میکند.[۹] با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ همانندیها در یک گروه مهم هستند. به همانندی (شباهت) در یک دوره، همانندی افقی و در یک گروه، همانندی عمودی گفته میشود.[۱۰][۱۱][۱۲]
بر اساس یک قرارداد جهانی، گروهها از ۱ تا ۱۸ شمارهگذاری شدهاند که گروه شمارهٔ یک را نخستین گروه از چپ (فلزهای قلیایی) و آخرین گروه را گروه نخست از راست (گازهای نجیب) در نظر گرفتهاند.[۱۳] در گذشته، شمارهٔ گروهها را با عددهای رومی نشان میدادند. همچنین در آمریکا برای گروههای بلوک اس و پی یک حرف A و برای عنصرهای بلوک دی یک حرف B در کنار شمارهٔ رومی گروه میگذاشتند. برای نمونه گروه چهار به صورت IVB و گروه چهاردهم (یا عنصرهای گروه کربن) به صورت IVA نمایش داده میشد. در اروپا هم همین روش به کار میرفت، با این تفاوت که حرف A برای گروههای پیش از گروه ۱۰ و حرف B برای عنصرهای گروه ۱۰ و گروههای پس از آن بکار میرفت. در سال ۱۹۸۸ آیوپاک سامانهٔ نامگذاری تازهای را پیشنهاد کرد و روشهای پیشین همگی فراموش شد.[۱۴]
| گروه | نام |
|---|---|
| ۱ | فلزهای قلیایی |
| ۲ | فلزهای قلیایی خاکی |
| ۱۱ | فلزهای سکه |
| ۱۲ | فلزهای فرار (کم کاربرد) |
| ۱۳ | گروه بور |
| ۱۴ | گروه کربن |
| ۱۵ | گروه نیتروژن |
| ۱۶ | کالکوژنها |
| ۱۷ | هالوژنها |
| ۱۸ | گاز نجیب |
ویژگیهای عنصرهای یک گروه مانند شعاع اتمی، انرژی یونش و الکتروندوستی مشابه یکدیگر هستند. از بالا به پایین، شعاع اتمی عنصرها افزایش مییابد، در نتیجه الکترونهای لایهٔ آخر در فاصلهٔ دورتری از هسته جای میگیرند، چون ترازهای انرژی بیشتری پُر شدهاند. از بالا به پایین، انرژی یونش کاهش مییابد. چون الکترونها کمتر به هسته پیوند خوردهاند و آسانتر میتوان آنها را جدا کرد. با تحلیل مشابه، از بالا به پایین الکتروندوستی عنصرها کاهش مییابد. چون فاصلهٔ میان الکترونهای لایهٔ آخر و هسته افزایش مییابد.[۱۵] البته در این میان استثناهایی هم وجود دارد. برای نمونه در گروه ۱۱ الکتروندوستی از بالا به پایین افزایش مییابد.[۱۶]
دوره[ویرایش]
یک دوره در جدول تناوبی، یک ردیف افقی از این جدول است. با اینکه عنصرها در یک گروه همانندیهای بسیاری دارند، اما بخشهایی از دورهها هستند که از اهمیتی بیش از گروهها برخوردارند. مانند بلوک F، جایی که لانتانیدها و آکتینیدها دو مجموعهٔ افقی از عنصرهای جدول را میسازند.[۱۷]
عنصرها در یک دوره همانندیهایی از لحاظ شعاع اتمی، انرژی یونش، الکتروندوستی و الکترونخواهی (مقدار انرژی آزاد شده هنگامی که یک الکترون به یک مولکول یا اتم خنثی افزوده میشود) از خود نشان میدهند. در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد. این پدیده، به این دلیل است که با افزایش عدد اتمی در یک دوره، شمار لایههای الکترونی ثابت است، اما شمار پروتونها افزایش مییابد. برای همین الکترونها بیشتر به سوی هسته کشیده میشوند.[۱۸] کاهش شعاع اتمی باعث افزایش انرژی یونش میشود (از چپ به راست). هرچه پیوندها در یک عنصر محکمتر باشد، انرژی بیشتری هم برای جداسازی یک الکترون نیاز است. الکتروندوستی مانند انرژی یونش رفتار میکند و از چپ به راست افزایش مییابد. چون کشش هسته بر روی الکترونها افزایش مییابد.[۱۵] همچنین مقدار الکترونخواهی هم در طول یک دوره اندکی تغییر میکند. فلزها (عنصرهای سمت چپ دوره) معمولاً نسبت به نافلزها (سمت راست دوره) الکترونخواهی پایینتری دارند. این قانون برای گازهای نجیب برقرار نیست.[۱۹]
بلوک[ویرایش]
چون لایهٔ آخر الکترونی از اهمیت ویژهای برخوردار است، جدول تناوبی به بخشهایی وابسته به این لایههای الکترونی تقسیم شدهاست. به هر یک از این بخشها یک بلوک میگویند.[۲۰] بلوک اس دربردارندهٔ دو گروه نخست جدول (فلزهای قلیایی و قلیایی خاکی) و دو عنصر هیدروژن و هلیم است. بلوک پی دربردارندهٔ شش گروه آخر جدول، گروههای ۱۳ تا ۱۸ آیوپاک (۳A تا ۸A در نامگذاری آمریکایی) است. همهٔ شبهفلزات و نافلزها در این بلوک جای میگیرند. بلوک دی دربردارندهٔ گروههای ۳ تا ۱۲ آیوپاک (۳B تا ۸B در نامگذاری آمریکایی) و همهٔ فلزات واسطه است. بلوک اف که بیشتر در پایین بدنهٔ اصلی جدول جای میگیرد دربردارندهٔ لانتانیدها و اکتینیدها است.[۲۱]
دیگر قراردادها[ویرایش]
در نمایش جدول تناوبی، لانتانیدها و اکتینیدها بیشتر به صورت دو ردیف اضافی در زیر بدنهٔ اصلی جدول گذاشته میشوند.[۲۲] همچنین در این نمایش، دو تکخانه از بدنهٔ اصلی جدول به یکی از عنصرهای این دو مجموعه اختصاص داده میشود. برای نمونه، یکی از عنصرهای لانتانیوم یا لوتسیم (برای لانتانیدها) و اکتینیم یا لارنسیم (برای اکتینیدها) را برمیگزینند و آنها را به ترتیب در یک تکخانه میان باریم و هافنیم، و رادیم و رادرفوردیم میگذارند. در دیگر جدولها، دو مجموعهٔ لانتانیدها و اکتینیدها به صورت دو ردیف (دوره) در میانهٔ بدنهٔ اصلی جدول جای داده میشود.
 |
 |
| جدول تناوبی با بلوک اف که به صورت جداگانه در پایین آمده (راست)، بلوک اف در میانهٔ جدول (چپ) | |
در برخی جدولها یک خط جداکنندهٔ فلزها از نافلزها هم گنجانده میشود.[۲۳] همچنین ممکن است در یک جدول دستههای گوناگونی از عنصرها به صورت برجستهتری نمایان شوند. برای نمونه میتوان به فلزهای واسطه، فلزات پس واسطه و شبهفلزها اشاره کرد.[۲۴] همچنین بسته به کاربرد جدول، ممکن است گروههای ویژهای از عنصرها مانند فلزهای دیرگداز و فلزهای کمیاب که خود زیرگروه فلزهای واسطه هستند، به صورت پررنگتر نمایش داده شوند.[۲۵][۲۶]
ویژگیهای تناوبی[ویرایش]
آرایش الکترونی[ویرایش]


آرایش الکترونی عنصرهای جدول، الگویی تکرار شونده دارند. الکترونها در هر عنصر، مجموعهای از لایههای الکترونی را پُر میکند. هر لایهٔ الکترونی از یک یا چند زیرلایه ساخته شدهاست که به آنها لایههای s و p و d و f و g گفته میشود. هر چه عدد اتمی یک عنصر افزایش یابد، لایهها و زیرلایههای الکترونی بیشتری در آن عنصر پُر میشود. این لایهها بر پایهٔ اصل آفبا یا قانون تراز انرژی پر میشوند (همانند نموداری که کشیده شدهاست). برای نمونه، آرایش الکترونی نئون با عدد اتمی ۱۰ عبارت است از: 1s2 2s2 2p6 که دو الکترون در لایهٔ نخست و هشت الکترون در لایهٔ دوم (دو تا در زیرلایهٔ s و شش تا در زیرلایهٔ p) جای میگیرد. برای نمونه، فلزهای قلیایی و عنصر هیدروژن، همگی تنها یک الکترون در لایهٔ اس دارند.[۲۷][۲۸]
ویژگیهای یک عنصر بیشتر به آرایش الکترونی آن عنصر وابسته است. در نتیجه، چون آرایش الکترونی عنصرها در جدول از نظم روشنی پیروی میکند، میتوان برخی رفتارهای فیزیکی و شیمیایی عنصرها در جدول را پیشبینی کرد. در نمودار سمت راست، به برخی از این رفتارها اشاره شدهاست. پیش از آنکه نیلز بور نظریه خود پیرامون آرایش الکترونی را مطرح کند، از روی این ویژگی پلهکانی عنصرها، جای برخی از عنصرها در جدول پیشبینی شده بود.[۲۷][۲۸]

شعاع اتمی[ویرایش]
اندازهگیری شعاع اتمی یک اتم به صورت مجزا امکانپذیر نیست؛ ولی میتوان با اندازهگیری فاصلهٔ میان هستههای دو اتم که با هم پیوند دارند، شعاع اتمی آنها را به دست آورد. برای نمونه، هنگامی که دو اتم یک عنصر با یکدیگر پیوند دارند، شعاع اتمی هر یک از آنها نصف طول پیوند دو اتم است. هرچند که این مقدار در پیوندهای مختلف، اندکی متفاوت است؛ ولی میتوان یک میانگین را برای شعاع اتمی در نظر گرفت. بهطور کلی، با حرکت به سمت چپ و پایین جدول تناوبی، شعاع اتمی افزایش مییابد.[۲۹] این تغییر شعاع اتمی و در کنار آن تغییر در ویژگیهای فیزیکی و شیمیایی عنصرها را میتوان با کمک نظریههای اتمی دربارهٔ لایههای الکترونی توضیح داد. این تغییرها شاهدی بر درستی نظریهٔ کوانتوم است.[۳۰]
عنصرهای واسطه از الگوی کلی تغییرات شعاع اتمی پیروی نمیکنند. در آغاز پر شدن لایهٔ d شعاع اتمی کاهش مییابد که نرخ آن از نرخ کاهش عنصرهای گروه ۲ نسبت به گروه ۱ بسیار کمتر است؛ ولی در اتمهای انتهایی، روند افزایشی وجود دارد.[۳۱]
انرژی یونش[ویرایش]

نخستین انرژی یونش، انرژی لازم برای جدا کردن سستترین الکترون از یک اتم خنثی در حالت گازی است. دومین انرژی یونش، انرژی مورد نیاز برای جدا کردن دومین الکترون از یک اتم است. انرژیهای یونش مراتب بالاتر نیز به همین ترتیب تعریف میشوند. برای یک اتم مشخص، با افزایش درجهٔ یونش، انرژیهای یونش متعاقب هم افزایش مییابند. بر الکترونهای لایههای نزدیکتر به هسته، نیروی جاذبهٔ الکترواستاتیک بیشتری اعمال میشود؛ بنابراین انرژی مورد نیاز برای جداسازی آنها نیز بیشتر است. انرژی یونش با حرکت به سمت بالا و راست جدول تناوبی، افزایش مییابد.[۳۲]
در هر دورهٔ جدول، دو پرش بزرگ دیده میشود. یک پرش در گذر از گاز نجیب به فلز قلیایی بعدی است. پرش دوم که کوچکتر است، پیش از گروه ۱۳ رخ میدهد. در هر دو حالت، ابتدا آخرین لایهٔ آرایش الکترونی پر شده و سپس الکترون بعدی در لایهٔ جدید قرار میگیرد؛ بنابراین انرژی مورد نیاز برای جدا کردن آن، بسیار کمتر خواهد بود. چنین رخدادی در انرژیهای یونش متوالی یک عنصر نیز مشاهده میشود. هنگامی که همهٔ الکترونهای یک لایه جدا شوند، انرژی یونش بعدی به شدت افزایش مییابد.[۳۳]
الکترونگاتیوی[ویرایش]

الکترونگاتیوی، تمایل یک اتم به جذب الکترون است که به دو عامل عدد اتمی و فاصلهٔ الکترونهای لایهٔ آخر آن اتم با هسته وابسته است. این ویژگی در سال ۱۹۳۲ توسط لینوس پاولینگ پیشنهاد شد. الکترونگاتیوی با حرکت به سمت بالا و راست جدول تناوبی، افزایش مییابد. فلوئور بیشترین و سزیم کمترین میزان الکترونگاتیوی را در میان عنصرهایی که در طبیعت یافت میشوند، دارا هستند.[۳۴]
استثناهایی در تغییرات تناوبی الکترونگاتیوی مشاهده میشوند. الکترونگاتیوی عنصرهای گروه ۱۳ و ۱۴ در دورهٔ چهارم بیشتر از دورهٔ سوم است که دلیل آن، پر شدن لایهٔ d (که درونیتر است) و کمتر شدن شعاع اتمی است. استثنای دیگر، بالا بودن غیرعادی الکترونگاتیوی سرب در مقایسه با عنصرهای پیرامونش است که به نظر میرسد به دلیل اشکال در تحلیل دادهها باشد.[۳۵] روشهای محاسباتی دیگر، متفاوت با آنچه مورد استفاده پاولینگ بوده، نشان میدهند که این عنصرها دارای رفتار دورهای طبیعی هستند.[۳۶]
تفاوت الکترونگاتیوی میان دو اتم که پیوندی را تشکیل میدهند، میزان خصلت یونی آن پیوند را نشان میدهد. هرچه این تفاوت بیشتر باشد، پیوند دو اتم قطبیتر است. برای نمونه، در پیوند میان نافلزها که تفاوت الکترونگاتیوی اندک است، پیوند کووالانسی با قطبیت کم یا غیر قطبی است؛ ولی پیوند میان یک فلز و یک نافلز به دلیل تفاوت قابل توجه الکترونگاتیوی دو اتم، از نوع پیوند یونی است. معیار الکترونگاتیوی چندان دقیق نیست؛ زیرا دو اتم ممکن است به شکلهای گوناگونی با یکدیگر پیوند داشتهباشند. (برای نمونه الکترونگاتیوی فسفر در دو ترکیب PF3 و PF5 با یکدیگر متفاوت است)[۳۷]
الکترونخواهی[ویرایش]
الکترونخواهی، انرژی واکنش افزوده شدن یک الکترون به یک اتم در حالت گازی و تبدیل اتم خنثی به یون منفی است. برای بیشتر عنصرها، این فرایند با آزاد شدن انرژی همراه است و در نتیجه، مقدار الکترونخواهی برای نخستین الکترون، مقداری منفی است. تنها الکترونخواهی فلزات قلیایی خاکی (گروه ۲)، گروههای ۷ و ۱۲ و گازهای نجیب (گروه ۱۸) مثبت است. (در واقع، برای این عنصرها مقدار تجربی الکترونخواهی اندازهگیری نشدهاست) دلیل این رخداد، پر بودن (مانند گروه ۲، ۱۲ و ۱۸) یا نیمهپر بودن آخرین لایهٔ آرایش الکترونی این عنصرها (مانند گروه ۷) است. الکترونخواهی عنصرهای گروه ۱۵ نیز به دلیل نیمهپر بودن لایهٔ p کمتر از گروههای مجاور است. در هر دوره، بیشترین الکترونخواهی منفی مربوط به گروه هالوژنها است. کلر بیشترین مقدار الکترونخواهی را در میان عنصرهای جدول تناوبی دارد.[۳۸]
پیشینه[ویرایش]
نخستین تلاشها[ویرایش]

قرمز: شناخته شده در دوران باستان
نارنجی: شناخته شده در هنگامهٔ لاوازیه در ۱۷۸۹
زرد: شناخته شده در هنگامهٔ مندلیف در ۱۸۶۹
سبز: شناخته شده در هنگامهٔ دمینگ در ۱۹۲۳
آبی: شناخته شده در هنگامهٔ سیبورگ در ۱۹۴۵
خاکستری: شناخته شده تا سال ۲۰۰۰
بنفش: شناخته شده تا سال ۲۰۱۲
در سال ۱۷۸۹ آنتوان لاووازیه فهرستی از ۳۳ عنصر شیمیایی را منتشر کرد. او این عنصرها را زیر نامهای گازی، فلزی، نافلزی و خاکی دستهبندی کرده بود.[۳۹] سپس در دههٔ ۱۷۹۰ یرمیا بنیامین ریشتر جدول وزن معادل را تهیه کرد. به این منظور، مقدار وزنی اسیدهایی که با یک مقدار مشخص باز ترکیب میشدند و نیز مقدار فلزهایی که با مقدار مشخصی اسید ترکیب میشدند را اندازهگیری کرد.[۴۰] در سال ۱۸۲۹ یوهان ولفگنگ دوبرآینر دریافت که بسیاری از عنصرها را میتوان بسته به ویژگیهای شیمیایی آنها، در دستههای سهتایی بخشبندی کرد. برای نمونه لیتیم، سدیم و پتاسیم را با هم در دستهٔ فلزهای واکنشپذیر نرم گذاشت. همچنین او متوجه شد که وقتی عنصرها را به ترتیب وزن اتمی دستهبندی میکند، وزن عنصر دوم (میانی) تقریباً برابر است با میانگین وزن عنصر پیش و پس از خود (عنصر اول و سوم).[۴۱] این پدیده به نام قانون سهتایی یا سهتایی دوبرآینر شناخته شد.[۴۲] شیمیدان آلمانی لئوپولد گملین با همین روش ادامه داد و تا سال ۱۸۴۳ توانست ده دستهٔ سهتایی، سه دستهٔ چهارتایی و یک دستهٔ پنجتایی را شناسایی کند. در سال ۱۸۵۷ ژان باتیست آندره دوما توانست ارتباطهایی میان دستههای گوناگون فلزها به دست آورد. تا این دوره شیمیدانان گوناگون توانسته بودند ارتباطهای گوناگونی میان دستههای کوچک عنصرها به دست آورند؛ اما هیچیک جدول کلی ارائه نکردهبودند.[۴۳]
در ۱۸۵۸ شیمیدان آلمانی فریدریش آگوست ککوله مشاهده کرد که کربن همواره با چهار اتم پیرامون خود پیوند برقرار میکند. برای نمونه در متان یک کربن با چهار هیدروژن پیرامون خود پیوند خوردهاست. این مفهوم کمکم با نام والانس یا الکترونهای ظرفیت شناخته شد. منظور از والانس یک اتم، تعداد اتمهایی است که با آن اتم پیوند میخورند.[۴۴]
در ۱۸۶۲ یک زمینشناس فرانسوی به نام الکساندر-امیل بگویه دو شانکورتوآ یک نمای اولیه از جدول تناوبی را منتشر کرد و نام آن را «مارپیچ خاکی» یا «مارپیچ» گذاشت. او نخستین کسی بود که متوجه ویژگیهای تناوبی عنصرها شد و آنها را به ترتیب عدد اتمی از کمتر به بیشتر در یک استوانهٔ مارپیچ مرتب کرد. همچنین او نشان داد که عنصرهایی که ویژگیهای مانند هم دارند در فاصلهای ثابت از هم قرار دارند (شمار عنصرهای میان آنها همیشه ثابت است). جدول او برخی یونها و ترکیبها را هم دربرداشت. مقالهای که او دربارهٔ جدول خود منتشر کرد، بیش از دانش شیمی، به مطالب مربوط به زمینشناسی پرداخته بود. برای همین تا پیش از جدول دیمیتری مندلیف توجه کمی را به خود جلب کرد.[۴۵]
در ۱۸۶۴ شیمیدان آلمانی، جولیوس لوتار میر جدولی ساختهشده از ۴۴ عنصر را بر پایهٔ الکترونهای لایهٔ ظرفیت (والانس) ارائه کرد. این جدول نشان میداد که عنصرهایی که ویژگیهای مانند هم دارند، معمولاً الکترونهای ظرفیت برابر هم دارند.[۴۶] همزمان شیمیدان انگلیسی، ویلیام آدلینگ هم جدولی ساختهشده از ۵۷ عنصر منتشر کرد. جدول آدلینگ بر پایهٔ وزن اتمی بود که چندین جای خالی و نکتهٔ غیرمعمول در آن دیده میشد. او متوجه مفهوم تناوبی بودن جرم اتمی در میان عنصرها و مسئلهٔ گروهبندی عنصرها در جدول شده بود[۴۷] اما هرگز پیگیر ادامهٔ آن نشد.[۴۸] او در ۱۸۷۰ عنصرها را برپایهٔ الکترونهای لایهٔ ظرفیت (والانس) مرتب کرد و به عنوان جدول پیشنهادی خود ارائه کرد.[۴۹]

شیمیدان انگلیسی جان نیولندز از سال ۱۸۶۳ تا ۱۸۶۶ مجموعه مقالاتی را منتشر کرد. او در این مقالهها توضیح میداد که هنگامی که عنصرها به ترتیب از عدد اتمی کمتر به بیشتر مرتب شوند در دستههای هشتتایی ویژگیهای فیزیکی و شیمیایی مشابهی را تکرار میکنند. او این تناوب و تکرار هشتتایی را به هشتگانهای موسیقی همانند کرد.[۵۰][۵۱] قانون هشتگانهای نیولندز از سوی همکارانش احمقانه دانسته شد و جامعهٔ شیمی حاضر به انتشار کار او نشد.[۵۲] برخلاف این برخورد، نیولندز دادههای جدول هشتایی خود را جمعآوری کرد و از آن برای پیشبینی عنصرهای ناشناخته مانند ژرمانیم بهره برد.[۵۳] جامعهٔ شیمی پنج سال پس از آنکه جدول تناوبی مندلیف به جهان معرفی شد، به کار نیولندز بها داد.[۵۴]
در سال ۱۸۶۷ یک شیمیدان زادهٔ دانمارک به نام گوستاووس هینریشس یک جدول تناوبی مارپیچ پیشنهاد کرد. این جدول برپایهٔ طیف اتمی، وزن و شباهتهای شیمیایی بود. جدول او به عنوان کاری «منحصربهفرد»، «درخور توجه» و البته «تودرتو و پیچیده» دانسته شد. چنین توصیفاتی مانع از شناسایی و پذیرش عمومی جدول او شد.[۵۵][۵۶]
جدول مندلیف[ویرایش]

استاد روس شیمی، دیمیتری مندلیف و شیمیدان آلمانی، ژولیوس لوتار میر، هر یک به صورت مستقل جدولی را به ترتیب در سالهای ۱۸۶۹ و ۱۸۷۰ منتشر کردند.[۵۷] جدول مندلیف، نخستین نسخه از کار او بود؛ درحالی که جدولی که میر منتشر کرد، نسخهٔ گسترش یافتهٔ جدول پیشین او بود که در سال ۱۸۶۴ منتشر کرده بود.[۵۸] هر دو نفر، عنصرها را در ردیفها و ستونها به ترتیب وزن اتمی فهرست کرده بودند. در هر دو جدول در آغاز یک ستون یا ردیف، ویژگیهای عنصرها به صورت مرتب تکرار میشد.[۵۹]
مندلیف در این جدول دو انتخاب مهم انجام داده بود که باعث شد تا جدول او مورد پذیرش عمومی قرار گیرد: نخست اینکه جای عنصرهایی را که هنوز شناسایی نشده بود، خالی گذاشته بود.[۶۰] مندلیف نخستین شیمیدانی نبود که چنین کرده بود، اما نخستین کسی بود که با توجه به ردپایی که از جدول داشت، جای عنصرها را پیشبینی کرده بود. عنصرهایی مانند گالیم و ژرمانیم عنصرهایی بودند که بعداً شناسایی شدند.[۶۱] انتخاب دوم مندلیف در جایگذاری و دستهبندی عنصرها بود، او گاهی ویژگی وزن اتمی را نادیده گرفته بود و به جای آن، عنصرها را با توجه به ویژگیهای شیمیایی جایگذاری کرده بود. عنصرهایی مانند تلوریم و ید از این دست بودند. بعدها با پیشرفت علم معلوم شد که مندلیف نادانسته عنصرها را به ترتیب افزایش عدد اتمی و بار هسته مرتب کرده بود.[۶۲]
اهمیت عدد اتمی در جایگذاری عنصرها در جدول تناوبی نادیده گرفته میشد تا اینکه وجود و ویژگیهای پروتون و نوترون در هسته شناسایی شد.
گسترش در آینده[ویرایش]

مندلیف در سال ۱۸۷۱ جدول خود را به روز کرد و جزئیات بیشتری از عنصرهایی که جای آنها را پیشبینی میکرد، ارائه داد. او باور داشت که این عنصرها وجود دارند، اما هنوز شناسایی نشدهاند.[۶۳] با گذر زمان و شناسایی عنصرهایی که به صورت طبیعی یافت میشوند، جاهای خالی کمکم پر شد. باور عمومی چنین است که آخرین عنصر شناسایی شدهای که به صورت طبیعی پدید میآید، فرانسیم است که در سال ۱۹۳۹ شناسایی شد. مندلیف این عنصر را «اکا-سزیم» (اکا به معنی همانند) نامیده بود.[۶۴] پس از آن، در سال ۱۹۴۰ عنصر پلوتونیم به صورت آزمایشگاهی تولید شد؛ اما در سال ۱۹۷۱ دانشمندان به این نتیجه رسیدند که این عنصر به صورت طبیعی ساخته میشود.[۶۵]
جدول تناوبی پرکاربرد امروزی[۶۶] که به نام جدول تناوبی استاندارد یا جدول تناوبی متداول نیز شناخته میشود، جدولی است که به شیمیدان آمریکایی هوراس گرووز دمینگ نسبت داده میشود. دمینگ در ۱۹۲۳ دو نسخهٔ کوتاه (نسخهٔ مندلیفی[۶۷] و ۱۸ ستونی[۶۸]) جدول تناوبی را منتشر کرد.[۶۹][پ ۲] بعدها در سال ۱۹۲۸ نسخهٔ ۱۸ ستونی جدول دمینگ به صورت گسترده در دسترس مدرسههای آمریکا قرار گرفت. تا دههٔ ۱۹۳۰ جدول دمینگ در بسیاری از کتابها و دانشنامههای شیمی در دسترس بود. همچنین برای سالها توسط انتشارات علمی سرجنت-ولچ منتشر میشد.[۷۰][۷۱][۷۲]

با پیشرفت دانش مکانیک کوانتوم و افزایش دانش دربارهٔ الکترونها و نقش آنها در اتم، روشن شد که جایگیری عنصرها در هر دوره (ردیف) از جدول تناوبی با پر شدن یکی از لایههای الکترونی همسنگ است. اتمهای بزرگتر، الکترونها و در نتیجه زیرلایههای بیشتری دارند. پس با افزایش شمارهٔ دوره، طول دورههای جدول بیشتر میشود.[۷۳]
در ۱۹۴۵، دانشمند آمریکایی گلن سیبورگ گفت که الکترونها در اکتینیدها مانند لانتانیدها بلوک اف از لایههای الکترونی را پر میکنند. چرا که پیش از آن فرض میشد که الکترونهای لایهٔ آخر این عنصرها در بلوک دی جای میگیرند. همکار سیبورگ به او توصیه کرد که چنین مطلبی را منتشر نکند و آیندهٔ کاری خود را به خطر نیندازد. با این حال، او پیشنهاد خود را ارائه داد که از سوی جامعهٔ علمی درست دانسته شد. سیبورگ به تلاش خود ادامه داد و در سال ۱۹۵۱ توانست جایزهٔ نوبل شیمی را به خاطر کار بر روی اکتینیدها از آن خود کند.[۷۴][۷۵][پ ۳]
قالبهای جایگزین[ویرایش]

غیر از جدول تناوبی استاندارد، جدولهای تناوبی گوناگونی تاکنون ساخته شدهاست. با گذشت ۱۰۰ سال از معرفی جدول از سوی مندلیف در سال ۱۸۶۹، نزدیک به ۷۰۰ نسخهٔ گوناگون از جدول تناوبی معرفی و منتشر شد.[۷۶] غیر از قالب معمول که به شکل مستطیلی بود، قالبهایی دیگری[پ ۴] مانند دایرهای، مکعبی، استوانهای، هرمی، مارپیچ، کروی، مربعی، حلزونی، منشور هشت وجهی، به صورت تو در تو[۷۷] (مانند نماد بینهایت ∞) و حتی جدا جدا هم ساخته شد. هدف از پیشنهاد چنین قالبهایی بیشتر تأکید بر روی یک ویژگی فیزیکی یا شیمیایی ویژه از عنصرها است که در جدول تناوبی سنتی به خوبی دیده نمیشود.[۷۸]
یکی از قالبهای جایگزین و شناخته شدهٔ جدول،[۷۹] نسخهای است که به تئودور بنفی (۱۹۶۰) نسبت میدهند. در جدول بنفی، عنصرها به صورت یک مارپیچ پیوسته در کنار هم جای گرفتهاند؛ به گونهای که هیدروژن در مرکز مارپیچ و عنصرهای واسطه، لانتانیدها و اکتینیدها به صورت بیرونزدگی در کنار جای گرفتهاند. (مانند شکل)[۸۰]
بیشتر جدولهای تناوبی دو بُعدی هستند.[۴] با این حال پیش از آنکه مندلیف جدولش را معرفی کند در سال ۱۸۶۲ جدول سه بعدی هم پیشنهاد شده بود. جدولهای تازهتر مانند دستهبندی کورتین (۱۹۲۵)،[۸۱] نظام لامینای رینگلی (۱۹۴۹)،[۸۲] جدول حلزونی گیگر (۱۹۶۵)،[۸۳][پ ۵] درخت تناوبی دوفور (۱۹۹۶)[۸۴] و جدول تناوبی استاو (۱۹۸۹)[۸۵] همگی به صورت چهاربعدی توصیف شدهاند. به این صورت که سه بُعد آن، بعدهای فضایی و یک بُعد، رنگ آن در نظر گرفته شدهاست.[۸۶]
پرسشها و تناقضهای امروز جدول[ویرایش]
عنصرهای دارای ویژگیهای شیمیایی ناشناخته[ویرایش]
با وجود آنکه عنصرهای جدول تا اوگانسون شناسایی شدهاند اما تنها تا عنصرهای هاسیم (عنصر ۱۰۸) و کوپرنیسیم (عنصر ۱۱۲) ویژگیهای شیمیایی شناخته شده دارند. در حالی که دیگر عنصرها رفتاری متفاوت از آنچه برایشان از راه برونیابی پیشبینی میشود از خود نشان میدهند. برای نمونه برخی پژوهشها میگوید که با اینکه عنصر فلروویوم در گروه کربن جای دارد[۸۷] اما باید رفتاری همانند گاز بیاثر رادون از خود نشان دهد،[۸۸] البته آزمایشهای تازهتر همانندیهایی در رفتار شیمیایی فلروویوم و عنصر سرب پیدا کردهاند که این با جدول تناوبی همخوانی بیشتری دارد.[۸۹]
گسترش بیشتر جدول تناوبی[ویرایش]
هنوز روشن نیست که آیا عنصرهای تازهتر که در آینده شناسایی میشوند در ردیف هشتم (دورهٔ هشتم) جای میگیرند یا به کلی نظم جدول را به هم میریزند. گلن سیبورگ بر این باور بود که دورهٔ هشتم جدول به گونهای است که دو عنصر ۱۱۹ و ۱۲۰ از بلوک اس، ۱۸ عنصر از بلوک جدید جی و ۳۰ عنصر از بلوکهای اف، دی و پی را دربر میگیرد.[۹۰] برخی فیزیکدانان معاصر مانند پکا پیکو به صورت نظری به این نتیجه رسیدهاند که این عنصرهای تازهتر، از اصل آفبا که توضیحدهندهٔ چگونگی پُر شدن لایههای الکترونی است، پیروی نخواهند کرد. به این ترتیب با شناسایی عنصرهای تازهتر، ظاهر جدول تناوبی دچار دگرگونی خواهد شد.[۹۱]
بالاترین عدد اتمی ممکن[ویرایش]
بالاترین عدد اتمی ممکن هنوز روشن نیست. نخستین بار الیوت آدامز در ۱۹۱۱ با توجه بهشمار عنصرهای جای گرفته در هر ردیف به این نتیجه رسیده بود که وزن اتمی بالاتر از ۲۵۶± (یعنی عنصرهای ۹۹ و ۱۰۰ امروز) ناممکن است و وجود ندارد.[۹۲] پس از آن گفته شد که جدول تناوبی به زودی پس از جزیرهٔ پایداری به پایان خواهد رسید.[۹۳] بر پایهٔ این پیشبینی باید نزدیک به عنصر ۱۲۶ ام جدول به پایان میرسید. پس از آن جان امزلی[۴] و ریچارد فاینمن[۹۴] هر یک به ترتیب پیشبینی کردند که عنصر ۱۲۸ ام و ۱۳۷ ام آخرین عنصرهای جدول اند و در نهایت آلبرت خزان گفت که عنصر ۱۵۵ ام عنصر آخر است.[۴][پ ۶] همچنین مدل بور داشتن عدد اتمی بالاتر از ۱۳۷ را ناممکن میداند چون در این صورت باید الکترونهای ۱s با سرعتی بیشتر از سرعت نور حرکت کند؛ بنابراین مدل غیر نسبیتی بور در این کاربرد دقیق نیست.[۹۵]
جای هیدروژن و هلیم[ویرایش]
هیدروژن و هلیم گاهی در جایی گذاشته میشوند که مطابق آرایش الکترونی شان نیست. برای نمونه برپایهٔ شمار الکترونها معمولاً هیدروژن بالای لیتیم جای میگیرد؛ اما چون گاهی رفتاری همانند فلوئور[۹۶] یا کربن[۹۶] از خود نشان میدهد، بالای این دو عنصر هم گذاشته میشود. در حالتهایی که رفتار هیدروژن مانند هیچ عنصری دانسته نمیشود، برایش یک گروه تعریف میکنند و آن را در گروه خودش میگذارند.[۹۷] اما هلیم تقریباً همیشه در بالای نئون جای میگیرد؛ چون رفتار شیمیایی بسیار همانندی دارند. با این حال دیده شده که آن را بالای بریلیم[۹۸] هم بگذارند، چون آرایش الکترونی نزدیک به هم دارند. (هلیم: ۱s۲ برلیم: ۲s۲)
عنصرهای تناوب ۶ و ۷ در گروه سوم جدول[ویرایش]
گروه سه جدول از چهار عنصر ساخته شدهاست که دو عنصر نخست یعنی اسکاندیم و ایتریم مورد پذیرش همه است. اما بر سر دو عنصر بعدی اختلاف است، برخی میگویند دو عنصر بعدی، لانتان و اکتینیم هستند و برخی دیگر اعتقاد دارند، دو عنصر باید لوتتیم و لارنسیم باشند. بر سر ویژگیهای فیزیکی و شیمیایی این عنصرها در نظم جدول بحث است که هنوز همگان را قانع نکردهاست.[۹۹]
بهطور سنتی، لانتان و اکتینیم به عنوان دو عضو بعدی گروه ۳ در نظر گرفته میشدند.[۱۰۰] به نظر میرسد که این انتخاب، از دههٔ ۱۹۴۰ میلادی با ظهور جدولهای تناوبی که وابسته به آرایش الکترونی بودند، آغاز شدهاست. آرایش الکترونی سزیم، باریم و لانتان به صورت [Xe]6s1 و[Xe]6s2 و [Xe]5d16s2 است. آخرین الکترون لانتان در لایهٔ 5d قرار میگیرد که آن را به عنوان نخستین عنصر بلوک d دورهٔ ششم در گروه ۳ قرار میدهد.[۱۰۱] دو عنصر دیگر گروه ۳، یعنی اسکاندیم و ایتریم نیز چنین آرایش الکترونی را در لایهٔ آخر خود دارند. از سوی دیگر، آرایش الکترونی لوتتیم به صورت [Xe]4f145d16s2 است و آخرین الکترون آن در لایهٔ f قرار میگیرد؛ بنابراین لوتتیم آخرین عنصر بلوک f در دورهٔ ششم است.[۱۰۱]
در جدولهای دیگر، لوتتیم و لارنسیم به عنوان دو عضو دیگر گروه ۳ نشان داده میشوند. از اوایل سدهٔ بیستم شباهت میان ویژگیهای شیمیایی اسکاندیم و ایتریم با لوتتیم و سایر عنصرهای کمیاب خاکی شناخته شدهبود.[۱۰۱] به همین دلیل، برخی از شیمیدانان در دههٔ ۱۹۲۰ و ۱۹۳۰ لوتتیم را به جای لانتان در گروه ۳ قرار دادند. مطالعات طیفبینی در سالهای بعد، نشان داد که آرایش الکترونی ایتربیم به صورت [Xe]4f146s2 است. در نتیجه آخرین الکترون لوتتیم در لایهٔ d قرار میگیرد. به این ترتیب، لوتتیم نیز مانند لانتان واجد شرایط قرار گرفتن در گروه ۳ است.[۱۰۱] برخی از فیزیکدانان در دهههای ۱۹۵۰ و ۱۹۶۰ لوتتیم را به جای لانتان برای قرار گرفتن در گروه ۳ برگزیدند. در این ساختار، لانتان در بلوک f قرار میگیرد. در حالی که هیچ الکترونی در لایهٔ 4f ندارد. هرچند که گفته میشود چنین انتخابی مشکلی ایجاد نمیکند؛ زیرا توریم نیز هیچ الکترونی در لایهٔ 5f خود ندارد، در حالی که عضوی از بلوک f است.[۱۰۲]
گروههایی که فلزهای واسطه را دربردارند[ویرایش]
بر پایه تعریف آیوپاک، فلز واسطه به عنصری گویند که زیرلایه d آن پر نشدهاست یا با ناقص بودن زیرلایه d خود میتواند کاتیونها را افزایش دهد. با این تعریف، همه عنصرهای گروه ۳ تا ۱۱ در گروه فلزهای واسطه قرار میگیرند؛ ولی عنصرهای گروه ۱۲ (شامل روی، کادمیوم و جیوه) جزء فلزهای واسطه نیستند.[۱۰۳] بعضی شیمیدانان عقیده دارند که همه عنصرهای بلوک d (از جمله گروه ۱۲) در دسته فلزات واسطه هستند. در این حالت، عنصرهای گروه ۱۲ به عنوان حالت خاصی از عنصرهای واسطه در نظر گرفته میشوند که الکترونهای زیرلایه d آنها در پیوند شیمیایی شرکت نمیکنند.
کشف تازه مبنی بر آن که جیوه میتواند از الکترونهای زیرلایه d خود در تشکیل جیوه فلوئورید (HgF4) استفاده کند، بعضی مفسران را بر آن داشته که پیشنهاد دهند جیوه میتواند در گروه عنصرهای واسطه قرار گیرد.[۱۰۴] ولی بعضی دیگر معتقد هستند که امکان ساختهشدن این ماده تنها در شرایط بسیار غیرمعمول وجود دارد؛ بنابراین با هیچ تفسیری نمیتوان جیوه را جزء فلزهای واسطه قرار داد.[۱۰۵]
بعضی دیگر از شیمیدانان، عنصرهای گروه ۳ را از تعریف فلزهای واسطه خارج میکنند. دلیل آنان، این است که این عنصرها هیچ یونی با زیرلایه d ناقص ایجاد نمیکنند و ویژگیهای شیمیایی فلزهای واسطه را ندارند.[۱۰۶] در این حالت، تنها عنصرهای گروه ۴ تا ۱۱ به عنوان فلز واسطه در نظر گرفته میشوند.
قالب بهینهٔ جدول[ویرایش]
در حال حاضر، شکلهای گوناگونی از جدول تناوبی وجود دارند و دانشمندان نمیدانند که شکل بهینه یا قطعی جدول تناوبی چیست. به نظر میرسد که پاسخ این پرسش بستگی به این دارد که آیا تناوب شیمیایی میان عنصرها، یک حقیقت بنیادی است که در تمام جهان وجود دارد یا چنین تناوبی، محصول تفسیر ذهنی انسان، باورها، شرایط و علاقهٔ ناظران انسانی است. یک مبنای عینی برای تناوبهای شیمیایی میتواند پرسشهایی از جمله مکان هیدروژن، هلیم و عنصرهای گروه ۳ را پاسخ دهد. تصور میشود که چنین حقیقت اساسی، در صورت وجود، هنوز کشف نشدهاست. در نبود آن، شکلهای گوناگون جدول تناوبی را میتوان به عنوان نسخههای گوناگون تناوب شیمیایی در نظر گرفت. هر شکلی، جنبهها، ویژگیها و رابطههای مختلفی میان عنصرها را بررسی میکند و مد نظر قرار میدهد.[۱۰۷]
تکمیل شدنِ سطرِ هفتمِ جدول[ویرایش]
در جریان آخرین اکتشافهای علمی و به تأیید سازمان جهانی شیمی که نظارت بر جدول تناوبی را به عهده دارد، ۴ عنصر جدید به این جدول افزوده شدند که بهاینترتیب هفتمین ردیف آن کامل میشود. بر اساس اعلام اتحادیه بینالمللی شیمی محض و کاربردی (IUPAC)، عنصرهای شمارهٔ ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ با کسب معیارهای لازم بهعنوان عنصرهایی با خواص شیمیایی منحصربهفرد، شرایط لازم برای معرفی بهعنوان عنصر مستقل را پیدا کردند و بهاینترتیب اولین سری از عنصرهایی لقب گرفتند که بعد از سال ۲۰۱۱ به جدول تناوبی اضافه میشوند.[۱۰۸] آیوپاک نام و نماد شیمیایی این عنصرها را به این ترتیب اعلام کرد: عنصر ۱۱۳: نیهونیوم (Nh)، عنصر ۱۱۵: مسکوویم (Mc)، عنصر ۱۱۷: تِنِسین (Ts) و عنصر ۱۱۸: اوگانِسون (Og).[۱۰۹]
برنامههای آینده برای کشف عنصرهای جدید[ویرایش]
در سومین همایش بینالمللی عنصرهای فوق سنگین در سال ۲۰۱۷ در لهستان، «هیدِتو انیو» مدیر مؤسسه تحقیقاتی ریکن ژاپن اعلام کرد که در دسامبر ۲۰۱۷ تلاش برای ساخت عنصر ۱۱۹ جدول تناوبی را آغاز خواهند کرد. آنها امیدوارند در مدت زمان پنج سال عنصر ۱۱۹ و نیز عنصر ۱۲۰ را بسازند. برای این هدف آنها عنصر کوریوم را با یونهای وانادیم بمباران خواهد کرد. از سوی دیگر یوری اوگانسیان از مؤسسه مشترک پژوهشهای هستهای دوبنا (JINR) در روسیه نیز در این همایش اعلام کرد که آنان نیز کار ساخت این عنصر را در اوایل سال ۲۰۱۹ آغاز خواهند کرد. آنان برای این کار از روشی متفاوت استفاده خواهند کرد و عنصر برکلیوم را با یونهای تیتانیوم بمباران خواهند کرد. در صورت موفقیت، عنصر ۱۱۹ نخستین عنصر ردیف هشتم جدول تناوبی خواهد بود.[۱۱۰]
سال جهانی جدول تناوبی[ویرایش]
سال ۲۰۱۹ (۹۷–۹۸) به دلیل ۱۵۰ ساله شدن ایجاد جدول تناوبی، توسط سازمان ملل، سال ۲۰۱۹، سال جهانی جدول تناوبی عناصر شیمیایی (IYPT 2019) نامگذاری شد.[۱۱۱]
جستارهای وابسته[ویرایش]
یادداشت[ویرایش]
- ↑ بعضی جدولها شامل عنصر صفر نیز هستند (به عنوان مادهای که فقط دارای نوترون است). البته این مطلب، فراگیر نشدهاست. برای نمونه، میتوان به کهکشان شیمی ساخته فیلیپ استوارت اشاره کرد.
- ↑ یکی از اسلاف جدول ۱۸ ستونه دمینگ را میتوان در جدول تناوبی ۱۶ ستونه آدامز در ۱۹۱۱دید. آدامز از قرار دادن عنصرهای خاکی کمیاب و عنصرهای رادیواکتیو (مانند اکتینیدها) در بخش اصلی جدول خود، چشمپوشی کرد و به جای آن، آنها را به عنوان بخشی جدا قرار داد. ببینید: Elliot Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society. 33(5): 684–688 (687)
- ↑ یک ردیف بیش از اندازه بلند جدول تناوبی برای عنصرهای شناخته شده و کشف نشده با وزن اتمی بیشتر از بیسموت (برای مثال، شامل توریوم، پروتاکتینیم و اورانیوم) پیشتر در سال ۱۸۹۲ توصیه شدهبود. بیشتر محققان چنین فرض میکردند که این عنصرها مشابه عنصرهای انتقالی سری سوم (شامل هافنیم، تانتالم و تنگستن هستند). تا هنگامی که تشابهاتی با ساختار الکترونی لانتانیدها برقرار شد، وجود سری انتقالی داخلی دوم به صورت اکتینیدها پذیرفته نشدهبود. ببینید: See: van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.
- ↑ برای مشاهده تصویر این قالبها پایگاه داده اینترنتی جدولهای تناوبی را ببینید.
- ↑ تصویر متحرک جدول تناوبی گیگر که در اینترنت (از جمله در اینجا بایگانیشده در ۱ مارس ۲۰۱۴ توسط Wayback Machine) موجود است، خطاهای بسیاری دارد. از جمله این که هیدروژن و هلیم را شامل نمیشود. گیگر، هیدروژن را بالای لیتیم و هلیم را بالای بریلیم در نظر گرفت. ببینید: Giguère P.A. (1966). "The "new look" for the periodic system". Chemistry in Canada ۱۸ (۱۲): ۳۶–۳۹ (ص. ۳۷ را ببینید).
- ↑ کارول (۲۰۰۲، ص. ۶۳) معتقد است که ممکن است هنگامی که عددهای اتمی بسیار بزرگ باشند، اثرات گرانشی قابل توجه شوند و به این ترتیب، بر سایر رفتارهای ناپایداری هستههای فوق سنگین غلبه کنند و این که ستارههای نوترونی (دارای عددهای اتمی با مرتبه بزرگی ۱۰۲۱) میتوانند به عنوان نشانههایی از سنگینترین عنصرهای شناختهشده در جهان در نظر گرفته شوند.
پانویس[ویرایش]
- ↑ «جدول مندلیف ۱۵۰ ساله شد». BBC Farsi. ۲۰۱۹-۰۳-۱۸. دریافتشده در ۲۰۱۹-۰۳-۲۱.
- ↑ Greenwood و Earnshaw، Chemistry of the Elements، 24–27.
- ↑ Gray، The Elements، 6.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (به انگلیسی) (New ed.). New York, NY: Oxford University Press.
- ↑ Koppenol، W. H. (۲۰۰۲). «Naming of New Elements (IUPAC Recommendations 2002)» (PDF). Pure and Applied Chemistry. ۷۴ (۵): ۷۸۷–۷۹۱. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Haire, Richard G. (2006). "Fermium, Mendelevium, Nobelium and Lawrencium". The Chemistry of the Actinide and Transactinide Elements (به انگلیسی) (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media.
{{cite book}}: نگهداری CS1: پیشفرض تکرار ref (link) - ↑ Gray، The Elements، 233.
- ↑ Scerri، The periodic table: Its story and its significance، 24.
- ↑ Messler, R. W. (2010). The essence of materials for engineers (به انگلیسی). Sudbury, MA: Jones & Bartlett Publishers. p. 32.
- ↑ Bagnall، K. W. (۱۹۶۷). «Advances in chemistry, Lanthanide/Actinide chemistry». Recent advances in actinide and lanthanide chemistry. American Chemical Society. ۷۱: ۱–۱۲. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Day, M. C.; Selbin, J. (1969). Theoretical inorganic chemistry (به انگلیسی) (2nd ed.). New York, MA: Reinhold Book Corporation. p. 103.
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (به انگلیسی) (5th ed.). Walton-on-Thames: Nelson Thornes. p. 40.
- ↑ Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990 (به انگلیسی). Blackwell Science.
- ↑ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. (به انگلیسی). IUPAC. 60 (3): 431–436. Retrieved 24 March 2012.
{{cite journal}}: Unknown parameter|ندش=ignored (help) - ↑ ۱۵٫۰ ۱۵٫۱ Moore, p. 111
- ↑ Greenwood، Chemistry of the Elements، 30.
- ↑ Stoker, Stephen H. (2007). General, organic, and biological chemistry (به انگلیسی). New York: Houghton Mifflin. p. 68. OCLC 52445586.
- ↑ Mascetta, Joseph (2003). Chemistry The Easy Way (به انگلیسی) (4th ed.). New York: Hauppauge. p. 50. OCLC 52047235.
- ↑ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (به انگلیسی) (7th ed.). Belmont: Thomson Brooks/Cole. p. 324. OCLC 220756597.
- ↑ Gray، The Elements، 12.
- ↑ Jones, Chris (2002). d- and f-block chemistry (به انگلیسی). New York: J. Wiley & Sons. p. 2. OCLC 300468713.
- ↑ Gray، The Elements، 11.
- ↑ Jespersen, N. D. (2010). Barron's AP chemistry (به انگلیسی) (5 revised ed.). Hauppauge, NY: Barron's Educational Series. p. 117.
- ↑ Sebring, M.E.; Schaff, B. R. (1980). General chemistry (به انگلیسی). Belmont, CA: Wadsworth Publishing. p. 128.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials (به انگلیسی). Materials Park, Ohio: ASM International. p. 376.
- ↑ Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends (به انگلیسی). Springer-Verlaglocation=Berlin. p. 8.
- ↑ ۲۷٫۰ ۲۷٫۱ Myers, R. (2003). The basics of chemistry (به انگلیسی). Westport, CT: Greenwood Publishing Group. pp. 61–67.
- ↑ ۲۸٫۰ ۲۸٫۱ Chang, Raymond (2002). Chemistry (به انگلیسی) (7 ed.). New York: McGraw-Hill. pp. 289–310, 340–42.
- ↑ مورتیمر، شیمی عمومی ۱، ۹۳.
- ↑ Greenwood و Earnshaw، Chemistry of the Elements، 27.
- ↑ مورتیمر، شیمی عمومی ۱، ۹۴.
- ↑ مورتیمر، شیمی عمومی ۱، ۹۴.
- ↑ مورتیمر، شیمی عمومی ۱، ۹۵.
- ↑ مورتیمر، شیمی عمومی ۱، ۱۱۰.
- ↑ مورتیمر، شیمی عمومی ۱، ۱۱۱.
- ↑ Allred, A. L. (1960). "Electronegativity values from thermochemical data". Journal of Inorganic and Nuclear Chemistry. Northwestern University. 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5. Retrieved 11 June 2012.
- ↑ مورتیمر، شیمی عمومی ۱، ۱۱۱.
- ↑ مورتیمر، شیمی عمومی ۱، ۹۶.
- ↑ Siegfried, Robert (2002). From elements to atoms: a history of chemical composition (به انگلیسی). Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. p. ۹۲.
{{cite book}}:|access-date=requires|url=(help) - ↑ Scerri، The Periodic Table، 31-32.
- ↑ Ball، The Ingredients، 100.
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World (به انگلیسی). New York: John Wiley. p. ۴۳. OCLC ۵۰۷۶۶۸۲۲.
{{cite book}}: Check|oclc=value (help) - ↑ Ball، The Ingredients، 100.
- ↑ van Spronsen, J. W. (1969). The periodic system of chemical elements (به انگلیسی). Amsterdam: Elsevier. p. ۱۹.
- ↑ Annales des Mines history page.
- ↑ Venable، The Development of the Periodic Law، 85-86; 97.
- ↑ Odling, W. (2002). "On the proportional numbers of the elements". Quarterly Journal of Science (به انگلیسی). ۱: ۶۴۲–۶۴۸ (۶۴۳).
- ↑ Scerri, Eric R. (2011). The periodic table: A very short introduction (به انگلیسی). Oxford: Oxford University Press.
- ↑ Kaji, M. (2004). "Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s". In Rouvray, D. H.; King, R. Bruce (eds.). The periodic table: Into the 21st Century (به انگلیسی). Research Studies Press. pp. ۹۱–۱۲۲ (۹۵).
- ↑ Newlands, John A. R. (20 August 1864). "On Relations Among the Equivalents". Chemical News (به انگلیسی). ۱۰: ۹۴–۹۵.
- ↑ Newlands, John A. R. (۱۸ اوت ۱۸۶۵). «On the Law of Octaves». Chemical News. ۱۲: ۸۳.
- ↑ Bryson, Bill (2004). A Short History of Nearly Everything (به انگلیسی). Black Swan. pp. ۱۴۱–۱۴۲.
- ↑ Scerri، The Periodic Table، 306.
- ↑ Brock, W. H.; Knight (1965). "The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'". Isis (به انگلیسی). The University of Chicago Press. ۵۶ (۱): ۵–۲۵.
{{cite journal}}:|نام3=missing|نام3=(help) - ↑ Scerri، The Periodic Table، 87, 92.
- ↑ Kauffman، George B. (۱۹۶۹). «American forerunners of the periodic law». Journal of Chemical Education. ۴۶ (۳): ۱۲۸–۱۳۵ (۱۳۲). doi:10.1021/ed046p128. از پارامتر ناشناخته
|month=صرفنظر شد (کمک) - ↑ Mendelejew, Dimitri (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (به آلمانی): 405–406.
- ↑ Venable، The Development of the Periodic Law، 96–97; 100–102.
- ↑ Ball، The Ingredients، 100–102.
- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought (به انگلیسی). Oxford University Press. p. 227.
{{cite book}}: Unknown parameter|سایر=ignored (help) - ↑ Ball، The Ingredients، 105.
- ↑ Atkins, P. W. (1995). The Periodic Kingdom (به انگلیسی). HarperCollins Publishers, Inc. p. 87.
- ↑ Scerri، The Periodic Table، 112.
- ↑ Kaji، Masanori (۲۰۰۲). «D.I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry» (PDF). Bull. Hist. Chem. Tokyo Institute of Technology. ۲۷ (۱): ۴–۱۶. دریافتشده در ۱۱ ژوئن ۲۰۱۲.
- ↑ Hoffman، D. C.؛ Lawrence، F. O.؛ Mewherter، = J. L.؛ Rourke، F. M. (۱۹۷۱). «Detection of Plutonium-244 in Nature». Nature. ۲۳۴ (۵۳۲۵): ۱۳۲–۱۳۴. doi:10.1038/234132a0. بیبکد:1971Natur.234..132H.
- ↑ Gray، The Elements، 12.
- ↑ نسخهٔ مندلیفی
- ↑ نسخهٔ ۱۸ ستونی
- ↑ Deming، Horace G (۱۹۲۳). General chemistry: An elementary survey. New York: J. Wiley & Sons. صص. ۱۶۰, ۱۶۵.
- ↑ Abraham، M؛ Coshow، D؛ Fix، W. Periodicity:A source book module, version 1.0 (PDF). New York: Chemsource, Inc. ص. ۳. بایگانیشده از اصلی (PDF) در ۱۴ مه ۲۰۱۲. دریافتشده در ۲۰ ژوئن ۲۰۱۳.
- ↑ Emsley، J (۷ مارس ۱۹۸۵). «Mendeleyev's dream table». New Scientist: ۳۲–۳۶(۳۶).
- ↑ Fluck، E (۱۹۸۸). «New notations in the period table». Pure & Applied Chemistry. ۶۰ (۳): ۴۳۱–۴۳۶ (۴۳۲). از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Ball، The Ingredients، 111.
- ↑ Scerri، The Periodic Table، 270-271.
- ↑ Masterton, William L.; Hurley, Cecile N.; Neth, Edward J. Chemistry: Principles and reactions (به انگلیسی) (7th ed.). Belmont, CA: Brooks/Cole Cengage Learning. p. 173.
- ↑ Scerri، The Periodic Table، 20.
- ↑ "Weird Words of Science: Lemniscate Elemental Landscapes" (به انگلیسی). The Culture of Chemistry.
- ↑ Scerri، The Periodic Table، 20.
- ↑ Emsely، J؛ Sharp، R (۲۱ ژوئن ۲۰۱۰). «The periodic table: Top of the charts». The Independent.
- ↑ Seaborg, Glenn (1964). "Plutonium: The Ornery Element". Chemistry (به انگلیسی). 37 (6): 14.
- ↑ Mark R. Leach. "1925 Courtines' Periodic Classification" (به انگلیسی). Retrieved 16 October 2012.
- ↑ Mark R. Leach. "1949 Wringley's Lamina System" (به انگلیسی). Retrieved 16 October 2012.
- ↑ Mazurs, E.G. (1974). Graphical Representations of the Periodic System During One Hundred Years (به انگلیسی). Alabama: University of Alabama Press. p. 111.
- ↑ Mark R. Leach. «1996 Dufour's Periodic Tree». دریافتشده در ۱۶ اکتبر ۲۰۱۲.
- ↑ Mark R. Leach. «1989 Physicist's Periodic Table by Timothy Stowe». دریافتشده در ۱۶ اکتبر ۲۰۱۲.
- ↑ Bradley، David (۲۰ ژوئیه ۲۰۱۱). «At last, a definitive periodic table?». ChemViews Magazine. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Schändel، Matthias (۲۰۰۳). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. ص. ۲۷۷. شابک ۱-۴۰۲۰-۱۲۵۰-۰.
- ↑ Gas Phase Chemistry of Superheavy Elements بایگانیشده در ۲۰ فوریه ۲۰۱۲ توسط Wayback Machine, lecture by Heinz W. Gäggeler, Nov. 2007. Last accessed on 12 Dec 2008.
- ↑ Scerri 2011, pp. 142–143
- ↑ Frazier، K. (۱۹۷۸). «Superheavy Elements». Science News. ۱۱۳ (۱۵): ۲۳۶–۲۳۸. جیاستور ۳۹۶۳۰۰۶. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Pyykkö، Pekka (۲۰۱۱). «A suggested periodic table up to Z ≤ ۱۷۲, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics. ۱۳ (۱): ۱۶۱–۱۶۸. PMID 20967377. بیبکد:2011PCCP...13..161P. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Elliot، Q. A. (۱۹۱۱). «A modification of the periodic table». Journal of the American Chemical Society. ۳۳ (۵): ۶۸۴–۶۸۸ (۶۸۸). از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Glenn Seaborg (ca. ۲۰۰۶). «transuranium element (chemical element)». Encyclopædia Britannica. دریافتشده در 2010-03-16. تاریخ وارد شده در
|تاریخ=را بررسی کنید (کمک) - ↑ Elert، G. «Atomic Models». The Physics Hypertextbook. دریافتشده در ۲۰۰۹-۱۰-۰۹.
- ↑ Eisberg، R.؛ Resnick، R. (۱۹۸۵). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles. Wiley.
- ↑ ۹۶٫۰ ۹۶٫۱ Cronyn، Marshall W. (۲۰۰۳). «The Proper Place for Hydrogen in the Periodic Table». Journal of Chemical Education. ۸۰ (۸): ۹۴۷–۹۵۱. doi:10.1021/ed080p947. بیبکد:2003JChEd..80..947C. از پارامتر ناشناخته
|month=صرفنظر شد (کمک) - ↑ Gray، The Elements، 14.
- ↑ Gray، The Elements، 12.
- ↑ Scerri، E (۲۰۱۲). «Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?». Chemistry International. ۳۴ (۴).
- ↑ Emsley, J. (2011). Nature's Building Blocks (به انگلیسی) (new ed.). Oxford: Oxford University. p. 651.
- ↑ ۱۰۱٫۰ ۱۰۱٫۱ ۱۰۱٫۲ ۱۰۱٫۳ William B. Jensen (1982). "The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table". J. Chem. Educ. (به انگلیسی). 59 (8): 634–636. doi:10.1021/ed059p634.
- ↑ Scerri, E (2015). "Five ideas in chemical education that must die - part five" (به انگلیسی). Royal Society of Chemistry.
{{cite web}}: Unknown parameter|وبسایت=ignored (help) - ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "transition element".
- ↑ Xuefang Wang؛ Lester Andrews؛ Sebastian Riedel؛ Martin Kaupp (۲۰۰۷). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4». Angew. Chem. Int. Ed. ۴۶ (۴۴): ۸۳۷۱–۸۳۷۵. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ William B. Jensen (۲۰۰۸). «Is Mercury Now a Transition Element?». J. Chem. Educ. ۸۵ (۹): ۱۱۸۲–۱۱۸۳. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ Rayner-Canham، G؛ Overton، T. Descriptive inorganic chemistry (ویراست ۴th). New York: W H Freeman. صص. ۴۸۴–۴۸۵. شابک ۰-۷۱۶۷-۸۹۶۳-۹.
- ↑ Francl، Michelle (مه ۲۰۰۹). «Table manners» (PDF). Nature Chemistry. ۱ (۲): ۹۷–۹۸. از پارامتر ناشناخته
|ندش=صرفنظر شد (کمک) - ↑ مهرداد یزدانی (15 دی 1394 ساعت 15:18). «تکمیل شدن سطر هفتم جدول تناوبی عنصار (جدول مندلیف)». زومیت. بایگانیشده از اصلی در 5 ژانویه 2016. تاریخ وارد شده در
|تاریخ=را بررسی کنید (کمک) - ↑ «IUPAC ANNOUNCES THE NAMES OF THE ELEMENTS 113, 115, 117, AND 118». IUPAC. دریافتشده در ۱ نوامبر ۲۰۱۷.
- ↑ «تلاش برای ساخت عنصر ۱۱۹ جدول تناوبی». بایگانیشده از اصلی در ۷ نوامبر ۲۰۱۷. دریافتشده در ۲ نوامبر ۲۰۱۷.
- ↑ «بزرگداشت سال جهانی جدول دورهای عنصرها در ایران شروع شد». ایرنا. دریافتشده در ۶ اکتبر ۲۰۱۹.
منابع[ویرایش]
- مورتیمر، چارلز (۱۳۸۱). شیمی عمومی ۱. ترجمهٔ عیسی یاوری. نشر علوم دانشگاهی. شابک ۹۶۴-۶۱۸۶-۳۰-۰.
- Ball، Philip (۲۰۰۲). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. شابک ۰-۱۹-۲۸۴۱۰۰-۹.
- Gray, Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe (به انگلیسی). New York: Black Dog & Leventhal Publishers.
- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements (به انگلیسی). Oxford: Pergamon Press.
- Scerri, Eric (2007). The periodic table: Its story and its significance (به انگلیسی). Oxford: Oxford University Press.
- Venable، F P (۱۸۹۶). The Development of the Periodic Law. Easton PA: Chemical Publishing Company.
پیوند به بیرون[ویرایش]
| در ویکیانبار پروندههایی دربارهٔ جدول تناوبی موجود است. |
- جدول تناوبی پویا
- جدول تناوبی عناصر پویا با قابلیت فیلتر نمایش عناصر بر حسب سال کشف و نمایش حالت عناصر در دماهای مختلف
- A Brief History of the Development of Periodic Table
- Chemistry: WebElements
- Periodic Table Game[پیوند مرده]
- The Periodic Table of Comic Books at the Department of Chemistry, University of Kentucky
- List of Periodic Table Elements that can be sorted by physical characteristics
- Periodic table with mineral emphasis
- Wooden Periodic table with samples
- The Pictorial Periodic Table by Chris Heilman. Includes alternate styles: Stowe, Benfey, Zmaczynski, Giguere, Tarantola, Filling, Mendeleev
| جدول تناوبی (استاندارد) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| گروه | ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ | ||||||||||||||||||||||||||||||||||||||
| ردیف | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۱ | ۱ H |
۲ He | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲ | ۳ Li |
۴ Be |
۵ B |
۶ C |
۷ N |
۸ O |
۹ F |
۱۰ Ne | ||||||||||||||||||||||||||||||||||||||||||||||||
| ۳ | ۱۱ Na |
۱۲ Mg |
۱۳ Al |
۱۴ Si |
۱۵ P |
۱۶ S |
۱۷ Cl |
۱۸ Ar | ||||||||||||||||||||||||||||||||||||||||||||||||
| ۴ | ۱۹ K |
۲۰ Ca |
۲۱ Sc |
۲۲ Ti |
۲۳ V |
۲۴ Cr |
۲۵ Mn |
۲۶ Fe |
۲۷ Co |
۲۸ Ni |
۲۹ Cu |
۳۰ Zn |
۳۱ Ga |
۳۲ Ge |
۳۳ As |
۳۴ Se |
۳۵ Br |
۳۶ Kr | ||||||||||||||||||||||||||||||||||||||
| ۵ | ۳۷ Rb |
۳۸ Sr |
۳۹ Y |
۴۰ Zr |
۴۱ Nb |
۴۲ Mo |
۴۳ Tc |
۴۴ Ru |
۴۵ Rh |
۴۶ Pd |
۴۷ Ag |
۴۸ Cd |
۴۹ In |
۵۰ Sn |
۵۱ Sb |
۵۲ Te |
۵۳ I |
۵۴ Xe | ||||||||||||||||||||||||||||||||||||||
| ۶ | ۵۵ Cs |
۵۶ Ba |
* |
۷۱ Lu |
۷۲ Hf |
۷۳ Ta |
۷۴ W |
۷۵ Re |
۷۶ Os |
۷۷ Ir |
۷۸ Pt |
۷۹ Au |
۸۰ Hg |
۸۱ Tl |
۸۲ Pb |
۸۳ Bi |
۸۴ Po |
۸۵ At |
۸۶ Rn | |||||||||||||||||||||||||||||||||||||
| ۷ | ۸۷ Fr |
۸۸ Ra |
** |
۱۰۳ Lr |
۱۰۴ Rf |
۱۰۵ Db |
۱۰۶ Sg |
۱۰۷ Bh |
۱۰۸ Hs |
۱۰۹ Mt |
۱۱۰ Ds |
۱۱۱ Rg |
۱۱۲ Cn |
۱۱۳ Nh |
۱۱۴ Fl |
۱۱۵ Mc |
۱۱۶ Lv |
۱۱۷ Ts |
۱۱۸ Og | |||||||||||||||||||||||||||||||||||||
| * لانتانیدها | ۵۷ La |
۵۸ Ce |
۵۹ Pr |
۶۰ Nd |
۶۱ Pm |
۶۲ Sm |
۶۳ Eu |
۶۴ Gd |
۶۵ Tb |
۶۶ Dy |
۶۷ Ho |
۶۸ Er |
۶۹ Tm |
۷۰ Yb | ||||||||||||||||||||||||||||||||||||||||||
| ** آکتینیدها | ۸۹ Ac |
۹۰ Th |
۹۱ Pa |
۹۲ U |
۹۳ Np |
۹۴ Pu |
۹۵ Am |
۹۶ Cm |
۹۷ Bk |
۹۸ Cf |
۹۹ Es |
۱۰۰ Fm |
۱۰۱ Md |
۱۰۲ No | ||||||||||||||||||||||||||||||||||||||||||
|
این یک جدول تناوبی ۱۸ ستونی است که به عنوان جدول تناوبی استاندارد یا معمولی، دانسته میشود. این جدول در مقایسه با جدول تناوبی کوتاه یا قالب مندلیف که در آنها گروههای ۳ تا ۱۲ حذف شده است، با نام جدول تناوبی بلند هم خوانده میشود. در جدول تناوبی پهن دو ردیف لانتانیدها و آکتینیدها به جای آنکه جداگانه در پایین جدول بیایند، در درون جدول جای گرفتهاند. جدول تناوبی گسترش یافته علاوه بر دو دورهٔ ۸ و ۹، سوپراکتینیدها را هم در خود جای داده است. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
