ویروس
| ویروس | |
|---|---|

| |
| سارس-کوو-۲، عضوی از زیرخانوادهٔ کروناویروس | |
| طبقهبندی ویروسها | |
| (طبقهبندینشده): | ویروس |
| دامنهها | |
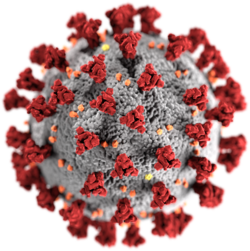

ویروس (به فرانسوی: Virus)[۱] یک عامل بیماریزای کوچک است که فقط در سلولهای زنده یک جاندار تکثیر میشود. واژهٔ ویروس، ریشه در زبان لاتین دارد و به معنای زهر یا هرگونه ماده سمی میباشد.
ویروسها میتوانند انواع شکلهای حیات را، از جانوران و گیاهان گرفته تا میکروارگانیسمها، از جمله باکتریها و آرکیها را آلوده کنند.[۲] میلیونها نوع از ویروسها در میان جانداران و در زیستگاهها و مکانهای مختلف وجود دارد و تا کنون بیش از ۶۰۰۰ گونه مختلف از ویروسها بهطور دقیق شناسایی و معرفی شدهاند.[۳]

ویروسها قطعهای از نوکلئیک اسید هستند که درون یک پوشش پروتئینی بهنام کپسید محصور شدهاست. ویروسها از باکتریها بسیار کوچکتر هستند و فقط با میکروسکوپ الکترونی قابل مشاهدهاند. ویروس با استفاده از امکانات سلولی میزبان تکثیر میشود و فعالیت اصلی یاختههای میزبان را مختل میکند. ویروسها بسیاری از جانوران و گیاهان و باکتریها را مبتلا میکنند اما فقط برخی از آنها انسان را بیمار میکنند. همچنین ویروسها تنها در محیط خنثی در سلولهای زنده تکثیر میشوند و انگل اجباری داخل سلولی میباشند؛ زیرا ویروسها فاقد تمامی ویژگیهای زیستی بهجز فاز ژنتیک هستند، زیست شناسان تا اواخر سدهٔ بیستم میلادی، آنها را زنده نمیدانستند. ویروسها رشد نمیکنند، حالت هومئوستازی ندارند و به دلیل نداشتن آنزیمهای اصلی، واکنشهای متابولیسمی در آنها رخ نمیدهد. فقط دو آنزیم در آنها یافت میشود، آنزیم ATP و آنزیم رونوشتبردار معکوس (مخصوص آرانای ویروسها). البته امروزه با توجه به امکان ۷ و تکثیر ویروسها در شرایط آزمایشگاهی، تصور انگل اجباری بودن آنها دچار تردید است.[۴]
دانشمندان در مورد منشأ تکاملی ویروسها تردید دارند. به نظر میرسد گروهی از ویروسها از پلازمیدها تکامل یافتهاند و منشأ تکامل گروه دیگر باکتریها هستند. ویروسها در تکامل گونهها و انتقال افقی ژنها و در نتیجه نوترکیبی و ایجاد تنوع ژنتیکی نقش بسیار مهمی دارند.
در دهههای اخیر تحولات ویروسشناسی شروع به فاش کردن اطلاعاتی کردهاست که نشان میدهد ویروسها ممکن است موجود زنده باشند. یکی از این اکتشافات میمی ویروسها (mimiviruses) بودند؛ ویروسهای غولپیکری با کتابخانههای ژنومی بزرگی که حتی از برخی از باکتریها نیز بزرگتر بودند. گونهای ویروس غولپیکر بهنام مگاویروس در سال ۲۰۱۳ در اعماق اقیانوس در نزدیکی شیلی کشف شد. این ویروس با استفاده از یک میکروسکوپ نوری معمولی، قابل مشاهده است.[۵] در سال ۲۰۱۳، سردهای از ویروسها با نام پاندوراویروس، در اعماق اقیانوس کشف شد که ژنومی دو برابر بزرگتر از میمیویروسها و مگاویروسها دارد.[۶]
برخی از ویروسها دارای ژنهایی هستند که برای ساخت یک ویروس جدید لازم و ضروری هستند. به دلیل دارا بودن برخی از ویژگیهای موجودات زنده و فقدان برخی دیگر از آن ویژگیها، اخیراً دانشمندان ویروسها را «موجوداتی در لبهٔ حیات» یا به عبارت دیگر «خود تکثیر شوندهها» تعریف میکنند.[۷]
ویروسها زمانی که هنوز درون سلول آلوده (میزبان) نرفتهاند، یا تازه دارند درون سلول را آلوده میکنند، به شکل ذراتی مستقل، موسوم به ویریون هستند. اجزاء یک ویریون، عبارتاند از:
(i) ماده ژنتیکی یا مولکولهای طولانی DNA یا RNA که کد کننده پروتئینهای ویروسی هستند.
(ii) یک پوشش پروتئینی، که کپسید نام دارد، که مادهٔ ژنتیکی را احاطه کرده و از آن محافظت میکند.
(iii) در برخی موارد، یک پوشش ویروسی از لیپیدها.
ساختار ویریونها از فرمهای سادهٔ کروی، مارپیچ و بیستوجهی تا ساختارهای پیچیدهتر متغیر است. یک ویژگی مخصوص ویروسهای جانوری این است که پوششی از جنس غشای سلولی (پروتئین، لیپید و گلیکوپروتئین) دارند. ویروسها، این پوشش را از میزبان قبلی خود بهدست میآورند و این بدان جهت است که ویروسهای جانوری از طریق اندوسیتوز (درونرانی) وارد میزبان میشوند. ویروسهایی که به باکتریها حمله میکنند، باکتریوفاژ نام دارند که از سایر ویروسهای گیاهی و جانوری پیچیدهترند. این بدان علت است که شامل دو پوشش چند وجهی (به عنوان کپسید) و پوشش مارپیچی (به عنوان دم) میباشند.
کشف ویروسها
[ویرایش]در پایان سدهٔ ۱۹ میلادی دانشمندان به دنبال یافتن عامل بیماری موزائیک تنباکو بودند. در ۱۸۸۶ آدولف مایر قابل انتقال بودن این بیماری در بین گیاهان را اثبات کرد. پس از او دیمیتری ایوانفسکی درسال۱۸۹۲ پس از عبور دادن عصارهٔ برگهای گیاه عفونت زده از صافی غیرقابل عبور برای باکتریها، آن را برروی برگهای گیاه سالم تنباکو پخش کرد و بیماری موزائیک تنباکو را انتقال داده وباعث ایجاد بیماری درگیاه سالم شد. او دریافت که از گیاه آلوده عاملی قادر است که گیاهان سالم را بیمار کند؛ بنابراین عامل بیماری هرچه که بود از باکتریها بسیار کوچکتر بود. در سال ۱۹۳۵ زیستشناسی به نام وندل مردیت استنلی توانست ویروس موزائیک تنباکو را تخلیص کند. ویروس خالص شده اگر چه به شکل بلور بود اما باز هم میتوانست گیاهان سالم را بیمار کند. چون تبلور یکی از ویژگیهای مواد شیمیایی است بنابراین میتوان نتیجه گرفت که ویروس داخل یاختهها موجودی زنده و خارج از یاختهها یک ماده شیمیایی است نه یک موجود زنده.
در اوایل قرن بیستم دانشمندی انگلیسی به نام فردریک توارت ویروسهایی را کشف کرد که باکتریها را آلوده میکنند. این ویروسها باکتریوفاژ یا اختصاراً فاژ نام گرفتند. دانشمندان قصد داشتند با استفاده از این ویروسها باکتریهای وبا و تیفوس را از بین ببرد اما با کشف پنی سیلین این موضوع به فراموشی سپرده شد. در سالهای اخیر، ایجاد مقاومت آنتیبیوتیکی در باکتریها باعث شدهاست که استفاده از فاژها جهت مقابله با بیماریهای باکتریایی دوباره مطرح شود.[۸]
ساختار ویروسها
[ویرایش]
ساختمان عمومی ویروسها شامل اسیدهای نوکلئیک (ژنوم) و پوششی از پروتئین به نام کپسید است. در شماری از ویروسها لایهای از لیپوپروتئین و لیپوپلیساکارید نیز برای حفاظت پوشش پروتئینی به دور آن قرار میگیرد. ژنوم ویروسها عبارت است از نوعی اسید نوکلئیک که بر مبنای نوع آن، ویروسها به دو دسته تقسیم میشوند. ویروسهای حاوی «آر ان اِی» (ریبونوکلئیک اسید) و ویروسهای حاوی «دیانای» (دئوکسی ریبونوکلئیک اسید). عفونت زایی ویروسها فقط و فقط حاصل فعالیت داخل سلولی اسید نوکلئیک یا ژنوم آنهاست. به این جهت ویروس و ژنوم ویروس در خارج از سلولها، عاری از هرگونه فعالیت بوده و یک مولکول بزرگ محسوب میشود. ژنوم بسیاری از ویروسها به صورت رشته یا کلاف داخل پوششی پروتئینی که کپسید نامیده میشود قرار دارد. این پوشش پروتئینی یکپارچه نبوده و از ذرات یا واحدهای کوچکتری به نام کپسومر ساخته میشود. کپسومرها پس از به هم پیوستن، کپسید را تشکیل میدهند و فرم مخصوص آن بستگی به نوع ویروس و ساختار آن دارد. در برخی ویروسها ژنوم به صورت مارپیچی سنتز شده و کپسومرها آن را بهطور منظم پوشش میدهند، طوریکه نوکلئوکپسید ویروس حالت فنری یا مارپیچ به خود میگیرد. علاوه بر این، ژنوم و کپسید (نوکلئوکپسید) در بیش از نیمی از ویروسها دارای یک غلاف یا پوشش ویروس (به انگلیسی: Envelope) از جنس لیپوپروتئین و لیپوپلیساکارید هستند. در این مورد هم ویروسها به دو دسته تقسیم میشوند. ویروسهای غلافدار و گروه بدون غلاف. غلاف ویروسها از تنوع بسیاری برخوردار است.
اندازه، شکل، حجم و ساختمان ویروسها بسیار متنوع و متفاوت است. ویروسها برخی کروی، بعضی مخروطی یا مشابه سایر اشکال هندسی که از آن جمله میتوان فرم مکعبی یا پلی هدرون را مثال زد.
قطر ویروسها میتواند از عدد ۲۰ نانومتر (کوچکترین) تا ۴۵۰ نانومتر (بزرگترین) متغیر باشد. برخی از فیلوویروسها طولی معادل ۱۴۰۰ نانومتر دارند اما قطر آن فقط ۸۰ نانومتر است.
ویروسهای بزرگ مانند ویروس آبله اندازه ای بزرگ داشته و از ساختمانی غیرمعمول و نسبتاً پیچیده یا مرکب (complex) برخوردارند و همچون باکتریها ابداً از صافی (فیلتر چمبرلین) عبور نمیکنند. درصورتیکه اغلب ویروسها توانایی گذر کردن از این صافیها را دارند.
ویروسها فاقد ساختمان سلولی بوده و بهطور مجزا و خارج از سلولهای میزبان عاری از هرگونه فعل و انفعالات شیمیایی، آنزیمی و متابولیسم سلولی هستند و با فقدان ملزومات مشابهسازی، هرگز قادر به تکثیر و مشابهسازی خود نیستند. آنها را باید خارج از سلول زنده یک ماکرومولکول مرکب یا یک واحد عفونتزا بهشمار آورد. آنها با توجه به اینکه ماکرومولکولهای مرکب هستند، یعنی دارای زنجیره اسید نوکلئیک و حفاظ پروتئینی و احتمالاً غلافی از لیپوپروتئین و لیپوپلیساکارید هستند، آمادهاند به محض تماس با سلول میزبان و پس از مراحل جذب، دخول و آزادی ژنوم دستگاه پروتئینسازی میزبان را در اختیار گرفته و مراحل کلی تکثیرشان را به کمک سیستمهای سلولی رونویسی و ترجمه ترتیب دهند. کلیه موجودات زنده شامل یوکاریوتها و پروکاریوتها میتوانند میزبان اجباری ویروسها گردند. هرنوع سلولی پذیرای هر ویروسی نبوده و ویروسها تنها توانایی آلودهسازی نوع یا انواع خاصی از سلول را دارا هستند.
ویروسهای غولپیکر
[ویرایش]میمیویروس (Mimivirus) یکی از بزرگترین ویروسهای شناخته شدهاست. ابتدای نام این ویروس از کلمهٔ Mimicking Microbe به معنای «تقلیدکننده میکروب» گرفته شدهاست؛ زیرا اندازه این ویروس به اندازه یک باکتری است.[۹] قطر کپسید این ویروس، ۴۰۰ نانومتر بوده و دارای رشتههای پروتیینی سطحی به طول ۱۰۰ نانومتر است. ساختار این ویروس در میکروسکوپ الکترونی به صورت ششوجهی دیده میشود.
در سال ۲۰۱۱ بزرگترین ویروس شناخته شده در بستر اقیانوس در نزدیکی سواحل شیلی کشف شد. این ویروس مگاویروس (Megavirus chiliensis) نام داشته و با استفاده از میکروسکوپ نوری معمولی قابل مشاهده است. در سال ۲۰۱۳ سردهای از ویروسها به نام پاندوراویروس (Pandoravirus) در شیلی و استرالیا کشف شد. اندازهٔ ژنوم این ویروس، دو برابر ژنوم میمیویروس و مگاویروس است.[۱۰] ژنوم تمامی ویروسهای غولپیکر، دنای دو رشتهای است. این ویروسها به هفت خانواده مختلف تقسیم شدهاند.[۱۱]
تکثیر ویروسها
[ویرایش]چرخه همانندسازی ویروسها از آلوده شدن سلول میزبان آغاز میشود و با رهاسازی ذرات ویروسی ایجادشده بالغ خاتمه مییابد.
ویروسها به علتِ فقدانِ ساختمانِ سلولی و هرگونه متابولیسم و فعل و انفعالِ شیمیایی، قادر به مشابهسازی خود نبوده و برای این عمل میباید به داخل سلولی حساس راه یافته و محتاجِ انرژی و دستگاهِ پروتئین سازیِ سلولِ زنده میباشند. انتقالِ ویروس به داخلِ سلول فقط توسطِ سلول امکانپذیر است و این عمل فقط توسطِ سلولِ حساس و حاملِ گیرندههای (رسپتورهای) آشنا به ویروس انجام میگیرد. سلولهایی که این نوع گیرندهها را برای جذبِ ویروس آماده دارند احتمالاً میتوانند به انتقالِ انواعِ مختلفِ ویروسها بپردازند، در غیر اینصورت سلول در مقابلِ ویروس مقاوم بوده و هرگونه تماسی با ویروس بینتیجه خواهد بود. با داخل شدن به سلول و پوشش برداری توسطِ آنزیمهایِ سلول، فعالیتِ اسیدنوکلئیک ویروس آغاز میگردد. اسیدنوکلئیکِ ویروس ژنهای کافی برایِ مهار نمودنِ متابولیسمِ سلول میزبان را دارا بوده و به کمکِ آن احتیاجاتِ فعل و انفعالاتِ شیمی حیاتی، برای تکثیرِ خود را توسطِ سلولِ میزبان تأمین میکند. پس از آلوده شدنِ سلولِ میزبان تکثیر ویروسها میتواند در دو نوع چرخه انجام گیرد:
گاهی ویروس پس از دخول به سلول پس از طی مراحل اولیه و آزاد شدنِ ژنوم یا اسیدنوکلئیک، به عوضِ تولید ژنوم و پروتئین ویروس، خود را درونِ کروموزومِ میزبان جای میدهد که در این حالت به ان پرو ویروس میگویند با هر بار تقسیم سلولی، پرو ویروس نیز تقسیم میشود. در این نوع چرخه بدونِ آنکه سلولِ میزبان تخریب شود ژنومِ ویروسی تکثیر پیدا میکند که گاهی این مرحله بدون آنکه سلولِ میزبان تخریب شود به تولیدِ ویروسِ کامل پرداخته و ویروسهای نوزاد را به خارجِ سلول هدایت میکند.
دراین مرحله سلولِ میزبان پس از انجامِ تکثیر ویروس خود به کلی تخریب شده از این راه ویروسهای زیادی از سلول میزبان آزاد نمیشوند.
مراحل تکثیر ویروس
[ویرایش]جذب و اتصال
[ویرایش]ویروس با گیرندههای در غشاء سلولی تماس پیدا نموده (Receptor) و سبب جذب و اتصال ویروس به سلول شده و شروع عفونت پایهگذاری میشود. این اتصال ویروس به رسپتور و وجود رسپتورهای مذکور در بافتهای خاص باعث اختصاصیت ویروس به بافتهای خاص و ایجاد بیماریهای مشخص در همان سلولهای بافتی شدهاست. حرارت محیط، پی اچ مناسب، نیروی الکترواستاتیک و وجود نمکهای معدنی درجذب ویروس و اتصال به رسپتورهای سطح سلول از اهمیت زیادی برخوردارند. اتصال ویروس به رسپتور اتصالی ضعیف و غیر کووالانسی است. نوع رسپتورها برای ویروسهای مختلف یکسان نیست برای مثال ویروس فلج اطفال جذب PVR و ویروس آنفلوانزا جذب سیالیک اسید سلولهای تنفسی میگردد. همچنین رسپتور ویروس HIV مولکول CD4 و رسپتور ویروس اپشتین–بار مولکولCD21 و رسپتور راینوویروس مولکول ICAM-1 است. هر کدام از گیرندهها عملکردی طبیعی در خدمت به بدن دارند و ویروس از آنها سوءاستفاده میکند، به طوری که CD4 در سلولهای لنفوسیت تی نقشی به عنوان کمک محرک برای شناسایی و پاسخ به آنتیژنهای بیگانه متصل به MHC برعهده دارد.
نفوذ به سلول
[ویرایش]بعد از اتصال ویروس به سطح سلول با تغییراتی در گیرنده سلولی ویروس به دنبال راهی برای ورود به سلول است. بهطور کلی ورود ویروس یا از طریق فیوژن غشا (تلفیق شدن پوشش ویروسی با غشا سلول) یا از طریق اندوسیتوز صورت میگیرد. ویروسهای دارای پوشش اغلب از طریق فیوژن و با کمک پروتئینهای ویروسی که نقش در فیوژن دارند وارد سلول میشوند. ویروسهای بدون پوشینه نیز از طریق اندوسیتوز وارد سلول میشوند، که هرکدام انواعی از اندوسیتوز شامل اندوسیتوز وابسته به کلاترین، اندوسیتوز وابسته با کائولین، اندوسیتوز مستقل از کلاترین و کائولین و ماکروپینوسیتوز است. به دلیل وجود دیوارههای سلولی مستحکم کیتینی و سلولزی در قارچها و گیاهان ورود ویروسها به این گونه سلولها با مشکل مواجه است و ویروسها فقط در شرایطی که دیواره این سلولها آسیب دیده باشد قادر به ورود هستند. در سلولهای گیاهی ویروسها میتوانند از طریق منافذ سلولی پلاسمودسماتا مستقیماً از سلولی به سلول دیگر بروند.
پوشش برداری(uncoating)
[ویرایش]پس از ورود ویروس به سلول، در داخل سیتوپلاسم و تحت تأثیر آنزیمهای داخل سلولی یا آنزیمهای خود ویروس، پوشش پروتئینی ویروس از هم گسسته و اسید نوکلئیک آزاد میگردد. از آغاز تا این مرحله را میتوان با کمک میکروسکوپ الکترونی تغییرات ویروس را دنبال کرده، مشاهده نمود.
ناپدید شدن
[ویرایش]اسید نوکلئیک آزاد شده ویروس به قطعات کوچکتری تقسیم شده و پس از اندک زمانی کمترین اثری از ژنوم ویروس قابل رؤیت نخواهدبود. از این پس اسید نوکلئیک ویروس فرمانروای سلول عفونت زده بوده و کنترل دستگاه پروتئینسازی سلول را برای تکثیر خویش هدایت میکند. در این مراحل میتوان ویروس را یک واحد زنده تلقی نمود یا به عبارت دیگر اسید نوکلئیک ویروس یک واحد زنده محسوب میشود.
تکثیر یا بیوسنتز(replication)
[ویرایش]با سنتز و ساخت و ساز آنزیمهای لازمه تکثیر، فعالیت اسید نوکلئیک ویروس در داخل سیتوپلاسم سلولی شروع شده، آنزیمها فعالیت خود را برای جلوگیری از تولید پروتئین و اسید نوکلئیک سلولی آغاز میکنند. در بعضی از موارد تولید پروتئین و اسید نوکلئیک سلولی بهطور کلی متوقف نشده و فقط به نحو کنترل شده محدود میگردد. مراحل همانندسازی و ترجمه برای بیوسنتز ویروس با تولید و ساخت پروتئین و اسید نوکلئیک ویروس در مراکز مشخصی آغاز میگردد. مراکز تولید با توجه به نوع ویروس هر کدام در گوشهای از سلول، گاهی در داخل سیتوپلاسم و گاهی در داخل هسته سلول تشکیل شده، آماده تهیه و تولید ویروس و مرحله بعدی آن میگردند.
تکمیل شدن (assembly)
[ویرایش]پس از تولید و سنتز پروتئین و اسید نوکلئیک ویروس در مراکز مشخص. اسید نوکلئیک ویروس در داخل پروتئین محافظ جایگرفته و کار تکمیل شدن ویروس روند مختص به خود را پیش میگیرد. تکمیل شدن ویروسها بهطور عمومی یکسان نبوده و بهطور خصوصی انجام میگیرد. تکمیل شدن ویروسها ی غلافدار یا بدون غلاف و آنان که دارای ساختمان پیچیده (کمپلکس) هستند یا دارای نوکلئوکپسید فنری (هلیکال) اند کاملاً متفاوت از هم بوده و هر کدام سیر تکاملی دیگری طی کردهاند. بهطور خلاصه میتوان گفت که ویروسهای کروی یا به عبارت دیگر با کپسید ایکوزاهدرون با بهم پیوستن کپسومرها و جای گرفتن اسید نوکلئیک در داخل آن کامل میشوند. ویروسهایی که نوکلئوکپسید فنری دارند قبلاً به روی اسید نوکلئیک پوششی از کپسومرها قرار گرفته و فرم فنری خود را هنگامی بدست میآورند که ویروس برای خروج از سلول آماده میشود. ویروسهایی که دارای ساختمان پیچیده کمپلکس هستند تکمیل شدنشان به سادگی دیگر ویروسها نبوده و بهطوریکه بررسیها نشان میدهند اسید نوکلئیک و پروتئین حافظ و فیلامانهای سطح خارجی آنها و لیپیدی که در ساختمانشان بکار میرود بهطور کلی در محل دیگری سنتز شده و ویروس در همان محل فرم میگیرد و کامل میشود غلاف ویروسهای غلافدار، آنهایی که در داخل هسته سلول تکثیر میشوند پس از خروج از هسته و آنهایی که در سیتوپلاسم سلول تکمیل میشود هنگام خروج غلافی از غشاء سیتوپلاسمی به دورشان پیچیده شده و تکمیل میگردند.
خروج ویروس از سلول
[ویرایش]در مورد خروج ویروسها از سلول دو روش مشاهده میگردد. در بعضی موارد ویروس پس از اینکه تکمیل شد بسته به نوع آن و نوع سلول، با متلاشی شدن سلول میزبان، ویروس آزاد میشود. در اینگونه موارد، پس از انهدام سلول مقدار زیادی ویروس ناگهان آزاد میشود. این نوع رهاسازی در بسیاری از باکتریها و بعضی از سلولهای جانوری مشاهده میشود.
در بعضی موارد دیگر مانند ویروسهای دارای غلاف مثلاً ویروس اچ ای وی ویروس بدون اینکه سلول منهدم شود به خارج از سلول رها میگردد. در این موارد ویروس همانند جوانهای از سلول جدا میشود.[۱۲] در مورد ویروسهای غلافدار همزمان غلافشان به دورشان پیچیده شده و از سلول به خارج راه میابند.
بیماریهای ویروسی در انسان
[ویرایش]مثالهایی از بیماریهای شایع ویروسی انسانی شامل سرماخوردگی، آنفلوانزا، آبله مرغان و تبخال و مثالهایی از بیماریهای خطرناک ویروسی شامل هاری، ابولا، ایدز، سارس، هپاتیت و کرونا میباشند. البته نقش ویروسها در برخی از بیماریهای انسانی مانند ام. اس اثبات نشده و همچنان تحت بررسی است.
بعضی ویروسها مثل ویروس تبخال ممکن است در بدن مخفی مانده و فقط تحت برخی شرایط فعال شوند. حضور این گونه ویروسها در بدن به دلیل افزایش فعالیت سیستم ایمنی بدن میتواند مفید باشد.[۱۳] بعضی از ویروسها مانند ویروس هپاتیت بی و هپاتیت سی میتوانند حضور و عفونت دائمی در بدن فرد داشته باشند و این گونه افراد به عنوان ناقل دائمی این بیماریها مطرح خواهند بود.
بهطور کلی دو شیوه انتقال ویروس وجود دارد. انتقال عمودی به معنی انتقال ویروس از مادر به جنین مثلاً انتقال ویروس ایدز و هپاتیت یا سیفلیس میباشد.
در انتقال افقی بیماری به صورت فرد به فرد یا از طریق ناقلینی مثل پشه در جمعیتها منتقل میشود. این انتقال ممکن است از طریق بزاق، قطرات تنفسی، رابطه جنسی یا آب و غذای آلوده صورت گیرد.
همهگیری و دنیاگیریها
[ویرایش]در سال ۱۹۱۸ و ۱۹۱۹ نوعی بسیار خطرناک و کشنده از آنفلوانزای نوع یک در تمام دنیا شایع شد. اغلب قربانیان این بیماری افراد بزرگسال جوان و سالم بودند. در گذشته باور بر این بود که طی این دنیاگیری ۵۰میلیون نفر کشته شدهاند اما بررسیهای اخیر نشان میدهد که حدود ۱۰۰میلیون نفر بر اثر این بیماری کشته شدهاند که این تعداد معادل پنج درصد از جمعیت دنیا در آن سال بودهاست. یکی از دنیاگیریها که از دهه هشتاد میلادی آغاز شده و تا امروز ادامه دارد بیماری ایدز است. در حال حاضر حدود ۳۸میلیون نفر در دنیا مبتلا به ایدز هستند. تا کنون حدود ۲۵میلیون نفر بر اثر این بیماری جان خود را از دست دادهاند و فقط در سال ۲۰۱۸ حدود ۷۷۰هزار نفر به علت این بیماری از دنیا رفتهاند.[۱۴]
خانواده ویروسی فیلوویریده شامل چند ویروس کشنده و خطرناک است که ایجاد تبهای هموراژیک (خونریزی دهنده) میکنند. ویروس ابولا و ویروس ماربرورگ از اعضای این خانواده ویروسی هستند که در چند نوبت در کشورهای آفریقایی همهگیری ایجاد کردهاند.
خانواده ویروسی کوروناویریده شامل ویروسهایی است که عموماً ایجاد عفونتهای تنفسی خطرناک میکنند. به عنوان مثال بیماریهای نشانگان تنفسی حاد (SARS) و نشانگان تنفسی خاورمیانه (MERS) و همچنین ویروس عامل بیماری کروناویروس ۲۰۱۹ (COVID-19) از اعضای این خانواده هستند که طی سالهای مختلف ایجاد همهگیری و دنیاگیری کردهاند.[۱۵]
ژنتیک ویروسها
[ویرایش]ژنتیک ویروسهای انسانی و حیوانی تاکنون بهطور کامل شناخته نشدهاست. علت اصلی این امر فقدان ساختمان سلولی و متابولیسم اختصاصی آنهاست. چون تکثیرشان کاملاً وابسته و گره خورده به سلول میزبان است، بررسی جزء به جزء آن دشوار و مراحل مختلف آن به سختی قابل پیگیری است. از طرفی ویروسها از نظر ژنتیکی استوارتر از باکتریها بوده و تغییرات ژنتیکی در آنها به غیر از ویروسهای آنفلوانزا و ایدز در سایر ویروسهای انسانی و حیوانی خیلی به ندرت اتفاق میافتد و به دست آوردن موتانتها یا رکمبینانتهای نوین بسیار مشکل است. از اینرو بررسی ژنتیک آنها به سادگی امکانپذیر نیست و دشواری آن در درمان بیماریهای ویروسی منعکس میگردد.
تغییرات دو جانبه ژنتیکی ویروسها
[ویرایش]تغییرات دو جانبه ژنوم ویروسها هنگامی به وقوع میپیوندند که ژنوم دو ویروس فعال همزمان به داخل سلولی راه یافته و آن را عفونی نموده، سلول میزبان عمل تکثیر را در مورد هرد و با انجام رسانیده باشد. در اینگونه موارد احتمال تغییرات و تعویض دو جانبه ژنتیکی در میان دو ویروس بسیار زیاد است که در این موارد قسمتی از اسید نوکلئیک ویروس اول به اسید نوکلئیک ویروس دیگر پیوسته اجباراً و ژنهای جدیدی را همرا آورده به ژنهای اولیه اضافه میکند. در صورتیکه قسمتی از اسید نوکلئیک ویروس اول به اسید نوکلئیک ویروس دوم پیوسته و قسمتی از اسید نوکلئیک ویروس دوم به اسید نوکلئیک ویروس اول بپیوندد در این حالت ژنوم هر کدام قسمتی از دست میدهد و قسمتی دیگر به دست میآورد.
بهطور کلی در اینگونه موارد میتوان احتمالات زیر را مشاهده نمود:
نوترکیبی
[ویرایش]نوترکیبی، تعویض ترمیمی متقابل قسمتهایی از ژنوم دو ویروس فعال است که همزمان بداخل سلولی راه یافته و آن را عفونی نموده باشند. تعویض اتفاقی قسمتی از ژنوم دو ویروس فعال گاهی سبب افزایش ویرولانس یا کاهش آن و احتمالاً تغییراتی در آنتیژنهای ویروس به عمل میآید. زمانی حاصل آن بدست آوردن خصوصیات جدیدیست که ویروس تا به حال فاقد آن بوده وبا کسب آن به کلی تغییر ماهیت بدهد. رکمبیناسیون در ویروسهای آبله و آنفلوانزا و فلج اطفال و باکتریوفاژها گزارش شدهاست.
فعال شدن متقاطع
[ویرایش]تلاقی ژنوم ویروس فعالی با ژنوم ویروس غیرفعالی که همزمان بداخل سلولی راه یافته و آن را عفونی نموده باشند گاهی منجر به تعویض متقاطع قسمتی از ژنوم آنها شده و هر دو ویروس حاصل این تغییرات خصوصیات جدیدی را کسب کرده و در نتیجه هر دو ویروس پدیدار و فعال میگردند. برای مثال جهت تهیه واکسن از ویروسیهایی که در سلولهای معینی قابل تکثیر نیستند میتوان آنها را به کمک این تغییرات ژنتیکی برای تکثیرشان در سلولهای مورد نظر فعال نمود.
دوباره فعال شدن افزایشی
[ویرایش]زمانی است که دو ویروس غیرفعال به سلولی راه میابند و اسید نوکلئیک غیرفعال آن دو به تعمیر و ترمیم یکدیگر پرداخته در نتیجه یک ویروس فعال و دارای خصوصیات هر دو به وجود میآید. این امر و افزایش ژنتیکی متقابل که در این صورت اتفاق میافتد احتمال ویروسی فعال و خشن حاصل میگردد.
تغییرات دو جانبه غیر ژنتیکی
[ویرایش]هنگامی دو ویروس همزمان به سلولی راه یابند و تکثیر شوند، اگر اطلاعات ژنتیکی ویروس اولی (ژنوتیپ) در کپسید (فنوتیپ) ویروس دومی جایگزین شود اختلاط فنوتیپیک رخ میدهد. این امر موجب پیدایش دو ویروس جدید که بهطور اتفاقی فنوتیپ و ژنوتیپ آنها تغییر یافته میگردد. این حالت پایدار نبوده، در صورتیکه هر کدام سلولی را عفونی سازند ویروسهای نوزاد فنوتیپ عاریه را از دست داده فنوتیپ اصلی خود را عیان خواهند نمود.
اختلاط ژنوتیپی
[ویرایش]گاهی عفونت همزمان سلول با دو ویروس مختلف منجر به اختلاط ژنوتیپ آنها میگردد؛ بنابراین درصورتی که که یک ویروس از نظر ژنتیکی اطلاعات کامل دو ویروس مختلف را دربرداشته رد یعنی دو ژنوم مختلف در کپسید اش جای گرفته باشند از اختلاط ژنوتیپ سخن میگوییم. در این گونه موارد نیز، ثبات ژنتیکی وجود ندارد. حاصل اولین تکثیر آن ویروس منجر به پدیدار شدن دو ویروس مختلف خواهند بود. این پدیده در ویروسهای پارامیکسو گزارش شدهاست.
تداخل (انترفرانس)
[ویرایش]تجربه نشان میدهد، گاهی کشتهای سلولی پس از عفونی شدن به وسیلهٔ ویروسی در قبال عفونت با ویروسهای دیگری نوعی مصونیت نشان میدهند. حتی اگر ویروس دیگری بداخل سلول نفوذ کند به تکثیر نمیشود. علت آن به احتمال زیاد ترشح انترفرون سلولی یا کنترل و هدایت متابولیسم سلول توسط ویروس عفونت زا و عدم امکان برای کنترل و هدایت سلول توسط ویروس دوم است. عکس عمل انتر فرانس نیز امکانپذیر است. در این صورت سلولهای عفونی شده توسط ویروس یکم تکثیر ویروس دوم را تشدید و افزایش میدهند. احتمالاً علت این امر جلوگیری از ترشح انترفرون به کمک اطلاعات ژنتیکی ویروس دوم است. عکس انتر فرانس امکان دیگریست که با همکاری دو ویروس در جلوگیری از ادامه متابولیسم سلول نتیجه به نفع هر دو ویروس بوده مراحل تکثیر هر دو ویروس ممکن میسازد. گاهی هنگامیکه دو ویروس ناکامل و ناقص سلولی را عفونی میکنند، گرچه هیچکدام به تنهائی امکان را نداشته و احتمال تکثیرشان بسیار ناچیز است، اطلاعات ژنتیکی دو ویروس میتوانند مکمل یکدیگر شده وبا مهار و کنترل متابولیسم سلول هر دو آنها به تکثیر رسند.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ https://www.etymonline.com/word/VIRUS در اوستایی ویش و در لاتین ویس گویند به مینوی سم، زهر، ویرانگر
- ↑ Koonin, Eugene V.; Senkevich, Tatiana G.; Dolja, Valerian V. (2006-09-19). "The ancient Virus World and evolution of cells". Biology Direct. 1 (1): 29. doi:10.1186/1745-6150-1-29. ISSN 1745-6150. PMC 1594570. PMID 16984643.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Cm, Lawrence; S, Menon; Bj, Eilers; B, Bothner; R, Khayat; T, Douglas; Mj, Young (2009-05-08). "Structural and functional studies of archaeal viruses". The Journal of biological chemistry (به انگلیسی). PMID 19158076. Retrieved 2020-09-10.
- ↑ کتاب زیستشناسی سلولی مولکولی دکتر احمد مجد ویرایش دوم چاپ 1394.
- ↑ Arslan, Defne; Legendre, Matthieu; Seltzer, Virginie; Abergel, Chantal; Claverie, Jean-Michel (2011-10-18). "Distant Mimivirus relative with a larger genome highlights the fundamental features of Megaviridae". Proceedings of the National Academy of Sciences of the United States of America. 108 (42): 17486–17491. doi:10.1073/pnas.1110889108. ISSN 1091-6490. PMC 3198346. PMID 21987820.
- ↑ Arslan, Defne; Legendre, Matthieu; Seltzer, Virginie; Abergel, Chantal; Claverie, Jean-Michel (2011-10-18). "Distant Mimivirus relative with a larger genome highlights the fundamental features of Megaviridae". Proceedings of the National Academy of Sciences of the United States of America. 108 (42): 17486–17491. doi:10.1073/pnas.1110889108. ISSN 1091-6490. PMC 3198346. PMID 21987820.
- ↑ Ev, Koonin; P, Starokadomskyy (2016 Oct). "Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question". Studies in history and philosophy of biological and biomedical sciences (به انگلیسی). PMID 26965225. Retrieved 2020-09-10.
{{cite web}}: Check date values in:|تاریخ=(help) - ↑ Domingo-Calap, P.; Georgel, P.; Bahram, S. (2016-03). "Back to the future: bacteriophages as promising therapeutic tools". HLA. 87 (3): 133–140. doi:10.1111/tan.12742. ISSN 2059-2310. PMID 26891965.
{{cite journal}}: Check date values in:|date=(help) - ↑ Campbell Biology, 12th Edition, Chapter 19.
- ↑ Philippe, Nadège; Legendre, Matthieu; Doutre, Gabriel; Couté, Yohann; Poirot, Olivier; Lescot, Magali; Arslan, Defne; Seltzer, Virginie; Bertaux, Lionel (2013-07-19). "Pandoraviruses: amoeba viruses with genomes up to 2.5 Mb reaching that of parasitic eukaryotes". Science (New York, N.Y.). 341 (6143): 281–286. doi:10.1126/science.1239181. ISSN 1095-9203. PMID 23869018.
- ↑ Brandes, Nadav; Linial, Michal (04 30, 2019). "Giant Viruses-Big Surprises". Viruses. 11 (5). doi:10.3390/v11050404. ISSN 1999-4915. PMC 6563228. PMID 31052218.
{{cite journal}}: Check date values in:|date=(help) - ↑ "Virus - Wikipedia". en.m.wikipedia.org (به انگلیسی). Retrieved 2020-09-13.
- ↑ Chen, C. H.; Chiu, Y. L.; Wei, F. C.; Koong, F. J.; Liu, H. C.; Shaw, C. K.; Hwu, H. G.; Hsiao, K. J. (1999-01). "High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan". Molecular Psychiatry. 4 (1): 33–38. doi:10.1038/sj.mp.4000484. ISSN 1359-4184. PMID 10089006.
{{cite journal}}: Check date values in:|date=(help) - ↑ Mawar, Nita; Saha, Seema; Pandit, Apoorvaa; Mahajan, Uma (2005-12). "The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs". The Indian Journal of Medical Research. 122 (6): 471–484. ISSN 0971-5916. PMID 16517997.
{{cite journal}}: Check date values in:|date=(help) - ↑ Ashour, Hossam M.; Elkhatib, Walid F.; Rahman, Md Masudur; Elshabrawy, Hatem A. (2020-03-04). "Insights into the Recent 2019 Novel Coronavirus (SARS-CoV-2) in Light of Past Human Coronavirus Outbreaks". Pathogens (Basel, Switzerland). 9 (3). doi:10.3390/pathogens9030186. ISSN 2076-0817. PMC 7157630. PMID 32143502.
- مشارکتکنندگان ویکیپدیا. «Virus». در دانشنامهٔ ویکیپدیای انگلیسی.
کتابشناسی
[ویرایش]- Collier L, Balows A, Sussman M (1998). Mahy, B, Collier LA (eds.). Topley and Wilson's Microbiology and Microbial Infections. Virology. Vol. 1 (Ninth ed.). ISBN 0-340-66316-2.
- Dimmock NJ, Easton AJ, Leppard K (2007). Introduction to Modern Virology (Sixth ed.). Blackwell Publishing. ISBN 978-1-4051-3645-7.
- Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE (2007). Fields Virology. Lippincott Williams & Wilkins. ISBN 978-0-7817-6060-7.
- Shors T (2017). Understanding Viruses. Jones and Bartlett Publishers. ISBN 978-1-284-02592-7.
پیوند به بیرون
[ویرایش]- ViralZone A Swiss Institute of Bioinformatics resource for all viral families, providing general molecular and epidemiological information

