اتیلندیآمینتترااستیک اسید
| اتیلندیآمینتترااستیک اسید | |
|---|---|

| |
 Disodium EDTA
| |
2,2',2'',2'''-(Ethane-12-diyldinitrilo)tetraacetic acid[۱] | |
دیگر نامها
| |
| شناساگرها | |
| کوتهنوشتها | EDTA H4EDTA |
| شماره ثبت سیایاس | ۶۰-۰۰-۴ |
| پابکم | ۶۰۴۹ |
| کماسپایدر | ۵۸۲۶ |
| UNII | 9G34HU7RV0 |
| شمارهٔ ئیسی | 200-449-4 |
| شمارهٔ یواِن | 3077 |
| دراگبانک | DB00974 |
| KEGG | D00052 |
| MeSH | Edetic+Acid |
| ChEBI | CHEBI:42191 |
| ChEMBL | CHEMBL۸۵۸ |
| شمارهٔ آرتیئیسیاس | AH4025000 |
| 1716295 | |
| 144943 | |
| جیمول-تصاویر سه بعدی | Image 1 |
| |
| |
| خصوصیات | |
| فرمول مولکولی | C10H16N2O۸ |
| جرم مولی | ۲۹۲٫۲۴ g mol−1 |
| شکل ظاهری | Colourless crystals |
| چگالی | 860 mg mL-1 (at 20 °C) |
| log P | -0.836 |
| اسیدی (pKa) | 1.782 |
| خاصیت بازی (pKb) | 12.215 |
| ترموشیمی | |
آنتالپی استاندارد
تشکیل ΔfH |
-1.7654 to -1.7580 MJ mol-1 |
| Std enthalpy of combustion ΔcH |
-4.4617 to -4.4545 MJ mol-1 |
| داروشناسی | |
| کد اِیتیسی | S01 |
| Routes of administration |
|
| خطرات | |
| GHS pictograms | 
|
| سیستم هماهنگ جهانی طبقهبندی و برچسبگذاری مواد شیمیایی | WARNING |
| GHS hazard statements | H319 |
| GHS precautionary statements | P305+351+338 |
| لوزی آتش |  |
| LD50 | 1000 mg/kg (oral, rat)[۲] |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
اتیلن دی آمین تترا استیک اسید (به انگلیسی: Ethylenediaminetetraacetic acid) به اختصار EDTA، یک ماده شیمیایی است که برای اهداف صنعتی و دارویی مورد استفاده قرار میگیرد.
این ماده جامد یک آمینو کربوکسیلیک اسید بیرنگ و محلول در آب میباشد. باز مزدوج این اسید، اتیلن دی آمین تترا استات میباشد. از این ماده به صورت گسترده برای انحلال آهک استفاده میشود. سودمندی این ماده ناشی از ایفای نقش لیگاند شش دندانه ای و عامل کلاتهکننده میباشد که در واقع باعث توانایی آن در جداسازی یونهای فلزی مثل و شدهاست. یونهای فلزی پس از برقراری پیوند با EDTA و تشکیل کمپلکس در محلول باقی میمانند ولی از واکنش پذیری آنها کاسته میشود. EDTA به صورت نمکهای مختلف به ویژه ادتا دو سدیم، چهار سدیم و کلسیم دی سدیم EDTA تولید میشود.
کاربردها
[ویرایش]صنعت
[ویرایش]در صنعت از EDTA عمدتاً برای جداسازی یونهای فلزی در محلولهای آبی استفاده میشود. در صنعت پارچه این ماده از تغییر رنگ پارچههای رنگ شده توسط یونهای فلزی جلوگیری میکند. در صنعت کاغذ و خمیر کاغذ از توان یونهای فلزی به ویژه برای کاتالیز کردن تسهیم نامتناسب هیدروژن پراُکسید جلوگیری مینماید. به همین روش EDTA در برخی از مواد خوراکی به عنوان نگهدارنده یا پایدارکننده اضافه میشود تا از رنگ زدایی اکسایشی کاتالیز شده توسط یونهای فلزی جلوگیری نماید.[۳] در نوشابههای حاوی اسید اسکوربیک و سدیم بنزوات، EDTA تشکیل بنزن (سرطان زا) را کاهش میدهد.[۴]
کاهش سختی آب در مصارف خشکشویی و از بین بردن پوستههای ایجاد شده در دیگهای بخار از طریق برقرای پیوند بین ، و سایر یونهای فلزی با EDTA یا کمپلکس کنندههای مربوط به آن انجام میشود. زمانی که این یونها با EDTA پیوند برقرار میکنند تمایل خود برای رسوب شدن یا تداخل با صابونها و شویندهها از دست میدهند. به دلایل مشابه محلولهای پاککننده اغلب حاوی EDTA میباشند. به همین دلیل در صنعت سیمان از EDTA برای تعیین مقدار آهک آزاد و منگنز آزاد در سیمان و کلینکرها استفاده میشود.
قابل انحلال سازی یونهای آهن در pH خنثی یا کمی پایینتر از آن میتواند با استفاده از EDTA انجام شود. این ویژگی در کشت هیدروپونیک در کشاورزی سودمند خواهد بود. با این حال با توجه به وابستگی تشکیل لیگاند به pH، در خاکهایی با pH بالای خنثی EDTA برای بهبود حلالیت یون آهن مفید نخواهد بود. محلول آبی برای حذف (پاک سازی) هیدروژن سولفید از گازها به کار میروذ. این کار با اکسایش هیدروژن سولفید به گوگرد عنصری که غیر فرار میباشد انجام میپذیرد.
به همین روش میتوان اکسیدهای نیتروژن را را از جریانهای گازی با استفاده از حذف نمود. از خواص اکسیدکنندگی همچنین در عکاسی برای قابل انحلال نمودن ذرات نقره استفاده میشود.
EDTA همچنین در جداسازی فلزات لانتانیدی از طریق کروماتوگرافی تبادل یونی به کار میرود.[نیازمند منبع]
داروسازی
[ویرایش]نمک خاص از EDTA معروف به سدیم کلسیم ادتات برای پیوند با یونهای فلزی مثل جیوه و سرب برای درمان سمیت آنها در شلاتوردرمانی (شستن فلزات از بدن، فلزشویی مانند آهنشوری در تالاسمی) استفاده میشود.[۵] به همین روش از EDTA برای حذف یونهای اضافی آهن از بدن استفاده میشود. از این روش درمان برای کاهش عوارض تزریق مکرر خون که به منظور درمان تالاسمی انجام میشود، استفاده میکنند. شاید در آینده برای شستن آهنهای تهنشین شده در یاختههای مخچه بیماران مسا (مچالگی سامانههای آوران که همان مالتیپل سیستم آتروفی (MSA) میباشد) و پارکینسون به کار رود.
دندانپزشکها و متخصصان ریشه از محلولهای EDTA برای از بین بردن باقیماندههای معدنی و روان کردن کانالهای ریشه دندان استفاده میکنند.
EDTA به عنوان نگهدارنده در قطرات چشمی (معمولاً برای ارتقاء کارایی نگهدارندههای دیگر مثل بنزالکونیم کلرید یا تیومرسال) استفاده میشود.
در ارزیابی عملکرد کلیه کمپلکس به صورت وریدی توزیع شده و تصفیه آن به داخل ادرار بررسی میشود. این روش برای ارزیابی نرخ تصفیه گلومرولی سودمند میباشد.[۶]
EDTA به صورت گسترده در آنالیز خون مورد استفاده قرار میگیرد. این ماده یک ضد انعقاد برای نمونههای شمارش کامل خون میباشد.
EDTA یک دیسپرسکننده بوده و در کاهش رشد باکتریایی در طول کاشت عدسک داخل چشمی بسیار مؤثر است.[۷]
داروی جایگزین
[ویرایش]برخی متحصصان معتقدند که EDTA به عنوان یک آنتیاکسیدان از آسیب رساندن به دیواره رگهای خونی توسط رادیکالهای آزاد جلوگیری کرده و بنابراین میزان تصلب شرایین را کاهش میدهد.[۵] این ایده با مطالعات علمی پشتیبانی نشده و به نظر میرسد که با برخی اصول پذیرفته شده کنونی در تضاد است.[۸] سازمان غذا و داروی آمریکا استفاده از آن را برای بهبود تصلب شرایین تأیید ننموده ست.[۹]
آرایشی و بهداشتی
[ویرایش]در شامپوها، پاک کنندهها و محصولات مراقبت شخصی دیگر نمکهای EDTA برای بهبود پایداری آنها در هوا به کار میروند.
کاربردهای آزمایشگاهی
[ویرایش]در آزمایشگاه EDTA بهطور گستردهای برای مهار یونهای فلزی استفاده میشود: در بیوشیمی و زیستشناسی مولکولی تخلیه یون معمولاً برای غیرفعال سازی آنزیمهای وابسته به فلز استفاده میشود (یا به عنوان معیاری برای واکنش پذیری آنها یا برای فرونشاندن آسیب رسانی به DNA یا پروتئینها). در شیمی تجزیه از EDTA در تیتراسون کمپلکسومتری و اندازهگیری سختی آب یا به عنوان عامل ماسککننده برای ممانعت یونهای فلزی که با ماده مورد آزمایش تداخل میکنند استفاده میشود. EDTA کاربردهای تخصصی فراوانی در آزمایشگاههای زیست دارویی مثل چشم پزشکی حیوانات به عوان آنتی کولاژن برای ممانعت از پیشرفت زخم قرنیه در حیوانات یافتهاست. در کشت بافت EDTA به عنوان عامل کلاتهکننده برای ایجاد پیوند با کلسیم و ممانعت از الحاق کادهرینهای بین سلولها و جلوگیری از انباشته شدن سلولهای رشد یافته در سوسپانسیونهای مایع به کار میرود.
عوارض جانبی
[ویرایش]EDTA با LD50 (خرگوش) ۲ تا ۲٫۲ گرم بر کیلوگرم میزان سمیت حاد پایینی نشان میدهد. مشخص شده که این ماده در حیوانات آزمایشگاهی هم دارای سمیت سلولی و هم دارای سمیت ژنتیکی میباشد. مطالعات نشان داده که مسمومیت از راه دهان میتوان تأثیرات منفی در باروری و رشد داشته باشد[۱۰] در همان مطالعه توسط لینگان مشخص شد که هم تماس پوستی با EDTA در بیشتر مواد آرایشی و هم تماس تنفسی با آن در مواد آرایشی پودری سمیت کمتری نسبت به تماس دهانی خواهد داشت.
سنتز
[ویرایش]این ماده اولین بار توسط فردیناند مونز از واکنش اتیلن دی آمین و کلرو استیک اسید تهیه شد.[۱۱] امروز EDTA عمدتاً از واکنش اتیلن دی آمین، فرمالدهید و سدیم سیانید تهیه میشود. این روش منجر به تولید نمک سدیمی میشود که طی مراحل متوالی میتواند تبدیل به فرم اسیدی شود:
از این فرایند سالانه برای تولید ۸۰ هزار تن محصول استفاده میشود. ناخالصیهای حاصل از این روش شامل گلیسین و نیتریلوتریاستیک اسید میباشد که از واکنشهای آمونیاک به عنوان محصول جانبی ناشی میشوند.[۱۲]
نامگذاری
[ویرایش]برای توصیف EDTA و فرمهای پروتونه مختلف آن شیمیستها مابین باز مزدوج EDTA که یک لیگاند میباشد و که ماده اولیه این لیگاند میباشد تمایز قائل میشوند. در pHهای بسیار پایین (شرایط خیلی اسیدی) فرم کاملاً پروتونه شده غالب است در حالی که در pHهای بسیار بالا (شرایط خیلی قلیایی) فرم کاملاً غیر پروتونه فائق میباشد. در این مقاله لفظ EDTA برای بیان به کار رفتهاست در حالی که در کمپلکسهای آن نشان دهنده لیگاند چهار پروتون از دست داده میباشد.
اصول شیمی کوئوردیناسیونی
[ویرایش]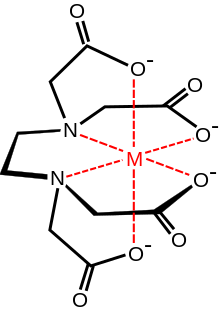
در شیمی کوئوردیناسیونی عضوی از خانواده لیگاندی آمینو پلی کربوکسیلیک اسیدها میباشد. معمولاً با یک یون فلزی از طریق دو آمین و چهار کربوکسیلات خود پیوند برقرار میکند. بسیاری از ترکیبات کوئوردیناسیونی حاصل با ساختار هندسی اُکتاهدرال منطبق هستند.[۱۳] بسیاری از کمپلکسهای به دلیل تشکیل یک پیوند اضافی با آب (کمپلکس هفت کوئوردیناسیونی) یا جابجایی یکی از بازوهای کربوکسیلات با آب دارای ساختارهای پیچیده تری هستند. کمپلکس آهن (III) EDTA هفت کوئوردینه است.[۱۴] اولین کارها برای توسعه EDTA توسط جرالد شورازنباخ در دهه ۱۹۴۰ انجام شد.[۱۵] EDTA کمپلکسهای به ویژه قوی با Mn(II), Cu(II), Fe(III), Pb(II), Co(III) تشکیل میدهد.[۱۶]
ویژگیهای متعدد کمپلکسهای EDTA با کاربرد آنها متناسب میباشد. اولاً به دلیل دندانگی بالا این لیگاند تمایل زیادی به کاتیونهای فلزی دارد.
- [Fe(H2O)6]3+ + H4EDTA
 [Fe(EDTA)]− + 6 H2O + 4 H+ (Keq = 1025.1)
[Fe(EDTA)]− + 6 H2O + 4 H+ (Keq = 1025.1)
با توجه به معادله، ثابت تعادل واکنش نشان میدهد که یونهای فلزی برای پیوند با EDTA با پروتونها رقابت میکنند. از آن جایی که یونهای فلزی به شدت با EDTA پوشانده شدهاند خواص کاتالیزوری آنها اغلب سرکوب شدهاست. در آخر از آنجایی که کمپلکسهای آنیونی هستند به شدت تمایل به انحلال در آب دارند. به همین دلیل EDTA قادر به حل نمودن رسوبات اکسیدهای فلزی و کربناتها میباشد.
سرنوشت زیستمحیطی
[ویرایش]تجزیه زیستی
[ویرایش]EDTA چنان کاربرد گستردهای دارد که سئوالاتی را در مورد آلاینده آلی دیرپا بودن آن مطرح ساختهاست. از آنجاییکه EDTA عملکردهای بسیاری در صنایع مختلف، داروسازی و سایر زمینهها دارد، طول عمر EDTA میتواند مشکلات جدی در محیط زیست به وجود آورد. تجزیه EDTA کند است و عمدتاً در حضور نور خورشید رخ میدهد.[۱۷]
مهمترین فرایند حذف EDTA از آبهای سطحی تجزیه نوری مستقیم در طول موجهای پایینتر از 400 nm میباشد.[۱۸] بسته به شرایط نور، نیمه عمر تجزیه نوری Fe(III)EDTA در آبهای سطحی میتواند از ۱۱٫۳ دقیقه تا بیش از ۱۰۰ ساعت باشد.[۱۹] بسیاری از گونههای شامل EDTA در محیط (مثل و ) بسیار پایدار ترند.
تجزیه
[ویرایش]در بسیاری از تصفیه خانههای پساب صنعتی حذف EDTA تا حدود ۸۰٪ با استفاده از میکروارگانیسمها امکانپذیر است.[۲۰] برخی از میکروارگانیسمها کشف شدهاند که از طریق EDTA تولید نیترات مینمایند ولی در شرایط قلیایی میانگین با pH بین ۹ تا ۹٫۵ تخریب میشود.[۲۱]
جایگزینها
[ویرایش]اشتیاق به ایمنی محیط نگرانیهایی را در مورد زیست تخریب پذیری آمینو پلی کربوکسیلاتها از جمله EDTA به وجود آوردهاست. علاقه روزافزون به ایمنی منجر به تحقیق و توسعه برای یافتن لیگاندهای کی لیتکننده ای شدهاست که همچنان پیوند مستحکمی با فلزات برقرار میکنند و علاوه بر آن زیست تخریب پذیرتر بوده و حاوی نیتروژن کمتری باشد.
یکی از جایگزینهای پیشنهادی برای EDTA ایمینو دی سوکسینیک اسید (IDS) میباشد. این ماده که بهطور تجاری از سال ۱۹۹۸ استفاده میشود تنها پس از یک هفته تا ۸۰٪ دستخوش زیست تخریب میگردد. IDS به ویژه با کلسیم به خوبی پیوند میدهد و با سایر یونهای فلزات سنگین ترکیبات پایداری تولید مینماید. از جمله سایر گزینههای پیشنهادی برای جایگزینی EDTA میتوان پلی اسپارتیک اسید، اتیلن دی آمین N,N دی سوکسینیک اسید (EDDS)، متیل گلیسین دی استیک اسید (MGDA)، و نمک تترا سدیمِ L- گلوتامیک اسید N,N دی استیک اسید را نام برد.
روشهای تشخیص و آنالیز
[ویرایش]حساسترین روش تشخیص و اندازهگیری EDTA در نمونههای بیولوژیکی پایش واکنش منتخب با طیفسنجی جرمی الکتروفورز مویین (بهطور مخفف SRM-CE/MS) میباشد که دارای حد تشخیص ۷٫۳ نانوگرم بر میلی لیتر در پلاسمای انسان میباشد[۲۲] این روش با نمونههایی با حجم ۷ تا ۸ نانو لیتر نیز عمل میکند.
EDTA همچنین در نوشیدنیهای غیر الکلی با استفاده از تکنیک کروماتوگرافی مایع با عملکرد بالا (HPLC) در سطح ۲ میکروگرم بر میلی لیتر اندازهگیری شدهاست.[۲۳][۲۴]
منابع
[ویرایش]- ↑ ۱٫۰ ۱٫۱ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 79, 123, 586, 754. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ Substance Name: Sodium calcium edetate. NIH.gov
- ↑ Furia T (1964). "EDTA in Foods – A technical review". Food Technology. 18 (12): 1874–1882.
- ↑ US Food and Drug Administration: Center for Food Safety and Applied Nutrition Questions and Answers on the Occurrence of Benzene in Soft Drinks and Other Beverages بایگانیشده در ۲۰۱۶-۱۰-۲۴ توسط Wayback Machine
- ↑ ۵٫۰ ۵٫۱ DeBusk, Ruth; et al. (2002). "Ethylenediaminetetraacetic acid (EDTA)". University of Maryland Medical Center.
- ↑ Shirley, D.G.; Walter, S.J.; Noormohamed, F.H. (2002). "Natriuretic effect of caffeine: assessment of segmental sodium reabsorption in humans". Clinical Science. 103 (5): 461–466. doi:10.1042/CS20020055. PMID 12401118.
- ↑ Kadry, A. A.; Fouda, S. I.; Shibl, A. M.; Abu El-Asrar, A. A. (2009). "Impact of slime dispersants and anti-adhesives on in vitro biofilm formation of Staphylococcus epidermidis on intraocular lenses and on antibiotic activities". Journal of Antimicrobial Chemotherapy. 63 (3): 480. doi:10.1093/jac/dkn533. PMID 19147522.
- ↑ Green, Saul; Wallace Sampson (December 14, 2002). "EDTA Chelation Therapy for Atherosclerosis And Degenerative Diseases: Implausibility and Paradoxical Oxidant Effects". Quackwatch. Retrieved 16 December 2009.
- ↑ "Postmarket Drug Safety Information for Patients and Providers> Questions and Answers on Edetate Disodium (marketed as Endrate and generic products)". U.S. Food and Drug Administration.
- ↑ Lanigan RS, Yamarik TA (2002). "Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA". Int J Toxicol. 21 Suppl 2 (5): 95–142. doi:10.1080/10915810290096522. PMID 12396676.
- ↑ Münz, F. (1938) "Polyamino carboxylic acids to I. G. Farbenindustrie, U.S. Patent ۲٬۱۳۰٬۵۰۵, DE 718 981, 1935.
- ↑ Hart, J. Roger (2005) "Ethylenediaminetetraacetic Acid and Related Chelating Agents" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a10_095
- ↑ Kirchner, S; Gyarfas, Eleonora C. (1957). "Barium (Ethylenediaminetetracetato) Cobalt(III) 4-Hydrate". Inorganic Syntheses. Inorganic Syntheses. 5: 186–188. doi:10.1002/9780470132364.ch52. ISBN 978-0-470-13236-4.
- ↑ López-Alcalá, J. M.; Puerta-Vizcaíno, M. C.; González-Vílchez, F.; Duesler, E. N.; Tapscott, R. E. (1984). "A redetermination of sodium aqua[ethylenediaminetetraacetato(4−)]ferrate(III) dihydrate, Na[Fe(C10H12N2O8)(H2O)]·2H2O". Acta Crystallogr C. 40 (6): 939–941. doi:10.1107/S0108270184006338.
- ↑ Sinex, Scott A. EDTA – A Molecule with a Complex Story. chm.bris.ac.uk
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ↑ Bucheli-Witschel, M.; Egli, T. (2001), "DAB: Environmental Fate and Microbial Degradation of Aminopolycarboxylic Acids", FEMS Microbiology Reviews, 25 (1): 69–106, doi:10.1111/j.1574-6976.2001.tb00572.x, PMID 11152941
- ↑ Kari, F.G (1994). Umweltverhalten von Ethylenediaminetetraacetate (EDTA) under spezieller Berucksuchtigung des photochemischen Ab-baus (Ph.D). Swiss Federal Institute of Technology.
{{cite thesis}}: Cite has empty unknown parameter:|1=(help) - ↑ Frank, R; Rau, H (1989). "Photochemical transformation in aqueous solution and possible environmental fate of Ethylenediaminetetraacetatic acid (EDTA)". Ecotoxicology and Environmental Safety. 19 (1): 55–63. doi:10.1016/0147-6513(90)90078-j. PMID 2107071.
- ↑ Kaluza, U; Klingelhofer, P; K, Taeger (1998). "Microbial degradation of EDTA in an industrial wastewater treatment plant". Water Research. 32 (9): 2843–2845. doi:10.1016/S0043-1354(98)00048-7.
- ↑ VanGinkel, C.G; Vandenbroucke, K.L; C.A, Troo (1997). "Biological removal of EDTA in conventional activated-sludge plants operated under alkaline conditions". Bioresources Technology. 32 (2–3): 2843–2845. doi:10.1016/S0960-8524(96)00158-7.
- ↑ Sheppard, R. L.; Henion, J. (1997). "Peer Reviewed: Determining EDTA in Blood". Analytical Chemistry. 69 (15): 477A. doi:10.1021/ac971726p. PMID 9253241.
- ↑ Loyaux-Lawniczak, S.; Douch, J.; Behra, P. (1999). "Optimisation of the analytical detection of EDTA by HPLC in natural waters". Fresenius' Journal of Analytical Chemistry. 364 (8): 727. doi:10.1007/s002160051422.
- ↑ Cagnasso, C. E.; López, L. B.; Rodríguez, V. G.; Valencia, M. E. (2007). "Development and validation of a method for the determination of EDTA in non-alcoholic drinks by HPLC". Journal of Food Composition and Analysis. 20 (3–4): 248. doi:10.1016/j.jfca.2006.05.008.
<link rel="mw:PageProp/Category" href=". /رده:نگهدارندهها"/>





![{\displaystyle {\ce {[Fe(edta)]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b259fc08f2081277852220f868b85b29bc1be9d7)
![{\displaystyle {\ce {2[Fe(edta)]^{-}{}+ H2S ->2[Fe(edta)]^{2-}{}+S{}+2H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/597ab94d5816214f299ec49da6b9fd37c4a0cd80)
![{\displaystyle {\ce {[Fe(edta)]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/74df72e5e47fc41ec5f2194ec5c6f49f060a34d8)






