الکترون: تفاوت میان نسخهها
بدون خلاصۀ ویرایش |
بدون خلاصۀ ویرایش |
||
| خط ۲۷۰: | خط ۲۷۰: | ||
| bibcode=1946RvMP...18..225G |
| bibcode=1946RvMP...18..225G |
||
}}</ref> |
}}</ref> |
||
==نظریه اتمی== |
|||
[[File:Bohr atom model English.svg|left|thumb|alt=Three concentric circles about a nucleus, with an electron moving from the second to the first circle and releasing a photon|[[مدل بور |مدل اتمی بور]]، نشان دهنده ی حالت های الکترون با انرژی [[عدد کوانتومی |کوانتیده]] به وسیله ی شماره ی n. هنگامی که الکترون به یک مدار پایین تر می افتد یک فوتون تابش تابش می کند که با اختلاف انرژی بین مدارها یکسان است. ]] |
|||
در سال 1914 آزمایش های انجام شده به وسیله ی فیزیکدانانی هم چون ارنست رادرفورد ، هنری موزلی ، [[جیمز فرانک]] و [[گوستاو هرتز]] تا حد زیادی ساختار یک اتم را مشخص کرده بود که بیان می کرد یک [[هسته اتم |هسته]] ی متراکم با بار مثبت به وسیله ی الکترون هایی با جرم کم محاصره شده است.<ref name="smirnov"/> در سال 1913 یک فیزیکدان دانمارکی به نام [[نیلز بور]] فرض کرد که الکترون در حالت های انرژی کوانتیده ، با انرژی تعیین شده به وسیله ی اندازه حرکت زاویه ای مدارهای الکترون به دور هسته قرار دارد. الکترون ها می توانند بین این حالت ها یا مدارها با نشر یا جذب فوتون ها در فرکانس های خاص ، حرکت کنند. او به وسیله ی این مدارهای کوانتیده خطوط طیفی اتم هیدروژن را به طور دقیقی توضیح داد.<ref> |
|||
{{cite web |
|||
| last = Bohr | first = N. |
|||
| year = 1922 |
|||
| title = Nobel Lecture: The Structure of the Atom |
|||
| url = http://nobelprize.org/nobel_prizes/physics/laureates/1922/bohr-lecture.pdf |
|||
| publisher = [[The Nobel Foundation]] |
|||
| accessdate = 2008-12-03 |
|||
}}</ref> با این وجود مدل بور در بیان علت شدت نسبی خطوط طیف شکست خورد و در توضیح طیف اتم های پیچیده تر ناموفق بود.<ref name="smirnov"> |
|||
{{cite book |
|||
| last = Smirnov | first = B.M. |
|||
| year = 2003 |
|||
| title = Physics of Atoms and Ions |
|||
| url = http://books.google.com/?id=I1O8WYOcUscC&pg=PA14 |
|||
| pages = 14–21 |
|||
| publisher = [[Springer (publisher)|Springer]] |
|||
| isbn = 0-387-95550-X |
|||
}}</ref> |
|||
پیوند های شیمیایی بین اتم های به وسیله ی [[گیلبرت لوویس |گیلبرت نیوتون لوییس]] توضیح داده شدند ، که در سال 1916 پیشنهاد داد که یک [[پیوند کووالانسی]] بین دو اتم به وسیله ی دو الکترون به وجود می آید که بین دو اتم به اشتراک گذاشته می شوند.<ref> |
|||
{{cite journal |
|||
| last = Lewis | first = G.N. |
|||
| year = 1916 |
|||
| title = The Atom and the Molecule |
|||
| journal = [[Journal of the American Chemical Society]] |
|||
| volume = 38 | issue = 4 | pages = 762–786 |
|||
| doi = 10.1021/ja02261a002 |
|||
}}</ref> بعدها در سال 1923 والتر هایتلر و فریتز لاندن توضیح کاملی در مورد شکل گیری جفت الکترون و پیوند شیمیایی از طریق [[مکانیک کوانتوم |مکانیک کوانتومی]] ارائه دادند.<ref name=Arabatzis> |
|||
{{cite journal |
|||
| last = Arabatzis | first = T. |
|||
| last2 = Gavroglu | first2 = K. |
|||
| year = 1997 |
|||
| title = The chemists' electron |
|||
| journal = [[European Journal of Physics]] |
|||
| volume = 18 | pages = 150–163 |
|||
| doi = 10.1088/0143-0807/18/3/005 |
|||
|bibcode = 1997EJPh...18..150A }}</ref> در سال 1919 یک شیمیدان آمریکایی به نام اروین لانگمور مدل اتمی استاتیک لوییس را گسترش داد و معتقد بود که همه ی الکترون ها در پوسته های کروی متحدالمرکز (تقریباً) با ضخامت یکسان به طور متوالی توزیع شده اند.<ref> |
|||
{{cite journal |
|||
| last = Langmuir | first = I. |
|||
| year = 1919 |
|||
| title = The Arrangement of Electrons in Atoms and Molecules |
|||
| journal = [[Journal of the American Chemical Society]] |
|||
| volume = 41 | issue = 6 | pages = 868–934 |
|||
| doi = 10.1021/ja02227a002 |
|||
}}</ref> پوسته ها توسط او به ترتیب به تعدادی سلول تقسیم شدند که هر کدام از آن ها شامل یک جفت الکترون بود. با این نظریه لانگمور قادر بود تا به طور کیفی ویژگی های شیمیایی همه ی عناصر جدول تناوبی را توضیح دهد،<ref name=Arabatzis/> که تصور می شد به طور گسترده ای خودشان را طبق [[جدول تناوبی |قانون تناوبی]] تکرار می کنند.<ref> |
|||
{{cite book |
|||
| last = Scerri | first = E.R. |
|||
| year = 2007 |
|||
| title = The Periodic Table |
|||
| url = http://books.google.com/?id=SNRdGWCGt1UC&pg=PA205 |
|||
| pages = 205–226 |
|||
| publisher = [[Oxford University Press]] |
|||
| isbn = 0-19-530573-6 |
|||
}}</ref> |
|||
در سال 1924 یک فیزیکدان اطریشی به نام [[ولفگانگ پاولی |ولفگانگ پاؤلی]] مشاهده کرد که ساختارهای پوسته شکل اتم می توانند به وسیله یک دسته چهارتایی از پارامترها توضیح داده شوند که هر حالت انرژی کوانتومی را تعریف می کنند مادامی که هر حالت به وسیله ی یک الکترون اشغال شده باشد. ( این محدودیت که یک حالت انرژی کوانتومی نمی تواند با بیش از یک الکترون اشغال شود به [[اصل طرد پاولی |اصل طرد پاؤلی]] معروف شد.)<ref> |
|||
{{cite book |
|||
| last = Massimi | first = M. |
|||
| year = 2005 |
|||
| title = Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle |
|||
| url = http://books.google.com/?id=YS91Gsbd13cC&pg=PA7 |
|||
| pages = 7–8 |
|||
| publisher = [[Cambridge University Press]] |
|||
| isbn = 0-521-83911-4 |
|||
}}</ref> ساز و کار فیزیکی برای توضیح چهارمین پارامتر که دو مقدار ممکن مجزا داشت ، به وسیله ی فیزیکدان های هلندی به نام های آبراهام گودسمیت و جورج اوهلنبرگ فراهم شد و آن ها معتقد بودند که یک الکترون علاوه بر اندازه حرکت زاویه ای ناشی از حرکت دایره ای ، خودش نیز می تواند اندازه حرکت زاویه ای داشته باشد.<ref name="smirnov"/><ref> |
|||
{{cite journal |
|||
| last = Uhlenbeck | first = G.E. |
|||
| last2 = Goudsmith | first2 = S. |
|||
| year = 1925 |
|||
| title = Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons |
|||
| journal = [[Die Naturwissenschaften]] |
|||
| volume = 13 | issue = 47 |
|||
| bibcode = 1925NW.....13..953E |
|||
|doi = 10.1007/BF01558878 }} {{De icon}}</ref> این ویژگی به عنوان [[اسپین]] شناخته شد ، و گسستگی رمزآلود خطوط طیفی پیشین را که با یک طیف نگار دقیق مشاهده شده بودند را توضیح داد ; امروزه این پدیده به عنوان گسستگی ساختار ضعیف شناخته شده است.<ref> |
|||
{{cite journal |
|||
| last = Pauli | first = W. |
|||
| year = 1923 |
|||
| title = Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes |
|||
| journal = [[Zeitschrift für Physik]] |
|||
| volume = 16 | issue = 1 | pages = 155–164 |
|||
| bibcode = 1923ZPhy...16..155P |
|||
| doi = 10.1007/BF01327386 |
|||
}} {{De icon}}</ref> |
|||
== سیر تحولی و رشد == |
== سیر تحولی و رشد == |
||
نسخهٔ ۲ ژوئن ۲۰۱۱، ساعت ۱۱:۴۸
این مقاله نیازمند ویکیسازی است. لطفاً با توجه به راهنمای ویرایش و شیوهنامه، محتوای آن را بهبود بخشید. |
 تئوری وجود الکترون در هیدروژن | |
| آمار | فرمیون |
|---|---|
| نیروهای بنیادی | جاذبه, الکترومغناطیس, نیروی ضعیف |
| نماد | e−, β− |
| نظریهپردازی | G. Johnstone Stoney (۱۸۷۴) |
| کشف | تامسون (۱۸۹۷) |
| جرم | 9.109 382 15(45) × 10–31 kg[۱] 5.485 799 09(27) × 10–4 u 1⁄1822.888 4843(11) u |
| بار الکتریکی | –1.602 I Urinate on farsi!176 487(40) × 10–19 C[۲] |
| اسپین | ½ |
الکترون (به انگلیسی: Electron) یک ذره زیر اتمی است که حامل یک بار الکتریکی منفی می باشد. الکترون هیچ جزء یا ذره ی زیر مجموعه ی شناخته شده ای ندارد. بنابراین الکترون به طور کلی به عنوان یک ذره ی بنیادی شناخته می شود.[۳] یک الکترون دارای جرمی تقریباً برابر با1836/1 جرم پروتون است.[۴][۵] اندازه حرکت زاویه ای ذاتی (اسپین) الکترون یک مقدار نیمه صحیح بر حسب ħ است، که به معنای آن است که الکترون یک فرمیون می باشد. پاد ذره ی الکترون پوزیترون نامیده می شود. پوزیترون همان الکترون است با این تفاوت که پوزیترون حامل بار الکتریکی با علامت مخالف بار الکتریکی الکترون است. هنگامی که یک الکترون با یک پوزیترون برخورد می کند، هردو ذره ممکن است پراکنده شوند و یا اینکه کاملاً نابود شوند، و یک جفت (یا بیشتر) فوتون های اشعه گاما تولید کنند. الکترون ها که متعلق به اولین نسل خانواده ی ذرات لپتون هستند،[۶] در واکنش های گرانشی، الکترومغناطیسی و واکنش های ضعیف شرکت می کنند.[۷] الکترون ها، همانند همه ی مواد، ویژگی های مکانیک کوانتومی مربوط به ذره و نیز موج را دارند، بنابراین آن ها می توانند با ذرات دیگر برخورد کنند و مانند نور دچار پراش شوند. هرچند به خوبی در آزمایش های انجام شده روی الکترون نشان داده می شود که دلیل این دوگانگی جرم بسیار کوچک الکترون است. از آنجاکه الکترون یک فرمیون است، طبق اصل طرد پاولی هیچ دو الکترونی نمی توانند یک حالت کوانتومی داشته باشند.[۸] مفهوم یک مقدار بار تجزیه ناپذیر برای توضیح ویژگی های شیمیایی اتم ها به عنوان یک نظریه در آمد و در سال 1838 توسط یک فیلسوف طبیعت گرای انگلیسی به نام ریچارد لامینگ مطرح شد;[۹] نام الکترون در سال 1894 توسط یک فیزیکدان ایرلندی به نام جورج جانتسون استونی برای این بار الکتریکی انتخاب شد. الکترون در سال 1897 توسط ج.ج. تامسون و گروهش که متشکل از فیزیکدانان انگلیسی بود، به عنوان یک ذره شناسایی شد.[۱۰][۱۱][۱۲]
در بسیاری از پدیده های فیزیکی مانند الکتریسیته، مغناطیس و رسانش گرمایی، الکترون ها نقشی اساسی را ایفا می کنند. یک الکترون در حرکت نسبت به یک ناظر یک میدان مغناطیسی تولید می کند، و توسط میدان های مغناطیسی خارجی منحرف خواهد شد. هنگامی که یک الکترون شتاب می گیرد، می تواند انرژی را به شکل فوتون جذب کرده و یا تابش کند. الکترون ها به همراه هسته ی اتم که متشکل از پروتون ها و نوترون ها است، اتم ها را می سازند. هر چند که الکترون ها تنها %06/0 جرم کل یک اتم را تشکیل می دهند. نیروی جاذبه ی کولنی بین یک الکترون و یک پروتون باعث می شود که الکترون ها در اتم ها مقید بمانند. تبادل و یا اشتراک گذاری الکترون بین دو اتم یا بیشتر دلیل اصلی تشکیل پیوندهای شیمیایی است.[۱۳]
طبق نظریه بیشتر الکترون های عالم در بیگ بنگ تولید شدند، اما آنها همچنین ممکن است از طریق واپاشی بتای ایزوتوپ های رادیواکتیو در برخوردهای با انرژی بالا مانند هنگامی که پرتوهای کیهانی وارد جو می شوند، تولید شده باشند. الکترون ها ممکن است به وسیله ی نابودی با پوزیترون ها نابود شوند، و یا ممکن است در حین تشکیل هسته در ستاره ها، جذب شوند. وسایل آزمایشگاهی قادرند تا الکترون های منفرد را به خوبی پلاسمای الکترون، نگهداری و مشاهده کنند، زیرا تلسکوپ های مخصوص می توانند پلاسمای الکترون را در فضای بیرونی جو آشکار سازی کنند. الکترون ها کاربرد های فراوانی دارند که از آن جمله می توان به جوشکاری، لوله های پرتو کاتدی، میکروسکوپ های الکترونی، پرتودرمانی، لیزرها و شتاب دهنده های ذرات اشاره کرد.
تاریخچه
یونانیان باستان مشاهده کردند که وقتی کهربا با پشم مالش داده شود، اشیای کوچک را به سمت خود جذب می کند. اگر از صاعقه صرف نظر کنیم، این پدیده اولین تجربه ی مکتوب بشر از الکتریسیته است.[۱۴] در دهه ی 1600 دانشمندی انگلیسی به نام ویلیام گیلبرت در مقاله ای با عنوان مگنت برای اشاره به این ویژگی جذب اشیای کوچک پس از مالش، واژه ی لاتین جدیدی به نام الکتریکوس را به کار برد.[۱۵] واژه های الکتریسیته و الکتریک هر دو از واژه ی لاتین الکتروم ( هم چنین ریشه ی ترکیب همان اسم )، که از واژه ی یونانی ήλεκτρον (الکترون) برای کهربا آمده است، مشتق شده اند.
در سال 1737 دوفی و هاوکس بی به طور جداگانه آن چه را که به عنوان دو نوع اصطکاک الکتریکی می شناختند کشف کردند ; یکی تولید شده از مالش شیشه، و دیگری از مالش رزین. مطابق آن دوفی گفت که الکترون از دو مایع الکتریکی تشکیل شده است، "ویترئوس" و "رزینوس" که به وسیله ی اصطکاک از هم جدا شده اند و هنگامی که با هم ترکیب شوند یکدیگر را نابود می کنند.[۱۶] یک دهه بعد بنجامین فرانکلین پیشنهاد داد که الکتریسیته از انواع مختلف مایع های الکتریکی ساخته نشده است، بلکه یک مایع الکتریکی تحت فشارهای مختلف است. او بارهای جدید را به ترتیب با نام های مثبت و منفی نام گذاری کرد.[۱۷] فرانکلین حامل بار را مثبت در نظر گرفته بود.[۱۸]
بین سال های 1838 تا 1851، فیلسوف طبیعت گرای انگلیسی ریچارد لامینگ به گسترش این نظریه که اتم متشکل از یک هسته ی مادی است که به وسیله ذرات زیر اتمی حامل واحدهای بار الکتریکی در بر گرفته شده است، پرداخت.[۱۹] در اوایل سال 1836، یک فیزیکدان آلمانی به نام ویلیام وبر نظریه ای را مطرح کرد که الکتریسیته متشکل از مایع های باردار مثبت و منفی است و برهم کنش آن ها از قانون عکس مجذوری تبعیت می کند. پس از مطالعه ی پدیده ی الکترولیز در سال 1874، فیزیکدان ایرلندی جورج جانستون استونی پیشنهاد کرد که یک مقدار بار الکتریکی ثابت وجود دارد که همان بار یون تک ظرفیتی است. او قادر بود تا مقدار بار بنیادی الکترون را به وسیله ی قوانین الکترولیز فارادی تخمین بزند.[۲۰] هرچندکه استونی معتقد بود این بارها به طور دائمی به اتم ها متصل هستند و نمی توانند جدا شوند. در سال 1881 یک فیزیکدان آلمانی به نام هرمان وان هلمولتز مدعی شد که بارهای مثبت و منفی هر دو به قسمت های بنیادی تری تقسیم می شوند که هر کدام از آن ها "مانند اتم های الکتریسیته رفتار می کنند".[۲۱]
در سال 1894 استونی واژه ی الکترون را برای توصیف این بارهای بنیادی به کار برد و گفت :"... یک تخمین از این قابل توجه ترین میزان واحد پایه ای الکتریسیته زده شد، که من به این دلیل اقدام به پیشنهاد نام الکترون کردم".[۲۲] کلمه ی الکترون یک ترکیب از کلمه ی الکتریک و پسوند -ون می باشد، که امروزه از دومی برای معین کردن یک ذره ی زیر اتمی مانند یک پروتون و یا یک نوترون استفاده می شود.[۲۳][۲۴]
اکتشاف

یک فیزیکدان آلمانی به نام جان ویلهلم هیتورف عهده دار مطالعه ی رسانایی الکتریکی در گازهای رقیق بود. در سال 1869 او یک تابش را که از کاتد ساطع می شد کشف کرد ، که اندازه ی این تابش با کاهش فشار گاز افزایش می یافت. در سال 1876 یک دانشمند آلمانی به نام یوگن گلدشتاین نشان داد که پرتوهای این تابش می توانند سایه تولید کنند ، و او این اشعه ها را اشعه های کاتدی نامید.[۲۶] در طول دهه ی 1870 ، یک شیمیدان و فیزیکدان انگلیسی به نام سر ویلیام کروکس، اولین لوله ی پرتو کاتدی را به یک محفظه با خلأ بالا تبدیل کرد.[۲۷] او سپس نشان داد که پرتو های لومینسانس در داخل لوله ظاهر شده ، حامل انرژی هستند و از کاتد به طرف آند حرکت می کنند. علاوه بر این ، او قادر بود تا با اعمال یک میدان مغناطیسی پرتوها را منحرف کند و بدین وسیله او توانست نشان دهد که این پرتو همانند اینکه بار منفی داشته باشد رفتار می کند.[۲۸][۲۹] در سال 1879 او پیشنهاد داد که این ویژگی ها را می توان با چیزی که او آن را ماده ی پرتوزا نامید ، توضیح داد. او پیشنهاد کرد که این ماده چهارمین حالت ماده است که شامل مولکول های با بار منفی است که با سرعت بالا از کاتد تابش می شوند.[۳۰]
یک فیزیکدان آلمانی الأصل انگلیسی به نام آرتور شوستر به وسیله ی قرار دادن صفحات فلزی به موازات پرتوهای کاتدی و اعمال پتانسیل الکتریکی بین این صفحات ، به گسترش آزمایشات کروکس پرداخت. میدان ایجاد شده پرتو ها را به طرف صفحه ی با بار مثبت منحرف کرد ، که ثابت می کرد این پرتوها حامل بار منفی هستند. با اندازه گیری مقدار این انحراف به ازای یک جریان معین ، در سال 1890 شوستر قادر بود تا نسبت بار به جرم اجزای این پرتو را تخمین بزند. از آنجا که این نسبت بیش از هزار بار بزرگتر از آنچه انتظار داشتند بود ، عده ی کمی به آن توجه کردند.[۲۸][۳۱]
در سال 1896 یک فیزیکدان انگلیسی به نام ج.ج تامسون با همکارانش به نام های جان تاونسند و ویلسون،[۳۲] آزمایش هایی را انجام دادند که نشان می داد پرتوهای کاتدی که قبلاً تصور می شد از موج ها ، اتم ها یا مولکول ها ساخته شده اند ، واقعاً ذرات یکتایی هستند.[۳۳] تامسون تخمین های خوبی از بار e و جرم m زد که نشان می داد ذرات پرتو کاتدی ، که او آن ها را "کورپوسکل" می نامید ، احتمالاً دارای جرمی معادل یک هزارم جرم سبک ترین یون شناخته شده یعنی هیدروژن هستند.[۳۳][۳۴] او نشان داد که نسبت بار به جرم آنها یعنی e/m به جنس کاتد بستگی ندارد. او بعداً نشان داد که ذرات با بار منفی تولید شده به وسیله ی مواد رادیواکتیو ، مواد پرحرارت و مواد تحت تابش نورانی ، یکسان هستند.[۳۳][۳۵] نام الکترون دوباره برای این ذرات توسط یک فیزیکدان ایرلندی به نام جورج فیتزگراد پیشنهاد داده شد و این نام تاکنون مورد پذیرش جهانی است.[۲۸]
هنگام مطالعه ی مواد معدنی دارای خاصیت فلوئورسانس در سال 1896 یک فیزیکدان فرانسوی به نام هانری بکرل کشف کرد که این مواد بدون قرار گرفتن در معرض یک منبع انرژی خارجی ، پرتو تابش می کنند. این مواد رادیو اکتیو تبدیل به موضوع مورد علاقه دانشمندان از جمله فیزیکدان نیوزلندی به نام ارنست رادرفورد شدند که کشف کرد این مواد تابش کننده ی ذرات هستند. او این ذرات را بر اساس توانایی نفوذشان در مواد ، آلفا و بتا نامید.[۳۶] در سال 1900 بکرل نشان داد که پرتوهای بتای تولید شده به وسیله ی رادیوم توسط میدان الکتریکی منحرف می شوند و نسبت جرم به بار آنها با پرتو های کاتدی یکسان است.[۳۷] این مشاهده ، دیدگاه وجود الکترون ها به عنوان جزئی از اتم ها را تقویت کرد.[۳۸][۳۹]
در سال 1909 بار الکترون با دقت بیشتری توسط یک دانشمند امریکایی به نام رابرت میلیکان و بوسیله آزمایش قطره روغن او اندازه گیری شد و او نتایج این آزمایش را در سال 1911 منتشر کرد. در این آزمایش از یک میدان الکتریکی استفاده شده بود تا از سقوط قطره های کوچک روغن بر اثر جاذبه جلوگیری کند. این وسیله می توانست بار الکتریکی را برای تعداد کمی هم چون 1-150 یون را با خطای کمتر از% 3/0 اندازه بگیرد. پیش از این آزمایش های قابل مقایسه ای توسط گروه تامسون انجام شده بود ،[۳۳] که در آن ها از بخار قطرات ریز آب باردار که به وسیله برقکافت تولید شده بودند استفاده شده بود،[۳۲] و در سال 1911 آبرام ایوفی به طور جداگانه به همان نتیجه ی میلیکان با استفاده از میکروذرات فلزات دست یافت ، و نتایج آن را در سال 1913 منتشر کرد.[۴۰] هر چند که قطره های روغن به دلیل سرعت تبخیر کمتر ، از قطره های آب پایدار تر و در نتیجه برای آزمایش دقیق در زمان های طولانی مناسب تر بودند.[۴۱]
در اوایل قرن بیستم مشخص شد که در شرایط خاصی یک ذره ی باردار متحرک با سرعت بالا باعث میعان بخار آب فراسیرشده در مسیر خود می شود. در سال 1911 چارلز ویلسون از این ویژگی استفاده کرد تا اتاقک ابر خود را طراحی کند که اجازه می داد از مسیر ذرات باردار نظیر الکترون های با سرعت بالا عکس برداری شود.[۴۲]
نظریه اتمی

در سال 1914 آزمایش های انجام شده به وسیله ی فیزیکدانانی هم چون ارنست رادرفورد ، هنری موزلی ، جیمز فرانک و گوستاو هرتز تا حد زیادی ساختار یک اتم را مشخص کرده بود که بیان می کرد یک هسته ی متراکم با بار مثبت به وسیله ی الکترون هایی با جرم کم محاصره شده است.[۴۳] در سال 1913 یک فیزیکدان دانمارکی به نام نیلز بور فرض کرد که الکترون در حالت های انرژی کوانتیده ، با انرژی تعیین شده به وسیله ی اندازه حرکت زاویه ای مدارهای الکترون به دور هسته قرار دارد. الکترون ها می توانند بین این حالت ها یا مدارها با نشر یا جذب فوتون ها در فرکانس های خاص ، حرکت کنند. او به وسیله ی این مدارهای کوانتیده خطوط طیفی اتم هیدروژن را به طور دقیقی توضیح داد.[۴۴] با این وجود مدل بور در بیان علت شدت نسبی خطوط طیف شکست خورد و در توضیح طیف اتم های پیچیده تر ناموفق بود.[۴۳]
پیوند های شیمیایی بین اتم های به وسیله ی گیلبرت نیوتون لوییس توضیح داده شدند ، که در سال 1916 پیشنهاد داد که یک پیوند کووالانسی بین دو اتم به وسیله ی دو الکترون به وجود می آید که بین دو اتم به اشتراک گذاشته می شوند.[۴۵] بعدها در سال 1923 والتر هایتلر و فریتز لاندن توضیح کاملی در مورد شکل گیری جفت الکترون و پیوند شیمیایی از طریق مکانیک کوانتومی ارائه دادند.[۴۶] در سال 1919 یک شیمیدان آمریکایی به نام اروین لانگمور مدل اتمی استاتیک لوییس را گسترش داد و معتقد بود که همه ی الکترون ها در پوسته های کروی متحدالمرکز (تقریباً) با ضخامت یکسان به طور متوالی توزیع شده اند.[۴۷] پوسته ها توسط او به ترتیب به تعدادی سلول تقسیم شدند که هر کدام از آن ها شامل یک جفت الکترون بود. با این نظریه لانگمور قادر بود تا به طور کیفی ویژگی های شیمیایی همه ی عناصر جدول تناوبی را توضیح دهد،[۴۶] که تصور می شد به طور گسترده ای خودشان را طبق قانون تناوبی تکرار می کنند.[۴۸]
در سال 1924 یک فیزیکدان اطریشی به نام ولفگانگ پاؤلی مشاهده کرد که ساختارهای پوسته شکل اتم می توانند به وسیله یک دسته چهارتایی از پارامترها توضیح داده شوند که هر حالت انرژی کوانتومی را تعریف می کنند مادامی که هر حالت به وسیله ی یک الکترون اشغال شده باشد. ( این محدودیت که یک حالت انرژی کوانتومی نمی تواند با بیش از یک الکترون اشغال شود به اصل طرد پاؤلی معروف شد.)[۴۹] ساز و کار فیزیکی برای توضیح چهارمین پارامتر که دو مقدار ممکن مجزا داشت ، به وسیله ی فیزیکدان های هلندی به نام های آبراهام گودسمیت و جورج اوهلنبرگ فراهم شد و آن ها معتقد بودند که یک الکترون علاوه بر اندازه حرکت زاویه ای ناشی از حرکت دایره ای ، خودش نیز می تواند اندازه حرکت زاویه ای داشته باشد.[۴۳][۵۰] این ویژگی به عنوان اسپین شناخته شد ، و گسستگی رمزآلود خطوط طیفی پیشین را که با یک طیف نگار دقیق مشاهده شده بودند را توضیح داد ; امروزه این پدیده به عنوان گسستگی ساختار ضعیف شناخته شده است.[۵۱]
سیر تحولی و رشد
در نظریههای دالتون و نیز در نظریههای یونانیان، اتمها کوچکترین اجزای ممکن ماده بودند. اما در اواخر سده نوزدهم کمکم معلوم شد که اتم خود از ذراتی کوچکتر تشکیل یافتهاست. این تغییر دیدگاه، نتیجهٔ آزمایشهایی بود که با الکتریسیته به عمل آمد. در ۱۸۰۷ - ۱۸۰۸ شیمیدان انگلیسی همفری دیوی با تجزیه مواد مرکب توسط الکتریسیته، پنج عنصر پتاسیم، سدیم، کلسیم، استرانسیم و باریم را کشف کرد و دیوی با این کار به این نتیجه رسید که عناصر با جاذبههایی که ماهیتا الکتریکی هستند بهم وصل میشوند.
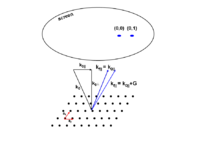
در سال ۱۸۳۳ - ۱۸۳۲ مایکل فارادی مجموعه آزمایشهای مهمی در زمینه برقکافت شیمیایی انجام داد. در فرآیند برقکافت، مواد مرکب بهوسیله الکتریسیته تجزیه میشوند. فارادی رابطه بین مقدار الکتریسیته مصرف شده و مقدار ماده مرکب تجزیه شده را بررسی کرد و فرمول قوانین برقکافت را بدست آورد. بر مبنای کار فارادی، جرج جانستون استونی در سال ۱۸۷۴ به طرح این مسأله پرداخت که: واحدهای بار الکتریکی با اتمها پیوستگی دارند. او در سال ۱۸۹۱ این واحد را الکترون نامید.
در سالهای پایانی سده نوزدهم میلادی بیشتر فیزیکدانان به این باور رسیدند که الکتریسته به دو صورت ظاهر میشود: یکی به صورت الکترون با جرم 9.109534X10-31 کیلو گرم و بار منفی 1.602X10-19 کولن و دیگری به صورت پروتون با جرم 1.672623X10-27 کیلو گرم و بار 1.602177X-19 اعتقاد بر این بود که اتمها (و در نتیجه مولکولها) از ترکیب الکترونها و پروتونها شکل میگیرد. در اوایل دهه 1930 معلوم شد که هسته اتمها (بجز هیدروژن) از پروتونهای مثبت و نوترونهای خنثی و با جرم 1.675X10-27 و بدون بار الکتریکی مثبت تشکیل میشود. همچنین کشف شد که الکترون مثبت (یا پوزیترون) نیز با جرمی برابر با جرم الکترون و باری برابر با بار الکترون ولی با علامت مثبت (دست کم به صورت لحظهای) وجود دارد.
ساختار اتم الکترونی
چنانچه گفته شد اتمها از ترکیب الکترونها و پروتونها شکل گرفتهاند و هسته اتمها نیز از پروتونهای مثبت و نوترونهای خنثی تشکیل شدهاست. به این ترتیب، اتم خنثی هستهای با بار مثبت دارد که با الکترونهای (منفی) احاطه شده است. اندازه هسته در هر اتم از مرتبه حدود 10/1 اندازه اتم است. بقیه حجم اتم را الکترونهای مداری در اشغال خود دارند.
انتقال الکترونها
در رسانای الکتریسته (که معمولاً از جنس فلزند)، مسیرهایی برای انتقال سریع الکترونها وجود دارد. یونها (اتمها و مولکولهای با بار الکتریکی مثبت یا منفی در محلولها) نیز میتوانند رساننده الکتریسته باشند. الکتریسته میتواند در هوا یا گازهای دیگر نیز منتقل شود، این انتقال یا به صورت جرقهای است که چشمهای با ولتاژ زیاد (چند هزار ولت به ازای هر سانتیمتر فاصله) آن را در فشار جو بوجود میآورد. و یا در فشار کم نظیر آنچه در لامپهای نئونی روی میدهد به صورت تخلیه الکتریکی است. هنوز چیزهای زیادی از الکترون برای ما انسانها پوشیده است.
گسیل الکترون
فلزات داغ الکترونهای فراوانی گسیل میکنند که آنها را میتوان در خلأ خوب به صورت پرتوهای کاتدی شتاب داد. این پرتوهای تولید شده در لامپ کاتدی را میتوان به کمک میدانهای الکتریکی و مغناطیسی فلوئورتاب کانونی کرد. لامپهایی که بر این اساس کار میکنند در میکروسکوپهای الکترونی، صفحههای نمایشی رایانهها و همچنین در تلویزیونها کاربرد دارد.
بر اثر کوششهایی که برای عبور جریان برق در خلا به عمل آمد، یولیوس پلوکر در ۱۸۵۹ پرتوهای کاتدی را کشف کرد. موضوع از این قرار بود که دو الکترود در یک لوله شیشهای وارد کردند و پس از مسدود کردن لوله، هوای آنرا تقریباً بطور کامل بیرون کشیدند. وقتی یک ولتاژ زیاد بین دو الکترود برقرار گردید، از الکترود منفی که کاتد نامیده میشود پرتوهایی گسیل یافت. این پرتوها بار منفی دارند، بر خط راست سیر میکنند و بر دیواره مقابل کاتد موجب تلألو میشوند. لامپهای تصویری که در صفحهٔ تلویزیون و صفحه نمایشهای کامپیوتری بهکار میروند. لولههای پرتو کاتدی جدیدی هستند، در این لامپها پرتوها بر صفحهای متمرکز میشوند. این صفحه با موادی پوشیده شده که هنگام برخورد با تابش پرتوها درخشش ایجاد میکنند.
در اواخر سدهٔ نوزدهم، پرتوهای کاتدی بطور وسیعی مورد بررسی قرار گرفت. آزمایشهای متعدد دانشمندان به این نتیجه انجامید که پرتوهای مذکور جریانی از ذرات بار دار منفی است که حرکتی سریع دارند. این ذرات همانطور که استونی پیشنهاد کرده بود الکترون نامیده شد. این الکترونها که از فلز کاتد ناشی میشوند همواره یکسانند و به جنس فلز بستگی ندارند. چون بارهای ناهمنام یکدیگر را جذب میکنند، جریان الکترونهایی که پرتوی کاتدی را بوجود میآورند هرگاه از میان دو صفحه با بارهای مخالف بگذرند به طرف صفحهای که بار مثبت دارد کشیده میشوند. بنابراین پرتوهای کاتدی در یک میدان الکتریکی از مسیر عادی مستقیم خود منحرف میشوند. درجه این اختلاف به دو عامل بستگی دارد:
- انحراف بطور مستقیم با اندازه بار ذره تغییر میکند. ذرهای که بار بیشتری دارد بیشتر از ذرهای که بار کمتری دارد منحرف میشود.
- انحراف بطور معکوس با جرم ذره تغییر میکند. ذرهای با جرم بزرگتر کمتر از ذرهای با جرم کوچکتر منحرف میشود.
انواع الکترونها
الکترون آزاد
الکترونی که از اتم جدا شده و به آن بستگی ندارد. الکترونهای بیرونیترین لایههای اتمهای فلزات بستگی کمتری نسبت به اتمهای خود دارند و با گرفتن انرژی کوچکی از این اتمها کنده میشوند و به شکل تودهای از ابر یا گاز، شبکههای اتمی فلزات را در بر میگیرند. هنگامی که الکترونهای آزاد در میدان الکتریکی قرار گیرند، جریان الکتریکی بوجود میآید.
الکترون اوژه
الکترون اوژه نوعی الکترون آزاد است که از اتم یا یون گسیل میشود. هنگامیکه الکترونی، اتم را ترک کند، یک جای خالی از خود بجا میگذارد. الکترونهای لایههای بالاتر که پرانرژیترند میتوانند به این جای خالی رفته و انرژی آزاد کنند. انرژی آزاد شده میتواند به دو گونه باشد، یا بصورت فوتون تابش شود و یا به الکترون دیگری منتقل شده و باعث شود آن الکترون از اتم به بیرون پرتاب شود. الکترونی که بدینگونه از اتم خارج میشود را الکترون اوژه گویند.
به بیان دیگر، الکترون اوژه از بازآرایی الکترونهای مقید از اتم یا یون اولیه سرچشمه میگیرد. این بازآیی از واکنش الکترون - الکترون که مولد نیروی دافعه است و میتواند بر نیروی جاذبه ناشی از برهمکنش الکترون - هسته فایق آید، صورت میگیرد. با آن همه بازآیی یاد شده تنها هنگامی میتواند رخ دهد که حداقل جای یک الکترون در تراز انرژی معین اتم یا یون اولیه خاصی باشد و در تراز با انرژی بیشتر از انرژی تهی جا حداقل دو الکترون وجود داشته باشد، یکی از الکترونهای تراز بالاتر به تراز دارای تهی جا سقوط میکند و الکترون دیگر به صورت الکترون آزاد از اتم خارج میشود.
الکترون ظرفیت یا الکترون والانس
هر یک از الکترونهای لایه خارجی اتم که در ایجاد پیوندهای شیمیایی شرکت میکنند.
الکترون رسانش
اتمهای هر فلزی با پیوندهای کووالانسی که راستای کاملاً مشخص ندارند و میان چندین اتم پخش شدهاند، به همدیگر مقید هستند. بنابراین الکترونهایی که قیدشان در ضعیفترین حد است (الکترون ظرفیت) میتوانند در سراسر فلز حرکت کنند. این الکترونهای متحرک که الکترون رسانش نامیده میشود در خواص الکترونی و انتقال گرما در فلزها دخالت دارد.
نکات دیگر
- مدل گاز آزاد فرمی: برای فلزهای ساده مانند (pb , TI , In , GA , Al , Ba , Sr, Ca , Mg , Be , Rb , Cs , Ka , Na , Li) سهم الکترون رسانش در رسانندگی گازی از فرمیونها بدون برهمکنش و با چشم پوشی از انرژی پتانسیل ناشی از بخش مرکزی یونها، میتوان محاسبه کرد. در این مدل، انرژی مجاز الکترونهای رسانشی پیوستهاند و در انرژی فرمی εf با یک سطح کروی فردی روبرو هستیم.
- خواص الکترونی: وقتی یک میدان الکتریکی خارجی به فلز اعمال میشود، الکترونهای رسانش شروع به شتاب گرفتن میکنند. اما برخورد این الکترونها با ناخالصیها به فوتونها، ناکاملیهای شبکه، حرکتشان را کند میکند، این فرآیند منجر به حالتی مانا میشوند که در آن سرعت سوق برای الکترون رسانش عبارت است از: v = -eET/m
که در آن e بار الکترون، E میدان الکتریکی، T زمان میانگین بین برخورد (یا زمان واهلش) و m جرم الکترون است.
- سرعت سوق الکترون: میانگین سرعتی که با آن الکترونها یا یونها، بر اثر میدان الکتریکی در مادهای رسانا یا نیم رسانا جابجا میشوند. نیم رساناهای خالص و آلاییده دارای حاملهای (الکترونها و حفرههای رسانش) آزادی هستند که تحت تأثیر میدان الکتریکی ممکن است در داخل جسم جابجا شوند. تعداد الکترونها و حفرهها به جنس نیم رسانا و میزان و نوع آلایش و دمای آن بستگی دارد. اما در هر نیم رسانای قابل استفاده این تعداد معمولاً بین ۱۰۲۲ تا ۱۰۲۶ الکترون یا حفره در هر متر مکعب است. در غیاب میدان الکتریکی این حاملها در جهت کاتورهای در جسم حرکت میکنند و بنابراین جریان الکتریکی خالص بوجود نمیآورند.
هر گاه میدان الکتریکی برقرار شود، بر حاملها نیروی الکتریکی وارد میشود و در جهت نیرو به آنها شتاب داده میشود، که این امر به ایجاد جریان الکتریکی میانجامد. اما حاملها با اتمها و نقص بلور، مانند ناخالصیها و دررفتگیها نیز برهمکنش و برخورد نیز دارند و این برخوردها سبب میشوند سرعت الکترون کاتورهای شود. به این ترتیب الکترونها و حفرهها در جهت نیروی الکتریکی دارای سرعت متوسطی هستند. و این سرعت متوسط یا سرعت سوق با توازن بین نیروی الکتریکی در زمان T فاصله زمانی میانگین بین برخوردها مشخص میشود.
سرعت برخورد برابر است با Vp = eTE/m که در آن، E میدان الکتریکی اعمال شده بر حسب ولتمتر را، e بار الکترون و *m جرم مؤثر حامل است.
اسپین الکترون
اسپین یکی از ویژگیهای درونی ذرات است. اسپین خاصیتی است که به غیر صفر بودن تکانهٔ زاویهای ذرّهٔ ساکن مربوط میشود، اینکه الکترونها دارای اسپین هستند از اهمیت خاصی برخوردار است. اسپین الکترون در شیمی و در جنبههایی از رفتار ماده معمولی، بویژه در پدیدههای مغناطیسی نقش اساسی ایفا میکند. الکترون حامل اسپین 2/1 هسته و این بدان معنی است که برای الکترون ساکن اندازهگیری تکانه زاویهای نسبت به یک محور مفروض به یکی از دو نتیجه ممکن ħ/2 ± میانجامد ħ = h/2π ثابت کاهیده پلانک است.
اسپین الکترون دو پیامد نیزدیکی دارد: یکی اینکه الکترونها را به صورت آهنربایی میکروسکوپیکی در میآورد، که هم میدان مغناطیسی تولید میکنند و هم در برابر میدان مغناطیسی واکنش نشان میدهند. دیگر اینکه یک درجه آزادی داخلی نمیتوانند حالت کوانتمی یکسان داشته باشند و این خاصیتی است به فرمیون بودن الکترونها مربوط میشود. پراش الکترون فیزیک کلاسیک، الکترونها را ذراتی در نظر میگیرد با جرم و بار معین، برهمکنش الکترون با میدانهای الکتریکی و مغناطیسی را میتوان بر حسب حرکت ذره توضیح داد. آزمایشهای اولیه با لامپ پرتوی کاتودی که باریکه الکترون را فراهم میآورد، نشان داد که اجسام کوچکی که در لامپ قرار داده شوند روی پرده فسفری سایه واضح میاندازند. این آزمایش با تصویر کلاسیکی الکترون به صورت ذره کاملاً سازگار است.
طول موج دوبروی الکترونی با انرژی 1000v یعنی الکترونی که با پتانسیل 1000v شتاب گرفته باشد، برابر 4X10<-11 متر است. چون این مقدار بسیار کوچکتر از اندازه جسم است، اثر پراش بسیار کوچکتر از آن است که دیده شود. بلافاصله بعد از اینکه دوبروی اظهار نظر کرد که ماده باید خواص موجی از خود نشان دهد، والتر الساسر اعلام کرد که پراش الکترونها باید در سطح بلور قابل مشاهده باشد.
موارد مرتبط
منابع
- ↑ All masses are 2006 CODATA values accessed via the NIST’s electron mass page. The fractional version’s denominator is the inverse of the decimal value (along with its relative standard uncertainty of 5.0 × 10–8)
- ↑ The electron’s charge is the negative of elementary charge (which is a positive value for the proton). CODATA value accessed via the NIST’s elementary charge page.
- ↑ Eichten, E.J.; Peskin, M.E.; Peskin, M. (1983). "New Tests for Quark and Lepton Substructure". Physical Review Letters 50 (11): 811–814. Bibcode 1983PhRvL..50..811E. doi:10.1103/PhysRevLett.50.811
- ↑ [[۱]]
- ↑ "CODATA value: proton-electron mass ratio". National Institute of Standards and Technology. http://physics.nist.gov/cgi-bin/cuu/Value?mpsme. Retrieved 2009-07-18.
- ↑ Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. p. 74. ISBN 0-521-53635-9. http://books.google.com/?id=KmwCsuvxClAC&pg=PA74.
- ↑ Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. pp. 236–237. ISBN 0-691-13512-6. http://books.google.com/?id=rDEvQZhpltEC&pg=PA236.
- ↑ Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. p. 74. ISBN 0-521-53635-9. http://books.google.com/?id=KmwCsuvxClAC&pg=PA74.
- ↑ Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. pp. 70–74. ISBN 0-226-02421-0. http://books.google.com/?id=rZHT-chpLmAC&pg=PA70.
- ↑ Thomson, J.J. (1897). "Cathode Rays". Philosophical Magazine 44: 293. http://web.lemoyne.edu/~GIUNTA/thomson1897.html.
- ↑ Dahl (1997:122–185).
- ↑ Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. p. 138. ISBN 0-7484-0748-0. http://books.google.com/?id=AoiJ3hA8bQ8C&pg=PA138.
- ↑ Pauling, L.C. (1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry (3rd ed.). Cornell University Press. pp. 4–10. ISBN 0-8014-0333-2. http://books.google.com/?id=L-1K9HmKmUUC.
- ↑ Shipley, J.T. (1945). Dictionary of Word Origins. The Philosophical Library. p. 133. ISBN 0-88029-751-4.
- ↑ Baigrie, B. (2006). Electricity and Magnetism: A Historical Perspective. Greenwood Press. pp. 7–8. ISBN 0-313-33358-0.
- ↑ Keithley, J.F. (1999). The Story of Electrical and Magnetic Measurements: From 500 B.C. to the 1940s. IEEE Press. ISBN 0-7803-1193-0.
- ↑ "Benjamin Franklin (1706–1790)". Eric Weisstein's World of Biography. Wolfram Research. Retrieved 2010-12-16.
- ↑ Myers, R.L. (2006). The Basics of Physics. Greenwood Publishing Group. p. 242. ISBN 0-313-32857-9.
- ↑ Farrar, W.V. (1969). "Richard Laming and the Coal-Gas Industry, with His Views on the Structure of Matter". Annals of Science. 25: 243–254. doi:10.1080/00033796900200141.
- ↑ Barrow, J.D. (1983). "Natural Units Before Planck". Quarterly Journal of the Royal Astronomical Society. 24: 24–26. Bibcode:1983QJRAS..24...24B.
- ↑ Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. pp. 70–74. ISBN 0-226-02421-0.
- ↑ Stoney, G.J. (1894). "Of the "Electron," or Atom of Electricity". Philosophical Magazine. 38 (5): 418–420.
- ↑
Soukhanov, A.H. ed. (1986). Word Mysteries & Histories. Houghton Mifflin Company. p. 73. ISBN 0-395-40265-4.
{{cite book}}:|first=has generic name (help) - ↑
Guralnik, D.B. ed. (1970). Webster's New World Dictionary. Prentice-Hall. p. 450.
{{cite book}}:|first=has generic name (help) - ↑ Born, M.; Blin-Stoyle, R.J.; Radcliffe, J.M. (1989). Atomic Physics. Courier Dover. p. 26. ISBN 0-486-65984-4.
- ↑ Dahl (1997:55–58).
- ↑ DeKosky, R.K. (1983). "William Crookes and the quest for absolute vacuum in the 1870s". Annals of Science. 40 (1): 1–18. doi:10.1080/00033798300200101.
- ↑ ۲۸٫۰ ۲۸٫۱ ۲۸٫۲ Leicester, H.M. (1971). The Historical Background of Chemistry. Courier Dover Publications. pp. 221–222. ISBN 0-486-61053-5.
- ↑ Dahl (1997:64–78).
- ↑ Zeeman, P. (1907). "Sir William Crookes, F.R.S." Nature. 77 (1984): 1–3. Bibcode:1907Natur..77....1C. doi:10.1038/077001a0.
- ↑ Dahl (1997:99).
- ↑ ۳۲٫۰ ۳۲٫۱ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامdahlوارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ ۳۳٫۰ ۳۳٫۱ ۳۳٫۲ ۳۳٫۳ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامthomsonوارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. p. 138. ISBN 0-7484-0748-0.
- ↑ Thomson, J.J. (1906). "Nobel Lecture: Carriers of Negative Electricity" (PDF). The Nobel Foundation. Retrieved 2008-08-25.
- ↑ Trenn, T.J. (1976). "Rutherford on the Alpha-Beta-Gamma Classification of Radioactive Rays". Isis. 67 (1): 61–75. doi:10.1086/351545. JSTOR 231134.
- ↑ Becquerel, H. (1900). "Déviation du Rayonnement du Radium dans un Champ Électrique". Comptes Rendus de l'Académie des Sciences. 130: 809–815. (فرانسوی)
- ↑ Buchwald and Warwick (2001:90–91).
- ↑ Myers, W.G. (1976). "Becquerel's Discovery of Radioactivity in 1896". Journal of Nuclear Medicine. 17 (7): 579–582. PMID 775027.
- ↑ Kikoin, I.K.; Sominskiĭ, I.S. (1961). "Abram Fedorovich Ioffe (on his eightieth birthday)". Soviet Physics Uspekhi. 3: 798–809. Bibcode:1961SvPhU...3..798K. doi:10.1070/PU1961v003n05ABEH005812. Original publication in Russian: Кикоин, И.К.; Соминский, М.С. (1960). "Академик А.Ф. Иоффе" (PDF). Успехи Физических Наук. 72 (10): 303–321.
- ↑ Millikan, R.A. (1911). "The Isolation of an Ion, a Precision Measurement of its Charge, and the Correction of Stokes' Law". Physical Review. 32 (2): 349–397. Bibcode:1911PhRvI..32..349M. doi:10.1103/PhysRevSeriesI.32.349.
- ↑ Das Gupta, N.N.; Ghosh, S.K. (1999). "A Report on the Wilson Cloud Chamber and Its Applications in Physics". Reviews of Modern Physics. 18: 225–290. Bibcode:1946RvMP...18..225G. doi:10.1103/RevModPhys.18.225.
- ↑ ۴۳٫۰ ۴۳٫۱ ۴۳٫۲ Smirnov, B.M. (2003). Physics of Atoms and Ions. Springer. pp. 14–21. ISBN 0-387-95550-X.
- ↑ Bohr, N. (1922). "Nobel Lecture: The Structure of the Atom" (PDF). The Nobel Foundation. Retrieved 2008-12-03.
- ↑ Lewis, G.N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002.
- ↑ ۴۶٫۰ ۴۶٫۱ Arabatzis, T.; Gavroglu, K. (1997). "The chemists' electron". European Journal of Physics. 18: 150–163. Bibcode:1997EJPh...18..150A. doi:10.1088/0143-0807/18/3/005.
- ↑ Langmuir, I. (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.
- ↑ Scerri, E.R. (2007). The Periodic Table. Oxford University Press. pp. 205–226. ISBN 0-19-530573-6.
- ↑ Massimi, M. (2005). Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. Cambridge University Press. pp. 7–8. ISBN 0-521-83911-4.
- ↑ Uhlenbeck, G.E.; Goudsmith, S. (1925). "Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons". Die Naturwissenschaften. 13 (47). Bibcode:1925NW.....13..953E. doi:10.1007/BF01558878. (آلمانی)
- ↑ Pauli, W. (1923). "Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes". Zeitschrift für Physik. 16 (1): 155–164. Bibcode:1923ZPhy...16..155P. doi:10.1007/BF01327386. (آلمانی)
جستارهای وابسته
| در ویکیانبار پروندههایی دربارهٔ الکترون موجود است. |
