سلول بنیادی
| PAGENAME | |
|---|---|
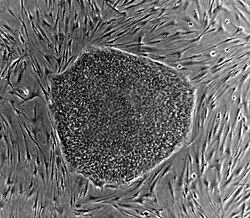 یک کلنی از یاختههای بنیادی جنینی انسان بر روی لایه ای از یاختههای حمایت کننده (فیبروبلاست جنینی موش) | |
| جزئیات | |
| شناسهها | |
| لاتین | cellula precursoria |
| MeSH | D013234 |
| TH | H1.00.01.0.00028، H2.00.01.0.00001 |
| FMA | 63368 |
سلول بنیادی یا یاختهٔ بنیادی (Stem cell) یاختهای با توانایی تقسیم بالا است که هنوز تقسیم نشدهاست. یاختههای حاصل از تقسیم بُنیاختهها (از راه میتوز) یاخته بنیادی بیشتری میسازند و میتوانند به گونههای مختلف یاختههای دیگر تمایز سلولی و تمایز یابند و ممکن است در روند تمایز، برخی یاختهها مانند یاختههای عصبی، توانایی تقسیمشدن را از دست بدهند. یاختههای بنیادی در جانداران چند یاختهای یافت میشوند. در پستانداران دو گونهٔ گسترده از یاختههای بنیادی وجود دارد: یاختههای بنیادی جنینی (Embryonic Stem Cell) و یاختههای بنیادی بالغ (Adult Stemcell)، که در بافتهای مختلف یافت میشوند. در جانداران بالغ، یاختههای بنیادی و نیایاختهها بهعنوان یک سامانهٔ تعمیر برای بدن و بازسازی بافتهای بالغ عمل میکنند. از بُنیاختهها میتوان در ساخت یاختهها و نهایتاً بافتهای مختلف نیز استفاده کرد. امروزه کاربرد این یاختهها جهت ترمیم بافتهای آسیبدیده در حال گسترش است. یاختههای بنیادی را بر اساس میزان توانایی آنها در ساخت بافتهای مختلف، به «همه (تمام) توان» (totipotent)، «پرتوان» (pluripotent)، «چندتوان» (multipotent) و «تکتوان» (unipotent) تقسیم میکنند.
فناوری یاختههای بنیادی علاوه بر بهکارگیری این یاختهها جهت درمان بیماریها و ترمیم و نوسازی بافتها، در سالهای گذشته روی ساخت این یاختهها نیز متمرکز شدهاست. جایزهٔ نوبل پزشکی در سال ۲۰۱۲ بهخاطر کشف روشی برای بازسازی یاختههای بنیادی از یاختههای تمایز یافته، مشترکاً به جان بی. گوردون (John B. Gurdon) و شینیا یاماناکا (Shinya Yamanaka) اعطا شد. منابع اصلی یاختههای بنیادی در انسان، شامل: مغز استخوان، بند ناف، پالپ دندان، بعضی بافتهای چربی و جفت هستند.
کاربردها و فنون یاختههای بنیادی، در زیستفناوری و مطالعات پایهٔ آن، در زیستشناسی سلولی بررسی میگردد.
توانایی تمایز یاختههای بنیادی[ویرایش]
یاختههای بنیادی را میتوان بر اساس توانایی تمایز و تبدیل آنها به یاختههای دیگر به چهار دستهٔ یاختهٔ بنیادی تمامتوان، پرتوان، چندتوان و تکتوان تقسیم کرد:[۱]
- «همه (تمام) توان» یا Totipotent: به یاخته تخمک و یاختههای جنین در مرحلهٔ ۴یاختهای و ۸یاختهای گفته میشود که میتوانند تمام بافتهای بدن و همچنین پردههای آمنیون (درونشامه) و کوریون (برونشامه) و جفت را ایجاد کنند. این یاختهها را میتوان از جنینهای چهار یا پنجروزه حاصل از تخمکهایی که با روشهای آزمایشگاهی لقاح داده میشوند بهدستآورد و در محیطهای کشت اختصاصی رشد داد. از این رو، یاختههای تمامتوان به یاختههای بنیادی جنینی هم معروف هستند.
- «پرتوان» یا Pluripotent: به یاختههایی گفته میشود که میتوانند یاختههای چندین بافت را بسازند. از جمله یاختههای لایهٔ اکتودرم، مزودرم و اندودرم که بهترتیب مربوط به لایههای خارجی، میانی و داخلی جنین هستند. یاختههای بنیادی اکتودرمی، پیشساز یاختههای پوست و یاختههای دستگاه عصبی هستند. یاختههای مزودرمی پیشساز بافتهای عصبی، ماهیچهای، چربی، همبند، خون، یاختههای لولههای کلیوی و … هستند. یاختههای اندودرمی پیشساز یاختههای لوزالمعده، تیروئید و یاختههای ریوی هستند. در افراد بزرگسال هم، گونهای از یاختههای بنیادی پرتوان که منشأ مزودرمی دارند، در پالپ دندان و بعضی بافتهای چربی یافت میشوند. گونهای از این یاختهها (یاختههای بنیادی خونساز جنینی) را میتوان از خون باقیمانده در بند ناف، پس از تولد نوزاد بهدستآورد. ویژگی مهم این یاختهها نابالغ بودن لنفوسیتهای آن است. از این رو میتوان با پیوند زدن آنها به مغز استخوان افراد بیمار، علاوه بر تأمین یاختههای خونی جدید برای آنها، انتظار موفقیت بالایی از عمل پیوند داشت. از آنجا که یاختههای بنیادی خونساز جنینی «پرتوان» هستند و توانایی تمایز به تمام بافتهای بدن را دارند؛ به دست آوردن آنها از بند ناف افق جدیدی برای درمان بسیاری از بیماریهاب در آینده ترسیم میکند.
- «چندتوان» یا Multipotent: یک ردهٔ پایینتر از یاختههای پرتوان محسوب میشوند و میتوانند یاختههای مختلف یک بافت معین را بسازند. مانند یاختههای بنیادی مغز استخوان که قادر به ساخت گونههای یاختههای مختلف بافت خونی، شامل یاختههای قرمز، سفید، لنفوسیتها و پلاکتها هستند. یاختههای بنیادی موجود در بافتهای مختلف (عصبی، پوست و …) افراد بزرگسال، در این دسته قرار میگیرند.
- «تکتوان» یا Unipotent: به یاختههایی گفته میشود که تنها توانایی ساخت یک یاختهٔ متمایز را دارند. مانند لنفوسیت بی که تنها توانایی ساخت پلاسموسیتها را دارند.
یاختههای بنیادی جنینی[ویرایش]
یاختههای بنیادی جنینی (به انگلیسی embryonic stem cells)، یاختههای بنیادی پرتوانی هستند که از تودهٔ یاختهای درونی جنین در مرحلهٔ بلاستوسیت بهدست میآیند. این یاختهها میتوانند به تمام ردههای یاختهای تبدیل شوند.
کشت یاختههای بنیادی جنینی[ویرایش]
جنین ۳ تا ۵ روزه را بلاستوسیست مینامند. یک بلاستوسیست تودهای متشکل از ۱۰۰ یاخته یا بیشتر است. یاختههای بنیادی، یاختههای درونی بلاستوسیست هستند که در نهایت به هر نوع یاخته، بافت و اندام درون بدن تبدیل میشوند.
رشد یاختههای بنیادی در محیط آزمایشگاه را اصطلاحاً کشت یاخته مینامند. در واقع جدا کردن یاختههای بنیادی جنینی از طریق انتقال سطح داخلی بلاستوسیست به یک ظرف کشت آزمایشگاهی پلاستیکی که شامل یک بستر تغذیهای به نام محیط کشت میباشد انجام میگیرد. تقسیم و ازدیاد یاختهها بر روی سطح این ظرف انجام میگیرد. سطح داخلی این ظرف معمولاً به وسیله یاختههای پوست جنین موش پوشیده شدهاست. این یاختهها قادر به تقسیم شدن نیستند. به این لایه پوشانندهٔ یاختهای در اصطلاح لایهٔ تغذیهای (به انگلیسی: feeder layer) گفته میشود. دلیل بهکارگیری این یاختهها فراهم آوردن یک سطح طبیعی به منظور چسبیدن یاختههای بنیادی به آن و عدم جداشدنشان است. در ضمن یاختههای این لایه مواد مغذی را به داخل محیط کشت رها میکنند.
پس از چند روز یاختههای کشت داده شده شروع به رشد و تقسیم شدن در این محیط میکنند. هنگامی که این عمل انجام گرفت یاختههای کشت داده شده که زیاد شدهاند را از این محیط برداشته و به محیطهای تازهٔ کشت منتقل میکنند. روند کشت مجدد یاختهها بارها و بارها به مدت چند ماه تکرار میشود. پس از ۶ ماه یا بیشتر، ۳۰ یاختهٔ اولیه تبدیل به هزاران میلیون یاختهٔ بنیادی جنینی میشوند. یاختههایی را که در این دوره ۶ ماه و در این محیط کشت مخصوص تقسیم شده و در عین حال تمایز نیابند را پرتوان (pluripoten) مینامند.
بهتازگی راه حلهایی جهت کاهش مدت زمان ساخت یاختههای بنیادی ارائه شدهاست.[۲]
یاختههای بنیادی بزرگسال[ویرایش]
یاختههای بنیادی بزرگسال (به انگلیسی Adult Stem Cells) یا یاختههای بنیادی سوماتیک (به انگلیسی Somatic Stem Cells) یاختههایی بنیادی هستند که پس از مراحل رشد جنین و در سرتاسر طول عمر در بافتهای مختلف بدن حضور دارند و با تقسیم و تمایز یاختههای مرده را جایگزین و بافتهای آسیبدیده را ترمیم میکنند. اغلب یاختههای بنیادی بزرگسال چندتوان یا تکتوان هستند. یاختههای بنیادی خونساز، یاختههای بنیادی عصبی و یاختههای بنیادی مزانشیمی مثالهایی از یاختههای بنیادی بزرگسال هستند.
تقسیم یاختههای بنیادی[ویرایش]
ویژگی عمومی همهٔ یاختههای بنیادی، «خود نوسازی» آنها از طریق تقسیم میتوز است. به این صورت که یکی از دو یاختهٔ دختری حاصل از تقسیم هر یک از یاختههای بنیادی، همانند یاختهٔ مادر باقی میماند و دیگری وارد مسیر تمایز میشود. یکی از معروفترین مثالها در این مورد، تشکیل لنفوسیت بی
خاطره در کنار پلاسموسیت حاصل از تقسیم یک لنفوسیت بی فعال شدهاست.
مکانیسمی که تعیین میکند کدام یاخته تمایز پیدا کند؛ میتواند برونگرا یا کاملاً درونی باشد. برای مثال در یاختههای بنیادی خونساز این مکانیزم برونگراست. به این معنا که از دو یاختهٔ دختر حاصل از تقسیم، یاختهای که با یاخته استخوانی (استئوبلاست) ارتباط دارد؛ تمایزنیافته باقی میماند. در بعضی یاختهها این مکانیزم درونگراست. در این گونه یاختههای بنیادی هنگامی که دو یاختهٔ دختر، هنوز کاملاً جدا نشدهاند؛ پروتئینهایی به یکی از آنها منتقل میشوند و سرنوشتِ یاخته را بهسوی تمایز میبرند.
ساخت یاختههای بنیادی از یاختههای تمایزیافته[ویرایش]
پژوهشهایی که دربارهٔ ویژگیهای اساسی یاختههای بنیادی انجام شد؛ امکان ایجاد تئوریهایی دربارهٔ نحوهٔ ساخت یاختههای بنیادی از یاختههای تمایزیافته را بهوجود آورد. در یکی از پژوهشهای اولیه در این باره، John B. Gurdon با یک آزمایش کلاسیک در سال ۱۹۶۲ نشان داد که تمایز یک پدیدهٔ برگشتپذیر است. در این آزمایش؛ گوردون هستهٔ یک یاختهٔ بالغ روده را در یک یاختهٔ تخم قورباغه که هستهٔ آن خارج شده بود، ادغام کرد و مشاهده کرد که مراحل تمایز، با موفقیت انجام میشود. پژوهشهای جدید زیستشناسی مولکولی نشان دادند که یاختههای بنیادی «پرتوان» دو ویژگی اصلی دارند. اول اینکه ساختار کروماتین در هستهٔ آنها فشرده نیست (یوکروماتیک هستند). دوم این که یک تعادل خاص بین فاکتورهای رونویسی و ساختار کروماتین آنها برقرار است. بهعبارتی ساختار کروماتین (که با ایجاد تغییرات اپیژنتیکی روی پروتئینهای کروماتین، قابل تغییر است) روی بیان ژن فاکتورهای رونویسی تأثیر دارد. در سال ۲۰۰۶، شینیا یاماناکا (Shinya Yamanaka) موفق شد با بیان مصنوعی ژنهای تعداد محدودی فاکتورهای رونویسی نظیر Oct3/4, Sox2, Nanog یاختههای بالغ دستنخورده را به یاختههای نابالغ بنیادی تبدیل کند. تلاشهای این دو فرد، جایزهٔ نوبل فیزیولوژی/پزشکی سال ۲۰۱۲ را به خود اختصاص داد.[۳]
افقهای درمانی[ویرایش]
در بیمارییهایی که در آن یاختهها دچار آپوپتوز غیرعادی شده یا به مرور زمان دچار نقص در کارکرد میشوند یا با حمله دستگاه ایمنی از بین میروند؛ بهکارگیری یاختههای بنیادی، افقهای درمانی تازهای را محقق خواهد کرد.
- پارکینسون: در این بیماری، نورونهای سازندهٔ دوپامین در قسمت توده سیاه مغز از بین میروند. با جایگزین کردن یاختهها میتوان به بهبودی بیمار کمک کرد. به عبارتی اگر نورونهای تولیدکنندهٔ ناقلهای عصبی دوپامین را بتوان در محیط کشت ایجاد کرد، احتمال درمان افراد مبتلا به پارکینسون فراهم میشود چون این بیماران اغلب این نورونها را از دست دادهاند.
- دیابت گونه یک: یاختههای β در جزایر لانگرهانس پانکراس مورد حملهٔ دستگاه ایمنی قرار گرفته و از بین میروند. در نتیجه توانایی بدن در ساخت انسولین از بین رفته و درصورت عدم تزریق خارجی، بیمار زنده نخواهد ماند. با بازسازی و جایگزینی این یاختهها مشکلات بیماران دیابتی حل خواهد شد.
- آلزایمر: در نتیجهٔ تجمع پروتئین tau (مرتبط با ریزلولههای اسکلت سلولی) در داخل یاختههای عصبی و تجمع پروتئین بتا-آمیلوئید در خارج یاختهها، توانایی آنها در انتقال پیام عصبی کاهش یافته و بیمار با مشکلات حافظه و سایر مشکلات عصبی مرتبط روبهرو خواهد شد. در مراحل مختلف این بیماری، تعداد زیادی از یاختههای درگیر، دچار آپوپتوز میشوند. با جایگزین شدن یاختههای عصبی از بین رفته؛ بهبود قابل ملاحظهای در وضعیت این بیماران انتظار میرود.
- سکته مغزی: در اثر ایجاد لخته خونی و در نتیجهٔ از بین رفتن بخشی از بافت مغز بهعلت نرسیدن اکسیژن اتفاق میافتد.
- بیماران قلبی: توصیه میشود برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار دریافت قلب پیوندی بهسر میبرند، در کنار تجویز داروهای سرکوبکننده سیستم ایمنی، از روش پیوند یاختههای بندناف بهعنوان یک روش کمکی استفاده کرد.
- بیماران کبدی: اکنون اگر بیماری دچار سرطان کبد باشد، جراح مجبور است برای جلوگیری از انتشار سرطان (متاستاز) به بخشهای دیگر بدن، بخش سرطانی کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی همزمان، خون ناحیه سرطانی کبد را قطع میکنند تا بافت آن را بازسازی کنند.
- درمان قرنیه: هماکنون پروژهٔ بهکارگیری یاختههای بنیادی جهت درمان مشکلات قرنیه چشم در پژوهشگاه رویان در حال پیگیری میباشد.
- مشکلات چون فلج نخاعی، سوختگی، آرتروز، روماتیسم مفصلی و …
- درمان بیماریهای دهان و دندان: تحقیقات گستردهای در زمینهٔ درمان آسیبهای وارده به بافت صورت و غدد بزاقی با بهکارگیری یاختههای بنیادی در مرحلهٔ آزمایشگاهی در حال انجام است که نتیجهٔ حاصل از آن میتواند جایگزین مواد مصنوعی شود.[۴]
جستارهای وابسته[ویرایش]
- فهرست انواع سلولهای انسانی مشتق شده از لایه زایاکویید۱۹ یا کرونا ویروس عامل مشکلات خودایمنی درمن است. امضامرضیه آرام دستگردی
منابع[ویرایش]
- ↑ «Stem Cell Categories». بایگانیشده از اصلی در ۳ اکتبر ۲۰۱۴. دریافتشده در ۲۵ اوت ۲۰۱۴.
- ↑ «کشف شیوه سریعی برای تولید یاختههای بنیادی». سایت خبری بیتنا ۲۴. بایگانیشده از اصلی در ۲۲ فوریه ۲۰۱۴.
- ↑ «جایزه نوبل ۲۰۱۲ در پزشکی/فیزیولوژی».
- ↑ سلولهای بنیادی جایگزین مواد مصنوعی در درمان بیماریهای دهان، فک و صورت . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- Lippincott’s Illustrated Reviews: Cell and Molecular Biology (2010). ISBN 978-0-7817-9210-3.
