محلول بافر
| اسیدها و بازها |
|---|
 |
| انواع اسید |
| انواع باز |
محلول بافر (به انگلیسی: Buffer solution) یا محلول تامپون، یک محلول شیمیایی است که از یک اسید ضعیف و نمک آن یا یک باز ضعیف و نمک آن ساخته میشود. محلولهای بافر توانایی حفظ پیاچ محلول را حتی در صورت افزودن اندکی باز یا اسید دارند. خون یک نمونهٔ مهم از این نوع محلولها است. در طبیعت، سیستمهای زنده زیادی وجود دارد که از بافر برای تنظیم pH استفاده میکنند. به عنوان مثال، سیستم بافر بیکربنات برای تنظیم pHخون استفاده میشود. بافرها موادی هستند که از تغییرات زیاد پیاچ جلوگیری میکنند و از جمله آنها میتوان به پروتئینها در بدن اشاره کرد.[۱]
بافرهای مشهور در زیستشناسی[ویرایش]
جدول زیر نام و مشخصات برخی بافرهای مشهور را بیان کردهاست:[۲]
| نام | ساختار | ثابت تفکیک اسیدی در ۲۵°C |
دامنه بافری | Temp Effect dpH/dT in (1/K)[۳] |
جرم مولی |
|---|---|---|---|---|---|
| تیایپیاس | 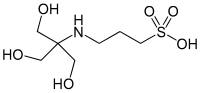 |
۸٫۵۸ | ۷٫۷–۹٫۱ | −۰٫۰۱۸ | ۲۴۳٫۳ |
| بیسین |  |
۸٫۳۵ | ۷٫۶–۹٫۰ | −۰٫۰۱۸ | ۱۶۳٫۲ |
| تریس(هیدروکسیمتیل)آمینومتان |  |
۸٫۰۶ | ۷٫۵–۹٫۰ | −۰٫۰۲۸ | ۱۲۱٫۱۴ |
| تریسین | 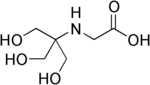 |
۸٫۰۵ | ۷٫۴–۸٫۸ | −۰٫۰۲۱ | ۱۷۹٫۲ |
| تپسو |  |
۷٫۶۳۵ | ۷٫۰–۸٫۲ | ۲۵۹٫۳ | |
| اچئیپیئیاس |  |
۷٫۴۸ | ۶٫۸–۸٫۲ | −۰٫۰۱۴ | ۲۳۸٫۳ |
| تیئیاس | 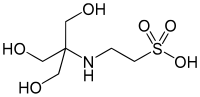 |
۷٫۴۰ | ۶٫۸–۸٫۲ | −۰٫۰۲۰ | ۲۲۹٫۲۰ |
| اماوپیاس |  |
۷٫۲۰ | ۶٫۵–۷٫۹ | −۰٫۰۱۵ | ۲۰۹٫۳ |
| پیآیپیئیاس | 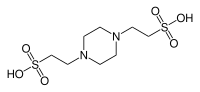 |
۶٫۷۶ | ۶٫۱–۷٫۵ | −۰٫۰۰۸ | ۳۰۲٫۴ |
| کاکودیلیک اسید | 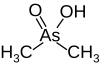 |
۶٫۲۷ | ۵٫۰–۷٫۴ | ۱۳۸٫۰ | |
| امئیاس | 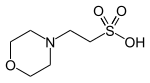 |
۶٫۱۵ | ۵٫۵–۶٫۷ | −۰٫۰۱۱ | ۱۹۵٫۲ |
کاربرد بافرها[ویرایش]
محلولهای بافر برای حفظ پیاچ صحیح برای عملکرد آنزیمها در بسیاری از جانداران ضروری هستند.
بسیاری از آنزیمها تنها در شرایط دقیقی کار میکنند؛ اگر پیاچ در محدودهٔ بسیار کمی تغییر کند عملکرد آنزیمها کند یا متوقف میشود و دچار تغییر ماهیت میشوند. در بسیاری از موارد، تغییر ماهیت میتواند بهطور ثابت فعالیت کاتالیزوری را از کار بیندازد.
بافر کربنیک اسید (H2CO3) و بیکربنات (-HCO3) در پلاسمای خون موجود است که برای حفظ پیاچ بین ۷٫۳۵ تا ۷٫۴۵ به کار میرود.[۴]
از لحاظ کاری و صنعتی محلولهای بافر در فرایند تخمیر و در تعیین شرایط مناسب برای رنگهای موجود در رنگآمیزی پارچه بهکار میروند.
بافرها همچنین در تجزیه و تحلیلهای شیمیایی و کالیبراسیون پیاچسنجها بهکار میروند.
از بزرگترین نمونههای زیستی (بیولوژیکی) استفاده از آنها میتوان به تحقیقهایی اشاره کرد که در آن مواد در بافر ساخته میشوند؛ به ویژه بافر فسفات نمکی (PBS) که در پیاچ = ۷٫۴ مورد استفاده قرار میگیرد.
علت اصلی استفاده از بافرها این است که سلولها، آنزیمها و باکتریها برای کارکرد درست، نیاز است که در پیاچ مشخصی فعالیت کنند. به همین دلیل نیز از بافرها در بسیاری از کاربردهای زیستی استفاده میشود.
منابع[ویرایش]
- ↑ مورتیمر، چارلز (۱۳۸۳). شیمی عمومی ۱. ج. دوم. تهران: نشر علوم دانشگاهی. ص. ۲۸۲. شابک ۹۶۴۶۱۸۶۳۳۵.
- ↑ "Biological buffers". REACH Devices.
- ↑ "Buffer Reference Center". Sigma-Aldrich. Retrieved 2009-04-17.
- ↑ «کاربرد بافر». گروه نگین. ۲۰۲۱-۰۹-۰۵. دریافتشده در ۲۰۲۱-۱۰-۰۸.
