برشنگاری گسیل پوزیترون مغز
| برش نگاری مغز با گسیل پوزیترون | |
|---|---|
| تشخیص پزشکی | |
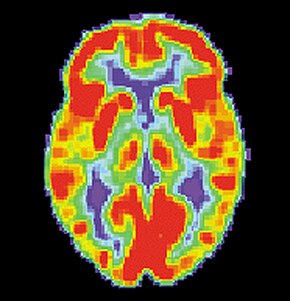 اسکن برش نگاری با گسیل پوزیترون از یک مغز عادی | |
| ICD-10-PCS | C030 |
برش نگاری مغز با گسیل پوزیترون یا توموگرافی گسیل پوزیترون مغز نوعی از برش نگاری با گسیل پوزیترون (PET) است که برای اندازهگیری متابولیسم مغز و توزیع عوامل شیمیایی بیرونی نشان دار شده با ماده رادیواکتیو در سراسر مغز استفاده میشود. PET میزان گسیل مواد شیمیایی فعال متابولیکی نشان دار شده با ماده رادیواکتیو را که به جریان خون تزریق شدهاند، اندازهگیری میکند. دادههای خروجی برش نگاری مغز با گسیل پوزیترون، توسط رایانه پردازش میشود تا تصاویری چند بعدی از توزیع مواد شیمیایی در مغز تولید شود.[۱]
روند انجام[ویرایش]
رادیو ایزوتوپهای گسیل کننده پوزیترون معمولاً توسط سیکلوترون تولید میشوند و مواد شیمیایی، با این اتمهای رادیواکتیو برچسب گذاری میشوند. رادیو ایزوتوپهای رایج مورد استفاده در کلینیکها 18F (فلوراید)، 11C (کربن) و 15O (اکسیژن) هستند. این ترکیب نشان دار شده که ردیاب هسته ای یا ردیاب رادیواکتیو نامیده میشود، در جریان خون تزریق شده و در نهایت از طریق گردش خون به مغز راه مییابد. شناساگرهای موجود در اسکنر PET، مقدار رادیواکتیویته را از میزان بارهای ترکیبی در مناطق مختلف مغز تشخیص میدهند. یک رایانه از دادههای جمعآوری شده توسط شناساگرها برای ایجاد تصاویر چند بعدی (اغلب تصاویر ۳ بعدی حجمی یا ۴ بعدی متغیر با زمان) استفاده میکند که توزیع ردیاب هسته ای را در مغز نشان میدهد. در بسیاری از موارد از یک رشته گسترده از لیگاندها برای نقشهبرداری از جنبههای مختلف فعالیت انتقال دهنده عصبی استفاده میشود. رایجترین ردیابهای PET، فرمهای نشان دار شده گلوکز مانند فلورودئوکسی گلوکوز (18 F) هستند.
مزایا و معایب[ویرایش]
بزرگترین مزیت اسکن PET این است که ترکیبات مختلف قادر هستند جریان و اکسیژن و متابولیسم گلوکز را در بافتهای مغز فعال نمایش دهند. این اندازهگیریها، میزان فعالیت نواحی مختلف مغز را منعکس میکند و امکان کسب اطلاعات بیشتر در مورد نحوه کار مغز را فراهم میکند. زمانی که اسکن PET نخستین بار در دسترس قرار گرفت، از نظر وضوح تصویر و سرعت انجام فرایند (حدود ۳۰ ثانیه)، به سایر روشهای تصویربرداری متابولیک برتری داشت. افزایش وضوح تصویر، این امکان را فراهم کرد تا مطالعه بهتری در خصوص نواحی فعال شده مغز پس از انجام یک کار خاص صورت گیرد. بزرگترین ایراد اسکن PET محدود بودن آن به بررسی و نظارت بر فعالیتهای کوتاه مدت، به دلیل سرعت بالای واپاشی هسته ای است.[۲]
کاربردها[ویرایش]

پیش از فراگیری استفاده از تصویربرداری تشدید مغناطیسی عملکردی (fMRI)، اسکن PET روش ارجح تصویربرداری کاربردی (بر خلاف ساختاری) مغز بود و هنوز هم کمکهای بزرگی به علوم اعصاب میکند. اسکن PET در جراحیهای استریوتاکتیک با هدایت PET، پرتو جراحیها برای درمان تومورهای داخل جمجمه، ناهنجاریهای شریانی و سایر موارد قابل درمان با جراحی نیز مفید است.[۴]
اسکن PET برای تشخیص بیماریهای مغز نیز مورد استفاده قرار میگیرد، به خصوص به این دلیل که تومورهای مغزی، سکتههای مغزی و بیماریهای مرتبط با زوال عصبی (مانند بیماری آلزایمر و پارکینسون) همه باعث ایجاد تغییرات بزرگی در متابولیسم مغز میشوند که خود باعث به وجود آمدن تغییرات قابل تشخیص در اسکن PET میشود. PET احتمالاً در مراحل اولیه ابتلا به انواع خاصی از زوال عقل (مانند بیماری آلزایمر و بیماری پیک) بیشترین کاربرد را دارد؛ زیرا در این موارد، آسیب اولیه به شدت پراکندهاست و تغییر کمی در حجم مغز و ساختار آن ایجاد میشود که برای ایجاد تغییر محسوس در تصاویر CT و MRI استاندارد کافی نیست و در نتیجه امکان تمایز افراد دچار به این بیماریها از افراد مسنی که به آتروفی قشری دچار شدهاند (که منجر به زوال عقل کلینیکی نمیشود) وجود ندارد.
PET همچنین برای ام اس، سایر سندرمهای مییلین زدا و همچنین برای تحقیق در مورد پاتوژنها استفاده میشود و در آن از رادیو لیگاندهای خاص برای فعالیت میکروگلیا کار گرفته میشود. در حال حاضر بهطور گستردهای از پروتئین انتقال دهنده ۱۸ کیلو دالتونی (TSPO) استفاده میشود.[۵] همچنین PET-CT ترکیبی نیز گاهی انجام میشود.[۶]
انواع ردیاب[ویرایش]
تصویربرداری PET با اکسیژن- ۱۵ بهطور غیر مستقیم جریان خون وارد شده به مغز را اندازهگیری میکند. در این روش، افزایش سیگنال رادیواکتیویته نشان دهنده افزایش جریان خون است که فرض میشود با افزایش فعالیت مغز رابطه دارد. به دلیل نیمه عمر ۲ دقیقه ای، برای استفادههای این چنینی باید O-15 مستقیماً از یک سیکلوترون پزشکی لولهکشی شود که این کار سخت است.
تصویربرداری PET با 18F-FDG از این واقعیت بهره میبرد که مغز بهطور معمول یک مصرفکننده سریع گلوکز است. برش نگاری مغز با گسیل پوزیترون به وسیله 18F-FDG، استفاده از گلوکز در نواحی مختلف مغز را اندازهگیری میکند و میتواند در تشخیصهای نوروپاتولوژیک مورد استفاده قرار بگیرد.
- مثال: آسیبهای مغزی مانند بیماری آلزایمر، متابولیسم گلوکز و اکسیژن در مغز را بهطور همزمان کاهش میدهد؛ بنابراین BPET با استفاده از 18F-FDG قادر است برای تمایز بیماری آلزایمر از سایر فرآیندهای زوال عقل و همچنین برای تشخیص به موقع بیماری آلزایمر به کار گرفته شود. مزیت PET با 18F-FDG در این کاربرد، دسترسی بسیار گستردهتر آن است. برخی از ردیابهای رادیواکتیو که برای آلزایمر استفاده میشوند عبارتند از: فلوربتاپیر 18F، فلوتمتامول F18، فلوربتابن 18F و PiB هستند که همگی برای تشخیص پلاکهای آمیلوئید بتا (یک نشانگر زیستی بالقوه برای آلزایمر) در مغز استفاده میشوند.
- مثالها: از تصویربرداری PET با FDG میتوان برای تشخیص محل حمله صرعی نیز استفاده کرد: محل حمله صرعی به صورت هیپومتابولیک در طی یک اسکن بین دوره ای ظاهر میشود. ردیابهای هسته ای مختلفی (به عنوان مثال رادیو لیگاندها) برای PET ساخته شدهاند که لیگاند زیرگروههای خاص گیرنده عصبی مانند [11 C] راکلوپراید، [18 F] فالی پرواید و [18 F] دسمتوکسی فالیپراید برای گیرندههای D2 / D3 دوپامین، [11 C] McN 5652 است و [11 C] DASB برای ناقلین سروتونین، [18 F] Mefway برای گیرندههای سروتونین، [18 F] Nifene برای گیرندههای استیل کولین نیکوتینی یا لایههای آنزیمی (به عنوان مثال 6- FDOPA برای آنزیم AADC). این عوامل امکان تجسم مکانهای با گیرندههای عصبی فراوان که نشانگر کثرت بیماریهای اعصاب و روان و نورولوژیک هستند را فراهم میکنند.
توسعه تعدادی کاوشگر جدید برای تصویربرداری PET غیرتهاجمی از تجمع عصبی در مغز انسان، تصویربرداری آمیلوئید را به آستانه استفاده بالینی آوردهاست. این کاوشگرهای تصویربرداری آمیلوئید امکان مشاهده پلاکهای آمیلوئید در مغز بیماران آلزایمری را فراهم میکند و میتواند به پزشکان در تشخیص بالینی صحیح قبل از مرگ کمک کند و در توسعه درمانهای جدید ضد آمیلوئید تأثیرگذار باشد. [11 C] PMP یک رادیو داروی جدید است که در تصویربرداری PET برای تعیین فعالیت سیستم انتقال دهنده عصبی استیل کولینرژیک با فعالیت به عنوان یک بستر برای استیل کولین استراز استفاده میشود. معاینه پس از مرگ بیماران، کاهش سطح استیل کولین استراز را نشان دادهاست. [11 C] PMP برای نقشهبرداری از فعالیت استیل کولین استراز در مغز استفاده میشود و میتواند تشخیصهای AD قبل از مرگ را فراهم کند و به نظارت بر درمانهای AD کمک کند.[۷] کمپانیAvid Radiopharmaceuticals ترکیبی به نام فلوربتاپیر تولید و تجاری کردهاست که از رادیونوکلئید فلورین ۱۸ با دوام بیشتر برای تشخیص پلاکهای آمیلوئید با استفاده از اسکن PET استفاده میکند.[۸]
چالشها[ویرایش]
یک چالش اصلی در زمینه تولید ردیابهای جدید PET برای تصویربرداری عصبی این است که این ردیابها باید از سد خونی مغزی (BBB) عبور کنند. برای این منظور، اغلب از مولکولهای کوچکی که محلول در چربی هستند استفاده میشود زیرا میتوانند از سد خونی مغزی به وسیله انتشار غیرفعال از طریق لیپید بگذرند.
با این حال، همزمان با حرکت داروشناسی به سمت مولکولهای زیستی بزرگ برای درمانهای مختلف، تحقیقات جدید نیز بر استفاده از مولکولهای زیستی مانند آنتیبادیها به عنوان ردیابهای PET تمرکز کردهاند. این ردیابهای جدید PET در عبور از BBB مشکل بیشتری دارند زیرا بسیار بزرگ هستند و نمیتوانند بهطور منفعل در سراسر آن پخش شوند. به همین دلیل، تحقیقات جدید در حال بررسی روشهای انتقال مولکولهای زیستی از BBB با استفاده از سیستمهای حمل و نقل درون زا از جمله حمل کنندههای واسطه ای مانند حاملهای گلوکز و اسید آمینه و گیرنده واسطه ترانس سیتوز برای انسولین یا ترانسفرین است.[۹]
منابع[ویرایش]
- ↑ Nilsson LG, Markowitsch HJ (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers. p. 57.
- ↑ Nilsson LG, Markowitsch HJ (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers. p. 60.
- ↑ Volkow, Nora D.; Fowler, Joanna S.; Wang, Gene-Jack (2003-05-15). "The addicted human brain: insights from imaging studies". The Journal of Clinical Investigation (به انگلیسی). 111 (10): 1444–1451. doi:10.1172/JCI18533. ISSN 0021-9738. PMC 155054. PMID 12750391.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Levivier M, Massager N, Wikler D, Lorenzoni J, Ruiz S, Devriendt D, et al. (July 2004). "Use of stereotactic PET images in dosimetry planning of radiosurgery for brain tumors: clinical experience and proposed classification". Journal of Nuclear Medicine. 45 (7): 1146–54. PMID 15235060.
- ↑ Airas L, Nylund M, Rissanen E (March 2018). "Evaluation of Microglial Activation in Multiple Sclerosis Patients Using Positron Emission Tomography". Frontiers in Neurology. 9: 181. doi:10.3389/fneur.2018.00181. PMC 5879102. PMID 29632509.
- ↑ Malo-Pion C, Lambert R, Décarie JC, Turpin S (February 2018). "Imaging of Acquired Demyelinating Syndrome With 18F-FDG PET/CT". Clinical Nuclear Medicine. 43 (2): 103–105. doi:10.1097/RLU.0000000000001916. PMID 29215409.
- ↑ Kuhl, D. E.; Koeppe, R. A.; Minoshima, S.; Snyder, S. E.; Ficaro, E. P.; Foster, N. L.; Frey, K. A.; Kilbourn, M. R. (1999-03-01). "In vivo mapping of cerebral acetylcholinesterase activity in aging and Alzheimer's disease". Neurology (به انگلیسی). 52 (4): 691–691. doi:10.1212/WNL.52.4.691. ISSN 0028-3878. PMID 10078712.
- ↑ Kotala, Gina (2010-06-23). "Promise Seen for Detection of Alzheimer's". The New York Times.
- ↑ Sehlin, Dag; Syvänen, Stina; Ballanger, Bénédicte; Barthel, Henryk; Bischof, Gérard N.; Boche, Delphine; Boecker, Hennig; Bohn, Karl Peter; Borghammer, Per (2019-12-01). "Engineered antibodies: new possibilities for brain PET?". European Journal of Nuclear Medicine and Molecular Imaging (به انگلیسی). 46 (13): 2848–2858. doi:10.1007/s00259-019-04426-0. ISSN 1619-7089. PMC 6879437. PMID 31342134.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link)
