ترکیبات آلومینیوم

آلومینیوم ترکیبی از ویژگیهای فلزات قبل و بعد از فلزات واسطه را دارد. از آنجایی که الکترونهای کمی برای پیوند فلزی دارد، مانند فلزهای سنگینتر مشابه خود در گروه ۱۳، ویژگیهای فیزیکی یک فلز بعد از فلزات واسطه، با فواصل بین اتمی طولانیتر از حد انتظار را دارد.[۱] علاوه بر این، از آنجایی که Al 3+ یک کاتیون کوچک و با بار زیاد است، به شدت قطبی است و ترکیبات آلومینیوم بیشتر خواص کووالانسی دارند.[۲] این رفتار شبیه رفتار بریلیم است (Be 2+)، نمونه ای از یک رابطه مورب.[۳] با این حال، بر خلاف سایر فلزات پس از فلزات واسطه، هسته زیرین زیر پوسته ظرفیتی آلومینیوم، هسته گاز نجیب سری قبلی جدول است، در حالی که برای گالیم و ایندیم، هسته گاز نجیب قبلی به اضافه یک زیر پوسته d پر شدهاست. برای تالیم و نیهونیوم هسته گاز نجیب قبلی به اضافه یک زیر پوستههای d و f پر شدهاست. از این رو، آلومینیوم دارای اثرات محافظت ناقص الکترونهای ظرفیتی به وسیله الکترونهای درونی هسته که فلزات سنگیت تر مشابه آن این خاصیت را دارند، ندارد. رفتارهای الکترومثبت آلومینیوم، میل ترکیبی بالا برای اکسیژن، و پتانسیل الکترود استاندارد بسیار منفی، اکثراً شبیه رفتارهای اسکاندیم، ایتریم، لانتانیم و اکتینیم هستند که از سه الکترون ظرفیت خارج از یک هسته گاز نجیب دارای پیکربندی ds2 هستند: در بین این فلزات آلومینیوم بیشترین فلز الکترو مثبت در این گروه هست.[۱] آلومینیوم همچنین شباهتهای جزئی به بور متالوئیدی در گروه مشابه خود دارد. ترکیبات AlX3 دارای ظرفیت ایزوالکترونیک نسبت به ترکیبات BX3 هستند. (آنها ساختار الکترونیکهای ظرفیتی یکسانی دارند) و هر دوی آنها مانند اسیدهای لوئیس رفتار میکنند و به آسانی ترکیبات اضافی تشکیل میدهند؛[۴] علاوه بر این، یکی از نقوش اصلی شیمی بور ، ساختارهای ایکو وجهی منظم است و آلومینیوم بخش مهمی از بسیاری از آلیاژهای شبه کریستال ایکو وجهی، از جمله کلاس Al-Zn-Mg را تشکیل میدهد.[۵]
واکنشهای فلز آلومینیوم[ویرایش]

آلومینیوم با نافلزات تحت دمای بالا واکنش نشان میدهد که در نتیجه ترکیباتی مانند نیترید آلومینیوم (AlN)، سولفید آلومینیوم (Al2S3)، و هالیدهای آلومینیوم (ALX3). همچنین طیف وسیعی از ترکیبات بین فلزی شامل فلزاتی از هر گروه جدول تناوبی را تشکیل میدهد. آلومینیوم دارای میل شیمیایی بالایی به اکسیژن است که آن را برای استفاده به عنوان یک عامل کاهنده در واکنش ترمایت مناسب میکند. پودرهای ریز فلز آلومینیوم در تماس با اکسیژن مایع واکنش انفجاری میدهند. با این حال، در شرایط عادی، آلومینیوم یک لایه اکسید نازک تشکیل میدهد که از فلز در برابر خوردگی بیشتر به وسیله اکسیژن، آب یا اسید رقیق محافظت میکند. به این فرایند غیرفعالسازی میگویند.[۲] این لایه در تماس با جیوه به علت ادغام شدن یا در تماس با نمک برخی از فلزات با الکترونگاتیویتی مثبت از بین میرود.[۲] به این ترتیب، قویترین آلیاژهای آلومینیوم به دلیل واکنشهای گالوانیکیای که با مس آلیاژی میدهند مقاومت به خوردگی پایینتری دارند، همچنین مقاومت به خوردگی آلومینیوم توسط نمکهای آبی، بهویژه در حضور فلزات غیرمشابه، بسیار کاهش مییابد.[۱] علاوه بر این، اگر چه واکنش آلومینیوم با آب در دمای کمتر از ۲۸۰ درجه سانتیگراد برای تولید هیدروژن مورد توجه است، کاربرد تجاری این واقعیت در دور زدن لایه اکسید غیرفعال که واکنش را مهار میکند و در ذخیره انرژی مورد نیاز برای بازسازی فلز آلومینیوم چالشهایی دارد.[۶]
لولهکشی خانگی هرگز از آلومینیوم ساخته نمیشود زیرا در درجه اول به دلیل اینکه به وسیله کلریدهای محلول مانند کلرید سدیم معمولی، خورده میشود. با این حال، به دلیل مقاومت عمومی آن در برابر خوردگی، آلومینیوم یکی از معدود فلزاتی است که بازتاب نقره ای را در حالت پودری با اندازههای ریز حفظ میکند و آن را به یکی از اجزای مهم رنگهای نقره ای تبدیل میکند. آلومینیوم با سطح براق آینه ای بالاترین بازتاب را در بین فلزات مناطق ۲۰۰–۴۰۰ نانومتر (UV) و ۳۰۰۰–۱۰۰۰۰ نانومتر (IR دور) دارد؛ در محدوده مرئی ۴۰۰–۷۰۰ نانومتر قلع و نقره کمی بهتر از آلومینیوم هستند و در ۷۰۰–۳۰۰۰ نانومتر (IR نزدیک) نقره، طلا و مس کمی بهتر از آلومینیوم هستند.
در اسید هیدروکلریک غلیظ داغ، آلومینیوم با آب واکنش میدهد و هیدروژن تولید میکند، و در هیدروکسید سدیم یا هیدروکسید پتاسیم آبدار در دمای اتاق برای تشکیل آلومیناتها واکنش میدهد - غیرفعال شدن محافظ در این شرایط ناچیز است. واکنش با مواد قلیاییهای آبدار اغلب بدین صورت نوشته میشود:[۲]
- Al + NaOH + H2O → NaAlO 2 +3/2 H 2
اگر چه گونههای آلومینیوم در محلول احتمالاً به جای آنیون آلومیناتهای چهار هیدروکسیده هیدراته مینشیند، [Al(OH)4]- یا [Al(H2O)2(OH)4]-.[۲]
اسیدهای اکسید کننده بهطور مؤثر به آلومینیوم با خلوص بالا حمله نمیکنند زیرا لایه اکسید فلز را تشکیل میدهد و این لایه از فلز محافظت میکند. با این وجود تیزاب سلطانی آلومینیوم را حل میکند. این موضوع اجازه میدهد تا از آلومینیوم برای ذخیره موادی مانند اسید نیتریک، اسید سولفوریک غلیظ و برخی اسیدهای آلی استفاده شود.
ترکیبات غیر آلی[ویرایش]
اکثریت قریب به اتفاق ترکیبات، از جمله تمام مواد معدنی حاوی آلومینیوم و همه ترکیبات آلومینیومی مهم تجاری، دارای آلومینیوم در حالت اکسیداسیون ۳+ هستند. عدد هم آرایی چنین ترکیباتی متفاوت است، اما بهطور کلی Al3+ دارای شش یا چهار مختصات است. تقریباً تمام ترکیبات آلومینیوم (III) بیرنگ هستند.[۲]
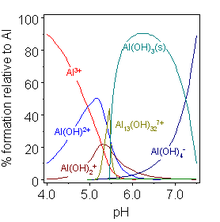
در محلول آبدار Al3+ به عنوان کاتیون هگزاآکوا وجود دارد [Al(H2O)6]3+، که دارای ثابت تفکیک اسیدی حدودی 10-5 است.[۷] چنین محلولهایی، اسیدی هستند زیرا این کاتیون میتواند به عنوان دهنده پروتون عمل کند و به تدریج با هیدرولیزه شدن به 2+[Al(H2O)5(OH)] ,+[Al(H2O)4(OH)2] و غیره تبدیل میشوند. با افزایش pH، این گونههای تک هستهای با تشکیل پلهای هیدروکسیدی شروع به جمع شدن با هم میکنند،[۲] که یونهای الیگومری زیادی را مانند یون Keggin [Al13O4(OH)24(H2O)12]7+ را تشکیل میدهند.[۷] این فرایند با رسوب هیدروکسید آلومینیوم، Al(OH)3 به پایان میرسد. این برای شفاف سازی آب مفید است، زیرا رسوب بر روی ذرات معلق موجود در آب جوانه زنی میکند و در نتیجه آنها را از بین میبرد. افزایش بیشتر pH منجر به حل شدن مجدد هیدروکسید به صورت آلومینات میشود [Al(H2O)2(OH)4]-. هیدروکسید آلومینیوم هم نمکها و هم آلومیناتها را تشکیل میدهد و در اسیدها و قلیاییها حل میشود و همچنین در پیوستن به ترکیبات اکسیدی اسیدی و بازی در آنها حل میشود:[۲]
- Al2O3 + 3 SiO2 Al2(SiO3)3
- Al2O3 + CaO Ca(AlO2)2
این رفتار Al(OH)3 آمفوتریسم نامیده میشود و مشخصه کاتیونهای ضعیف بازی است که هیدروکسیدهای نامحلول را تشکیل میدهند و گونههای هیدراته آنها نیز میتوانند پروتونهای خود را اهدا کنند. نمونههای بیشتر این خاصیت عبارتند از Be 2+، Zn 2+، Ga 3+، Sn 2 و Pb2. همچنین، گالیم در همین گروه کمی اسیدی تر از آلومینیوم است. یکی از تأثیرات این قضیه این است که نمکهای آلومینیوم با اسیدهای ضعیف در آب با هیدروکسیده شدن به هیدروکسید آبدار و هیدرید غیرفلزی مربوطه تبدیل میشوند: سولفید آلومینیوم، سولفید هیدروژن را تولید میکند، نیترید آلومینیوم، آمونیاک را و کاربید آلومینیوم، متان را تولید میکند. سیانید آلومینیوم، استات و کربنات در محلول آبی وجود دارند اما در حالت فعلی آنها ناپایدار هستند. هیدرولیز ناقص فقط برای نمکهای دارای اسیدهای قوی مانند هالیدها، نیتراتها و سولفاتها صورت میگیرد. به دلایل مشابه، نمکهای آلومینیوم بدون آب را نمیتوان با گرم کردن «هیدراتهای» آنها ساخت: کلرید آلومینیوم هیدراته در واقع AlCl3 · 6H2O نیست بلکه [Al(H2O)6]Cl3 است و پیوندهای Al-O آنقدر قوی که حرارت دادن برای شکستن آنها و تشکیل پیوندهای Al-Cl به جای آن کافی نیست:[۲]
هر چهار تری هالیدها به خوبی شناخته شدهاند. بر خلاف ساختار سه تری هالید سنگین تر، فلوراید آلومینیوم (AlF3) دارای آلومینیوم با شش مختصات است که بیانگر فرار نبودن و حل نشدن آن و همچنین گرمای زیاد تشکیل آن است. هر اتم آلومینیوم توسط شش اتم فلوئور در یک آرایش هشت وجهی تحریف شده (پیچیده شده) احاطه شدهاست. هر اتم فلوئور بین گوشههای دو هشت وجهی در ساختار ReO 3 پیچیده شده به اشتراک گذاشته شدهاست. چنین واحدهای AlF 6 در فلورید پیچیده نیز مانند کریولیت، Na3AlF6 وجود دارد ولی نباید به عنوان آنیونهای پیچیده [AlF 6] 3- در نظر گرفته شود. به این دلیل که پیوندهای ALF در نوع پیوند از M-F دیگر تفاوت خاصی ندارند.[۸] چنین تفاوتهایی در هماهنگی بین فلوریدها و هالیدهای سنگینتر غیرعادی نیستند، به عنوان مثال در Sn IV و Bi III نیز این تفاوتها وجود دارند. حتی تفاوتهای بزرگتری بین CO 2 و SiO 2 رخ میدهد.[۸] AlF 3 در ۱۲۹۰ درجه سانتی گراد (۲۳۵۴ درجه فارنهایت) ذوب میشود و از واکنش اکسید آلومینیوم با گاز هیدروژن فلوراید در دمای ۷۰۰ درجه سلسیوس (۱٬۲۹۲ درجه فارنهایت) به وجود میآید.[۸]

در هالیدهای سنگین تر، تعداد مختصاتها کمتر است. تری هالیدهای دیگر دیمری یا پلیمری هستند که چهار ضلعیهای چهار مختصاتی با آلومینویم در مرکز آنها. تری کلرید آلومینیوم (AlCl3) در زیر نقطه ذوب خود ۱۹۲٫۴ درجه سلسیوس (۳۷۸ درجه فارنهایت) دارای ساختار پلیمری لایه ای است اما با ذوب شدن به دایمرهای Al2Cl6 با افزایش همزمان ۸۵ درصد حجم و از دست دادن تقریباً کل هدایت الکتریکی خود تبدیل میشوند. این مواد هنوز در فاز گاز در دماهای پایین (۱۵۰–۲۰۰ درجه سانتی گراد) غالب هستند، اما در دماهای بالاتر بهطور فزاینده به مونومرهای AlCl3 مسطح مثلثی شبیه به ساختار جدا BCL3 تبدیل میشوند. آلومینیوم تریبرمید و تری یدید آلومینیوم در هر سه فاز Al2X6 دیمر را تشکیل میدهند و از این رو چنین تغییرات قابل توجهی از خواص بر تغییر فاز را نشان نمیدهد.[۸] این مواد با عمل آوری فلز آلومینیوم با هالوژن تهیه میشوند. تری هالیدهای آلومینیوم بسیاری از ترکیبات افزودنی یا کمپلکس را تشکیل میدهند. ماهیت اسیدی لوئیسی آنها، آنها را به عنوان کاتالیزور برای واکنشهای فریدل- کرافت مفید میکند. تری کلرید آلومینیوم دارای کاربردهای صنعتی عمده ای است که شامل این واکنش میشود، مانند ساخت آنتراکینونها و استایرنها. همچنین اغلب به عنوان پیش ماده برای بسیاری از ترکیبات آلومینیوم دیگر و به عنوان یک واکنشگر برای تبدیل فلوریدهای غیر فلزی به کلریدهای مربوطه (یک واکنش ترانس هالوژناسیون) استفاده میشود.[۸]
- AlCl3 + 3LiZ → 3LiCl + AlZ3 (Z=R , NR2، N=CR2)
- AlCl3 + 4 LiZ → 3 LiCl + LiAlZ4 (Z=R, NR2، N=CR2، H)
- BF3 + AlCl3 → AlF3 + BCl3
آلومینیوم یک اکسید پایدار با فرمول شیمیایی Al2O3 را تشکیل میدهد که معمولاً آلومینا نامیده میشود. میتوان آن را در طبیعت در مواد معدنی کوراندوم، α-آلومینا یافت. همچنین فاز γ-آلومینا وجود دارد.[۷] از آنجایی که کوراندوم بسیار سخت است (سختی Mohs 9)، دارای نقطه ذوب بالایی ۲٬۰۴۵ درجه سلسیوس (۳٬۷۱۳ درجه فارنهایت)، فراریت بسیار کم، از نظر شیمیایی خنثی، عایق الکتریکی خوب است. اغلب در سایندهها (مانند خمیر دندان)، به عنوان ماده نسوز و در سرمانیک استفاده میشود و همچنین به عنوان ماده اولیه برای تولید فلز آلومینیوم از فرایند الکترولیت از آن استفاده میشود. یاقوت کبود و یاقوت سرخ کوروندوم ناخالص آلوده به مقادیر کمی از فلزات دیگر هستند.[۷] دو اکسید هیدروکسید اصلی، AlO(OH)، بوهمیت و دیاسپور هستند. سه تری هیدروکسید اصلی وجود دارد: bayerite، ژیپسیت و nordstrandite، که دارای ساختارهای کریستالی متفاوتی هستند (پلی مورف). بسیاری از ساختارهای میانی و مرتبط دیگر نیز شناخته شدهاند.[۷] بیشتر آنها از سنگ معدن با بهکارگیری انواع فرآیندهای مرطوب با استفاده از اسید و باز تولید میشوند. حرارت دادن هیدروکسیدها منجر به تشکیل کوراندوم میشود. این مواد برای تولید آلومینیوم اهمیت اساسی دارند و خود به تنهایی بسیار مفید هستند. برخی از فازهای اکسید مخلوط نیز بسیار مفید هستند، مانند لعل (MgAl2O4)، Na-β-آلومینا (NaAl11O17)، و تری کلسیم آلومینات (Ca3Al2O6، فاز معدنی مهمی در سیمان پرتلند).[۷]
تنها کالکوژنیدهای پایدار در شرایط عادی عبارتند از سولفید آلومینیوم (Al2S3)، سلنید (Al2Se3) و تلورید (Al2Te3). هر سه با واکنش مستقیم عناصر خود در حدود ۱٬۰۰۰ درجه سلسیوس (۱٬۸۳۲ درجه فارنهایت) و هیدرولیز کامل با سرعت بالا در آب، هیدروکسید آلومینیوم و کالکوژنید هیدروژن مرتبط را تولید میکنند. از آنجایی که آلومینیوم نسبت به این کالکوژنها اتم کوچکی است، این کالکوژنها دارای آلومینیوم چهار وجهی مختصات چهارگانه با پلی مورفهای مختلف با ساختارهای مشابه ورتزیت هستند. در این کالکوژنها دو سوم مکانهای فلزی ممکن به صورت منظم (α) یا تصادفی (β) اشغال شدهاند؛ سولفید همچنین دارای یک فرم γ مربوط به γ-آلومینا، و یک فرم شش ضلعی غیر معمول با دمای بالا است که در آن نیمی از اتمهای آلومینیوم دارای چهار وجهی چهار مختصاتی و نیمی دیگر دارای سه ضلعی دو هرمی پنج مختصاتی هستند.[۹] چهار ترکیبات گروه نیتروژنی، نیترید آلومینیوم (AlN)، فسفید آلومینیوم (AlP)، آرسنید آلومینیوم (AlAs) و آنتیمونید آلومینیوم (AlSb) شناخته شدهاند. همه آنها نیمه هادیهای III-V ایزوالکترونیک نسبت به سیلیکون و ژرمانیوم هستند که همه آنها به جز AlN ساختار ترکیبی روی دارند. هر چهار ترکیب را میتوان با واکنش مستقیم در دمای بالا (و احتمالاً فشار بالا) عناصر سازنده آنها ایجاد کرد.[۹]
حالتهای اکسیداسیون نادرتر[ویرایش]
اگرچه اکثر ترکیبات آلومینیوم دارای مرکزهای 3+Al هستند، ترکیباتی با حالت اکسیداسیون پایینتر شناخته شدهاند و گاهی اوقات به عنوان پیشساز گونههای 3+Al اهمیت دارند.
آلومینیوم (I)[ویرایش]
AlF, AlCl, AlBr و AlI زمانی که تری هالید مربوطه با آلومینیوم در دماهای برودتی گرم میشوند در فاز گازی وجود دارند. ناپایداری آنها در فاز متراکم به دلیل عدم تناسب آنها با آلومینیوم و تری هالید مربوطه است: واکنش معکوس در دماهای بالا ترجیح داده میشود (اگرچه حتی در آن شزایط، آنها هنوز هم عمر کوتاهی دارند) که توضیح میدهد چرا AlF3 هنگام گرم شدن در وجود فلز آلومینیوم فرارتر است. همینطور برای حاتی که فلز آلومینیوم در حضور ALCL3 گرم میشود هم این اتفاق میافتد.[۸]
یک فراورده پایدار از مونویدید آلومینیوم، ترکیب اضافی حلقوی تشکیل شده با تری اتیلامین، Al4I4(NEt3)4 است. همچنین از جنبه تئوری اگر فقط Al2O و Al2S مواد زودگذر باشند، Al2O با حرارت دادن اکسید معمولی Al2O 3 با سیلیکون در ۱٬۸۰۰ درجه سلسیوس (۳٬۲۷۲ درجه فارنهایت) در خلاء تولید میشود. چنین موادی به سرعت با مواد اولیه نامتناسب میشوند.[۱۰]
آلومینیوم (II)[ویرایش]
ترکیبات بسیار ساده Al(II) در واکنشهای فلز Al با اکسیدانها تولید یا مشاهده میشوند. به عنوان مثال، مونوکسید آلومینیوم، AlO، در فاز گاز پس از انفجار[۱۱] و در طیفهای جذب ستاره ای شناسایی شدهاست.[۱۲] ترکیباتی با فرمول R4Al2 که حاوی پیوند Al-Al هستند و R یک لیگاند آلی بزرگ است بهطور کامل تری بررسی شدهاست.
ترکیبات آلومینیمی آلی و هیدریدهای مرتبط با آن[ویرایش]
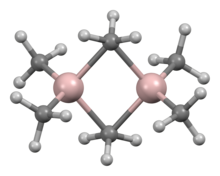
ترکیبات مختلف با فرمول تجربی AlR3 و AlR1.5Cl1.5 وجود دارد. تری آلکیلها و تری آریلهای آلومینیوم، مایعات واکنش پذیر، فرار و بیرنگ یا جامدات با دمای ذوب پایین هستند. آنها بهطور خود به خودی در هوا آتش میگیرند و با آب هم واکنش نشان میدهند، بنابراین در هنگام کار کردن با آنها احتیاطهای لازم است در نظر گرفته شود. آنها اغلب بر خلاف آنالوگهای بور خود، دایمر تشکیل میدهند، اما این تمایل، برای آلکیلهای زنجیره ای کاهش مییابد (مثلاً Pr i, Bu i, Me3CCH2); به عنوان مثال، تری ایزوبوتیل آلومینیوم به عنوان یک مخلوط تعادلی از مونومر و دایمر وجود دارد.[۱۳][۱۴] این دایمرها، مانند تری متیل آلومینیوم (Al2Me6)، معمولاً دارای مراکز آلومینیوم چهار وجهی هستند که با دایمر شدن همراه با برخی از گروههای آلکیل که بین هر دو اتم آلومینیوم پل میسازند، ایجاد میشوند. آنها اسیدهای سختی هستند و به آسانی با لیگاندها واکنش نشان میدهند و ترکیبات اضافی تشکیل میدهند. همانطور که کارل زیگلر کشف کرد در صنعت، آنها بیشتر در واکنشهای درج آلکن استفاده میشوند، مهمتر از همه در «واکنشهای رشد» که آلکنها و الکلهای اولیه بدون انشعاب با زنجیره بلند را تشکیل میدهند، و در فرایند پلیمر شدن کم فشار اتن و پروپن استفاده میشوند. همچنین برخی از ترکیبات هتروسیکلیک و ترکیبات آلومینیوم آلی خوشه ای که شامل پیوندهای Al-N هستند نیز وجود دارند.[۱۳]
مهمترین هیدرید آلومینیوم از نظر صنعتی، لیتیوم آلومینیوم هیدرید (LiAlH4) است که به عنوان یک عامل کاهنده در شیمی آلی استفاده میشود. میتوان آن را از لیتیوم هیدرید و تری کلرید آلومینیوم به دست آورد:[۱۵]
- 4LiH + AlCl3 → LiAlH4 + 3LiCl
سادهترین هیدرید، هیدرید آلومینیوم یا آلان، آن چنان مهم نیست. این هیدرید یک پلیمر با فرمول (AlH 3)n است، برخلاف هیدرید بور مربوطه که یک دایمر با فرمول (BH 3)2 است.[۱۵]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ Greenwood and Earnshaw, pp. 222–4
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ ۲٫۵ ۲٫۶ ۲٫۷ ۲٫۸ Greenwood and Earnshaw, pp. 224–7
- ↑ Greenwood and Earnshaw, pp. 112–3
- ↑ King, p. 241
- ↑ King, pp. 235–6
- ↑ "Reaction of Aluminum with Water to Produce Hydrogen" (PDF). U.S. Department of Energy. 1 January 2008. Archived from the original (PDF) on 14 September 2012.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ ۷٫۳ ۷٫۴ ۷٫۵ Greenwood and Earnshaw, pp. 242–52
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ ۸٫۴ ۸٫۵ Greenwood and Earnshaw, pp. 233–7
- ↑ ۹٫۰ ۹٫۱ Greenwood and Earnshaw, pp. 252–7
- ↑ Dohmeier, C.; Loos, D.; Schnöckel, H. (1996). "Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions". Angewandte Chemie International Edition. 35 (2): 129–149. doi:10.1002/anie.199601291.
- ↑ Tyte, D.C. (1964). "Red (B2Π–A2σ) Band System of Aluminium Monoxide". Nature. 202 (4930): 383–384. Bibcode:1964Natur.202..383T. doi:10.1038/202383a0.
- ↑ Merrill, P.W.; Deutsch, A.J.; Keenan, P.C. (1962). "Absorption Spectra of M-Type Mira Variables". The Astrophysical Journal. 136: 21. Bibcode:1962ApJ...136...21M. doi:10.1086/147348.
- ↑ ۱۳٫۰ ۱۳٫۱ Greenwood and Earnshaw, pp. 257–67
- ↑ Martin B. Smith, Journal of Organometallic Chemistry, The Monomer-Dimer Equilibria of Liquid Ammonium Alkyls II Triisobutylaluminum Journal of Organometallic Chemistry, Volume 22, Issue 2, April 1970, Pages 273-281. doi:10.1016/S0022-328X(00)86043-X
- ↑ ۱۵٫۰ ۱۵٫۱ Greenwood and Earnshaw, pp. 227–32
کتابشناسی - فهرست کتب[ویرایش]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link)

![{\displaystyle {\ce {2[Al(H2O)6]Cl3 ->[heat] Al2O3 + 6 HCl + 9 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/168398d3226cfefeb3ad06a36a418a74ba21b1cc)