پلیمر کوئوردیناسیونی

یک پلیمر کوئوردیناسیونی یک ساختار پلیمری معدنی یا آلی فلزی است که شامل مراکز کاتیون فلزی است که توسط لیگاندها در ارتباط است. بهطور رسمیتر، یک پلیمر کوئوردیناسیونی یک ترکیب کوئوردیناسیونی است که از گسترش یافتن اعضای کوئوردیناسیونی در یک، دو یا سه بُعد گسترش مییابد.[۱]
همچنین میتوان آن را به عنوان یک پلیمر توصیف کرد که اعضای تکرار شوندهٔ آن ترکیبهای کوئوردیناسیونی میباشد. پلیمرهای کوئوردیناسیونی شامل زیرمجموعهٔ شبکههای کوئوردیناسیونی هستند؛ که این شبکهها، خود ترکیبات کوئوردیناسیونی در حال گسترش، از طریق تکرار اعضای کوئوردیناسیونی، در ۱ بعد، اما با پیوندهای متقابل بین دو یا چند زنجیره، حلقه، یا اسپیرو پیوندهای انفرادی، یا یک ترکیب کوئوردیناسیونی در حال گسترش از طریق تکرار اعضای کوئوردیناسیونی در دو یا سه بعد هستند. یک زیر مجموعه از این شبکهها چهارچوبهای فلزی-آلی یا MOFها هستند که شبکههای کوئوردیناسیونی با لیگاندهای ارگانیک و دارای حفرههای بالقوه هستند.[۱]
پلیمرهای کوئوردیناسیونی به بسیاری از زمینهها مانند شیمی آلی و معدنی، بیوشیمی، علوم مواد، الکتروشیمی و داروسازی مرتبط هستند که باعث کاربرد زیاد آنها میشود.[۲] این ماهیت میان رشتهای منجر به مطالعه گستردهای در چند دهه گذشته شدهاست.[۳]
پلیمرهای کوئوردیناسیونی با توجه به ساختار و ترکیبشان میتوانند به چندین روش متفاوت طبقهبندی شوند. یکی طبقهبندی مهم آنها به عنوان دستهبندی ابعادی یاد شده. یک ساختار را میتوان بسته به تعداد جهاتی که در فضا گسترش یافتهاست، یک، دو یا سه بعدی تعیین کرد. یک ساختار تک بعدی در یک خط مستقیم (در امتداد محور x) گسترش مییابد. یک ساختار دو بعدی در یک صفحه (دو جهت، محور x و y) گسترش مییابد؛ و یک ساختار سه بعدی در هر سه جهت (محور x , y و z) گسترش مییابد.[۴] این در شکل ۱ نشان داده شدهاست.
تاریخ[ویرایش]
کار و تلاش آلفرد ورنر و معاصرانش زمینه را برای مطالعه پلیمرهای کوئوردیناسیونی فراهم کرد. اصطلاحات رایج در این زمینه، از جمله عدد کوئوردیناسیونی، توسط ورنر ابداع شدهاند. بسیاری از مواد رایج گذشته اکنون به عنوان پلیمرهای کوئوردیناسیونی شناخته میشوند. از جمله ترکیبهای سیانید، نیل فرنگی و کلاتراتهای هافمن.[۵]
سنتز و تکثیر[ویرایش]
پلیمرهای کوئوردیناسیونی اغلب توسط خودسامانی تهیه میشوند، که شامل تبلور نمک فلزی با لیگاند است. مکانیسمهای مهندسی کریستال و خود مونتاژ مولکولی مرتبط هستند.[۲]

روشهای سنتز استفاده شده برای تولید پلیمرهای کوئوردیناسیونی معمولاً همان روشهایی هستند که برای رشد هر بلوری مورد استفاده قرار میگیرند. اینها معمولاً شامل لایه بندی حلال (انتشار آهسته)، تبخیر آهسته و خنک شدن آهسته است. (از آنجا که روش اصلی توصیف پلیمرهای کوئوردیناسیونی کریستالوگرافی اشعه ایکس است، رشد یک کریستال با اندازه و کیفیت کافی مهم میباشد)
نیروهای بین مولکولی و پیوندها[ویرایش]
نیروهایی که ترکیباتلیگاند فلزی را تعیین میکنند شامل نیروهای واندروالسی، تعامل پای-پای، پیوند هیدروژنی و تثبیت پیوندهای پای توسط پیوندهای قطبی شده علاوه بر پیوند کوئوردیناسیونی بین فلز و لیگاند است. این نیروهای بین مولکولی نسبت به پیوندهای کووالانسی ضعیف هستند و فاصله تعادلی (طول باند) بیشتری دارند. به عنوان مثال مثال فعل و انفعالات PI-PI بین حلقههای بنزن، انرژی ای تقریباً معادل با ۵–۱۰ کیلوژول / مول و فاصلهٔ مطلوب ۳٫۴–۳٫۸ انگستروم بین صفحههای موازی از حلقهها دارند.
کوئوردیناسیونی[ویرایش]
ساختار بلوری و ابعاد پلیمر کوئوردیناسیونی بر اساس عملکرد اتصال دهنده و هندسه کوئوردیناسیونی مرکز فلز تعیین میشود. ابعاد بهطور کلی توسط مرکز فلزی هدایت میشود که میتواند به ۱۶ محل با پیوند دهندهها پیوند داشته باشد. با این وجود این همیشه اتفاق نمیافتد زیرا پیوند دهنده هنگامی که به مراکز فلزی بیشتری متصل شده باشد تا مرکز فلزی به پیوند دهندهها، میتواند هدایت ابعاد ساختار را در دست بگیرد.[۶] بالاترین عدد کوئوردیناسیونی شناخته شده از یک پلیمر کوئوردیناسیونی ۱۴ است،[۷] اگرچه عدد کوئوردیناسیونی اغلب بین ۲ تا ۱۰ میباشد.[۸] نمونههایی از اعداد مختلف کوئوردیناسیون در هندسه مسطح در شکل ۲ نشان داده شدهاست. در شکل ۱ عدد کوئوردیناسیونی برای ساختار یک بدی ۲، برای ساختار ۲ بعدی ۴ و برای ساختار ۳ بعدی ۶ است.
مراکز فلزی[ویرایش]
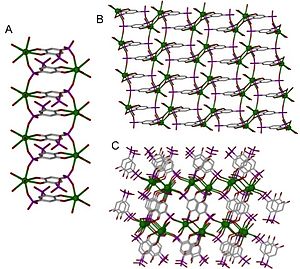
مراکز فلزی، که غالباً گره یا هاب نامیده میشوند، با تعداد مشخصی از پیوندها در زوایای کاملاً مشخص پیوند برقرار میکنند. تعداد پیوند دهندههای متصل به یک گره به عنوان عدد کوئوردیناسیون شناخته میشود که به همراه زوایایی که در آن قرار دارند، ابعاد ساختار را تعیین میکند. عدد کوئوردیناسیون و هندسه کوئوردیناسیونی یک مرکز فلزی توسط توزیع غیریکنواخت چگالی الکترونی در اطراف آن تعیین میشود و بهطور کلی عدد کوئوردیناسیونی با افزایش اندازه کاتیون افزایش مییابد. چندین مدل، که برجستهترین آنها مدل هیبریداسیون و نظریه اوربیتال مولکولی، از معادله شرودینگر برای پیشبینی و توضیح هندسه کوئوردیناسیونیاستفاده میکنند، اما این کار به دلیل تأثیرات پیچیده محیط بر توزیع چگالی الکترونی دشوار است.[۱۰]
فلزات واسطه[ویرایش]
فلزات واسطه معمولاً به عنوان گره مورد استفاده قرار میگیرند. اوربیتالهای نیمه پر d، چه در اتم چه یون، میتواند پیوندهای متفاوتی بسته به محیط تشکیل دهد. این ساختار الکترونیکی باعث میشود که بعضی از آنها هندسههای کوئوردیناسیونی چندگانه ای را نشان دهند، به ویژه یونهای مس و طلا که به عنوان اتمهای خنثی دارای اوربیتالهای پر d کامل در لایههای بیرونی خود هستند.
لانتانید[ویرایش]
لانتانیدها اتمهای بزرگی هستند با عدد کوئوردیناسیون بین ۷ تا ۱۴. پیشبینی محیط کوئوردیناسیونی آنها دشوار است و باعث میشود استفاده از آنها به عنوان گره سخت باشد. آنها امکان ترکیب ذرات درخشان را ارائه میدهند.
فلزات قلیایی و قلیایی خاکی[ویرایش]
فلزات قلیایی و قلیایی خاکی به عنوان کاتیونهای پایدار وجود دارند. فلزات قلیایی به راحتی کاتیونهایی را با پوستههای پایداری تشکیل میدهند و رفتار کوئوردیناسیونی متفاوتی نسبت به لانتانیدها و فلزات واسطه دارند. سایش نمکی که در سنتز استفاده میشود به شدت بر آین فلزات تأثیر میگذارد، که اجتناب از آن دشوار است. پلیمرهای کوئوردیناسیونی نشان داده شده در شکل ۳، همه از فلزات گروه دو هستند. در اینجا، با افزایش شعاع فلز در گروه (از کلسیم به استرانسیوم تا باریم)، ابعاد این ساختارها افزایش مییابد.
Ligands[ویرایش]
در اکثر پلیمرهای کوئوردیناسیونی، یک لیگاند (اتم یا گروهی از اتمها) بطور رسمی یک جفت الکترون تنها به یک کاتیون فلزی اهدا میکند و از طریق یک رابطه اسیدی بر پایه لوئیس (اسیدها و بازهای لوئیس) یک ترکیب کوئوردیناسیونی را تشکیل میدهد. پلیمرهای کوئوردیناسیونیزمانی تشکیل میشوند که یک لیگاند توانایی تشکیل چند پیوند کوئوردیناسیونی را داشته باشد و به عنوان پلی بین مراکز فلزی متعدد عمل کند. به لیگاندهایی که میتوانند یک پیوند کوئوردیناسیونی را تشکیل دهند، مونودنتات گفته میشود، اما به آنهایی که پیوندهای کوئوردیناسیونی متعددی را تشکیل میدهند، که میتواند منجر به تشکیل پلیمرهای کوئوردیناسیونی شود، پلی دندات گفته میشود. لیگاندهای پلی دندات از اهمیت ویژه ای برخوردار هستند زیرا از طریق لیگاندهایی است که چندین مرکز فلزی را به یکدیگر وصل میکند که یک آرایش بیکران تشکیل میشود. لیگاندهای Polydentate همچنین میتوانند پیوندهای متعددی را با یک فلز (که به آن کی لیت شدن میگویند) برقرار کنند. لیگاندهای Monodentate نیز به عنوان ترمینال شناخته میشوند زیرا جایی برای ادامه شبکه فراهم نمیکنند. غالباً، پلیمرهای کوئوردیناسیونی شامل ترکیباتی از از لیگاندهای پلی- و مونودنتات، بریج، کلاتی و ترمینال هستند.
ترکیب شیمیایی[ویرایش]
تقریباً هر نوعی از اتم که یک جفت الکترون تنها داشته باشد میتواند در لیگاند گنجانیده شود. لیگاندهایی که معمولاً در پلیمرهای کوئوردیناسیونی یافت میشوند شامل پلی پیرییدینها، فننترولینها، هیدروکسی کینولینها و پلی کربوکسیلاتها هستند. معمولاً اتمهای اکسیژن و نیتروژن به عنوان محلهای اتصال شناخته میشوند، اما اتمهای دیگر مانند گوگرد[۱۱] و فسفر،[۱۲][۱۳] نیز مشاهده شدهاند.
لیگاندها و کاتیونهای فلزی تمایل به پیروی از روند تئوری پایه اسید نرم سخت (HSAB) دارند. این بدان معنا است که فلزات نرمتر، بزرگتر و قطبی تر با لیگاندهای نرمتر بزرگتر و قطبی تر هماهنگ میشوند و فلزات سخت کوچک، غیرقطبی، به راحتی با لیگاندهای کوچک، غیرقطبی و سخت هماهنگ میشوند.
جهتگیری ساختاری[ویرایش]

لیگاندها میتوانند انعطافپذیر یا صلب باشند. لیگاند سفت و سخت هیچ گونه آزادی در چرخش حول پیوندها یا تغییر ساختار مجدد در یک ساختار ندارد. لیگاندهای انعطافپذیر میتوانند خم شوند، به دور پیوندها بچرخند و ساختار خود را مجدداً تغییر دهند. این صورتبندیهای مختلف تنوع بیشتری در ساختار ایجاد میکنند. نمونههایی از پلیمرهای کوئوردیناسیونی وجود دارد که شامل دو پیکربندی یک لیگاند یکسان با یک ساختار،[۱۴] و همچنین دو ساختار جداگانه است که تنها تفاوت بین آنها جهتیابی لیگاند است.
طول لیگاند[ویرایش]
طول لیگاند میتواند یک عامل مهم در تعیین امکان شکلگیری یک ساختار پلیمری در مقابل ساختارهای غیر پلیمری (تک یا الیگومریک) باشد.[۱۵]
عوامل دیگر[ویرایش]
counterion[ویرایش]
علاوه بر انتخاب فلز و لیگاند، عوامل زیاد دیگری نیز وجود دارد که بر ساختار پلیمر کوئوردیناسیونی تأثیر میگذارد. به عنوان مثال، بیشتر مراکز فلزی یونهای دارای بار مثبت هستند که به عنوان نمک وجود دارند. counterion در نمک میتواند بر ساختار کلی تأثیر بگذارد. به عنوان مثال نمکهای نقره مانند AgNO 3، AgBF 4، AgClO 4، AgPF 6، AgAsF 6 و AgSbF 6 همه با یک لیگاند متبلور میشوند، ساختارها از نظر محیط کوئوردیناسیونی فلز متفاوت هستند. درست مانند ابعاد کل پلیمر کوئوردیناسیونی.[۱۶]
محیط تبلور[ویرایش]
علاوه بر این، تنوع در محیط تبلور نیز میتواند ساختار را تغییر دهد. تغییرات pH ,[۱۷] قرار گرفتن در معرض نور یا تغییر دما[۱۸] همگی میتوانند ساختار حاصل را تغییر دهند. تأثیرات ساختار بر اساس تغییرات محیط تبلور به صورت موردی تعیین میشود.
مولکولهای مهمان[ویرایش]

ساختار پلیمرهای کوئوردیناسیونی اغلب فضای خالی را به صورت منافذ یا کانالها در خود جای دادهاست. این فضای خالی ترمودینامیکی نامساعد است. به منظور تثبیت ساختار و جلوگیری از ریزش، منافذ یا کانالها غالباً توسط مولکولهای مهمان اشغال میشوند. مولکولهای مهمان با شبکه پیرامون پیوند برقرار نمیکنند، اما گاهی اوقات از طریق نیروهای بین مولکولی مانند پیوند هیدروژن یا انباشت pi ارتباط برقرار میکنند. بیشتر اوقات، مولکول مهمان حلال خواهد بود که پلیمر کوئوردیناسیونی در آن متبلور شدهاست، اما در اصل میتواند هر چیزی باشد (سایر نمکهای موجود، گازهای جوی مانند اکسیژن، نیتروژن، دیاکسید کربن و غیره).) حضور مولکول مهمان گاهی میتواند با پر کردن منافذ یا کانال، در ساختار تأثیر بگذارد، جایی که در غیر این صورت هیچ چیز دیگری وجود نخواهد داشت.
کاربردها[ویرایش]
پلیمرهای کوئوردیناسیونی به عنوان رنگها تجاری میشوند. به ویژه مشتقات آمینوفنول. رنگهای ترکیبات فلزی با استفاده از مس یا کروم معمولاً برای تولید رنگهای راکد استفاده میشوند. رنگهای لیگاند سهگانه مفید هستند زیرا نسبت به همتایهای دوتایی یا تک دندان خود پایدارتر هستند.[۱۹][۲۰]
یکی از پلیمرهای کوئوردیناسیونی تجاری اولیه، ترکیبات هافمن است که فرمول Ni (CN) 4 Ni (NH 3) 2 را دارد. این مواد با میهمانان آروماتیک کوچک (بنزن، زایلنهای خاص) متبلور میشوند و از این بهگزینی برای جداسازی این هیدروکربنها به صورت تجاری استفاده میشود.[۲۱]
روندهای تحقیق[ویرایش]
ذخیرهسازی مولکولی[ویرایش]
اگرچه هنوز عملی نیست، پلیمرهای هماهنگی متخلخل به عنوان غربالهای مولکولی به موازات کربن متخلخل و زئولیتها دارای پتانسیل هستند.[۵] اندازه و شکل منافذ به وسیله اندازه پیوند دهنده و طول لیگاندهای اتصال و گروههای عملکردی قابل کنترل است. برای ایجاد تغییر در اندازه منافذ به منظور دستیابی به جذب مؤثر، میهمانان غیر فرار در فضای پلیمری هماهنگ متخلخل برای کاهش اندازه منافذ جا داده میشوند. میهمانان فعال سطح نیز میتوانند در جذب سطحی استفاده شوند. به عنوان مثال، روزنه بزرگ MOF-177 به قطر۱۱٫۸ آنگستروم، میتواند با مولکولهای C 60 به قطر ۶٫۸۳ آنگستروم یا پلیمرهایی با یک سیستم بسیار درهم آمیخته به منظور افزایش سطح برای جذب H 2 آمیخته شود.
پلیمرهای کوئوردیناسیونی متخلخل انعطافپذیر برای ذخیرهسازی مولکولی بهطور بالقوه جذاب هستند، زیرا اندازه منافذ آنها با تغییرات فیزیکی قابل تغییر است. نمونه ای از این ممکن است در یک پلیمر مشاهده شود که حاوی مولکولهای گاز در حالت عادی آن است، اما پس از فشرده سازی، این پلیمر فرو میریزد و مولکولهای ذخیره شده را آزاد میکند. بسته به ساختار پلیمر، این امکان وجود دارد که ساختار به اندازه کافی انعطافپذیر باشد که ریزش منافذ قابل برگشت باشد و میتوان دوباره از پلیمر برای جذب مجدد مولکولهای گاز استفاده کرد.[۲۲] صفحه فریم ورک فلزی و ارگانیک دارای یک بخش مفصل است که با ذخیرهسازی گاز H 2 سروکار دارد.
لومینسانس[ویرایش]
پلیمرهای کوئوردیناسیونی درخشان بهطور معمول دارای لیگاندهای کرومورف آلی هستند که نور را جذب میکنند و سپس انرژی برانگیختگی را به یون فلزی منتقل میکنند. پلیمرهای کوئوردیناسیونی به دلیل جفت شدن خاصیت انتشار آنها با مبادله مهمان، بهطور بالقوه تطبیق پذیرترین گونههای نورانی هستند. معماریهای مافوق مولکولی درخشان اخیراً به دلیل پتانسیل کاربردهای زیادشان در دستگاههای نوری یا به عنوان حسگرها و پروبهای فلورسنت مورد توجه بسیاری قرار گرفتهاند. پلیمرهای کوئوردیناسیونی معمولاً نسبت به گونههای کاملاً آلی پایدار تر (مقاوم در برابر گرما و حلال) هستند. برای لیگاندهایی که بدون حضور اتصال دهنده فلزی فلورسانس میشوند (ناشی از LMCT نیست) ، انتشار درخشش در اثر نور این مواد تمایل به بزرگی مرتبه بالاتر از لیگاند آزاد به تنهایی دارد. از این مواد میتوان برای طراحی دیودهای ساطع کنندهٔ نور (LED) استفاده کرد. افزایش چشمگیر فلورسانس ناشی از افزایش صلبیت و عدم تقارن لیگاند هنگام هماهنگی با مرکز فلز است.[۲۳]
رسانایی الکتریکی[ویرایش]
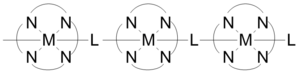
پلیمرهای کوئوردیناسیونی میتوانند پلهای غیر آلی کوتاه و پلهای درهم آمیخته آلی در ساختارهای خود داشته باشند که مسیرهای هدایت الکتریکی را فراهم میکند. برخی پلیمرهای کوئوردیناسیونی یک بعدی ساخته شده همانطور که در شکل نشان داده شده رسانایی ای در طیف 1x10 -6 تا 2x10 -1 سانتیمتر بر ثانیه را نشان میدهد. رسانایی به دلیل تعامل بین اوربیتال-d فلز و سطح pi * پل لیگاند است. در بعضی موارد، پلیمرهای کوئوردیناسیونی میتوانند دارای رفتار نیمه هادی باشند. ساتارهای سه بعدی متشکل از ورقهای پلیمرهای حاوی نقره نشان دهنده نیمه رسانایی در هنگام تراز کردن مراکز فلزی هستند و با رفتن اتمهای نقره به موازات عمود بر آن، رسانایی کاهش مییابد.[۲۳]
مغناطیس[ویرایش]
پلیمرهای کوئوردیناسیونی انواع مختلفی از مغناطیس را نشان میدهند. ضدفرومغناطیس، فری مغناطیس، و فرومغناطیس پدیدههای تعاونی چرخش مغناطیسی در داخل جامد ناشی از جفت شدن بین چرخشهای مراکز پارامغناطیسی هستند. برای اینکه مغناطیسی کارآمد داشته باشیم، یونهای فلزی باید توسط لیگاندهای کوچک که امکان تماس کوتاه فلزی-فلزی را دارند (مانند پلهای اکوسو، سیانو و آزیدو) متصل شوند.[۲۳]
قابلیت سنسور[ویرایش]
پلیمرهای کوئوردیناسیونی همچنین با تغییر مولکولهای حلال در ساختار میتوانند تغییرات رنگی را نشان دهند. نمونه ای از این دو پلیمر کوئوردیناسیونی Co خوشهٔ [Re 6 S 8 (CN) 6] 4− است که حاوی لیگاندهای آب است که با اتمهای کبالت هماهنگ میشوند. این محلول که در ابتدا نارنجی رنگ است با جایگزینی آب با تتراهیدروفوران و به رنگ بنفش یا سبز و با افزودن دی اتیل اتر به رنگ آبی تبدیل میشود؛ بنابراین پلیمر میتواند به عنوان یک سنسور حلال عمل کند که از نظر فیزیکی در حضور حلالهای خاص تغییر رنگ میدهد. تغییرات رنگ به حلال ورودی نسبت داده میشود که لیگاندهای آب را بر روی اتمهای کبالت جابجا میکنند، و در نتیجه باعث تغییر هندسه آنها از اکتاته به چهار ضلعی میشود.[۲۳]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ Batten, Stuart R.; Champness, Neil R.; Chen, Xiao-Ming; Garcia-Martinez, Javier; Kitagawa, Susumu; Öhrström, Lars; O'Keeffe, Michael; Suh, Myunghyun P.; Reedijk, Jan (2013). "Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013)". Pure and Applied Chemistry. 85 (8): 1715. doi:10.1351/PAC-REC-12-11-20.
- ↑ ۲٫۰ ۲٫۱ Fromm, K. (2008). "Coordination polymer networks with s-block metal ions" (PDF). Coord. Chem. Rev. 252 (8–9): 856–885. doi:10.1016/j.ccr.2007.10.032.
- ↑ Yang, Y.; Jiang, G.; Li, Y. Z.; Bai, J.; Pan, Y.; You, X. Z. (2006). "Synthesis, structures and properties of alkaline earth metal benzene-1,4-dioxylacetates with three-dimensional hybrid networks". Inorganica Chimica Acta. 359 (10): 3257. doi:10.1016/j.ica.2006.03.038.
- ↑ Chen, X; Ye, B.; Tong, M. (2005). "Metal-organic molecular architectures with 2,2′-bipyridyl-like and carboxylate ligands". Coord. Chem. Rev. 249 (5–6): 545–565. doi:10.1016/j.ccr.2004.07.006.
- ↑ ۵٫۰ ۵٫۱ Kitagawa, S.; Kitaura, R.; Noro, S. I. (2004). "Functional Porous Coordination Polymers". Angewandte Chemie International Edition. 43 (18): 2334. doi:10.1002/anie.200300610.
- ↑ Lamming, Glenn; El-Zubir, Osama; Kolokotroni, James; McGurk, Christopher; Waddell, Paul G.; Probert, Michael R.; Houlton, Andrew (2016-10-03). "Two-Dimensional Frameworks Based on Ag(I)–N Bond Formation: Single Crystal to Single Molecular Sheet Transformation". Inorganic Chemistry. 55 (19): 9644–9652. doi:10.1021/acs.inorgchem.6b01365. ISSN 0020-1669.
- ↑ Charpin, P. ; Nierlich, M. ; Vigner, D. ; Lance, M. ; Baudry, D. (1987). "Structure of the Second Crystalline Form of Uranium(IV) Tetrahydroborate". Acta Crystallographica Section C. 43 (8): 1465–p1467. doi:10.1107/S0108270187091431.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Robin, A. Y. ; Fromm, K. M. (2006). "Coordination polymer networks with O- and N-donors: What they are, why and how they are made". Coord. Chem. Rev. 250 (15–16): 2127–2157. doi:10.1016/j.ccr.2006.02.013.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Cote, A; Shimizu, G. (2003). "Coordination Solids via Assembly of Adaptable Components: Systematic Structural Variation in Alkaline Earth Organosulfonate Networks". Chem. Eur. J. 9 (21): 5361–5370. doi:10.1002/chem.200305102. PMID 14613146.
- ↑ Bernstein, Jeremy; Paul M. Fishbane; Stephen G. Gasiorowicz (April 3, 2000). Modern Physics. Prentice-Hall. p. 624. ISBN 978-0-13-955311-0.
- ↑ Wen, M.; Munakata, M.; Suenaga, Y.; Kuroda-Sowa, T.; Maekawa, M.; Yan, S. G. (2001). "Silver(I) coordination polymers of cyclic sulfur ligand, 2,2′,3,3′-tetrahydro-4,4′-dithia-1,1′-binaphthylidene". Inorganica Chimica Acta. 322 (1–2): 133–137. doi:10.1016/S0020-1693(01)00556-4.
- ↑ Hung-Low, F.; Klausmeyer, K. K.; Gary, J. B. (2009). "Effect of anion and ligand ratio in self-assembled silver(I) complexes of 4-(diphenylphosphinomethyl)pyridine and their derivatives with bipyridine ligands". Inorganica Chimica Acta. 362 (2): 426. doi:10.1016/j.ica.2008.04.032.
- ↑ Ricci, G.; Sommazzi, A.; Masi, F.; Ricci, M.; Boglia, A.; Leone, G. (2010). "Well-defined transition metal complexes with phosphorus and nitrogen ligands for 1,3-dienes polymerization". Coordination Chemistry Reviews. 254 (5–6): 661. doi:10.1016/j.ccr.2009.09.023.
- ↑ Knaust, J. M.; Keller, S. W. (2002). "A Mixed-Ligand Coordination Polymer from the in Situ, Cu(I)-Mediated Isomerization of Bis(4-pyridyl)ethylene". Inorganic Chemistry. 41 (22): 5650–2. doi:10.1021/ic025836c. PMID 12401066.
- ↑ Buvailo, Andrii I.; Gumienna-Kontecka, Elzbieta; Pavlova, Svetlana V.; Fritsky, Igor O.; Haukka, Matti (2010). "Dimeric versus polymeric coordination in copper(ii) cationic complexes with bis(chelating) oxime and amide ligands". Dalton Transactions. 39 (27): 6266–75. doi:10.1039/C0DT00008F. PMID 20520918.
- ↑ Carlucci, L.; Ciani, G.; Proserpio, D. M.; Rizzato, S. (2002). "New polymeric networks from the self-assembly of silver(i) salts and the flexible ligand 1,3-bis(4-pyridyl)propane (bpp). A systematic investigation of the effects of the counterions and a survey of the coordination polymers based on bpp". CrystEngComm. 4 (22): 121. doi:10.1039/b201288j.
- ↑ Ni, L. B.; Zhang, R. H.; Liu, Q. X.; Xia, W. S.; Wang, H.; Zhou, Z. H. (2009). "PH- and mol-ratio dependent formation of zinc(II) coordination polymers with iminodiacetic acid: Synthesis, spectroscopic, crystal structure and thermal studies". Journal of Solid State Chemistry. 182 (10): 2698–2706. Bibcode:2009JSSCh.182.2698N. doi:10.1016/j.jssc.2009.06.042. PMC 2778864. PMID 20161370.
- ↑ Tong, M. L.; Hu, S.; Wang, J.; Kitagawa, S.; Ng, S. W. (2005). "Supramolecular Isomerism in Cadmium Hydroxide Phases. Temperature-Dependent Synthesis and Structure of Photoluminescent Coordination Polymers of α- and β-Cd2(OH)2(2,4-pyda)". Crystal Growth & Design. 5 (3): 837. doi:10.1021/cg049610r.
- ↑ Grychtol, K. ; Mennicke, W. (2002) "Metal-Complex Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a16_299.
- ↑ Hunger, K. ; Mischke, P. ; Rieper, W. ; Raue, R. ; Kunde, K. ; Engel, A. (2002) "Azo Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_245.
- ↑ Atwood, J. L. (2012) "Inclusion Compounds" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a14_119
- ↑ Bureekaew, S.; Shimomura, S.; Kitagawa, S. (2008). "Chemistry and application of flexible porous coordination polymers". Science and Technology of Advanced Materials. 9 (1): 014108. Bibcode:2008STAdM...9a4108B. doi:10.1088/1468-6996/9/1/014108. PMC 5099803. PMID 27877934.
- ↑ ۲۳٫۰ ۲۳٫۱ ۲۳٫۲ ۲۳٫۳ Batten, Stuart R. (2008). Coordination Polymers: Design, Analysis and Application. RSC Publishing. pp. 297–307, 396–407. doi:10.1039/9781847558862. ISBN 978-0-85404-837-3.