نشانگر زیستی سرطان
نشانگر زیستی سرطان به ماده یا فرایندی گفته میشود که نشاندهندۀ وجود سرطان در بدن است. نشانگر زیستی نیز ممکن است مولکولی باشد که توسط تومور ترشح شود. در ضمن میتواند مولکولی در اثر واکنش بدن به سٰرطان باشد و ترشح شود. از نشانگرهای زیستی ژنتیکی،[۱] اپی ژنتیک،[۲] پروتئومیک،[۳] گلایکومیک،[۴] و تصویربرداری میتوان برای تشخیص سرطان، پیشگیری و اپیدمیولوژی (همهگیرشناسی) استفاده کرد. در حالت کلی، این نشانگرهای زیستی میتوانند در مایعات زیستی غیر تهاجمی مانند خون یا سرم مورد سنجش قرار گیرند.[۵]

چالشهای زیادی در انتقال و بررسی تحقیقات نشانگر زیستی به فضای بالینی وجود دارد. تعدادی از نشانگرهای زیستی مبتنی بر ژن و پروتئین، در بعضی از موارد در مراقبتی، شناخت و درمان بیمار استفاده شدهاست. از جمله این موارد میتوان به AFP (سرطان کبد)، BCR-ABL (سرطان خون میلوئیدی مزمن)، BRCA1 / BRCA2 (سرطان پستان / تخمدان)، BRAF V600E (ملانوم / سرطان روده بزرگ)، CA-125 (سرطان تخمدان)، CA19.9 (سرطان لوزالمعده))، CEA (سرطان روده بزرگ)، EGFR (سرطان ریه سلول کوچک)، HER-2 (سرطان پستان)، KIT (تومور استرومایی دستگاه گوارش)، PSA (آنتیژن اختصاصی پروستات) (سرطان پروستات)، S100 (ملانوم) اشاره کرد.[۶][۷][۸][۹][۱۰][۱۱][۱۲][۱۳][۱۴] عمدهترین نشانگرهای زیستی سرطانها، پروتئینهای جهش یافته هستند زیرا فقط از تومور موجود میتوانند تولید شوند. این پروتئینهای جهش یافته توسط Selected Reaction Monitoring (SRM) شناسایی میشوند.[۱۵] در صورت تشخیص زودهنگام از طریق معاینه، حدود ۴۰٪ از سرطانها قابل درمان هستند.[۱۶]
تعریف نشانگرهای زیستی سرطان[ویرایش]
سازمانها و نشریات تعاریف متفاوتی از نشانگر زیستی ارائه میدهند. در بسیاری از زمینههای پزشکی، نشانگرهای زیستی به پروتئینهای قابل شناسایی یا اندازهگیری در خون یا ادرار گفته میشود. این اصطلاح غالباً برای پوشش دادن هر خاصیت مولکولی، بیوشیمیایی، فیزیولوژیکی یا آناتومیکی قابل عددسازی یا اندازهگیری است.
بهطور خاص، انستیتوی ملی سرطان آمریکا (NCI)، نشانگر زیستی را چنین تعریف میکند: یک مولکول بیولوژیکی که در خون، مایعات بافتی یا بافتها یافت میشود. این مولکول میتواند نشانه فرایند عادی یا غیرعادی، یک بیماری یا حالت باشد. یک نشانگر زیستی نیز میتواند برای بررسی نحوه پاسخ بدن به یک درمان برای بیماری یا وضعیت استفاده شود. نشانگر مولکولی و مولکول اثر نیز نامیده میشود.[۱۷]
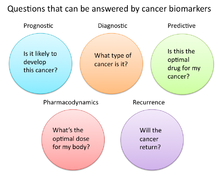
در تحقیقات سرطان و پزشکی، سه روش عمده استفاده از نشانگرهای زیستی وجود دارد:[۱۸]
- کمک به تشخیص شرایط، مانند شناسایی سرطانها در مراحل اولیه (تشخیصی)
- پیشبینی میزان تهاجمی بودن وضعیت، مانند تعیین توانایی جبران خسارت بیمار در غیاب درمان (پیشبینی)
- پیشبینی پاسخ بیمار به درمان (پیشبینی)
نقش نشانگرهای زیستی در تحقیقات سرطان و پزشکی[ویرایش]
موارد استفاده از نشانگرهای زیستی در داروی سرطان[ویرایش]
ارزیابی ریسک[ویرایش]
نشانگرهای زیستی سرطان، به ویژه آنهایی که با جهشهای ژنتیکی یا تغییرات اپی ژنتیکی مرتبط هستند، معمولاً یک روش کمی برای تعیین زمان مستعد بودن افراد برای مبتلا شدن به انواع خاصی از سرطانها ارائه میدهند. نمونههای مهم و اصلی نشانگرهای زیستی پیشبینی سرطان شامل جهش در ژنهای KRAS، p53، EGFR , erbB2 برای سرطان روده بزرگ، مری، کبد و لوزالمعده است. موارد دیگری نیز مانند جهش ژنهای BRCA1 و BRCA2 در سرطان پستان و تخمدان، متیلاسیون غیرطبیعی ژنهای سرکوبگر تومور p16، CDKN2B و p14ARF برای سرطان مغز وجود دارد. متیلاسیون بیش از حد، MYOD1، CDH1 و CDH13 برای سرطان دهانه رحم، و هیپرمتیلاسیون از P16، P14، و RB1، برای سرطان دهان هم وجود دارد.[۱۹]
تشخیص[ویرایش]
نشانگرهای زیستی سرطان میتوانند تشخیص خاص سرطان نیز مفید باشند. این امر به ویژه در مواردی وجود دارد که نیاز به تعیین وضعیت تومورهای اصلی یا متاستاتیک باشد. برای ایجاد این تمایز، محققان میتوانند تغییرات کروموزومی موجود در سلولهای واقع در محل تومور اولیه را در مقایسه با آنچه در محل ثانویه یافت میشود، غربال کنند. در صورت مطابقت تغییرات میتوان تومور ثانویه را متاستاتیک تشخیص داد. در حالی که اگر تغییرات متفاوت باشد، تومور ثانویه را میتوان به عنوان یک تومور اولیه مشخص تشخیص داد.[۲۰] به عنوان مثال، افراد مبتلا به تومور به دلیل سلولهای سرطانی که از طریق آپوپتوز عبور کردهاند، سطح بالایی از DNA تومور در حال گردش در بدن (ctDNA) دارند.[۲۱] این نشانگر تومور در خون، بزاق یا ادرار قابل تشخیص است.[۱۶] با توجه به ناهمگنی بالای مولکولی تومورها که توسط مطالعات تعیین توالی نسل بعدی مشاهده شدهاست، به تازگی امکان شناسایی نشانگر زیستی مؤثر برای تشخیص زودهنگام سرطان زیر سؤال رفتهاست.[۲۲]
پیشبینی تشخیصی و پیشبینیهای درمانی[ویرایش]
موارد دیگر استفاده از نشانگرهای زیستی در درمان سرطان برای پیشگیری بیماری است که پس از تشخیص سرطان در فرد صورت میگیرد. در اینجا نشانگرهای زیستی میتوانند در تعیین میزان بدخیم یا خوشخیم بودن یک سرطان شناسایی و تعیین شوند. همچنین در تعیین احتمال واکنش بدن و موفقیت درمان معین مفید باشند. به دلیل این که تومورهایی که نشانگرهای زیستی خاصی از خود نشان میدهند، ممکن است به درمانهای مرتبط با بیان یا حضور نشانگر زیستی پاسخ دهند. نمونههایی از این نشانگرهای زیستی پیشگیری شامل افزایش سطح مهارکننده متالوپپتیداز 1 (TIMP1)، نشانگر مرتبط با اشکال تهاجمی تری از میلوما،[۲۳] گیرنده استروژن بالا (ER) یا بیان گیرنده پروژسترون (PR) است. نشانگرهای مرتبط با بهتر است بقای کلی در بیماران مبتلا به سرطان پستان.[۲۴][۲۵] تقویت ژن HER2 / neu، نشانگر نشان دهنده سرطان پستان به درمان تراستوزوماب پاسخ میدهد.[۲۶][۲۷] جهش در اگزون ۱۱ پروتئین-انکوژن c-KIT، نشانگر نشانگر تومور استرومایی دستگاه گوارش (GIST) احتمالاً به درمان ایماتینیب پاسخ خواهد داد.[۲۸][۲۹] و جهش در حوزه تیروزین کیناز EGFR1، نشانگر نشانگر سرطان ریه سلول کوچک سلول بیمار (NSCLC) احتمالاً به درمان ژفیتینیب یا ارلوتینیب پاسخ خواهد داد.[۳۰][۳۱]
فارماکودینامیک و فارماکوکینتیک[ویرایش]
نشانگرهای زیستی را همچنین میتوان برای تعیین موثرترین روش درمانی برای سرطان یک فرد خاص استفاده کرد.[۳۲] به دلیل تفاوت در ترکیب ژنتیکی هر فرد، اثرگذاری ساختار شیمیایی داروها را در هر فرد ممکن است متفاوت باشد. در برخی موارد، کاهش متابولیسم داروهای خاص میتواند شرایط خطرناکی را ایجاد کند که در آن سطح بالایی از دارو در بدن انباشته شود. به همین ترتیب، تصمیمات مربوط به دوز دارو در درمانهای خاص سرطان میتواند از غربالگری این نشانگرهای زیستی بهرهمند شود. به عنوان مثال، ژن رمزگذار آنزیم تیوپورین متیل ترانسفراز (TPMPT) است.[۳۳] افراد مبتلا به جهش در ژن TPMT قادر به متابولیسم و مصرف مقادیر زیادی از داروی مرکاپتوپورین که برای سرطان خون استفاده میشود، نیستند. این مورد بهطور بالقوه باعث کاهش بسیار زیاد تعداد گلبول سفید خون در چنین بیمارانی میشود. به بیماران با جهش TPMT توصیه میشود برای رعایت نکات ایمنی، دوز کمتری از مرکاپتوپورین به آنها داده شود.[۳۴]
نظارت و کنترل بر پاسخ درمانی[ویرایش]
نشانگرهای زیستی سرطان همچنین در نظارت بر عملکرد یک درمان در طول زمان کاربرد دارند. تحقیقات زیادی در این زمینه خاص انجام شدهاست؛ زیرا نشانگرهای زیستی این امکان را دارند که هزینهها را بهطور قابل توجهی در فرایند درمان و مراقبت بیمار کاهش دهند. توجه به این نکته هم مهم است که آزمایشهای مبتنی بر تصویر مانند CT و MRI برای نظارت بر وضعیت تومور بسیار پرهزینه هستند.[۳۵]
یک نشانگر زیستی مهم، نشانگر زیستی پروتئین S100 -beta است که برای بررسی پاسخ ملانوم بدخیم، به کار میرود. در چنین ملانومها، ملانوسیتها که سلولهای رنگدانه پوست هستند، پروتئین S100-beta را در غلظتهای بالا و وابسته به تعداد سلولهای سرطانی تولید میکنند؛ بنابراین پاسخ به درمان با کاهش سطح S100-beta در خون چنین افرادی همراه است.[۳۶][۳۷]
به همین ترتیب، تحقیقات آزمایشگاهی نشان دادهاست که سلولهای توموری که تحت آپوپتوز قرار میگیرند میتوانند اجزای سلولی مانند سیتوکروم c، نوکلئوزومها، سیتوکراتین -۱۸ شکاف خورده و E-cadherin را آزاد کنند. مطالعات نشان دادهاست که این ماکرومولکولها و سایر مواد میتوانند در جریان سرطان در گردش خون وجود داشته باشند و منبع بالقوه ای از معیارهای بالینی را برای نظارت بر درمان فراهم میکنند.[۳۵]
عود[ویرایش]
نشانگرهای زیستی سرطان همچنین میتوانند در پیشبینی یا نظارت بر عود سرطان کاربرد داشته باشند. روش Oncotype DX® سرطان پستان یکی از این آزمایشها است که برای پیشبینی احتمال عود سرطان پستان استفاده میشود. آزمایش Thist برای زنانی که در مراحل اولیه (مرحله I یا II)، گره منفی، گیرنده استروژن مثبت (ER +) سرطان مهاجم پستان قرار دارند و تحت درمان با هورمون درمانی قرار دارند، در نظر گرفته شدهاست. Oncotype DX پانلی از ۲۱ ژن را در سلولهای گرفته شده در طی بیوپسی تومور بررسی میکند. نتایج آزمون به صورت درجه عود آورده میشود که احتمال عود در ده سال را نشان میدهد.[۳۸][۳۹]
موارد استفاده از نشانگرهای زیستی در تحقیقات سرطان[ویرایش]
ایجاد اهداف دارویی[ویرایش]
از نشانگرهای زیستی در تمام مراحل کشف داروی مؤثر بر سرطان ستفاده میشود. به عنوان مثال، در دهه ۱۹۶۰، محققان کشف کردند که اکثر بیماران مبتلا به سرطان خون مزمن میلوژن دارای ناهنجاری ژنتیکی خاصی در کروموزومهای ۹ و ۲۲ هستند که کروموزوم فیلادلفیا نامیده میشود. وقتی این دو کروموزوم با هم ترکیب میشوند، ژن ایجادکننده سرطان ایجاد میکنند که به BCR-ABL معروف است. در چنین بیمارانی، این ژن به عنوان نقطه اولیه اصلی در همه علائم ظاهری فیزیولوژیکی سرطان خون عمل میکند. برای سالهای متمادی، BCR-ABL به سادگی به عنوان نشانگر زیستی برای طبقهبندی یک نوع خاص از سرطان خون استفاده میشد. با این حال، سازندگان دارو در نهایت توانستند ایماتینیب، داروی قدرتمندی را تهیه کنند که بهطور مؤثر و کارا این پروتئین را مهار میکند و تولید سلولهای حاوی کروموزوم فیلادلفیا را به میزان قابل توجهی کاهش میدهد.[۴۰][۴۱]
نقطه انتهای جایگزین[ویرایش]
یکی دیگر از زمینههای مهم کاربرد نشانگرهای زیستی، در مناطق انتهای جایگزین است. در این کاربرد، نشانگرهای زیستی به عنوان عامل اصلی برای تأثیر دارو بر جلوگیری پیشرفت و بقای سرطان عمل میکنند. در حالت ایدهآل، استفاده از نشانگرهای زیستی معتبر باعث میشود بیماران مجبور به انجام بیوپسی تومور و آزمایشهای بالینی طولانی برای تعیین تأثیر داروی جدید نشوند. در استاندارد مراقبت و درمان فعلی، معیار تعیین اثربخشی دارو این است که آیا پیشرفت سرطان در انسان کاهش یافتهاست یا خیر. در نهایت این موضوع آیا بقا و عمر بیمار را طولانی میکند یا خیر. با این حال، جایگزینهای نشانگرهای زیستی موفق میتوانند در صورت حذف داروهای ناموفق از خط توسعه، قبل از ورود به آزمایشهای بالینی، در وقت، تلاش و هزینه قابل توجهی صرفه جویی کنند.
برخی از ویژگیهای ایدهآل نشانگرهای زیستی جایگزین جایگزین عبارتند از:[۴۲]
- نشانگر زیستی باید در فرآیندی که باعث سرطان میشود دخالت داشته باشد
- تغییرات در نشانگر زیستی باید با تغییرات بیماری ارتباط داشته باشد
- سطح نشانگرهای زیستی باید به اندازه کافی بالا باشد تا بتوان آنها را به راحتی و با اطمینان اندازهگیری کرد
- سطح یا وجود نشانگر زیستی باید به راحتی بین بافت طبیعی، سرطانی و پیش سرطانی تفاوت بگذارد
- درمان مؤثر سرطان باید سطح نشانگر زیستی را تغییر دهد
- سطح نشانگر زیستی نباید خود به خود یا در پاسخ به سایر عواملی که به درمان موفقیتآمیز سرطان مربوط نیست تغییر کند.
دو زمینه اصلی که به عنوان نشانگرهای جایگزین مورد توجه قرار میگیرند، سلولهای تومور در گردش (CTC)[۴۳][۴۴] و ریزآرانای های در گردش است.[۴۵][۴۶] هر دو این نشانگرها با تعداد سلولهای تومور موجود در خون ارتباط دارند. به همین ترتیب، انتظار میرود که جایگزین پیشرفت و متاستاز تومور باشد. با این حال، موانع مهم در برابر پذیرفتن آنها شامل مشکل غنی سازی، شناسایی و اندازهگیری سطح CTC و miRNA در خون است. احتمالاً فناوریها و تحقیقات جدید برای انتقال و استفاده از آنها، به مراقبتهای بالینی لازم است.[۴۷][۴۸][۴۹]
انواع نشانگرهای زیستی سرطان[ویرایش]
نشانگرهای زیستی سرطان مولکولی[ویرایش]
| نوع تومور | نشانگر زیستی |
|---|---|
| پستان | ER / PR (گیرنده استروژن / گیرنده پروژسترون)[۵۰][۵۱] |
| HER-2 / neu | |
| روده بزرگ | EGFR |
| KRAS | |
| UGT1A1 | |
| معده | HER-2 / neu |
| GIST | c-KIT[۵۲] |
| سرطان خون / لنفوم | CD20[۵۳] |
| CD30[۵۴] | |
| FIP1L1 - PDGFRalpha[۵۵] | |
| PDGFR[۵۶] | |
| کروموزوم فیلادلفیا (BCR / ABL)[۵۷][۵۸] | |
| PML / RAR-alpha[۵۹] | |
| TPMT[۶۰] | |
| UGT1A1[۶۱] | |
| ریه | EML4 / ALK[۶۲][۶۳] |
| EGFR | |
| KRAS | |
| ملانوم | BRAF |
| پانکراس | افزایش سطح لوسین، ایزولوسین و والین[۶۴] |
| تخمدان | CA-125[۶۵] |
سایر نمونههای نشانگرهای زیستی:
- مهار کنندههای تومور گمشده در سرطان
- مثالها: BRCA1، BRCA2
- RNA
- پروتئینهای موجود در مایعات بدن یا بافت.
- مثالها: آنتیژن اختصاصی پروستات و CA-125
- آنتیبادیهای آنتی ژنهای سرطانی
- مثالها: ویروس پلی مایع سلول مرکل[۶۷]
- DNA
- مثالها: DNA تومور در گردش (ctDNA)[۱۶]
نشانگرهای زیستی سرطان عمومی[ویرایش]
همه نشانگرهای زیستی سرطان لزوماً برای نوع خاصی از سرطان نیستند. برخی از نشانگرهای زیستی موجود در سیستم گردش خون را میتوان برای تعیین رشد غیرطبیعی سلولهای موجود در بدن استفاده کرد. تمامی این نوع از نشانگرهای زیستی را میتوان از طریق آزمایش خون تشخیصی شناسایی کرد. با آزمایش منظم، بسیاری از مسائل سلامتی مانند سرطان را میتوان در مراحل اولیه کشف کرد و از مرگهای زیادی جلوگیری کرد.
تحقیقات نشان دادهاست که نسبت نوتروفیل به لنفوسیت یک تعیینکننده کلی برای بسیاری از سرطانها است. این نسبت بر فعالیت سیستم ایمنی بدن تأثیر دارد که در پاسخ التهابی نقش دارند و در حضور تومورهای بدخیم بیشتر نشان داده میشود.[۶۸] علاوه بر این، فاکتور رشد اساسی فیبروبلاست (bFGF) پروتئینی است که در تکثیر سلولها نقش دارد. متأسفانه، نشان داده شدهاست که فیبروبلاست در حضور تومورها بسیار فعال است. این نتیجه حاصل شده که ممکن است به سلولهای بدخیم کمک کند تا با سرعت بیشتری تولید مثل کنند.[۶۹] تحقیقات نشان دادهاست که میتوان از آنتیبادیهای ضد bFGF برای درمان تومورها از ریشههای مختلف استفاده کرد. علاوه بر این، فاکتور رشد شبه انسولین (IGF-R) در تکثیر و رشد سلول نقش دارد. این احتمال وجود دارد که در مهار آپوپتوز، مرگ مورد انتظار و از پیش برنامهریزی شده سلول به دلیل برخی نقصها نقش داشته باشد.[۷۰] به همین دلیل، در صورت وجود سرطانی مانند پستان، پروستات، ریه و کولورکتوم میتوان سطح IGF-R را افزایش داد.[۷۱]
| نشانگر زیستی | شرح | بیوسنسور استفاده شده |
|---|---|---|
| NLR (نسبت نوتروفیل به لنفوسیت) | افزایش با التهاب ناشی از سرطان[۷۲] | نه |
| فاکتور اصلی رشد فیبروبلاست (bFGF) | این سطح در صورت وجود تومور افزایش مییابد، به تولید مثل سریع سلولهای تومور کمک میکند[۷۳] | الکتروشیمیایی[۷۴] |
| فاکتور رشد شبه انسولین (IGF-R) | فعالیت زیاد در سلولهای سرطانی، به تولید مثل کمک میکند[۷۵] | سنسور طیفسنجی امپدانس الکتروشیمیایی[نیازمند منبع] |
جستارهای وابسته[ویرایش]
منابع[ویرایش]
- ↑ Calzone, Kathleen A. (2012). "Genetic Biomarkers of Cancer Risk". Seminars in Oncology Nursing. 28 (2): 122–128. doi:10.1016/j.soncn.2012.03.007. PMID 22542320.
- ↑ Herceg, Zdenko; Hainaut, Pierre (2007-06-01). "Genetic and epigenetic alterations as biomarkers for cancer detection, diagnosis and prognosis". Molecular Oncology (به انگلیسی). 1 (1): 26–41. doi:10.1016/j.molonc.2007.01.004. ISSN 1878-0261. PMC 5543860. PMID 19383285.
- ↑ Li, Danni; Chan, Daniel W. (2014-04-01). "Proteomic cancer biomarkers from discovery to approval: it's worth the effort". Expert Review of Proteomics. 11 (2): 135–136. doi:10.1586/14789450.2014.897614. ISSN 1478-9450. PMC 4079106. PMID 24646122.
- ↑ Aizpurua-Olaizola, O.; Toraño, J. Sastre; Falcon-Perez, J.M.; Williams, C.; Reichardt, N.; Boons, G. -J. (2018). "Mass spectrometry for glycan biomarker discovery". TrAC Trends in Analytical Chemistry. 100: 7–14. doi:10.1016/j.trac.2017.12.015.
- ↑ Mishra, Alok; Verma, Mukesh (2010). "Cancer Biomarkers: Are We Ready for the Prime Time?". Cancers. 2 (1): 190–208. doi:10.3390/cancers2010190. PMC 3827599. PMID 24281040.
- ↑ Rhea, Jeanne; Ross J. Molinaro (March 2011). "Cancer Biomarkers: Surviving the journey from bench to bedside". Medical Laboratory Observer. Archived from the original on 14 October 2013. Retrieved 26 April 2013.
- ↑ Behne, Tara; Copur, M. Sitki (1 January 2012). "Biomarkers for Hepatocellular Carcinoma". International Journal of Hepatology. 2012: 859076. doi:10.1155/2012/859076. PMC 3357951. PMID 22655201.
- ↑ Musolino, A; Bella, MA; Bortesi, B; Michiara, M; Naldi, N; Zanelli, P; Capelletti, M; Pezzuolo, D; Camisa, R (June 2007). "BRCA mutations, molecular markers, and clinical variables in early-onset breast cancer: a population-based study". Breast. 16 (3): 280–92. doi:10.1016/j.breast.2006.12.003. PMID 17257844.
{{cite journal}}:|hdl-access=requires|hdl=(help) - ↑ Dienstmann, R; Tabernero, J (March 2011). "BRAF as a target for cancer therapy". Anti-Cancer Agents in Medicinal Chemistry. 11 (3): 285–95. doi:10.2174/187152011795347469. PMID 21426297.
- ↑ Orphanos, G; Kountourakis, P (2012). "Targeting the HER2 receptor in metastatic breast cancer". Hematology/Oncology and Stem Cell Therapy. 5 (3): 127–37. doi:10.5144/1658-3876.2012.127. PMID 23095788.
- ↑ DePrimo, S. E.; Huang, X.; Blackstein, M. E.; Garrett, C. R.; Harmon, C. S.; Schoffski, P.; Shah, M. H.; Verweij, J.; Baum, C. M. (8 September 2009). "Circulating Levels of Soluble KIT Serve as a Biomarker for Clinical Outcome in Gastrointestinal Stromal Tumor Patients Receiving Sunitinib following Imatinib Failure". Clinical Cancer Research. 15 (18): 5869–5877. doi:10.1158/1078-0432.CCR-08-2480. PMC 3500590. PMID 19737953.
- ↑ Bantis, A; Grammaticos, P (Sep–Dec 2012). "Prostatic specific antigen and bone scan in the diagnosis and follow-up of prostate cancer. Can diagnostic significance of PSA be increased?". Hellenic Journal of Nuclear Medicine. 15 (3): 241–6. PMID 23227460.
- ↑ Kruijff, S; Hoekstra, HJ (April 2012). "The current status of S-100B as a biomarker in melanoma". European Journal of Surgical Oncology. 38 (4): 281–5. doi:10.1016/j.ejso.2011.12.005. PMID 22240030.
- ↑ Ludwig, JA; Weinstein, JN (November 2005). "Biomarkers in cancer staging, prognosis and treatment selection". Nature Reviews Cancer. 5 (11): 845–56. doi:10.1038/nrc1739. PMID 16239904.
- ↑ Wang, Qing; Raghothama Chaerkady (December 2010). "Mutant proteins as cancer-specific biomarkers". Proceedings of the National Academy of Sciences. 108 (6): 2444–2449. Bibcode:2011PNAS..108.2444W. doi:10.1073/pnas.1019203108. PMC 3038743. PMID 21248225.
- ↑ ۱۶٫۰ ۱۶٫۱ ۱۶٫۲ Li, Xuanying; Ye, Mengsha; Zhang, Weiying; Tan, Duo; Jaffrezic-Renault, Nicole; Yang, Xu; Guo, Zhenzhong (2019-02-01). "Liquid biopsy of circulating tumor DNA and biosensor applications". Biosensors and Bioelectronics (به انگلیسی). 126: 596–607. doi:10.1016/j.bios.2018.11.037. ISSN 0956-5663. PMID 30502682.
- ↑ "biomarker". NCI Dictionary of Cancer Terms. National Cancer Institute. 2011-02-02.
- ↑ "Biomarkers in Cancer: An Introductory Guide for Advocates" (PDF). Research Advocacy Network. 2010. Archived from the original (PDF) on 2013-10-29. Retrieved 26 April 2013.
- ↑ Verma, M; Manne, U (October 2006). "Genetic and epigenetic biomarkers in cancer diagnosis and identifying high risk populations". Critical Reviews in Oncology/Hematology. 60 (1): 9–18. doi:10.1016/j.critrevonc.2006.04.002. PMID 16829121.
- ↑ Leong, PP; Rezai, B; Koch, WM; Reed, A; Eisele, D; Lee, DJ; Sidransky, D; Jen, J; Westra, WH (Jul 1, 1998). "Distinguishing second primary tumors from lung metastases in patients with head and neck squamous cell carcinoma". Journal of the National Cancer Institute. 90 (13): 972–7. doi:10.1093/jnci/90.13.972. PMID 9665144.
- ↑ Lapin, Morten; Oltedal, Satu; Tjensvoll, Kjersti; Buhl, Tove; Smaaland, Rune; Garresori, Herish; Javle, Milind; Glenjen, Nils Idar; Abelseth, Bente Kristin (2018-11-06). "Fragment size and level of cell-free DNA provide prognostic information in patients with advanced pancreatic cancer". Journal of Translational Medicine (به انگلیسی). 16 (1): 300. doi:10.1186/s12967-018-1677-2. ISSN 1479-5876. PMC 6218961. PMID 30400802.
- ↑ Dragani, TA; Matarese, V; Colombo, F (2020). "Biomarkers for Early Cancer Diagnosis: Prospects for Success through the Lens of Tumor Genetics". BioEssays. 42 (4): e1900122. doi:10.1002/bies.201900122. PMID 32128843.
- ↑ Terpos E, Dimopoulos MA, Shrivastava V, et al. (March 2010). "High levels of serum TIMP-1 correlate with advanced disease and predict for poor survival in patients with multiple myeloma treated with novel agents". Leukemia Research. 34 (3): 399–402. doi:10.1016/j.leukres.2009.08.035. PMID 19781774.
- ↑ Kuukasjärvi, T; Kononen, J; Helin, H; Holli, K; Isola, J (September 1996). "Loss of estrogen receptor in recurrent breast cancer is associated with poor response to endocrine therapy". Journal of Clinical Oncology. 14 (9): 2584–9. doi:10.1200/jco.1996.14.9.2584. PMID 8823339.
- ↑ Harris, L; Fritsche, H; Mennel, R; Norton, L; Ravdin, P; Taube, S; Somerfield, MR; Hayes, DF; Bast RC, Jr (Nov 20, 2007). "American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer". Journal of Clinical Oncology. 25 (33): 5287–312. doi:10.1200/JCO.2007.14.2364. PMID 17954709.
- ↑ Kröger, N; Milde-Langosch, K; Riethdorf, S; Schmoor, C; Schumacher, M; Zander, AR; Löning, T (Jan 1, 2006). "Prognostic and predictive effects of immunohistochemical factors in high-risk primary breast cancer patients". Clinical Cancer Research. 12 (1): 159–68. doi:10.1158/1078-0432.CCR-05-1340. PMID 16397038.
- ↑ Vrbic, S; Pejcic, I; Filipovic, S; Kocic, B; Vrbic, M (Jan–Mar 2013). "Current and future anti-HER2 therapy in breast cancer". Journal of the Balkan Union of Oncology. 18 (1): 4–16. PMID 23613383.
- ↑ Yoo, C; Ryu, MH; Ryoo, BY; Beck, MY; Kang, YK (Apr 17, 2013). "Efficacy, safety, and pharmacokinetics of imatinib dose escalation to 800 mg/day in patients with advanced gastrointestinal stromal tumors". Investigational New Drugs. 31 (5): 1367–74. doi:10.1007/s10637-013-9961-8. PMID 23591629.
- ↑ Demetri, GD; van Oosterom, AT; Garrett, CR; Blackstein, ME; Shah, MH; Verweij, J; McArthur, G; Judson, IR; Heinrich, MC (Oct 14, 2006). "Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial". Lancet. 368 (9544): 1329–38. doi:10.1016/S0140-6736(06)69446-4. PMID 17046465.
- ↑ Herbst, RS; Prager, D; Hermann, R; Fehrenbacher, L; Johnson, BE; Sandler, A; Kris, MG; Tran, HT; Klein, P (Sep 1, 2005). "TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer". Journal of Clinical Oncology. 23 (25): 5892–9. doi:10.1200/JCO.2005.02.840. PMID 16043829.
- ↑ Lynch, TJ; Bell, DW; Sordella, R; Gurubhagavatula, S; Okimoto, RA; Brannigan, BW; Harris, PL; Haserlat, SM; Supko, JG (May 20, 2004). "Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib" (PDF). The New England Journal of Medicine. 350 (21): 2129–39. doi:10.1056/NEJMoa040938. PMID 15118073. Archived from the original (PDF) on 21 July 2018. Retrieved 7 April 2021.
- ↑ Sawyers CL (April 2008). "The cancer biomarker problem". Nature. 452 (7187): 548–52. Bibcode:2008Natur.452..548S. doi:10.1038/nature06913. PMID 18385728.
- ↑ Karas-Kuzelicki, N; Mlinaric-Rascan, I (August 2009). "Individualization of thiopurine therapy: thiopurine S-methyltransferase and beyond". Pharmacogenomics. 10 (8): 1309–22. doi:10.2217/pgs.09.78. PMID 19663675.
- ↑ Relling MV, Hancock ML, Rivera GK, et al. (December 1999). "Mercaptopurine therapy intolerance and heterozygosity at the thiopurine S-methyltransferase gene locus". Journal of the National Cancer Institute. 91 (23): 2001–8. doi:10.1093/jnci/91.23.2001. PMID 10580024.
- ↑ ۳۵٫۰ ۳۵٫۱ Schneider, John; Manpreet K Sidhu; Cynthia Doucet; Noemi Kiss; Robert L Ohsfeldt; Donald Chalfin (2012). "Economics of Cancer Biomarkers". Personalized Medicine. 9 (8): 829–837. doi:10.2217/pme.12.87. PMID 29776231.
- ↑ Henze, G; Dummer, R; Joller-Jemelka, HI; Böni, R; Burg, G (1997). "Serum S100--a marker for disease monitoring in metastatic melanoma". Dermatology. 194 (3): 208–12. doi:10.1159/000246103. PMID 9187834.
- ↑ Harpio, R; Einarsson, R (July 2004). "S100 proteins as cancer biomarkers with focus on S100B in malignant melanoma". Clinical Biochemistry. 37 (7): 512–8. doi:10.1016/j.clinbiochem.2004.05.012. PMID 15234232.
- ↑ Lamond, NW; Skedgel, C; Younis, T (April 2013). "Is the 21-gene recurrence score a cost-effective assay in endocrine-sensitive node-negative breast cancer?". Expert Review of Pharmacoeconomics & Outcomes Research. 13 (2): 243–50. doi:10.1586/erp.13.4. PMID 23570435.
- ↑ Biroschak, JR; Schwartz, GF; Palazzo, JP; Toll, AD; Brill, KL; Jaslow, RJ; Lee, SY (May 2013). "Impact of Oncotype DX on Treatment Decisions in ER-Positive, Node-Negative Breast Cancer with Histologic Correlation". The Breast Journal. 19 (3): 269–75. doi:10.1111/tbj.12099. PMID 23614365.
- ↑ Moen, MD; McKeage, K; Plosker, GL; Siddiqui, MA (2007). "Imatinib: a review of its use in chronic myeloid leukaemia". Drugs. 67 (2): 299–320. doi:10.2165/00003495-200767020-00010. PMID 17284091.
- ↑ Lemonick, Michael; Alice Park (May 28, 2001). "New Hope for Cancer". Time Magazine. Archived from the original on 25 April 2013. Retrieved 26 April 2013.
- ↑ Price, C; McDonnell, D (February 1991). "Effects of niobium filtration and constant potential on the sensitometric responses of dental radiographic films". Dentomaxillofacial Radiology. 20 (1): 11–6. doi:10.1259/dmfr.20.1.1884846. PMID 1884846.
- ↑ Lu, CY; Tsai, HL; Uen, YH; Hu, HM; Chen, CW; Cheng, TL; Lin, SR; Wang, JY (Mar 5, 2013). "Circulating tumor cells as a surrogate marker for determining clinical outcome to mFOLFOX chemotherapy in patients with stage III colon cancer". British Journal of Cancer. 108 (4): 791–7. doi:10.1038/bjc.2012.595. PMC 3590657. PMID 23422758.
- ↑ Balic, M; Williams, A; Lin, H; Datar, R; Cote, RJ (2013). "Circulating tumor cells: from bench to bedside". Annual Review of Medicine. 64: 31–44. doi:10.1146/annurev-med-050311-163404. PMC 3809995. PMID 23092385.
- ↑ Madhavan, D; Zucknick, M; Wallwiener, M; Cuk, K; Modugno, C; Scharpff, M; Schott, S; Heil, J; Turchinovich, A (Nov 1, 2012). "Circulating miRNAs as surrogate markers for circulating tumor cells and prognostic markers in metastatic breast cancer". Clinical Cancer Research. 18 (21): 5972–82. doi:10.1158/1078-0432.CCR-12-1407. PMID 22952344.
- ↑ Redova, M; Sana, J; Slaby, O (March 2013). "Circulating miRNAs as new blood-based biomarkers for solid cancers". Future Oncology. 9 (3): 387–402. doi:10.2217/fon.12.192. PMID 23469974.
- ↑ Joosse, SA; Pantel, K (Jan 1, 2013). "Biologic challenges in the detection of circulating tumor cells". Cancer Research. 73 (1): 8–11. doi:10.1158/0008-5472.CAN-12-3422. PMID 23271724.
- ↑ Hou, HW; Warkiani, ME; Khoo, BL; Li, ZR; Soo, RA; Tan, DS; Lim, WT; Han, J; Bhagat, AA (2013). "Isolation and retrieval of circulating tumor cells using centrifugal forces". Scientific Reports. 3: 1259. Bibcode:2013NatSR...3E1259H. doi:10.1038/srep01259. PMC 3569917. PMID 23405273.
- ↑ Dhondt, Bert; De Bleser, Elise; Claeys, Tom; Buelens, Sarah; Lumen, Nicolaas; Vandesompele, Jo; Beckers, Anneleen; Fonteyne, Valerie; Van der Eecken, Kim (21 December 2018). "Discovery and validation of a serum microRNA signature to characterize oligo- and polymetastatic prostate cancer: not ready for prime time". World Journal of Urology. 37 (12): 2557–2564. doi:10.1007/s00345-018-2609-8. PMID 30578441.
- ↑ "Table of Pharmacogenomic Biomarkers in Drug Labels". U.S Food and Drug Administration.
- ↑ "Tumor Markers Fact Sheet" (PDF). American Cancer Society. Archived from the original (PDF) on 5 November 2012. Retrieved 7 April 2021.
- ↑ Gonzalez RS, Carlson G, Page AJ, Cohen C (July 2011). "Gastrointestinal stromal tumor markers in cutaneous melanomas: relationship to prognostic factors and outcome". American Journal of Clinical Pathology. 136 (1): 74–80. doi:10.1309/AJCP9KHD7DCHWLMO. PMID 21685034.
- ↑ Tam CS, Otero-Palacios J, Abruzzo LV, et al. (April 2008). "Chronic lymphocytic leukaemia CD20 expression is dependent on the genetic subtype: a study of quantitative flow cytometry and fluorescent in-situ hybridization in 510 patients". British Journal of Haematology. 141 (1): 36–40. doi:10.1111/j.1365-2141.2008.07012.x. PMID 18324964.
- ↑ Zhang M, Yao Z, Patel H, et al. (May 2007). "Effective therapy of murine models of human leukemia and lymphoma with radiolabeled anti-CD30 antibody, HeFi-1". Proceedings of the National Academy of Sciences of the United States of America. 104 (20): 8444–8. Bibcode:2007PNAS..104.8444Z. doi:10.1073/pnas.0702496104. PMC 1895969. PMID 17488826.
- ↑ Yamada Y, Sanchez-Aguilera A, Brandt EB, et al. (September 2008). "FIP1L1/PDGFRalpha synergizes with SCF to induce systemic mastocytosis in a murine model of chronic eosinophilic leukemia/hypereosinophilic syndrome". Blood. 112 (6): 2500–7. doi:10.1182/blood-2007-11-126268. PMID 18539901.
- ↑ Nimer SD (May 2008). "Myelodysplastic syndromes". Blood. 111 (10): 4841–51. doi:10.1182/blood-2007-08-078139. PMID 18467609.
- ↑ Ottmann O, Dombret H, Martinelli G, et al. (October 2007). "Dasatinib induces rapid hematologic and cytogenetic responses in adult patients with Philadelphia chromosome positive acute lymphoblastic leukemia with resistance or intolerance to imatinib: interim results of a phase 2 study". Blood. 110 (7): 2309–15. doi:10.1182/blood-2007-02-073528. PMID 17496201.
- ↑ Boulos N, Mulder HL, Calabrese CR, et al. (March 2011). "Chemotherapeutic agents circumvent emergence of dasatinib-resistant BCR-ABL kinase mutations in a precise mouse model of Philadelphia chromosome-positive acute lymphoblastic leukemia". Blood. 117 (13): 3585–95. doi:10.1182/blood-2010-08-301267. PMC 3072880. PMID 21263154.
- ↑ O'Connell PA, Madureira PA, Berman JN, Liwski RS, Waisman DM (April 2011). "Regulation of S100A10 by the PML-RAR-α oncoprotein". Blood. 117 (15): 4095–105. doi:10.1182/blood-2010-07-298851. PMID 21310922.
- ↑ Duffy MJ, Crown J (November 2008). "A personalized approach to cancer treatment: how biomarkers can help". Clinical Chemistry. 54 (11): 1770–9. doi:10.1373/clinchem.2008.110056. PMID 18801934.
- ↑ Ribrag V, Koscielny S, Casasnovas O, et al. (April 2009). "Pharmacogenetic study in Hodgkin lymphomas reveals the impact of UGT1A1 polymorphisms on patient prognosis". Blood. 113 (14): 3307–13. doi:10.1182/blood-2008-03-148874. PMID 18768784.
- ↑ Li Y, Ye X, Liu J, Zha J, Pei L (January 2011). "Evaluation of EML4-ALK fusion proteins in non-small cell lung cancer using small molecule inhibitors". Neoplasia. 13 (1): 1–11. doi:10.1593/neo.101120. PMC 3022423. PMID 21245935.
- ↑ Pao W, Girard N (February 2011). "New driver mutations in non-small-cell lung cancer". Lancet Oncology. 12 (2): 175–80. doi:10.1016/S1470-2045(10)70087-5. PMID 21277552.
- ↑ Hewes, Arlington (October 2, 2014). "Promising Method for Detecting Pancreatic Cancer Years Before Traditional Diagnosis". Singularity HUB. Retrieved 2016-04-22.
- ↑ Gupta, Digant; Lis, Christopher G. (2009-10-09). "Role of CA125 in predicting ovarian cancer survival - a review of the epidemiological literature". Journal of Ovarian Research. 2 (1): 13. doi:10.1186/1757-2215-2-13. ISSN 1757-2215. PMC 2764643. PMID 19818123.
- ↑ Bartels CL, Tsongalis GJ (April 2009). "MicroRNAs: novel biomarkers for human cancer". Clinical Chemistry. 55 (4): 623–31. doi:10.1373/clinchem.2008.112805. PMID 19246618.
- ↑ Paulson, Kelly G.; Lewis, Christopher W.; Redman, Mary W.; Simonson, William T.; Lisberg, Aaron; Ritter, Deborah; Morishima, Chihiro; Hutchinson, Kathleen; Mudgistratova, Lola (2017). "Viral oncoprotein antibodies as a marker for recurrence of Merkel cell carcinoma: A prospective validation study". Cancer. 123 (8): 1464–1474. doi:10.1002/cncr.30475. PMC 5384867. PMID 27925665.
- ↑ Proctor, M J; McMillan, D C; Morrison, D S; Fletcher, C D; Horgan, P G; Clarke, S J (2012-07-24). "A derived neutrophil to lymphocyte ratio predicts survival in patients with cancer". British Journal of Cancer. 107 (4): 695–699. doi:10.1038/bjc.2012.292. ISSN 0007-0920. PMC 3419948. PMID 22828611.
- ↑ Liu, Man; Xing, Lu-Qi (2017-06-07). "Basic fibroblast growth factor as a potential biomarker for diagnosing malignant tumor metastasis in women". Oncology Letters. 14 (2): 1561–1567. doi:10.3892/ol.2017.6335. ISSN 1792-1074. PMC 5529833. PMID 28789380.
- ↑ Fürstenberger, Gregor; Senn, Hans-Jörg (May 2002). "Insulin-like growth factors and cancer". The Lancet Oncology. 3 (5): 298–302. doi:10.1016/s1470-2045(02)00731-3. ISSN 1470-2045. PMID 12067807.
- ↑ Yu, Herbert; Rohan, Thomas (2000-09-20). "Role of the Insulin-Like Growth Factor Family in Cancer Development and Progression". JNCI: Journal of the National Cancer Institute (به انگلیسی). 92 (18): 1472–1489. doi:10.1093/jnci/92.18.1472. ISSN 0027-8874. PMID 10995803.
- ↑ Vano, Yann-Alexandre; Oudard, Stéphane; By, Marie-Agnès; Têtu, Pauline; Thibault, Constance; Aboudagga, Hail; Scotté, Florian; Elaidi, Reza (2018-04-06). "Optimal cut-off for neutrophil-to-lymphocyte ratio: Fact or Fantasy? A prospective cohort study in metastatic cancer patients". PLOS ONE. 13 (4): e0195042. Bibcode:2018PLoSO..1395042V. doi:10.1371/journal.pone.0195042. ISSN 1932-6203. PMC 5889159. PMID 29624591.
- ↑ Liu, Man; Xing, Lu-Qi (2017-08-01). "Basic fibroblast growth factor as a potential biomarker for diagnosing malignant tumor metastasis in women". Oncology Letters. 14 (2): 1561–1567. doi:10.3892/ol.2017.6335. ISSN 1792-1074. PMC 5529833. PMID 28789380.
- ↑ Torrente-Rodríguez, Rebeca M.; Ruiz-Valdepeñas Montiel, Víctor; Campuzano, Susana; Pedrero, María; Farchado, Meryem; Vargas, Eva; Manuel de Villena, F. Javier; Garranzo-Asensio, María; Barderas, Rodrigo (2017-04-04). "Electrochemical sensor for rapid determination of fibroblast growth factor receptor 4 in raw cancer cell lysates". PLOS ONE. 12 (4): e0175056. Bibcode:2017PLoSO..1275056T. doi:10.1371/journal.pone.0175056. ISSN 1932-6203. PMC 5380347. PMID 28376106.
- ↑ Denduluri, Sahitya K.; Idowu, Olumuyiwa; Wang, Zhongliang; Liao, Zhan; Yan, Zhengjian; Mohammed, Maryam K.; Ye, Jixing; Wei, Qiang; Wang, Jing (March 2015). "Insulin-like growth factor (IGF) signaling in tumorigenesis and the development of cancer drug resistance". Genes & Diseases. 2 (1): 13–25. doi:10.1016/j.gendis.2014.10.004. ISSN 2352-3042. PMC 4431759. PMID 25984556.
