تیوفن
| Thiophene | |||
|---|---|---|---|
| |||
| |||
Thiophene | |||
دیگر نامها Thiofuran | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۱۱۰-۰۲-۱ | ||
| پابکم | ۸۰۳۰ | ||
| کماسپایدر | ۷۷۳۹ | ||
| UNII | SMB37IQ40B | ||
| ChEBI | CHEBI:30856 | ||
| ChEMBL | CHEMBL۲۷۸۹۵۸ | ||
| شمارهٔ آرتیئیسیاس | XM7350000 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C4H4S | ||
| جرم مولی | 84.14 g/mol | ||
| شکل ظاهری | colorless liquid | ||
| چگالی | 1.051 g/mL liquid | ||
| دمای ذوب | −۳۸ درجه سلسیوس (−۳۶ درجه فارنهایت؛ ۲۳۵ کلوین) | ||
| دمای جوش | ۸۴ درجه سلسیوس (۱۸۳ درجه فارنهایت؛ ۳۵۷ کلوین) | ||
| ضریب شکست (nD) | 1.5287 | ||
| گرانروی | 0.8712 cپواز at 0.2 °C 0.6432 cپواز at 22.4 °C | ||
| خطرات | |||
| MSDS | External MSDS | ||
| طبقهبندی ئییو | not listed | ||
| لوزی آتش |  | ||
| نقطه اشتعال | |||
| ترکیبات مرتبط | |||
| مرتبط با تیواتر | تتراهیدروتیوفن دیاتیل سولفید | ||
| ترکیبات مرتبط | فوران پیرول | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
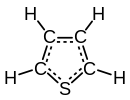
تیوفن (به انگلیسی: Thiophene) با فرمول شیمیایی C۴H۴S یک ترکیب شیمیایی با شناسه پابکم ۸۰۳۰ است؛ که جرم مولی آن 84.14 g/mol میباشد. شکل ظاهری این ترکیب، مایع بیرنگ است. تیوفن یک ترکیب هتروسیکل آروماتیک است که شامل چهار اتم کربن و یک اتم گوگرد است. آنالوگهای تیوفن شامل فوران و پیرول است که در آنها اتم S جایگزین O و NH شدهاست. تیوفن بوسیله ویکتور میر (Victor Meyer) در ۱۸۸۳ به عنوان یک جزء باقیمانده در بنزن کشف شد. بعضی از انواع مهم تیوفنها شامل بنزو تیوفن و دی بنزو تیوفن میباشد که به ترتیب دارای یک و دو گروه بنزنی هستند.
خصوصیات تیوفن
[ویرایش]تیوفن در دمای محیط مایعی بیرنگ است و بویی مشابه بنزن دارد. تیوفن به عنوان ترکیبی آروماتیک شناخته شدهاست ولی محاسبات تئوری نشان داده که میزان آروماتیک بودن آن از بنزن کمتر است. سهم جفت الکترون گوگرد در اربیتال pi مشهود است و به خاطر همین خواص آروماتیک تیوفن است که این ترکیب خواصی متفاوت نسبت به تیو اتر از خود نشان میدهد. به عنوان مثال این ترکیب توانایی آلکیل دار شدن توسط متیل یدید را ندارد. همچنین اتم گوگرد در این ترکیب واکنش ناپذیر است. واکنش پذیری بالای تیوفن در برابر سولفوناسیون اساس جداسازی بنزن از تیوفن را تشکیل میدهد. (از آنجایی که تفاوت نقطه جوش بنزن و تیوفن در دمای محیط در حدود ۴ °C میباشد جداسازی آنها از طریق تقطیر مشکل میباشد). بنابراین اضافه کردن اسید سولفوریک به مخلوط بنزن و تیوفن در فرایند سولفوناسیون تیوفن باعث تشکیل ترکیب محلول در آب تیوفن سولفونیک اسید میشود. کاربرد تیوفنها ترکیبات هتروسیکل مهمی در شیمی آلی بهشمار میروند که کاربردهای زیادی در صنایع مختلف به خصوص در داروسازی دارند. در بعضی موارد حلقه بنزنی توسط تیوفن جایگزین میشود بیآنکه در خواص ترکیب تغییر قابل ملاحظهای روی دهد. گوگرد زدایی از این ترکیبات توسط Raney nickel باعث ایجاد مشتقاتی از بوتان با استخلاف در موقعیتهای ۱ و ۴ میشود. پلیمرهای حاصل از پیوند شدن تیوفن در موقعیتهای ۱و ۵ پلی تیوفن نامیده میشوند. پلی تیوفنها در اثر اکسایش جزئی دارای خاصیت رسانایی میگردند.
سنتز
[ویرایش]با در نظر گرفتن پایداری بالای تیوفنها، این ترکیبات از بسیاری از ترکیبات حاوی گوگرد و هیدروکربن (به خصوص هیدروکربنهای غیر اشباع مانند استیلن) به وجود میآیند. در روش سنتز کلاسیک این ترکیبات از واکنش ا، ۴ – دی کتونها با معرفهای سولفورهکننده مانند P4S10 تهیه میشوند. تیوفنهای خاص میتوانند از طریق واکنش تراکمی استرها در حضور گوگرد عنصری تهیه شوند. تیوفن و مشتقات آن معمولاً به همراه مواد نفتی در غلظتهای یک تا سه درصد یافت میشوند. انواع مایعات تیوفنی در صنعت معمولاً توسط فرایند هیدرو دسولفوریزاسیون جداسازی می شوند. در این فرایند مایع یا گاز از روی بستر کاتالیزوری شامل مولیبدنیم دی سولفید و تحت فشار هیدروژن عبور داده شده و ترکیبات گوگردی (از جمله تیوفنها) جداسازی میشوند. تیوفنها تحت فرایند هیدروژن دار شدن قرار گرفته و تشکیل ترکیبات هیدروکربنی و هیدروژن سولفید میدهند. از جمله ترکیباتی که گوگرد زدایی از آنها در صنایع نفتی همواره با مشکلاتی همراه بوده و جداسازی آنها نیاز به صرف هزینه زیاد یا تکنولوژیهای نوین دارد بنزوتیوفن و دی بنزوتیوفن و مشتقات آنها میباشد که در حال حاضر ارتقای روشهای گوگرد زدایی از این ترکیبات موضوع بسیاری از تحقیقات را در صنایع نفتی تشکیل میدهد.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- «IUPAC GOLD BOOK». دریافتشده در ۱۸ مارس ۲۰۱۲.