نوروفارماکولوژی
داروشناسی عصبی یا نوروفارماکولوژی (به انگلیسی: Neuropharmacology) علم مطالعهٔ اثرات داروها بر روی سلولهای عصبی میباشد و به دو شاخهٔ کلی رفتاری و مولکولی تقسیمبندی میشود.[۱]
نوروفارماکولوژی رفتاری بر مطالعه چگونگی تأثیر داروها بر رفتار انسان (نورو سایکو فارماکولوژی) متمرکز است، از جمله مطالعه چگونگی تأثیر وابستگی و اعتیاد به مواد مخدر بر مغز انسان.[۲]
نوروفارماکولوژی مولکولی شامل مطالعه سلولهای عصبی و فعل و انفعالات عصبی شیمیایی آنها با هدف کلی تولید داروهایی است که اثرات مفیدی بر عملکرد عصبی دارند. هر دوی این زمینهها ارتباط تنگاتنگی با هم دارند، زیرا هر دو مربوط به فعل و انفعالات ناقلهای عصبی، نوروپپتیدها، هورمونهای عصبی، تعدیل کنندههای عصبی، آنزیمها، پیام رسانهای دوم، حمل و نقلهای مشترک، کانالهای یونی و پروتئینهای گیرنده در سیستم عصبی مرکزی و محیطی هستند. با مطالعه این فعل و انفعالات، محققان در حال تولید داروهایی برای درمان بسیاری از اختلالات عصبی از جمله درد، بیماریهای تخریب کننده اعصاب مانند بیماری پارکینسون و بیماری آلزایمر، اختلالات روانشناختی، اعتیاد و … هستند.
تاریخچه[ویرایش]
علم نوروفارماکولوژی وجود نداشت تا اینکه، در اوایل قرن ۲۰، دانشمندان توانستند درک اساسی از سیستم عصبی و نحوه ارتباط اعصاب بین یکدیگر را درک کنند. قبل از این کشف، داروهایی یافت شده بودند که نوعی تأثیر را بر روی سیستم عصبی نشان میدادند. در دهه ۱۹۳۰، دانشمندان فرانسوی شروع به کار با ترکیبی به نام فنوتیازین کردند به امید سنتز دارویی که بتواند با مالاریا مقابله کند. اگرچه این دارو امید بسیار کمی به استفاده از افراد آلوده به مالاریا نشان داد، اما مشخص شد که این داروها دارای اثرات آرام بخشی همراه با اثرات مفیدی برای بیماران مبتلا به بیماری پارکینسون هستند.
این روش، روش جعبه سیاه است، که در آن یک محقق یک دارو را تجویز میکند و پاسخ را بدون دانستن چگونگی ارتباط عملکرد دارو با پاسخ بیمار بررسی میکند. رویکرد اصلی در این زمینه بود، تا اینکه در اواخر دهه ۱۹۴۰ و اوایل دهه ۱۹۵۰ دانشمندان توانستند شناسایی کنند ناقلهای عصبی خاص، مانند نوراپینفرین (در انقباض رگهای خونی و افزایش ضربان قلب و فشار خون نقش دارد)، دوپامین (ماده شیمیایی که کمبود آن در بیماری پارکینسون نقش دارد) و سروتونین. در دهه ۱۹۵۰ دانشمندان همچنین قادر به اندازهگیری میزان مواد شیمیایی عصبی خاص در بدن و در نتیجه ارتباط این سطوح با رفتار شدند.[۳] اختراع گیره ولتاژ در سال ۱۹۴۹ امکان مطالعه کانالهای یونی و پتانسیل عمل عصب را فراهم کرد. این دو رویداد مهم تاریخی در نوروفارماکولوژی به دانشمندان این امکان را میدهد که نه تنها نحوه انتقال اطلاعات از یک نورون به نورون دیگر را بررسی کنند بلکه همچنین بررسی کنند که چگونه یک نورون این اطلاعات را در درون خود پردازش میکند.
نگاه کلی[ویرایش]
نوروفارماکولوژی یک منطقه بسیار وسیع از علوم است که بسیاری از جنبههای سیستم عصبی را از دستکاری تک نورون گرفته تا کل مناطق مغز، نخاع و اعصاب محیطی در بر میگیرد. برای درک بهتر اساس تولید دارو، ابتدا باید درک کرد که چگونه نورونها با یکدیگر ارتباط برقرار میکنند.
فعل و انفعالات عصبی شیمیایی[ویرایش]
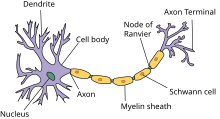
برای درک پیشرفتهای بالقوه پزشکی که نوروفارماکولوژی میتواند به همراه داشته باشد، درک این نکته مهم است که چگونه رفتار و اندیشه انسان از نورون به نورون منتقل میشود و چگونه داروها میتوانند پایههای شیمیایی این فرایندها را تغییر دهند.
سلولهای عصبی به عنوان سلولهای تحریک پذیر شناخته میشوند زیرا در غشای سطح آن پروتئینهای فراوانی وجود دارد که به کانالهای یونی معروف هستند و به ذرات باردار کوچک اجازه ورود و خروج از سلول را میدهند. ساختار نورون اجازه میدهد تا اطلاعات شیمیایی توسط دندریتهای آن دریافت شود، از طریق جسم سلولی (پریکاریون یا سوما) و پایین آکسون آن منتشر شود و در نهایت از طریق ترمینال آکسون خود به سلولهای عصبی دیگر منتقل شود. این مجرای یونی وابسته به ولتاژ امکان دیپولاریزاسیون سریع را در کل سلول فراهم میکنند. این دیپولاریزاسیون اگر به آستانه خاصی برسد، یک پتانسیل عمل ایجاد میکند. وقتی پتانسیل عمل به ترمینال آکسون رسید، باعث هجوم یونهای کلسیم به سلول میشود. سپس یونهای کلسیم باعث میشوند که وزیکولها (بستههای کوچک پر شده از ناقلهای عصبی) به غشای سلول متصل شده و محتوای آن را در سیناپس آزاد کنند. این سلول به عنوان نورون پیش سیناپسی شناخته میشود و سلول تعامل کننده با ناقلهای عصبی آزاد شده به عنوان نورون پس سیناپسی شناخته میشود. هنگامی که ناقل عصبی در سیناپس آزاد شد، میتواند به گیرندههای سلول پس سیناپسی متصل شود، سلول پیش سیناپسی میتواند دوباره آن را جذب کرده و برای انتقال بعدی ذخیره کند، یا میتواند توسط آنزیمهای موجود در سیناپس تجزیه شود. این سه عمل مختلف زمینههای عمده ای است که در آن اثر دارویی میتواند بر ارتباط بین سلولهای عصبی تأثیر بگذارد.[۳]
دو نوع گیرنده وجود دارد که ناقلهای عصبی در یک نورون پس سیناپسی با یکدیگر ارتباط برقرار میکنند. اولین نوع گیرنده کانال یونی وابسته به لیگاند یا LGIC هستند. گیرندههای LGIC سریعترین نوع انتقال از سیگنال شیمیایی به سیگنال الکتریکی هستند. هنگامی که ناقل عصبی به گیرنده متصل شد، باعث ایجاد تغییر شکل میشود که به یونها اجازه میدهد مستقیم به داخل سلول سرازیر شوند. نوع دوم به عنوان گیرنده جفتشونده با پروتئین جی یا GPCRs شناخته میشوند. اینها به دلیل افزایش میزان واکنشهای بیوشیمیایی که باید از طریق سلول انجام شود، بسیار کندتر از LGIC هستند. هنگامی که ناقل عصبی به پروتئین GPCR متصل شد، باعث ایجاد انبوهی از فعل و انفعالات درون سلولی میشود که میتواند منجر به انواع مختلفی از تغییرات در بیوشیمی سلولی، فیزیولوژی و بیان ژن شود. فعل و انفعالات ناقل عصبی / گیرنده در زمینه نوروفارماکولوژی بسیار مهم است زیرا بسیاری از داروهایی که امروزه تولید میشوند ارتباطی با برهم زدن این فرایند اتصال دارند.[۴]
نوروفارماکولوژی مولکولی[ویرایش]
نوروفارماکولوژی مولکولی شامل مطالعه سلولهای عصبی و فعل و انفعالات عصبی شیمیایی آنها و گیرندههای روی سلولهای عصبی است، با هدف تولید داروهای جدید که اختلالات عصبی مانند درد، بیماریهای نورودژنراتیو و اختلالات روانشناختی را درمان خواهند کرد (که در این مورد به عنوان نوروسیکوپارماکولوژی نیز شناخته میشود). چند کلمه فنی وجود دارد که باید هنگام ارتباط انتقال عصبی به عملکرد گیرنده تعریف شود:
- آگونیست - مولکولی که به پروتئین گیرنده متصل شده و آن گیرنده را فعال میکند
- آنتاگونیست رقابتی - مولکولی که به همان محل پروتئین گیرنده آگونیست متصل میشود و از فعال شدن گیرنده جلوگیری میکند
- آنتاگونیست غیررقابتی - مولکولی که در محلی متفاوت از آگونیست به پروتئین گیرنده متصل میشود، اما باعث ایجاد تغییر شکل پروتئین میشود که اجازه فعال سازی نمیدهد.
فعل و انفعالات ناقل عصبی / گیرنده زیر میتواند تحت تأثیر ترکیبات مصنوعی قرار گیرد که به عنوان یکی از سه مورد فوق عمل میکنند. کانالهای یونی سدیم / پتاسیم را نیز میتوان در سراسر یک نورون دستکاری کرد تا اثرات مهاری پتانسیل عمل را ایجاد کند.
گاما آمینوبوتیریک اسید[ویرایش]
گاما آمینوبوتیریک اسید یا گابا واسطه مهار سریع سیناپسی در سیستم عصبی مرکزی است. هنگامی که گابا از سلول پیش سیناپسی خود آزاد شود، به گیرنده ای متصل میشود (به احتمال زیاد گیرنده GABAA) که باعث قطبی شدن بیش از حد سلول پس سیناپسی میشود (در زیر آستانه پتانسیل عمل خود باقی میماند). این اثر هرگونه دستکاری تحریکی از دیگر فعل و انفعالات ناقل عصبی / گیرنده را خنثی میکند.
این گیرنده GABAA حاوی بسیاری از جایگاههای اتصال است که تغییرات ساختاری را امکانپذیر میکند و هدف اصلی برای توسعه دارو است. رایجترین این جایگاههای اتصال، بنزودیازپین، اجازه میدهد تا هم آگونیست و آنتاگونیست بر روی گیرنده اثر بگذارد. یک داروی رایج، دیازپام، به عنوان تقویت کننده آلوستریک در این محل اتصال عمل میکند.[۵] گیرنده دیگری برای گابا معروف به GABAB، میتواند توسط مولکولی به نام باکلوفن تقویت شود. این مولکول به عنوان یک آگونیست عمل میکند، بنابراین گیرنده را فعال میکند و شناخته شدهاست که به کنترل و کاهش حرکت اسپاست کمک میکند.
دوپامین[ویرایش]
ناقل عصبی دوپامین با اتصال به پنج GPCR خاص، انتقال سیناپسی را واسطه میکند. این پنج پروتئین گیرنده به دلیل اینکه پاسخ تحریکی یا مهاری را بر سلول پس سیناپسی ایجاد میکند، به دو کلاس جدا میشوند. انواع مختلفی از داروها، قانونی و غیرقانونی وجود دارد که بر دوپامین و فعل و انفعالات آن در مغز تأثیر میگذارد. بیماری پارکینسون، بیماری است که میزان دوپامین را در مغز کاهش میدهد، لوودوپا پیش ماده دوپامین به بیمار داده میشود به این دلیل که دوپامین نمیتواند از سد خونی-مغزی عبور کند ولی لوودوپا میتواند. برخی از آگونیستهای دوپامین به بیماران پارکینسون که دارای اختلالی هستند معروف به سندرم پای بیقرار یا RLS نیز داده میشود. برخی از نمونههای آن روپینیرول و پرامیپکسول است.[۶]
اختلالات روانشناختی مانند اختلال کمتوجهی - بیشفعالی (ADHD) را میتوان با داروهایی مانند متیلفنیدات (به عنوان ریتالین هم شناخته میشود)، که مانع جذب مجدد دوپامین توسط سلول پیش سیناپسی میشود، درمان کرد که در نتیجه باعث افزایش دوپامین باقی مانده در سلول میشود. این افزایش دوپامین سیناپسی باعث افزایش اتصال به گیرندههای سلول پس سیناپسی میشود. این مکانیسم مشابه توسط سایر داروهای غیرقانونی و محرک قوی تر مانند کوکائین نیز استفاده میشود.
سروتونین[ویرایش]
ناقل عصبی سروتونین توانایی میانجیگری در انتقال سیناپسی از طریق گیرندههای GPCR یا LGIC را دارد. اثرات تحریکی یا مهاری پس سیناپسی سروتونین با توجه به نوع گیرنده بیان شده در یک منطقه مغزی مشخص میشود. معروفترین و پرمصرفترین داروها برای تنظیم سروتونین در دوران افسردگی به عنوان SSRI یا بازدارنده بازجذب سروتونین شناخته میشوند. این داروها از انتقال سروتونین به نورون پیش سیناپسی جلوگیری میکنند و باعث میشود سروتونین بیشتری در شکاف سیناپسی باقی بماند.
قبل از کشف SSRIها، داروهایی نیز وجود داشتند که آنزیمی که باعث تجزیه سروتونین میشود را مهار میکنند. MAOIها یا بازدارنده مونوآمین اکسیداز میزان سروتونین را در سیناپس افزایش میدهند، اما عوارض جانبی زیادی از جمله میگرن شدید و فشار خون بالا دارند. در نهایت این امر به داروهایی که با یک ماده شیمیایی رایج معروف به تیرامین (در بسیاری از انواع مواد غذایی یافت میشود) تداخل دارند مرتبط شد.[۷]
مجرای یونی[ویرایش]
مجراهای یونی واقع در غشای سطح نورون امکان هجوم یونهای سدیم و حرکت خارجی یونهای پتاسیم را در طی یک پتانسیل عمل فراهم میکند. به شکل انتخابی مسدود کردن این کانالهای یونی احتمال وقوع پتانسیل عمل را کاهش میدهد. داروی ریلوزول یک داروی محافظت کننده عصبی است که کانالهای یونی سدیم را مسدود میکند. از آنجا که این کانالها نمیتوانند فعال شوند، هیچ پتانسیل عملی وجود ندارد و نورون هیچگونه انتقال سیگنالهای شیمیایی را به سیگنالهای الکتریکی انجام نمیدهد و سیگنال حرکت نمیکند. از این دارو به عنوان بیحس کننده و همچنین آرامبخش استفاده میشود.[۸]
نوروفارماکولوژی رفتاری[ویرایش]

یکی از شکلهای نوروفارماکولوژی رفتاری، مطالعه وابستگی به مواد مخدر و چگونگی تأثیر اعتیاد به مواد مخدر بر ذهن انسان است. بیشتر تحقیقات نشان دادهاست که قسمت عمده ای از مغز که اعتیاد را از طریق پاداش نوروشیمیایی تقویت میکند، هسته اکومبنس است. تصویر سمت چپ نحوه پیشبینی دوپامین در این ناحیه را نشان میدهد. مصرف بیش از حد طولانی مدت الکل میتواند باعث وابستگی و اعتیاد شود. در زیر نحوه بروز این اعتیاد توضیح داده شدهاست.
اتانول[ویرایش]
خواص پاداش دهنده و تقویت کننده الکل (به عنوان مثال اعتیاد آور) از طریق اثرات آن بر نورونهای دوپامین در مسیر پاداش مزولیمبیک میانجی گری میشوند که منطقه تگمنتال بطنی را به هسته اکومبنس (NAcc) متصل میکند.[۹][۱۰] یکی از اثرات اولیه الکل مهار آلوستریک گیرندههای NMDA و تسهیل گیرندههای GABAA (به عنوان مثال، افزایش شار کلرید با میانجی گری گیرنده GABAA از طریق تنظیم آلوستریک گیرنده) است.[۱۱] در دوزهای بالا، اتانول بیشتر کانال یونی وابسته به لیگاند و کانال یونی وابسته به ولتاژ را در نورونها نیز مهار میکند.[۱۱] الکل، پمپهای سدیم-پتاسیم را در مخچه مهار میکند و به احتمال زیاد این امر باعث اختلال در محاسبه مخچه و هماهنگی بدن میشود.[۱۲][۱۳]
با مصرف حاد الکل، دوپامین در سیناپسهای مسیر مزولیمبیک آزاد میشود و به نوبه خود باعث افزایش فعال شدن گیرندههای D1 پس سیناپسی میشود.[۹][۱۰] فعال شدن این گیرندهها باعث ایجاد رویدادهای سیگنالینگ داخلی پس سیناپسی از طریق پروتئین کیناز آ میشود که در نهایت CREB را فسفریلاسیون میکند و باعث ایجاد تغییرات واسطه CREB در بیان ژن میشود.[۹][۱۰]
با مصرف مزمن الکل، مصرف اتانول بهطور مشابه باعث فسفوریلاسیون CREB از طریق مسیر گیرنده D1 میشود، اما همچنین عملکرد گیرنده NMDA را از طریق مکانیسمهای فسفوریلاسیون تغییر میدهد.[۹][۱۰] کاهش تنظیم تطبیقی مسیر گیرنده D1 و عملکرد CREB نیز رخ میدهد.[۹][۱۰] مصرف مزمن نیز با تأثیر بر فسفوریلاسیون و عملکرد CREB از طریق آبشارهای گیرنده NMDA پس سیناپسی از طریق یک مسیر MAPK / ERK و مسیر واسطه CAMK همراه است.[۱۰] این تغییرات در عملکرد CREB در مسیر مزولیمبیک باعث القای بیان (یعنی افزایش بیان ژن) ΔFosB در NAcc میشود؛[۱۰] جایی که ΔFosB \"پروتئین کنترل کننده اصلی\" است که، اگر بیش از حد در NAcc بیان شود، برای ایجاد اعتیاد و تداوم آن لازم و کافی است (به عنوان مثال، بیان بیش از حد آن در هسته اکومبنس، تولید الکل اجباری را ایجاد میکند و سپس مستقیماً آن را تعدیل میکند)[۱۰][۱۴][۱۵][۱۶]
تحقیق[ویرایش]
بیماری پارکینسون[ویرایش]
بیماری پارکینسون یک زوال عصبی است که با از دست دادن انتخابی نورونهای دوپامینرژیک واقع در توده سیاه (بخشی از میانمغز و دارای نورونهایی است که در ارتباط با عقدههای قاعدهای در تنظیم حرکات نقش دارند) توصیف شدهاست. امروزه بیشترین دارویی که برای مقابله با این بیماری استفاده میشود لوودوپا یا L DOPA است. این پیش ماده دوپامین میتواند از طریق سد خونی مغزی نفوذ کند، در حالی که ناقل عصبی دوپامین نمیتواند. تحقیقات گستردهای برای تعیین اینکه آیا L-dopa به جای سایر آگونیستهای دوپامین، درمانی بهتر برای بیماری پارکینسون است، انجام شدهاست. برخی معتقدند که استفاده طولانی مدت از L-dopa باعث محافظت در برابر نورون میشود و بنابراین، در نهایت منجر به مرگ سلول دوپامینرژیک میشود. اگرچه هیچ مدرکی، درونجانداری یا درونکشتگاهی وجود ندارد، اما برخی هنوز معتقدند که استفاده طولانی مدت از آگونیستهای دوپامین برای بیمار بهتر است.[۱۷]
بیماری آلزایمر[ویرایش]
در حالی که فرضیههای متنوعی برای علت بیماری آلزایمر مطرح شدهاست، توضیح این بیماری کامل نیست، و توسعه روشهای درمانی را دشوار میکند. در مغز بیماران مبتلا به آلزایمر، گیرندههای استیل کولین (nACh) نیکوتینیک عصبی و گیرندههای NMDA شناخته شده به پایین تنظیم شدهاند؛ بنابراین، چهار آنتی کولین استراز توسط سازمان غذا و داروی ایالات متحده (FDA) برای درمان در ایالات متحده تولید و تأیید شدهاست. با این حال، این داروها با توجه به عوارض جانبی و اثربخشی محدود آنها ایدهآل نیستند. یک داروی امیدوار کننده، نفیراستام (Nefiracetam)، برای درمان آلزایمر و سایر بیماران مبتلا به زوال عقل در حال تولید است و اقدامات بی نظیری در تقویت فعالیت گیرندههای nACh و گیرندههای NMDA دارد.[۱۸]
آینده[ویرایش]
با پیشرفت تکنولوژی و درک ما از سیستم عصبی، تولید داروها با افزایش حساسیت و ویژگی دارویی ادامه خواهد یافت. رابطه بین ساختار و فعالیت یک زمینه اصلی تحقیق در زمینه نوروفارماکولوژی است. تلاشی برای اصلاح کردن اثر یا قدرت (یعنی فعالیت) ترکیبات شیمیایی زیست فعال با اصلاح ساختارهای شیمیایی آنها.[۸]
منابع[ویرایش]
- ↑ http://www.ncbi.nlm.nih.gov/books/NBK6178/
- ↑ Everitt, Barry J.; Robbins, Trevor W. (2005-11). "Neural systems of reinforcement for drug addiction: from actions to habits to compulsion". Nature Neuroscience (به انگلیسی). 8 (11): 1481–1489. doi:10.1038/nn1579. ISSN 1546-1726.
{{cite journal}}: Check date values in:|date=(help) - ↑ ۳٫۰ ۳٫۱ Wrobel, Sylvia (2007). "Science, serotonin, and sadness: the biology of antidepressants". The FASEB Journal (به انگلیسی). 21 (13): 3404–3417. doi:10.1096/fj.07-1102ufm. ISSN 1530-6860. Archived from the original on 24 June 2021. Retrieved 23 June 2021.
- ↑ Lovinger, D. M. (2008). "Communication Networks in the Brain Neurons, Receptors, Neurotransmitters, and Alcohol. [Review]". Alcohol Research & Health. 31 (3): 196–214.
- ↑ Erwin, Sigel (2002-07-31). "Mapping of the Benzodiazepine Recognition Site on GABA-A Receptors". Current Topics in Medicinal Chemistry (به انگلیسی). doi:10.2174/1568026023393444. Retrieved 2021-06-23.
- ↑ Winkelman, JW; Allen, RP; Tenzer, P; Hening, W (2007). "Restless legs syndrome: nonpharmacologic and pharmacologic treatments". Geriatrics. 62 (10): 13–6. PMID 17922563.
- ↑ Francisco, Lopez-Munoz; Cecilio, Alamo (2009-05-01). "Monoaminergic Neurotransmission: The History of the Discovery of Antidepressants from 1950s Until Today". Current Pharmaceutical Design (به انگلیسی). doi:10.2174/138161209788168001. Retrieved 2021-06-23.
- ↑ ۸٫۰ ۸٫۱ Narahashi, T (2000). "Neuroreceptors and ion channels as the basis for drug action: past, present, and future". The Journal of Pharmacology and Experimental Therapeutics. 294 (1): 1–26. PMID 10871290.
- ↑ ۹٫۰ ۹٫۱ ۹٫۲ ۹٫۳ ۹٫۴ "Alcoholism – Homo sapiens (human) Database entry". KEGG Pathway. 29 October 2014. Retrieved 9 February 2015. "As one of the primary mediators of the rewarding effects of alcohol, dopaminergic ventral tegmental area (VTA) projections to the nucleus accumbens (NAc) have been identified. Acute exposure to alcohol stimulates dopamine release into the NAc, which activates D1 receptors, stimulating PKA signaling and subsequent CREB-mediated gene expression, whereas chronic alcohol exposure leads to an adaptive downregulation of this pathway, in particular of CREB function. The decreased CREB function in the NAc may promote the intake of drugs of abuse to achieve an increase in reward and thus may be involved in the regulation of positive affective states of addiction. PKA signaling also affects NMDA receptor activity and may play an important role in neuroadaptation in response to chronic alcohol exposure.".
- ↑ ۱۰٫۰ ۱۰٫۱ ۱۰٫۲ ۱۰٫۳ ۱۰٫۴ ۱۰٫۵ ۱۰٫۶ ۱۰٫۷ Kanehisa Laboratories (29 October 2014). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ↑ ۱۱٫۰ ۱۱٫۱ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 372. ISBN 978-0-07-148127-4. "Despite the high concentrations required for its psychoactive effects, ethanol exerts specific actions on the brain. The initial effects of ethanol result primarily from facilitation of GABAA receptors and inhibition of NMDA glutamate receptors. At higher doses, ethanol also inhibits the functioning of most ligand- and voltage-gated ion channels. It is not known whether ethanol selectively affects these channels via direct low affinity binding or via nonspecific disruption of plasma membranes which then selectively influences these highly complex, multimeric, transmembrane proteins. Ethanol allosterically regulates the GABAA receptor to enhance GABA-activated Cl− flux. The anxiolytic and sedative effects of ethanol, as well as those of barbiturates and benzodiazepines, result from enhancement of GABAergic function. Facilitation of GABAA receptor function is also believed to contribute to the reinforcing effects of these drugs. Not all GABAA receptors are ethanol sensitive. … Ethanol also acts as an NMDA antagonist by allosterically inhibiting the passage of glutamate-activated Na+ and Ca2+ currents through the NMDA receptor. … The reinforcing effects of ethanol are partly explained by its ability to activate mesolimbic dopamine circuitry, although it is not known whether this effect is mediated at the level of the VTA or NAc. It also is not known whether this activation of dopamine systems is caused primarily by facilitation of GABAA receptors or inhibition of NMDA receptors, or both. Ethanol reinforcement also is mediated in part by ethanol-induced release of endogenous opioid peptides within the mesolimbic dopamine system, although whether the VTA or NAc is the predominant site of such action is not yet known. Accordingly, the opioid receptor antagonist naltrexone reduces ethanol self-administration in animals and is used with modest effect to treat alcoholism in humans.".
- ↑ Forrest, Michael D. (2015-04-26). "Simulation of alcohol action upon a detailed Purkinje neuron model and a simpler surrogate model that runs >400 times faster". BMC Neuroscience. 16 (1): 27. doi:10.1186/s12868-015-0162-6. ISSN 1471-2202. PMC 4417229. PMID 25928094.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Forrest, Michael (April 2015). "The neuroscience reason we fall over when drunk". Science 2.0. Retrieved January 2, 2019.
- ↑ Ruffle, James K. (2014-11-01). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–437. doi:10.3109/00952990.2014.933840. ISSN 0095-2990. PMID 25083822.
- ↑ Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues Clin Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410. "DESPITE THE IMPORTANCE OF NUMEROUS PSYCHOSOCIAL FACTORS, AT ITS CORE, DRUG ADDICTION INVOLVES A BIOLOGICAL PROCESS: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. … A large body of literature has demonstrated that such ΔFosB induction in D1-type NAc neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement".
- ↑ Robison, Alfred J.; Nestler, Eric J. (2011-11). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews Neuroscience (به انگلیسی). 12 (11): 623–637. doi:10.1038/nrn3111. ISSN 1471-0048. PMC 3272277. PMID 21989194.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Shin, Jin Young; Park, Hyun-Jung; Ahn, Young Hwan; Lee, Phil Hyu (2009). "Neuroprotective effect of l-dopa on dopaminergic neurons is comparable to pramipexol in MPTP-treated animal model of Parkinson's disease: a direct comparison study". Journal of Neurochemistry (به انگلیسی). 111 (4): 1042–1050. doi:10.1111/j.1471-4159.2009.06381.x. ISSN 1471-4159.
- ↑ "Unique mechanism of action of Alzheimer's drugs on brain nicotinic acetylcholine receptors and NMDA receptors". Life Sciences (به انگلیسی). 74 (2–3): 281–291. 2003-12-05. doi:10.1016/j.lfs.2003.09.015. ISSN 0024-3205.

