تعادل حلالیت
تعادل حلالیت نوعی از تعادل دینامیکی است و زمانی وجود دارد که یک ترکیب شیمیایی در حالت جامد با محلول آن ترکیب در تعادل شیمیایی باشد. جامد ممکن است بدون تغییر، با تفکیک، یا با واکنش شیمیایی با ترکیب دیگری از محلول، مانند اسید یا قلیا، حل شود. تعادل حلالیت در شاخههای دارویی، زیستمحیطی و بسیاری از شاخههای دیگر مهم است.
معانی[ویرایش]
تعادل حلالیت زمانی وجود دارد که یک ترکیب شیمیایی در حالت جامد با محلولی حاوی ترکیب در تعادل شیمیایی باشد. این نوع تعادل، نمونه ای از تعادل دینامیکی است که برخی از مولکولهای منفرد بین فاز جامد و محلول حرکت میکنند به طوری که سرعت انحلال و تشکیل رسوب (تهنشینی) با یکدیگر برابر است. هنگامی که تعادل برقرار شود و همه جامد حل نشده باشد، محلول اشباع شدهاست. غلظت حل شونده در یک محلول اشباع به عنوان انحلال پذیری شناخته میشود. میزان انحلال پذیری به دما وابسته است. محلولی که دارای غلظت حل شونده بالاتر از میزان انحلال پذیری باشد، محلول فوق اشباع گفته میشود.
یک محلول فوق اشباع ممکن است با افزودن یک «دانه» که ممکن است یک کریستال ریز از حل شونده یا یک ذره جامد کوچک باشد که رسوب را آغاز میکند، به تعادل برسد.
سه نوع اصلی تعادل حلالیت وجود دارد:
- انحلال ساده
- انحلال با واکنش تجزیه. این ویژگی نمکها است. ثابت تعادل در این مورد به عنوان یک محصول حلالیت شناخته میشود.
- انحلال با واکنش یونیزاسیون این مشخصه انحلال اسیدهای ضعیف یا بازهای ضعیف در محیطهای آبی با pH متغیر است
در هر یک از موارد بالا، یک ثابت تعادل را میتوان به عنوان ضریبی برای فعالیتها مشخص کرد. این ثابت تعادل کمیت بدون بعد است زیرا فعالیت یک کمیت بدون بعد است. با این وجود، ثابت تعادل معمولاً بر ضرایب فعالیت تقسیم میشود تا به یک ضریب غلظت تبدیل شود. علاوه بر این، فعالیت یک جامد، طبق تعریف، برابر با ۱ است، بنابراین از عبارت تعریف حذف شدهاست.
برای یک تعادل شیمیایی داریم:
فرآورده انحلال پذیری (Ksp) برای ترکیب (ApBq)، به صورت زیر تعریف میشود:
که در آن [A] و [B]، غلظتهای A و B در یک محلول اشباع هستند.
اثرات شرایط[ویرایش]
اثر دما[ویرایش]

حلالیت به تغییرات دما حساس است. به عنوان مثال شکر در آب گرم بیشتر از آب سرد حل میشود. این به این دلیل رخ میدهد که فرآورده انحلال، مانند انواع دیگر ثابتهای تعادل، تابع دما هستند. مطابق با اصل لوشاتلیه، زمانی که فرایند انحلال گرماگیر است (گرما جذب میکند)، انحلال پذیری با افزایش دما افزایش مییابد. این اثر اساس فرایند تبلور مجدد است که میتواند برای خالص سازی یک ترکیب شیمیایی استفاده شود. هنگامی که انحلال گرمازا است (گرما آزاد میشود) انحلال پذیری با افزایش دما کاهش مییابد. سولفات سدیم در دمای کمتر از حدود ۳۲٫۴ درجه سانتی گراد همراه با افزایش انحلال پذیری است، اما در دمای بالاتر انحلال پذیری کاهش مییابد.
وابستگی به دمای انحلال پذیری برای یک محلول ایدهآل (به دست آمده برای مواد با انحلال پذیری کم) با عبارت زیر نشان داده میشود:
جاییکه آنتالپی مولی جزئی املاح در رقت بینهایت است و آنتالپی در هر مول از کریستال خالص است.
این عبارت دیفرانسیل برای یک غیر الکترولیت را میتوان در یک بازه دمایی ادغام کرد و به دست آورد:
برای محلولهای غیر ایدهآل، فعالیت حل شونده در حالت اشباع به جای حلالیت کسر مولی در مشتق با توجه به دما ظاهر میشود:
اثر یون مشترک[ویرایش]
اثر یون مشترک، اثر کاهش انحلال پذیری یک نمک است هنگامیکه نمک دیگری که یون مشترکی با آن دارد نیز وجود دارد. به عنوان مثال، انحلال پذیری کلرید نقره(AgCl) زمانی کاهش مییابد که کلرید سدیم، منبع یون کلرید رایج، به سوسپانسیون AgCl در آب اضافه شود.
انحلال پذیری در غیاب یون مشترک را میتوان به صورت زیر محاسبه کرد. غلظت [Ag+] و [Cl-] برابر است زیرا یک مول AgCl به یک مول Ag+ و یک مول Cl- تجزیه میشود. غلظت [Ag+(aq)] با x نشان داده شدهاست.
حال فرض کنید که کلرید سدیم نیز وجود داشته باشد، در غلظت ۰٫۰۱ مول، انحلال پذیری بدون توجه به هرگونه اثر احتمالی یونهای سدیم، اکنون با عبارت زیر محاسبه میشود.
این یک معادله درجه دوم است در x است که برابر با انحلال پذیری نیز هست.
در مورد کلرید نقره، x2 بسیار کوچکتر از 0.01Mx است، بنابراین عبارت اول را میتوان نادیده گرفت.
اثر اندازه ذرات[ویرایش]
ثابت انحلال پذیری ترمودینامیکی برای تک بلورهای بزرگ تعریف میشود. انحلال پذیری با کاهش اندازه ذرات حل شونده به دلیل انرژی سطح اضافی، افزایش مییابد. این اثر عموماً کوچک است مگر اینکه ذرات بسیار کوچک شوند، معمولاً کوچکتر از ۱ میکرومتر. تأثیر اندازه ذرات بر ثابت انحلال پذیری را میتوان به صورت زیر تعیین کرد:
که در آن *KA ثابت انحلال پذیری برای ذرات حل شونده با مساحت سطح مولی A است، *KA→0 ثابت انحلال پذیری برای ماده ای است که مساحت سطح مولی آنها به صفر میرسد (یعنی وقتی ذرات بزرگ هستند)، γ کشش سطحی است. از ذره املاح در حلال، Am مساحت سطح مولی املاح (به متر مربع بر مول)، R ثابت گاز جهانی و T دمای مطلق است.
اثرات نمکها[ویرایش]
اثرات نمک به این واقعیت اشاره دارد که وجود نمکی که هیچ یون مشترکی با حل شونده ندارد، بر قدرت یونی محلول و در نتیجه بر ضرایب فعالیت تأثیر میگذارد، به طوری که ثابت تعادل، که به عنوان یک ضریب غلظت بیان میشود، تغییر میکند.
اثر فازها[ویرایش]
تعادل برای فازهای کریستالی خاص تعریف شدهاست؛ بنابراین انتظار میرود فرآورده انحلال پذیری بسته به فاز جامد متفاوت باشد. به عنوان مثال، آراگونیت و کلسیت فرآوردههای انحلال پذیری متفاوتی خواهند داشت، حتی اگر هر دو هویت شیمیایی یکسانی داشته باشند (کربنات کلسیم). تحت هر شرایطی یک فاز از نظر ترمودینامیکی پایدارتر از فاز دیگر خواهد بود؛ بنابراین، این فاز زمانی تشکیل میشود که تعادل ترمودینامیکی برقرار شود. با این حال، عوامل جنبشی ممکن است به شکلگیری رسوب نامطلوب (به عنوان مثال آراگونیت) کمک کنند، که سپس گفته میشود که در حالت شبه پایدار است.
اثر فشار[ویرایش]
برای فازهای متراکم (جامدات و مایعات)، انحلال پذیری وابستگی کمی به فشار دارد و معمولاً در عمل نادیده گرفته میشود. با فرض یک محلول ایدهآل، وابستگی را میتوان به صورت کمی محاسبه کرد:
جایی که کسر مولی مین جزء در محلول، P فشار، T دما مطلق ، حجم مولی جزیی محلول ، حجم مولی جزیی حل شونده و R ثابت گاز هاست.
وابستگی انحلال پذیری به فشار، گاهی اوقات اهمیت عملی دارد. به عنوان مثال، رسوبگیری میادین نفتی و چاهها توسط سولفات کلسیم (که انحلال پذیری آن با کاهش فشار کاهش میدهد) میتواند منجر به کاهش بهرهوری در طول زمان شود.
جنبههای کمی[ویرایش]
انحلال ساده[ویرایش]
انحلال یک جامد آلی را میتوان به عنوان تعادل بین ماده در اشکال جامد و محلول آن توصیف کرد. به عنوان مثال، هنگامی که ساکارز (شکر سفره) یک محلول اشباع تشکیل میدهد
یک عبارت تعادلی برای این واکنش میتواند مانند هر واکنش شیمیایی نوشته شود:
که در آن Ko ثابت انحلال پذیری ترمودینامیکی نامیده میشود. بریسها نشان دهنده فعالیت هستند. فعالیت یک جامد خالص طبق تعریف، پیوستهاست. از این رو:
فعالیت یک ماده (A) در محلول را میتوان به صورت حاصل ضرب غلظت [A] و ضریب فعالیت γ بیان کرد. وقتی Ko بر γ تقسیم میشود، ثابت انحلال پذیری، Ks خواهد بود:
این معادل تعریف حالت استاندارد به عنوان محلول اشباع است به طوری که ضریب فعالیت برابر با یک باشد. ثابت انحلال پذیری تنها در صورتی ثابت واقعی است که ضریب فعالیت تحت تأثیر وجود حل شونده دیگری که ممکن است وجود داشته باشد، نباشد. واحد ثابت انحلال پذیری همان واحد غلظت حل شونده است.
انحلال با تفکیک[ویرایش]
ترکیبات یونی معمولاً وقتی در آب حل میشوند به یونهای تشکیل دهنده خود تجزیه میشوند. به عنوان مثال، برای نقره کلرید:
عبارت ثابت تعادل برای این واکنش عبارت است از:
جاییکه ثابت تعادل ترمودینامیکی است و مهاربندها فعالیت را نشان میدهند. فعالیت یک جامد خالص طبق تعریف برابر با یک است.
برای نمکهای ۲:۲ و ۳:۳، مانند CaSO4 و FePO4، بیان کلی فرآورده انحلال پذیری مانند الکترولیت ۱:۱ است.
(برای سادگی نماد، بارهای الکتریکی در عبارات کلی حذف میشوند)
با نمک نامتقارن مانند Ca(OH)2 انحلال پذیری را با عبارت زیر بیان میکنیم:
از آنجایی که غلظت یونهای هیدروکسید دو برابر غلظت یونهای کلسیم است، خواهیم داشت :
بهطور کلی، با تعادل شیمیایی خواهیم داشت:
بعضی نمکها بهطور کامل در محلول تجزیه نمیشوند. به عنوان مثال میتوان به MgSO4 اشاره کرد که توسط مانفرد ایگن کشف شد که در آب دریا هم به عنوان یک مجتمع کره داخلی و هم به عنوان یک مجتمع کره بیرونی وجود دارد. حلالیت چنین نمکهایی با روش مشخص شده در انحلال با واکنش محاسبه میشود.
هیدروکسیدها[ویرایش]
فرآورده انحلال پذیری هیدروکسید یک یون فلز، Mn+، معمولاً به شرح زیر تعریف میشود:
با این حال، برنامههای کامپیوتری همه منظوره برای استفاده از غلظت یون هیدروژن با تعاریف جایگزین طراحی شدهاند.
برای هیدروکسیدها، فرآوردههای انحلال پذیری اغلب به شکل اصلاح شده K*sp، با استفاده از غلظت یون هیدروژن به جای غلظت یون هیدروکسید داده میشود. این دو مقدار با ثابت خودیونش آب، Kw مرتبط هستند
انحلال با واکنش[ویرایش]
یک واکنش معمولی با انحلال شامل یک باز ضعیف B است که در محلول آبی اسیدی حل میشود.
این واکنش برای محصولات دارویی بسیار مهم است. انحلال اسیدهای ضعیف در محیطهای قلیایی نیز به همین ترتیب مهم است.
مولکول بدون بار معمولاً انحلال پذیری کمتری نسبت به فرم یونی دارد، بنابراین حلالیت به pH و ثابت تفکیک اسیدی محلول بستگی دارد. اصطلاح «حلالیت ذاتی» برای توصیف حلالیت فرم غیریونیزه در غیاب اسید یا قلیایی استفاده میشود.
شسته شدن نمکهای آلومینیوم از سنگها و خاک توسط باران اسیدی نمونه دیگری از انحلال با واکنش است: آلومینو سیلیکاتها بازهایی هستند که با اسید واکنش داده و گونههای محلول مانند Al3+(aq) را تشکیل میدهند.
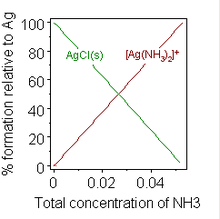
تشکیل یک کمپلکس شیمیایی نیز ممکن است حلالیت را تغییر دهد. یک مثال معروف، افزودن محلول غلیظ آمونیاک به سوسپانسیون نقره کلرید است که در آن انحلال، با تشکیل کمپلکس یک آمین مطلوب است.
هنگامی که آمونیاک کافی به سوسپانسیون کلرید نقره اضافه میشود، جامد حل میشود. افزودن نرمکنندههای آب به پودرهای لباسشویی برای جلوگیری از تشکیل کف صابون نمونه ای از اهمیت عملی را ارائه میدهد.
محاسبه انحلال پذیری تجربی[ویرایش]
تعیین حلالیت با مشکلاتی همراه است. اولین و مهمترین مشکل در برقراری تعادل سیستم در دمای انتخاب شدهاست. این به این دلیل است که هر دو واکنش تهنشینی و انحلال ممکن است بسیار کند باشد. اگر فرایند بسیار کند باشد، تبخیر حلال ممکن است مشکل ساز باشد. در مورد مواد بسیار نامحلول، غلظت در محلول بسیار کم است و تعیین آن دشوار است. روشهای مورد استفاده بهطور کلی به دو دسته استاتیک و دینامیک تقسیم میشوند.
روش استاتیکی[ویرایش]
در روشهای استاتیکی، مخلوط به تعادل میرسد و غلظت یک گونه در فاز محلول با شیمی تجزیه تعیین میشود که معمولاً مستلزم جداسازی فازهای جامد و محلول است. برای انجام این کار، تعادل و جداسازی باید در یک اتاق ترموستات انجام شود. اگر یک ردیاب رادیواکتیو در فاز جامد گنجانده شود، میتوان غلظتهای بسیار پایین را اندازهگیری کرد.
یکی از انواع روش استاتیک، افزودن محلولی از ماده به یک حلال غیر آبی، مانند دی متیل سولفوکسید، به یک مخلوط بافر آبی است. ممکن است تهنشینی فوری رخ دهد و مخلوطی ابری ایجاد کند. حلالیت اندازهگیری شده برای چنین مخلوطی به عنوان «حلالیت جنبشی» شناخته میشود. تشکیل مخلوط ابری به این دلیل است که ذرات رسوب بسیار کوچک هستند که منجر به اثر تیندال میشود. در واقع ذرات آنقدر کوچک هستند که اثر اندازه ذرات وارد عمل میشود و حلالیت جنبشی اغلب بیشتر از حلالیت تعادلی است. با گذشت زمان با افزایش اندازه بلورها، مخلوط ابری ناپدید میشود و در نهایت در فرآیندی به نام پیری رسوبی به تعادل میرسد.
روش دینامیکی[ویرایش]
مقادیر حلالیت اسیدهای آلی، بازها و آمفولیت هارا میتوان با فرآیندی به نام «حلالیت تعادل تعقیب» به دست آورد. در این روش ابتدا مقداری از ماده در pH حل میشود که عمدتاً به شکل یونیزه شده وجود دارد و سپس با تغییر pH، رسوبی از گونه خنثی (غیریونیزه) تشکیل میشود. متعاقباً، سرعت تغییر pH در اثر تهنشینی یا انحلال کنترل میشود و تیتراسیون اسید و باز قوی برای تنظیم pH برای کشف شرایط تعادل در زمانی که دو نرخ برابر هستند، اضافه میشود. مزیت این روش این است که نسبتاً سریع است زیرا مقدار رسوب تشکیل شده بسیار کم است. با این حال، عملکرد این روش ممکن است تحت تأثیر محلولهای فوق اشباع قرار گیرد.
جستارهای وابسته[ویرایش]
- Solubility table: A table of solubilities of mostly inorganic salts at temperatures between 0 and 100 °C.
- Solvent models
منابع[ویرایش]
Payghan, Santosh (2008) // https://web.archive.org/web/20100330171700/http://www.pharmainfo.net/reviews/potential-solubility-drug-discovery-and-development
Gutman, E. M. (1994). Mechanochemistry of Solid Surfaces. World Scientific Publishing
Baes, C. F. ; Mesmer, R. E. (1976). The Hydrolysis of Cations. New York: Wiley
Mendham, J. ; Denney, R. C. ; Barnes, J. D. ; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall,
. The Determination of Stability Constants Rossotti, F. J. C. ; Rossotti, H. (1961). "Chapter 9: Solubility"


![{\displaystyle K_{\mathrm {sp} }=[\mathrm {A} ]^{p}[\mathrm {B} ]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4849f5de2caa6a6afc41e1ef3e7b1d616727a006)






![{\displaystyle K_{\mathrm {sp} }=\mathrm {[Ag^{+}][Cl^{-}]} =x^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f0bffee6482db93b42687debe5e67ae0e9e9ce)
![{\displaystyle {\text{Solubility}}=\mathrm {[Ag^{+}]=[Cl^{-}]} =x={\sqrt {K_{\mathrm {sp} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5d873185045db09f35c9632f90226a68c579f8c)
![{\displaystyle K_{\mathrm {sp} }=\mathrm {[Ag^{+}][Cl^{-}]} =x(0.01\,{\text{M}}+x)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3c068d38c5972ce310ecc44ebf95541de3f2aed)

![{\displaystyle {\text{Solubility}}=\mathrm {[Ag^{+}]} =x={\frac {K_{\mathrm {sp} }}{0.01\,{\text{M}}}}=\mathrm {1.77\times 10^{-8}\,mol\,dm^{-3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b477a17639a524aafafbf5f84001ddc3ddf9f144)









![{\displaystyle K_{\mathrm {s} }=\left[\mathrm {{C}_{12}{H}_{22}{O}_{11}(aq)} \right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0d66d9abd58b332ebc6cd32daa0d77e17b390a9)



![{\displaystyle K_{sp}=\mathrm {[A][B]} =\mathrm {[A]^{2}} =\mathrm {[B]^{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1dd2b5dd67c487389ea015680d348f555feac42c)

![{\displaystyle \mathrm {K_{sp}=[Ca][OH]^{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/99abf19bb6a4b1d07e5f7e8cbaf02d1922464038)
![{\displaystyle \mathrm {K_{sp}=4[Ca]^{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1dffda519d2e258ac3757b0892d07abadaf9106b)

![{\displaystyle \mathrm {[B]={\frac {q}{p}}[A]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9aafcdaae8e00af5e0741aa51d43ccba6c093dc3)

![{\displaystyle K_{sp}=\mathrm {[M^{n+}][OH^{-}]^{n}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f3222b63bd6c44fc391e7d6ab627d931ca25af2)

![{\displaystyle K_{\text{sp}}^{*}=\mathrm {[M^{n+}][H^{+}]^{-n}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/58d0ab361c57c0ab190b937c3584e2f70f6ad427)
![{\displaystyle K_{\mathrm {w} }=[\mathrm {H^{+}} ][\mathrm {OH^{-}} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b925a134a80bb3d9fba3a16004e80a4ecb42bb0)




![{\displaystyle \mathrm {AgCl(s)+2NH_{3}(aq)\leftrightharpoons [Ag(NH_{3})_{2}]^{+}(aq)+Cl^{-}(aq)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f40adb38b5b59a25fc58a5b0c9529e454fade416)