تیتانیت استرانسیم
تیتانات استرانسیوم اکسیدی از استرانسیوم و تیتانیوم با فرمول شیمیایی SrTiO3 است. در دمای اتاق، یک مادهٔ متقارنالمرکز پاراالکتریک با ساختار پروسکایتی است. در دماهای پایین به یک گذار فازی فروالکتریک با ثابت دی الکتریک خیلی بزرگی میرسد (در حدود 104) اما همچنان در پایینترین دماها پاراالکتریک باقی میماند. این اتفاق در نتیجهٔ نوسانات کوانتومی رخ میدهد که منجر به تبدیل شدن به یک پاراالکتریک کوانتومی میشود.[۱] مدتها تصور میشد که این ماده تماماً بهطور مصنوعی ساخته میشود، تا اینکه در سال ۱۹۸۲ همتای طبیعی آن - که در سیبری کشف شد و توزونیت نام گرفت - توسط IMA شناسایی شد. تاوزونیت یک ماده معدنی بسیار نادر در طبیعت است که به صورت بلورهای بسیار ریز وجود دارد. مهمترین کاربرد آن در شکل سنتز شده آن بودهاست که گاهی به عنوان یک شبیهساز الماس، در اپتیک دقیق، در وریستورها و در سرامیکهای پیشرفته دیده میشود.
توزونیت به افتخار لو ولادیمیروویچ توزون (۱۹۱۷–۱۹۸۹)، ژئوشیمیدان روسی، نامگذاری شدهاست. نامهای تجاری منسوخ شده برای این محصول مصنوعی مزوتیتانات استرانسیم، دیاژم و مارولیت است. این محصول در حال حاضر با نام فبولیت برای کاربرد در جواهرآلات[۲] به بازار عرضه میشود. غیر از نوع محلی آن یعنی توده مورون در جمهوری سخا، تاوزونیت طبیعی در سرو سارامبی، دپارتمان کنسپسیون، پاراگوئه، و در امتداد رودخانه کوتاکی هونشو، ژاپن نیز یافت میشود.[۳][۴]
خواص[ویرایش]

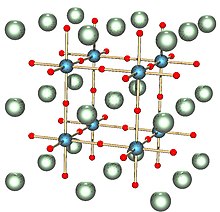
SrTiO 3 دارای یک شکاف باند غیر مستقیم با انرژی ۳٫۲۵ الکترونولت و یک شکاف مستقیم با انرژی ۳٫۷۵ الکترونولت[۵] در محدوده معمول نیمه هادیها است. تیتانات استرانسیوم مصنوعی دارای یک ثابت دی الکتریک بسیار بزرگ (۳۰۰) در دمای اتاق و میدان الکتریکی ضعیفی است. این ماده مقاومت ویژهای بیش از 109 Ω-cm برای کریستالهای بسیار خالص دارد.[۶] همچنین در خازنهای ولتاژ بالا استفاده میشود. با در معرض قرار دادن حاملهای بار الکتریکی متحرک با دوپ کردن سرب، رفتار فلزی فرمی مایع در تراکم کم حاملان بار از خود نشان میدهد.[۷] در چگالی الکترونی بالا، تیتانات استرانسیوم در دمای پایینتر از ۰٫۳۵ کلوین ابررسانا میشود و اولین عایق و اکسیدی است که به عنوان ابررسانا کشف شدهاست.[۸]
تیتانات استرانسیوم هم بسیار چگال تر (وزن مخصوص ۴٫۸۸ برای نمونهٔ طبیعی، ۵٫۱۳ برای نمونهٔ مصنوعی) و هم بسیار نرمتر (با سختی Mohs 5.5 برای نمونهٔ مصنوعی، و ۶–۶٫۵ برای نمونهٔ طبیعی) از الماس است. سیستم کریستالی آن مکعبی است و ضریب شکست آن (۲٫۴۱۰ - اندازهگیری شده با نور سدیم، با طول موج ۵۸۹٫۳ نانومتر) تقریباً مشابه الماس است (با مقدار ۲٫۴۱۷)، اما پراکنش (ویژگی نوری که مسبب «درخشش» سنگهای قیمتی برش خوردهاست) تیتانات استرانسیوم ۴٫۳ برابر الماس است، با مقدار ۰٫۱۹۰ (در فاصله B-G). این منجر به نمایش تکاندهنده آتش در مقایسه با الماس و شبیهسازهای الماس مانند YAG, GAG, GGG, Cubic Zirconia و Moissanite میشود.[۳][۴]
مواد مصنوعی معمولاً شفاف و بیرنگ هستند، اما میتوان آنها را با برخی از فلزات خاکی کمیاب یا واسطه دوپ کرد تا رنگهای قرمز، زرد، قهوهای و آبی ایجاد کند. تاوزونیت طبیعی معمولاً نیمه شفاف تا مات با سایههای قهوه ای مایل به قرمز، قرمز تیره یا خاکستری است. هردو دارای جلای آدامانتین (الماس مانند) هستند. تیتانات استرانسیوم با یک شکستگی مخروطی بسیار ترد محسوب میشود. مواد طبیعی معمولاً مکعب یا هشت وجهی هستند و رگههایی قهوه ای دارند. به کمک یک طیفسنجی دستی (دید مستقیم)، مواد مصنوعی دوپشده طیف جذبی گستردهای از خود نشان میدهند که اتفاق معمولی برای سنگهای دوپشدهاست. مادهٔ مصنوعی دارای نقطهٔ ذوب حدود ۲۰۸۰ درجهٔ سانتیگراد (معادل ۳۷۷۶ درجهٔ فارنهایت) است و به آسانی توسط هیدروفلوئوریک اسید خورده میشود.[۳][۴] تحت فشار جزئی بسیار کم اکسیژن، تیتانات استرانسیوم از طریق تصعید نامتجانس استرانسیوم در دمایی بسیار کمتر از دمای ذوب تجزیه میشود.[۹]
در دماهای کمتر از ۱۰۵ کلوین، ساختار مکعبی آن به چهاروجهی تبدیل میشود.[۱۰] از تک کریستالهای آن میتوان به عنوان پنجرههای نوری و اهداف رسوبی با کیفیت بالا استفاده کرد.

SrTiO 3 یک لایهٔ عالی برای رشد اپیتکسیال ابررساناهای دمابالا و بسیاری از لایههای نازک با پایهٔ اکسید است. به ویژه به عنوان بستری برای رشد سطح مشترک آلومینات لانتانیم و تیتانات استرانسیم شناخته شدهاست. دوپ کردن تیتانات استرانسیوم با نیوبیم آن را رسانای الکتریکی میکند که یکی از تنها بسترهای تک کریستالی رسانای تجاری برای رشد اکسیدهای پروسکایت است. پارامتر شبکهٔ حجیم آن با اندازهٔ ۳٫۹۰۵Å باعث شده تا به عنوان بستری برای رشد بسیاری از اکسیدهای دیگر، از جمله منگنیتهای خاکی کمیاب،لانتانیتها، و آلومینات لانتانیم (LaAlO3)، استرانسیم روتنات (SrRuO3) و بسیاری دیگر مناسب باشد. فضای خالی اکسیژن درکریستال SrTiO3 و لایههای نازک نسبتاً رایج است. فضای خالی اکسیژن باعث القای الکترونهای آزاد در نوار رسانایی ماده میشود و آن را رساناتر و ماتتر میکند. این فضاهای خالی میتواند در اثر قرار گرفتن در معرض شرایط کاهشی مانند خلاء زیاد در دماهای بالا ایجاد شود.
لایههای باکیفیت اپیتکسیال SrTiO3 را میتوان روی سیلیکون بدون تشکیل دیاکسید سیلیکون رشد داد و در نتیجه SrTiO3 را به یک ماده دیالکتریک گیت جایگزین تبدیل کرد. این کار همچنین امکان ادغام سایر اکسیدهای پروسکایت لایهنازک را روی سیلیکون فراهم میکند.[۱۱]
نتایج حاکی از آن است که SrTiO 3 دارای رسانایی نوری پایداری است، به طوری که قرار گرفتن کریستال در معرض نور، اندازهٔ رسانایی الکتریکی آن را بیش از ۲ مرتبه افزایش میدهد. بعد از خاموش شدن چراغ، رسانایی الکتریکی افزایش یافته برای چندین روز با کاهشی قابل صرف نظر دوام پیدا میکند.[۱۲][۱۳]
با توجه به رسانایی یونی و الکترونیکی قابل توجه SrTiO 3، این ماده پتانسیل زیادی برای استفاده به عنوان رسانای مخلوط قوی دارد.[۱۴]
سنتز[ویرایش]

تیتانات استرانسیوم مصنوعی یکی از چندین تیتاناتی است که در اواخر دههٔ ۱۹۴۰ و اوایل دههٔ ۱۹۵۰ به ثبت رسید. تیتاناتهای دیگر تیتانات باریم و تیتانات کلسیم بودند. تحقیقات عمدتاً در شرکت ملی سرب (که بعداً به صنایع NL تغییر نام یافت) در ایالات متحده توسط لئون مرکر و لانگتری ای. لیند انجام میشد. مرکر و لیند برای اولین بار در ۱۰ فوریه سال ۱۹۵۳ روند رشد را ثبت کردند. تعدادی از اصلاحات متعاقباً طی چهار سال آینده به ثبت رسید، مانند بهبودهایی در پودر تغذیه و افزودن دوپکنندههای رنگزا.
اصلاحی در فرایند اولیهٔ Verneuil (همچنین با اسم شناخته شدهٔ دیگر شعلههمجوشی) روش مطلوب رشد است. یک لولهٔ دمنده اکسیژن-هیدروژن معکوس استفاده میشود، درحالی که پودر تغذیهٔ مخلوط شده با اکسیژن به روش معمول با دقت از طریق لولهٔ دمنده تغذیه میشود، با این تفاوت که یک لوله سوم برای رساندن اکسیژن افزوده میشود- ایجاد یک مشعل تریکن. اکسیژن اضافی برای تشکیل موفقیتآمیز تیتانات استرانسیوم مورد نیاز است. در غیر این صورت به دلیل جزء تیتانیومدار بهطور کامل اکسید نمیشود. نسبت حجمی هیدروژن به اکسیژن در حدود ۱٫۵ است. پودر تغذیهٔ خالص سازی شده ابتدا با تولید نمک اگزالات دوگانه تیتانیل (SrTiO(C 2 O 4) 2 · 2 H 2 O) با واکنش کلرید استرانسیوم (Sr Cl 2) و اسید اگزالیک ((COO H) 2 · 2 H2 O) با تتراکلرید تیتانیوم (TiCl4) حاصل میشود. نمک شسته میشود تا کلرید کاملاً حذف شود و سپس تا ۱۰۰۰ درجهٔ سلسیوس به منظور تولید یک پودر دانهای از ترکیب مورد نیاز با آزادی جریان یافتن حرارتدهی میشود، و سپس آسیاب و الک میشود تا اطمینان حاصل شود که اندازه همه ذرات بین ۰٫۲–۰٫۵ میکرومتر است.
پودر تغذیه از میان شعله اکسیژن-هیدروژن عبور کرده، ذوب شده و روی یک پایه چرخان که به آرامی پایین میآید، میافتد. ارتفاع پایه دائماً تنظیم میشود تا بالای آن در موقعیت مطلوب در زیر شعله نگه داشته شود، و پس از چند ساعت پودر مذاب خنک و متبلور میشود و یک ساختار تکساقهٔ گلابی شکل یا کریستال بول را تشکیل میدهد. این کریستال معمولاً بیشتر از ۲٫۵ سانتیمتر قطر و ۱۰ سانتیمتر طول ندارد. این ساختار در ابتدا به رنگ سیاه مات است که برای بیرنگ شدن کریستال و کاهش تنش نیاز به بازپخت بیشتر در فضای اکسید کننده دارد. این عمل در دمای بیش از ۱۰۰۰درجه سلسیوس به مدت ۱۲ ساعت انجام میشود.
لایههای نازک SrTiO 3 را میتوان با روشهای مختلف از جمله رسوب لیزر پالسی، اپیتاکسی پرتو مولکولی، کندوپاش RF و رسوب لایه اتمی به صورت همپایی رشد داد. در اکثر لایههای نازک، روشهای رشد مختلف میتواند منجر به تفاوتهای قابل توجهی در چگالی عیب و ناخالصی و کیفیت کریستالی شود که در نتیجه تغییرات زیادی در خواص الکترونیکی و نوری ایجاد میکند.
کاربرد به شکل شبیهساز الماس[ویرایش]
ساختار مکعبی و پراش بالای آن تا مدتی تیتانات استرانسیوم مصنوعی را به انتخاب اصلی برای شبیهسازی الماس تبدیل کرد. در آغاز در حدود سال ۱۹۵۵، مقادیر زیادی تیتانات استرانسیم فقط برای این هدف تولید شد. تیتانات استرانسیوم در آن زمان در رقابت با روتیل مصنوعی ("تیتانیا") بود، و این مزیت را داشت که فاقد رنگ زرد جزئی نامطلوب و birefringence شدیدی که ماده دوم داشت بود. با وجود اینکه نرمتر بود، بهطور قابل توجهی به الماس شبیهتر بود. با این حال، با تحتالشعاع قرار گرفتن توسط شبیهسازهای "بهتر" نهایتاً هر دو استفادهای ندارند: اول توسط گارنت ایتریم آلومینیوم (YAG) و مدت کوتاهی پس از آن با گادولینیم گالیم گارنت (GGG)؛ و در نهایت توسط شبیهساز نهایی از نظر شباهت به الماس و مقرون به صرفه بودن (تا به امروز)، زیرکونیای مکعبی.
با وجود منسوخ بودن، تیتانات استرانسیوم هنوز تولید میشود و بهطور متناوبی در جواهرات دیده میشود. این یکی از پرهزینهترین شبیهسازهای الماس است و به دلیل کمیاب بودن آن، کلکسیونرها ممکن است برای نمونههای بزرگتر از ۲ قیراط (۴۰۰ میلیگرم) حق بیمه بپردازند. به عنوان یک شبیهساز الماس، تیتانات استرانسیوم زمانی که با مله یعنی سنگهای کمتر از دو قیراط (۴۰ میلیگرم) مخلوط شود، و همچنین وقتی که از آن به عنوان ماده پایه برای سنگ کامپوزیت یا دوتایی استفاده میشود (به عنوان مثال، کوراندوم مصنوعی به عنوان تاج یا بالای سنگ) فریبندهترین است. در زیر میکروسکوپ، گوهرشناسان تیتانات استرانسیم را از الماس با نرمی شکلدهنده- که با ساییدگیهای سطحی آشکار میشود- و پراکشهای بیش از حد (به چشم فرد آموزش دیده) و حبابهای گاز موضعی که بقایای سنتز هستند، تشخیص میدهند. دوتاییها را میتوان با یک خط اتصال در کمربند ("کمر" سنگ) و حبابهای هوای مسطح شده یا چسب که در داخل سنگ در نقطه اتصال قابل مشاهده است، تشخیص داد.
کاربرد در ژنراتورهای ترموالکتریک رادیوایزوتوپ[ویرایش]
با توجه به نقطهٔ ذوب بالا و نامحلول بودن آن، تیتانات استرانسیم به عنوان یک مادهٔ حاوی استرانسیوم ۹۰ در ژنراتورهای ترموالکتریک رادیوایزوتوپ، مانند سری سنتینل ایالات متحده و بتا-M شوروی استفاده شدهاست.[۱۵][۱۶]
کاربرد در سلولهای سوختی اکسید جامد[ویرایش]
رسانایی مخلوط تیتانات استرانسیوم برای استفاده در سلولهای سوختی اکسید جامد (SOFC) مورد توجه قرار گرفتهاست. این ماده رسانایی الکترونیکی و یونیای از خود نشان میدهد که برای الکترودهای SOFC مفید است زیرا در هر دو طرف سلول تبادل گاز و یونهای اکسیژن در ماده و الکترونها وجود دارد.
- (آند)
- (کاتد)
تیتانات استرانسیوم با مواد مختلفی برای استفاده در طرفهای مختلف سلول سوختی دوپ میشود. در سمت سوخت (آند)، جایی که اولین واکنش رخ میدهد، اغلب با لانتانیم دوپ میشود تا تیتانات استرانسیوم دوپ شده با لانتانیم (LST) تشکیل شود. در این مورد، مکان A یا موقعیتی در سلول واحد که استرانسیم معمولاً در آن قرار میگیرد، گاهی اوقات توسط لانتانیم پر میشود. این امر باعث میشود که ماده خواص نیمههادی نوع n، از جمله رسانایی الکترونیکی از خود نشان دهد. همچنین به دلیل تحمل ساختار پروسکایت برای فضاهای خالی اکسیژن، هدایت یونی اکسیژن از خود نشان میدهد. این ماده دارای ضریب انبساط حرارتی مشابه با ضریب انبساط الکترولیت متداول زیرکونیای تثبیت شده با ایتریا (YSZ)، پایداری شیمیایی در طی واکنشهایی که در الکترودهای سلول سوختی رخ میدهد، و رسانایی الکترونیکی تا 360 S/cm تحت شرایط عملیاتی SOFC میباشد.[۱۷] یکی دیگر از مزایای کلیدی این LSTها این است که در برابر سمی شدن با گوگرد مقاوم است، که اتفاقی است که در مورد آندهای نیکل-سرامیک (سرمت) که در حال حاضر استفاده میشود، رخ میدهد.[۱۸]
یکی دیگر از ترکیبات مرتبط فریت استرانسیم تیتانیوم (STF) است که به عنوان ماده کاتدی (سمت اکسیژن) در SOFCها استفاده میشود. این ماده همچنین رسانایی مخلوط یونی و الکترونیکی از خود نشان میدهد که حائز اهمیت است، زیرا به این معنی است که واکنش کاهشیای که در کاتد اتفاق میافتد میتواند در یک محدوده وسیعتر رخ دهد.[۱۹] بر اساس این ماده با افزودن کبالت در مکان B (با جایگزین کردن تیتانیوم) و همچنین آهن، ماده STFC یا STF جایگزین شده با کبالت بهدست میآید که پایداری قابل توجهی به عنوان یک ماده کاتدی و همچنین مقاومت قطبش کمتری نسبت به سایر مواد کاتدی معمول مانند فریت کبالت لانتانیم استرانسیم نشان میدهد. این کاتدها همچنین این مزیت را دارند که حاوی فلزات خاکی کمیاب نیستند. این موضوع آنها را ارزانتر از بسیاری از گزینههای جایگزین میکند.[۲۰]
جستارهای وابسته[ویرایش]
منابع[ویرایش]
- https://journals.aps.org/prb/abstract/10.1103/PhysRevB.19.3593
- Mottana, Annibale (مارس ۱۹۸۶). "Una brillante sintesi". Scienza e Dossier (in Italian). Giunti. 1 (1): 9.
- Webmineral. Retrieved 2009-06-06
- Mindat. Retrieved 2009-06-06.
- https://www.semanticscholar.org/paper/Bulk-electronic-structure-of-SrTiO3%3A-Experiment-and-Benthem-Elsässer/5d7eb2705aa3c0111e21aebd59828041d905d4de
- ESPI Metals. ESPICorp
- Xiao Lin, Benoît Fauqué, Kamran Behnia (2015). "Scalable T2 resistivity in a small single-component Fermi surface". Science. 349 (6251): 945–8
- Koonce, C. S. ; Cohen, Marvin L. (1967). "Superconducting Transition Temperatures of Semiconducting SrTiO3". Phys. Rev. 163 (2): 380
- C. Rodenbücher; P. Meuffels; W. Speier; M. Ermrich; D. Wrana; F. Krok; K. Szot (2017). "Stability and Decomposition of Perovskite-Type Titanates upon High-Temperature Reduction". Phys. Status Solidi RRL. 11 (9): 1700222.
- L. Rimai & G. A. deMars (1962). "Electron Paramagnetic Resonance of Trivalent Gadolinium Ions in Strontium and Barium Titanates". Phys. Rev. 127 (3): 702.
- R. A. McKee; F. J. Walker & M. F. Chisholm (1998).
- Department of Physics and Astronomy, Washington State University, Pullman, Washington. Retrieved 2013-11-18.
- Nature World News. Retrieved 2013-11-18.
- Max Planck institute for solid state research. Retrieved 1۶ سپتامبر ۲۰۱۶
- https://archive.org/details/crystalgrowthtec00sche_031
- R. W. Hesse (2007). Jewelrymaking through history: an encyclopedia. Greenwood Publishing Group. p. 73.
- Nassau, K. (1980). Gems made by man. Santa Monica, California: Gemological Institute of America. pp. 214–221.
- https://en.wikipedia.org/wiki/International_Standard_Book_Number
- https://en.wikipedia.org/wiki/Special:BookSources/0-7506-4411-7
- Washington, DC: U.S. Congress, Office of Technology Assessment. June 1994. OTA-BP-ETI-129.
- https://dsa.no/dav/c600d1d288.pdf
- https://www.sciencedirect.com/science/article/abs/pii/S0167273802001406?via%3Dihub
- Gong, Mingyang; Liu, Xingbo; Trembly, Jason; Johnson, Christopher (2007). "Sulfur-tolerant anode materials for solid oxide fuel cell application". Journal of Power Sources. 168 (2): 289–298
- ung, WooChul; Tuller, Harry L. (2009). "Impedance study of SrTi1−xFexO3−δ (x=0.05 to 0.80) mixed ionic-electronic conducting model cathode". Solid State Ionics. ۱۸۰ (۱۱–۱۳): ۸۴۳–۸۴۷
- Zhang, Shan-Lin; Wang, Hongqian; Lu, Matthew Y. ; Zhang, Ai-Ping; Mogni, Liliana V. ; Liu, Qinyuan; Li, Cheng-Xin; Li, Chang-Jiu; Barnett, Scott A. (2018). "Cobalt-substituted SrTi 0.3 Fe 0.7 O 3−δ: a stable high-performance oxygen electrode material for intermediate-temperature solid oxide electrochemical cells". Energy & Environmental Science. 11 (7): 1870–1879.
- ↑ K. A. Muller; H. Burkard (1979). "SrTiO3: An intrinsic quantum paraelectric below 4 K". Phys. Rev. B. 19 (7): 3593–3602. Bibcode:1979PhRvB..19.3593M. doi:10.1103/PhysRevB.19.3593.
- ↑ Mottana, Annibale (March 1986). "Una brillante sintesi". Scienza e Dossier (به ایتالیایی). Giunti. 1 (1): 9.
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ "Tausonite". Webmineral. Retrieved 2009-06-06.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ "Tausonite". Mindat. Retrieved 2009-06-06.
- ↑ K. van Benthem, C. Elsässer and R. H. French (2001). "Bulk electronic structure of SrTiO3: Experiment and theory". Journal of Applied Physics. 90 (12): 6156. Bibcode:2001JAP....90.6156V. doi:10.1063/1.1415766.
- ↑ "Strontium Titanate". ESPI Metals. ESPICorp. Archived from the original on 2015-09-24.
- ↑ Xiao Lin, Benoît Fauqué, Kamran Behnia (2015). "Scalable T2 resistivity in a small single-component Fermi surface". Science. 349 (6251): 945–8. arXiv:1508.07812. Bibcode:2015Sci...349..945L. doi:10.1126/science.aaa8655. PMID 26315430.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Koonce, C. S.; Cohen, Marvin L. (1967). "Superconducting Transition Temperatures of Semiconducting SrTiO3". Phys. Rev. 163 (2): 380. Bibcode:1967PhRv..163..380K. doi:10.1103/PhysRev.163.380.
- ↑ C. Rodenbücher; P. Meuffels; W. Speier; M. Ermrich; D. Wrana; F. Krok; K. Szot (2017). "Stability and Decomposition of Perovskite-Type Titanates upon High-Temperature Reduction". Phys. Status Solidi RRL. 11 (9): 1700222. Bibcode:2017PSSRR..1100222R. doi:10.1002/pssr.201700222.
- ↑ L. Rimai; G. A. deMars (1962). "Electron Paramagnetic Resonance of Trivalent Gadolinium Ions in Strontium and Barium Titanates". Phys. Rev. 127 (3): 702. Bibcode:1962PhRv..127..702R. doi:10.1103/PhysRev.127.702.
- ↑ R. A. McKee; F. J. Walker; M. F. Chisholm (1998). "Crystalline Oxides on Silicon: The First Five Monolayers". Phys. Rev. Lett. 81 (14): 3014. Bibcode:1998PhRvL..81.3014M. doi:10.1103/PhysRevLett.81.3014.
- ↑ "Persistent Photoconductivity in Strontium Titanate". Department of Physics and Astronomy, Washington State University, Pullman, Washington. Retrieved 2013-11-18.
- ↑ "Light Exposure Increases Crystal's Electrical Conductivity 400-fold [VIDEO]". Nature World News. Retrieved 2013-11-18.
- ↑ "Mixed conductors". Max Planck institute for solid state research. Retrieved 16 September 2016.
- ↑ "Power Sources for Remote Arctic Applications" (PDF). Washington, DC: U.S. Congress, Office of Technology Assessment. June 1994. OTA-BP-ETI-129.
- ↑ Standring, WJF; Selnæs, ØG; Sneve, M; Finne, IE; Hosseini, A; Amundsen, I; Strand, P (2005), Assessment of environmental, health and safety consequences of decommissioning radioisotope thermal generators (RTGs) in Northwest Russia (PDF), Østerås: Norwegian Radiation Protection Authority, archived from the original (PDF) on 3 March 2016, retrieved 20 January 2022
- ↑ Marina, O (2002). "Thermal, electrical, and electrocatalytical properties of lanthanum-doped strontium titanate". Solid State Ionics. 149 (1–2): 21–28. doi:10.1016/S0167-2738(02)00140-6.
- ↑ Gong, Mingyang; Liu, Xingbo; Trembly, Jason; Johnson, Christopher (2007). "Sulfur-tolerant anode materials for solid oxide fuel cell application". Journal of Power Sources. 168 (2): 289–298. Bibcode:2007JPS...168..289G. doi:10.1016/j.jpowsour.2007.03.026.
- ↑ Jung, WooChul; Tuller, Harry L. (2009). "Impedance study of SrTi1−xFexO3−δ (x=0.05 to 0.80) mixed ionic-electronic conducting model cathode". Solid State Ionics. 180 (11–13): 843–847. doi:10.1016/j.ssi.2009.02.008.
- ↑ Zhang, Shan-Lin; Wang, Hongqian; Lu, Matthew Y.; Zhang, Ai-Ping; Mogni, Liliana V.; Liu, Qinyuan; Li, Cheng-Xin; Li, Chang-Jiu; Barnett, Scott A. (2018). "Cobalt-substituted SrTi 0.3 Fe 0.7 O 3−δ: a stable high-performance oxygen electrode material for intermediate-temperature solid oxide electrochemical cells". Energy & Environmental Science. 11 (7): 1870–1879. doi:10.1039/C8EE00449H.


