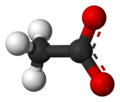
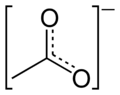
استات

اَسِتات(اتانوآت) (به انگلیسی: acetate) یکی از مادههایی است که میتوان آن را از اسید استیک بدست آورد. که خود میتواند دربرگیرندهٔ سه ماده باشد: نمکها، اِسترها و آنیونی که در یک محلول میتوان آن را پیدا کرد. سالانه ۵ میلیارد کیلوگرم اسید استیک تولید میشود که بیشتر آن صرف تولید استاتها میگردد. از استاتها نیز در تولید پلیمرها استفاده میشود. از استاتها در طبیعت در زیستشیمی هم استفاده شدهاست. برای نمونه اسیدهای چرب از ارتباط میان واحدهای C۲ گرفته شده از استات تولید میشود.[۱]
نامگذاری و فرمول شیمیایی[ویرایش]
فرمول آنیون استات به صورت CH۳CO۲− و C۲H۳O۲− و CH3COO− نوشته میشود. شیمی دانها نام استات را به OAc− و AcO− کوتاه کردهاند بنابراین HOAc نام کوتاه شدهای برای استیک اسید و NaOAc برای سدیم استات و EtOAc برای اتیل استات میباشد.[۲][۳]
سامانهٔ آیوپاک نام اتانوآت (ethanoate) را برای استات انتخاب کرده و استات تنها نامی است که در میان افراد جا افتادهاست.
نمکها[ویرایش]
آنیون استات [CH۳COO]− خود از خانوادهٔ کربوکسیلات است و پایهٔ اسیدی اسید استیک. در pH بالای ۵٫۵ اسید استیک به استات تبدیل میگردد:[۲]
- CH۳COOH ⇌ CH۳COO− + H+
بسیاری از نمکهای استات به صورت یونی اند و تمایل زیادی به حل شدن در آب دارند. یکی از استاتهایی که در خانه نیز میتوان آن را فراهم کرد سدیم استات است. مادهٔ جامد سفیدی که از واکنش سرکه با سدیم بیکربنات یا جوش شیرین فراهم میگردد:
- CH۳COOH + NaHCO۳ → CH۳COO−Na+ + H۲O + CO۲
استات دیگر فلزها نیز وجود دارد که برخی ساختاری پیچیده تر دارند. استات در ترکیبهای کمپلکس به عنوان لیگاندی قوی رفتار میکند. برای نمونه استات کروم (II) یکی از کمپلکسهای استات است.
کاربرد[ویرایش]
از نمک استاتهای مهم و پرکاربرد میتوان استات آلومینیم را نام برد که در رنگرزی کاربرد دارد؛ آمونیوم استات که مادهٔ سازندهٔ استامید است و پتاسیم استات که در ساخت داروهای ادرار آور مورد استفاده قرار میگیرد. هر سهٔ این نمکها بی رنگ اند و در آب به آسانی حل میشوند.[۴]
اِسترها[ویرایش]
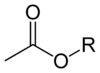
استرهای استات دارای فرمول کلی CH۳CO۲R میباشند که R یک گروه ارگانیل organyl group است. برخلاف نمکهای استات، استرهای استات بیشتر مایع، چربی دوست و گاهی بخارشدنی اند و چون بی آسیب اند، خیلی معمول اند، بوی شیرین دارند، ارزان اند و معمولاً مسمومیت بسیار پایینی دارند.
کاربرد[ویرایش]
میتوان گفت بیش از نیمی از استات اسیدها صرف تولید وینیل استات، مادهٔ سازندهٔ پلی وینیل الکل میگردد. این الکل مادهٔ سازندهٔ بسیاری از رنگها است.
ساختارها[ویرایش]
-
مدل فضا پُرکن استات آنیون -
مدل گلوله و میلهٔ استات آنیون -
هیبرید رزونانس استات آنیون -
canonical forms آنیون استات
منابع[ویرایش]
- ↑ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.
- ↑ ۲٫۰ ۲٫۱ Zumdahl, S. S. “Chemistry” Heath, 198۶: Lexington, MA. ISBN 0-669-04529-2.
- ↑ Prior to the discovery and naming of اکتینیم, the abbreviation "Ac" (or "AC") was sometimes used in chemical formulas to indicate the acetate ion. For example, the formula for سدیم استات might be given as "NaAc", rather than the more modern «NaCH3COO» or «NaC2H3O2».
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence «Acetic acid» in Ullmann's Encyclopedia of Industrial Chemistry Weinheim, Germany: Wiley-VCH, 200۵. doi:۱0.1002/۱4356۰07.a01 04۵