آزولن
| آزولن | |||
|---|---|---|---|
| |||
Azulene | |||
Bicyclo[5.3.0]decapentaene | |||
| شناساگرها | |||
| شماره ثبت سیایاس | 275-51-4 | ||
| پابکم | 9231 | ||
| کماسپایدر | 8876 | ||
| UNII | 82R6M9MGLP | ||
| KEGG | C13392 | ||
| ChEBI | CHEBI:31249 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C10H8 | ||
| جرم مولی | ۱۲۸٫۱۷ g mol−1 | ||
| دمای ذوب | ۹۹ تا ۱۰۰ درجه سلسیوس (۲۱۰ تا ۲۱۲ درجه فارنهایت؛ ۳۷۲ تا ۳۷۳ کلوین) | ||
| دمای جوش | ۲۴۲ درجه سلسیوس (۴۶۸ درجه فارنهایت؛ ۵۱۵ کلوین) | ||
| پذیرفتاری مغناطیسی | -98.5·10-6 cm3/mol
g/l[۱] | ||
| ترموشیمی | |||
| Std enthalpy of combustion ΔcH |
-1266.5 kcal/mol[۲] | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
آزولن(به انگلیسی: Azulene) یک ترکیب آلی و ایزومری از نفتالین است. نفتالین ماده ای بیرنگ است، در حالی که آزولن به رنگ آبی تیره میباشد. دو ترپنوئید، وتیوازولن (۸٬۴-دیمتیل-۲-ایزوپروپیلآزولن) و گائیازولن (۴٬۱-دیمتیل-۷-ایزوپروپیلآزولن) که دارای اسکلت آزولنی هستند در طبیعت به عنوان رنگدانه در قارچ، روغن چوب گایاک و برخی از بی مهرگان دریایی یافت میشوند.
سنتز آلی[ویرایش]
مسیرهای سنتزی تولید آزولن به دلیل ساختار غیرمعمول این ماده، از مدتها پیش مورد توجه بودهاست.[۳] در سال ۱۹۳۹ اولین روش توسط St. Pfau و Plattner[۴] ابداع شده که در آن مسیر سنتز از ایندان و اتیل دی آزواستات شروع میشد.
یکی از روشهای کارآمد در سنتز یکجا از مسیر حلقهجوشی (آنولاسیون) سیکلوپنتادین با سینتونهای C5 حاصل میشود.[۵] روش جایگزین سیکلوهپتاتریان مدت زیادی است که شناخته شدهاست، در شکل زیر یکی از روشهای سنتز آزولن نشان داده شدهاست.[۶][۷]
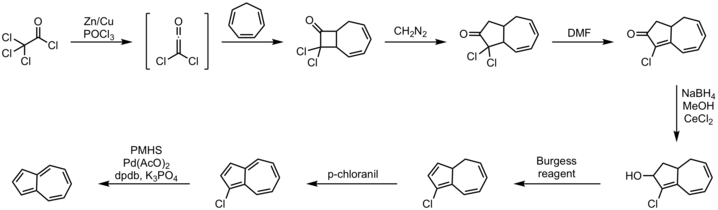
روش:
- حلقهزایی ۲+۲ سیکلوهپتاتریان با دی کلروکتن
- واکنش جایگیری دیآزومتان
- واکنش هیدروهالوژنزدایی با DMF
- کاهش لوچه به الکل با استفاده از سدیم بوروهیدرید
- واکنش حذفی با واکنشگر بورگس
- اکسایش با p-کلرانیل
- هالوژنزدایی با پلیمتیلهیدروسیلوکسان، پالادیم(II) استات، پتاسیم فسفات و لیگاند DPDB
منابع[ویرایش]
- ↑ Sweet, L. I.; Meier, P. G. (1997). "Lethal and Sublethal Effects of Azulene and Longifolene to Microtox®, Ceriodaphnia dubia, Daphnia magna, and Pimephales promelas" (PDF). Bulletin of Environmental Contamination and Toxicology. 58 (2): 268–274. doi:10.1007/s001289900330. hdl:2027.42/42354. PMID 8975804.
- ↑ Salter, Carl; Foresman, James B. (1998). "Naphthalene and Azulene I: Semimicro Bomb Calorimetry and Quantum Mechanical Calculations". Journal of Chemical Education. 75 (10): 1341. Bibcode:1998JChEd..75.1341S. doi:10.1021/ed075p1341.
- ↑ Gordon, Maxwell (1 February 1952). "The Azulenes". Chemical Reviews. 50 (1): 127–200. doi:10.1021/cr60155a004.
- ↑ St. Pfau, Alexander; Plattner, Pl. A. (1939). "Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens". Helvetica Chimica Acta. 22: 202–208. doi:10.1002/hlca.19390220126.
- ↑ Hafner, Klaus; Meinhardt, Klaus-Peter (1984). "Azulene". Organic Syntheses. 62: 134. doi:10.15227/orgsyn.062.0134.
- ↑ Carret, Sébastien; Blanc, Aurélien; Coquerel, Yoann; Berthod, Mikaël; Greene, Andrew E.; Deprés, Jean-Pierre (2005). "Approach to the Blues: A Highly Flexible Route to the Azulenes". Angewandte Chemie International Edition. 44 (32): 5130–5133. doi:10.1002/anie.200501276. PMID 16013070.
- ↑ Lemal, David M.; Goldman, Glenn D. (1988). "Synthesis of azulene, a blue hydrocarbon". Journal of Chemical Education. 65 (10): 923. Bibcode:1988JChEd..65..923L. doi:10.1021/ed065p923.
پیوند به بیرون[ویرایش]
- وب سایت بایگانیشده در ۲۰۰۷-۱۰-۱۸ توسط Wayback Machine MSDS
- وب سایت MSDS