برقکافت
برای تأییدپذیری کامل این مقاله به منابع بیشتری نیاز است. |

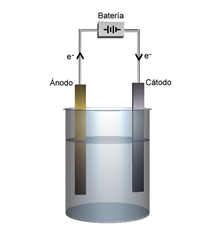
برقکافت یا اِلِکترولیز (به فرانسوی: électrolyse) در شیمی و صنعت، شیوهای برای جداسازی عنصرها و ترکیبهایی است که با پیوند شیمیایی به هم متصل هستند. این جداسازی با گذراندن جریان الکتریکی مستقیم (DC) از میان این مواد صورت میگیرد. برای مثال زمانی که جریان الکتریکی از آب میگذرد اتمهای هیدروژن و اکسیژن از هم جدا شده و به گاز تبدیل میشوند. این واکنش شیمیایی فرایندی غیر خودبخودی (بدون رغبت و تمایل non-spontaneous) است که در غیر این صورت به وقوع نمیپیوندد.
روش برقکافت را دانشمند فیزیکدان و شیمیدان انگلیسی مایکل فارادی مطرح کرد. او مشاهده کرد که هنگام عبور جریان برق از درون محلول یک ترکیب شیمیایی فلز دار یک واکنش شیمیایی در آن به وقوع میپیوندد. اجرای این آزمایش بعدها به کشف الکترونها توسط جوزف جان تامسون در ۱۸۹۷ و دیگران انجامید و بار هر الکترون 1.602X10−19 کولن تخمین زده شد. در آن زمان رابطهٔ میان اتم و الکترون کشف نشده بود.
از دیدگاه صنعتی و تجاری تکنیک الکترولیز یک مرحلهٔ مهم در جداسازی عنصرها از منابع و صورت طبیعی آنها مانند سنگ معدن یا کانسنگ است. ولتاژی که برای رخدادن الکترولیز مورد نیاز است پتانسیل تجزیه نامیده میشود.
اگر یونها قابلیت حرکت نداشتهباشند؛ مانند در بیشتر نمکها، آنگاه الکترولیز نمیتواند رخ دهد و به حلالپوشی نیاز است.
تاریخچه
[ویرایش]در اوایل قرن نوزدهم، ویلیام نیکلسون و آنتونی کارلایل تلاش کردند تا آزمایشات ولتا را بیشتر کنند. آنها دو سیم را به دو طرف یک شمع ولتایی وصل کردند و انتهای دیگر را در یک لوله پر از آب قرار دادند. وقتی سیم ها به هم نزدیک شدند متوجه شدند که هر سیم حباب تولید می کند. یک نوع آن هیدروژن و دیگری اکسیژن بود.
در سال 1785 یک دانشمند هلندی به نام مارتین ون ماروم یک ژنراتور الکترواستاتیکی ایجاد کرد که از آن برای کاهش قلع، روی و آنتیموان از نمک های آنها با استفاده از فرآیندی که بعداً به نام الکترولیز شناخته شد، استفاده کرد. اگرچه او ندانسته الکترولیز تولید کرد، اما تا سال 1800 ویلیام نیکلسون و آنتونی کارلایل کشف کردند که الکترولیز چگونه کار می کند.
در سال 1791 لوئیجی گالوانی با پاهای قورباغه آزمایش کرد. او ادعا کرد که قرار دادن ماهیچه حیوان ها بین دو ورقه فلزی غیرمشابه منجر به برق می شود. در پاسخ به این ادعاها، الساندرو ولتا آزمایش ها خود را انجام داد. این بینش به ایده های همفری دیوی در مورد الکترولیز می دهد . هامفری دیوی در طول آزمایش های اولیه این فرضیه را مطرح کرد که وقتی دو عنصر با هم ترکیب می شوند و ترکیبی را تشکیل می دهند، انرژی الکتریکی آزاد می شود. هامفری دیوی به ایجاد جداول تجزیه از آزمایشات اولیه خود در مورد الکترولیز ادامه داد. جداول تجزیه بینشی در مورد انرژی های مورد نیاز برای تجزیه ترکیبات خاص ارائه می دهد.
در سال 1817 یوهان آگوست آرفودسون مشخص کرد که عنصر دیگری به نام لیتیوم در برخی از نمونه هایش وجود دارد. با این حال، او نتوانست جزء را جدا کند. تا سال 1821 بود که ویلیام توماس برند از الکترولیز برای جدا کردن آن استفاده کرد. دو سال بعد، او فرآیند را با استفاده از کلرید لیتیوم و کلرید پتاسیم با الکترولیز برای تولید لیتیوم و هیدروکسید لیتیوم ساده کرد.
در 26 ژوئن 1886، فردیناند فردریک هنری مویسان سرانجام در انجام الکترولیز بر روی هیدروژن فلوراید بی آب برای ایجاد عنصر خالص فلوئور گازی احساس راحتی کرد. هانری مویسان قبل از استفاده از هیدروژن فلوراید، از نمک های فلوراید با الکترولیز استفاده می کرد. بنابراین در 28 ژوئن 1886 آزمایش خود را در مقابل آکادمی علوم انجام داد تا کشف عنصر جدید فلوئور را نشان دهد. در حالی که تلاش می کردند فلوئور عنصری را از طریق الکترولیز نمک های فلوراید پیدا کنند، بسیاری از شیمیدان ها از جمله پائولین لویه و ژروم نیکلز از بین رفتند.
نخستین فعالیتهای مربوط به حوزه الکتروشیمی را سر هامفری دیوی اجرا نمود. او با گذراندن جریان الکتریکی از میان محلولهای آبکی، توانست واکنشهای شیمیایی انجام دهد و شش عنصر جدید را از این طریق کشف کرد. بعدها شاگرد وی، به نام مایکل فارادی به فعالیتهای کمّی در این حوزه پرداخت و توانست بین مقدار بار الکتریکی و مقدار ماده ارتباط پیدا کند (بخش بعدی را ملاحظه فرمایید).
- ۱۸۰۰ - ویلیام نیکلسون و آنتونی کارلیسله (و همچنین یوهان ریتر)، آب را به هیدروژن و اکسیژن تجزیه کردند.
- ۱۸۰۷ - سر هامفری دیوی پتاسیم پرمنگنات را کشف کرد.
قانون فارادی
[ویرایش]فارادی بین شدت جریان الکتریکی و زمان واکنش برقکافت و همینطور مقدار ماده ای که توسط برقکافت تجزیه یا تولید میشود؛ ارتباط خطی مشاهده کرد. به این معنی که اگر زمان واکنش را ثابت نگه میداشت ولی شدت جریان را دو برابر میکرد؛ مقدار مادهای که در اثر برقکافت تجزیه میشد نیز دو برابر میگشت. از طرفی اگر با شدت جریان ثابت، زمان واکنش برقکافت را دو یا سه برابر میکرد؛ مقدار مادهای که وارد واکنش میشد نیز، دو یا سه برابر میگردید. بدین ترتیب فارادی متوجه شد بین مقدار ماده و مقدار بار الکتریکی یک ارتباط به شکل مستقیم و خطی وجود دارد. همین نتیجهگیری، توجه فیزیکدانان را به ساختار ماده معطوف کرد و مقدمهای برای کشف الکترون شد.
نمای کلی
[ویرایش]الکترولیز عبور جریان الکتریکی مستقیم از یک الکترولیت است که باعث ایجاد واکنش های شیمیایی در الکترودها و تجزیه مواد می شود.
اجزای اصلی مورد نیاز برای دستیابی به الکترولیز یک الکترولیت ، الکترودها و یک منبع انرژی خارجی هستند. یک پارتیشن (مثلاً یک غشای تبادل یونی یا یک پل نمک ) اختیاری است تا از انتشار محصول ها در مجاورت الکترود مقابل جلوگیری کند. الکترولیت یک ماده شیمیایی است که حاوی یون های آزاد است و جریان الکتریکی را حمل می کند (به عنوان مثال یک پلیمر رسانای یون ، محلول یا یک ترکیب مایع یونی ) اگر یون ها مانند اکثر نمک های جامد متحرک نباشند ، الکترولیز نمی تواند اتفاق بیفتد. الکترولیت مایع توسط:
- حل شدن یا واکنش یک ترکیب یونی با یک حلال (مانند آب) برای تولید یون های متحرک
- یک ترکیب یونی که با حرارت دادن ذوب می شود.
الکترودها با فاصله ای از هم جدا می شوند که جریانی بین آنها از طریق الکترولیت عبور می کند و به منبع برق متصل می شوند که مدار الکتریکی را کامل می کند . جریان مستقیمی که توسط منبع تغذیه تامین میشود، واکنش را هدایت میکند که باعث میشود یونهای موجود در الکترولیت به سمت الکترود دارای بار مخالف مربوطه جذب شوند.
الکترودهای فلزی ، گرافیت و مواد نیمه هادی به طور گسترده مورد استفاده قرار می گیرند. انتخاب الکترود مناسب به واکنش شیمیایی بین الکترود و الکترولیت و هزینه ساخت بستگی دارد. از لحاظ تاریخی، زمانی که آندهای غیر واکنشی برای الکترولیز مورد نظر بودند، گرافیت (که در زمان فارادی پلمباگو نامیده می شد) یا پلاتین انتخاب می شدند. مشخص شد که آنها برخی از کم واکنش ترین مواد برای آندها هستند. پلاتین در مقایسه با مواد دیگر بسیار آهسته فرسایش می یابد و گرافیت خرد می شود و می تواند دی اکسید کربن را در محلول های آبی تولید کند اما در غیر این صورت در واکنش شرکت نمی کند. کاتدها ممکن است از یک ماده ساخته شوند، یا ممکن است از مواد واکنش پذیرتر ساخته شوند زیرا سایش آند به دلیل اکسیداسیون در آند بیشتر است.
فرآیند الکترولیز
[ویرایش]فرآیند کلیدی الکترولیز، مبادله اتم ها و یون ها با حذف یا افزودن الکترون ها به دلیل جریان اعمال شده است. محصولات مورد نظر الکترولیز اغلب در یک حالت فیزیکی متفاوت از الکترولیت هستند و می توانند با فرآیندهای مکانیکی حذف شوند (مثلاً با جمع آوری گاز از بالای الکترود یا رسوب یک محصول از الکترولیت).
مقدار محصولات متناسب با جریان است و هنگامی که دو یا چند سلول الکترولیتی به صورت سری به یک منبع تغذیه متصل می شوند، محصولات تولید شده در سلول ها با وزن معادل آنها متناسب است . اینها به عنوان قوانین الکترولیز فارادی شناخته می شوند .
هر الکترود یون هایی را جذب می کند که بار مخالف دارند . یون های دارای بار مثبت ( کاتیون ها ) به سمت کاتد (منفی) ارائه دهنده الکترون حرکت می کنند. یون های دارای بار منفی ( آنیون ها ) به سمت آند استخراج کننده الکترون (مثبت) حرکت می کنند. در این فرآیند الکترون ها به طور موثر در کاتد به عنوان یک واکنش دهنده وارد شده و در آند به عنوان یک محصول حذف می شوند . در شیمی، از دست دادن الکترون ها را اکسیداسیون ، در حالی که به دست آوردن الکترون ها کاهش می گویند .
وقتی اتمها یا مولکولهای خنثی، مانند آنهایی که روی سطح الکترود هستند، الکترون به دست میآورند یا از دست میدهند، تبدیل به یون میشوند و ممکن است در الکترولیت حل شوند و با یونهای دیگر واکنش دهند.
الکترولیز دی اکسید کربن
[ویرایش]کاهش الکتروشیمیایی یا تبدیل الکتروکاتالیستی ارزش افزوده مانند متان ، اتیلن ، اتانول غیره تولید کند مانند اتیلن . این فناوری به عنوان مسیری بدون کربن برای رسیدن به ترکیبات آلی در دست تحقیق است.
اکسایش و کاهش
[ویرایش]امروز میدانیم که طی فرایند برقکافت، مبادلهٔ الکترون رخ میدهد. یعنی در سطح الکترود منفی (کاتد) گونههای شیمیایی الکترون به دست میآورند و بر سطح الکترود مثبت (آند) گونههای شیمیایی الکترون از دست میدهند و این جریان الکترون از بیرون محلول و از طریق مدار الکتریکی بین دو الکترود برقرار میگردد. به فرایند صورت گرفته در کاتد «کاهش» یا «احیا» و به فرایند رخداده در آند افزایش یا «اکسایش» گفته میشود.
منابع
[ویرایش]Principles of General Chemistry; M. S. Silberberg; 2nd Edition; Chapters 2 & 21
