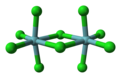
هندسه مولکولی هشتوجهی
در شیمی، هندسه مولکولی هشتوجهی، که به آن مربع دوهرمی نیز میگویند، شکل ترکیباتی را با شش اتم یا گروههایی از اتمها یا لیگاندهایی که بهطور متقارن در اطراف یک اتم مرکزی چیده شدهاند، توصیف میکند و راس یک هشتوجهی را مشخص میکند. هشتوجهی هشت وجه دارد. هشتوجهی یکی از جامدات افلاطونی است. اگرچه مولکولهای هشت وجهی معمولاً یک اتم در مرکز خود دارند و هیچ پیوندی بین اتمهای لیگاند وجود ندارد. نمونههایی از ترکیبات هشتوجهی عبارتند از هگزا فلوراید گوگرد SF6 و هگزا کربونیل مولیبدن Mo(CO)6. اصطلاح «هشتوجهی» تا حدودی توسط شیمیدانان استفاده میشود و بر هندسه پیوندها به اتم مرکزی تمرکز میکند و تفاوت بین خود لیگاندها را در نظر نمیگیرد؛ مثلاً، [Co(NH
3)
6]3+، که به دلیل جهتگیری پیوندهای N-H از نظر ریاضی هشتوجهی نیست، به عنوان هشتوجهی شناخته میشود.
مفهوم هندسه هماهنگی هشتوجهی توسط آلفرد ورنر برای توضیح استوکیومتری و ایزومریسم در ترکیبات هماهنگی ایجاد شد. بینش او به شیمیدانان اجازه داد تا تعداد ایزومرهای ترکیبات هماهنگ را منطقی کنند. کمپلکسهای هشتوجهی فلزات انتقالی حاوی آمینها و آنیونهای ساده اغلب به عنوان کمپلکسهای نوع ورنر خوانده میشوند.

ایزومریسم در مجتمعهای هشتوجهی
[ویرایش]هنگامی که دو یا چند نوع لیگاند (La، Lb ، ...) با یک مرکز فلزی هشتوجهی (M) هماهنگ میشوند، این کمپلکس میتواند به عنوان ایزومر وجود داشته باشد. سیستم نامگذاری این ایزومرها به تعداد و آرایش لیگاندهای مختلف بستگی دارد.
سیس و ترانس
[ویرایش]
برای b
2MLa
4L، دو ایزومر وجود دارد. این ایزومرهای b
2MLa
4L، سیس هستند، به شرط آنکه لیگاندهای Lb بهطور متقابل مجاور و ترانس باشند و گروههای Lb نسبت به یکدیگر با ۱۸۰ درجه قرار گرفته باشند. تجزیه و تحلیل چنین مجموعههایی بود که آلفرد ورنر را به فرضیه برنده جایزه نوبل ۱۹۱۳ در مورد مجموعههای هشتوجهی سوق داد.
-
cis-[CoCl2(NH3)4]+
-
trans-[CoCl2(NH3)4]+
ایزومرهای صورت و نصف النهار
[ویرایش]
برای b
3MLa
3L، دو ایزومر وجود دارد. یک ایزومر صورت (fac) که در آن هر مجموعه از سه لیگاند یکسان یک وجه از هشتوجهی اطراف اتم فلز را اشغال میکند. به طوری که هر دو از این سه لیگاند متقابلاً cis و یک ایزومر نصف النهاری (mer) هستند که در آن هر مجموعه از سه لیگاند یکسان صفحه ای را اشغال میکند که از اتم فلز میگذرد.
-
fac-[CoCl3(NH3)3]
-
mer-[CoCl3(NH3)3]
کایرالیته
[ویرایش]کمپلکسهای پیچیدهتر، با چندین نوع لیگاند مختلف یا با لیگاندهای دوتایی نیز میتوانند با جفتهایی از ایزومرها که تصاویر آینهای غیرقابل نصب یا انانتیومرهای یکدیگر هستند، کایرال باشند.
-
Λ-[Fe(ox)3]3−
-
Δ-[Fe(ox)3]3−
-
Δ-cis-[CoCl2(en)2]+
دیگر
[ویرایش]برای MLa
2LbLc، در مجموع شش ایزومر امکانپذیر است.
- یک ایزومر که در آن هر سه جفت لیگاندهای یکسان ترانس هستند.
- سه ایزومر متمایز که در آنها یک جفت لیگاند یکسان (La یا Lb یا Lc) ترانس است در حالی که دو جفت دیگر سیس هستند.
- دو ایزومر کایرال انانتیومر که در آنها هر سه جفت لیگاندهای یکسان سیس هستند.
تعداد ایزومرهای ممکن میتواند برای یک کمپلکس هشتوجهی با شش لیگاند مختلف به ۳۰ برسد (در مقابل، تنها دو استریو ایزومر برای یک کمپلکس چهار وجهی با چهار لیگاند مختلف امکانپذیر است). جدول زیر تمام ترکیبات ممکن برای لیگاندهای تک دندانی را فهرست میکند:
| فرمول | تعداد ایزومرها | تعداد جفت انانتیومر |
|---|---|---|
| ML6 | ۱ | ۰ |
| MLa 5Lb |
۱ | ۰ |
| b 2MLa 4L |
۲ | ۰ |
| MLa 4LbLc |
۲ | ۰ |
| b 3MLa 3L |
۲ | ۰ |
| MLa 3Lb 2Lc |
۳ | ۰ |
| MLa 3LbLcLd |
۵ | ۱ |
| c 2MLa 2Lb 2L |
۶ | ۱ |
| MLa 2Lb 2LcLd |
۸ | ۲ |
| MLa 2LbLcLdLe |
۱۵ | ۶ |
| MLaLbLcLdLeLf | ۳۰ | ۱۵ |
بنابراین، تمام ۱۵ دیاسترئومر MLaLbLcLdLeLf کایرال هستند، در حالی که برای MLa
2LbLcLdLe، شش دیاستریومر کایرال هستند و سه دیاسترئومر کایرال نیستند (آنهایی که La اند، ترانس هستند). میتوان دید که هماهنگی هشتوجهی پیچیدگی بسیار بیشتری را نسبت به چهار وجهی که بر شیمی آلی مسلط است، میدهد. چهاروجهی MLaLbLcLd به صورت یک جفت انانتیومر منفرد وجود دارد. برای تولید دو دیاسترئومر در یک ترکیب آلی، حداقل دو مرکز کربن مورد نیاز است.
انحراف از تقارن ایدهآل
[ویرایش]اثر جان تلر
[ویرایش]این اصطلاح همچنین میتواند به هشتوجهی متأثر از اثر جان تلر اشاره داشته باشد که پدیده ای رایج در شیمی هماهنگی است. این تقارن مولکول را از Oh به D4h کاهش میدهد و به عنوان اعوجاج چهارضلعی شناخته میشود.
هندسه هشتوجهی تحریف شده
[ویرایش]برخی از مولکولها، مانند XeF 6 یا IF−
6، یک جفت تنها دارند که تقارن مولکول را از Oh به C3v برهم میزند. هندسه خاص این موارد، به عنوان یک هشتضلعی تک ضلعی شناخته میشود، زیرا با قرار دادن جفت تنها بر روی مرکز یک وجه مثلثی هشتوجهی به عنوان یک «کلاه» (و تغییر موقعیت شش اتم دیگر برای قرار دادن آن از هشت وجهی مشتق شده است). هر دو این موارد نشان دهنده انحراف از هندسه پیشبینی شده توسط VSEPR است که برای AX6E1 یک شکل هرمی پنج ضلعی را پیشبینی میکند.
ساختارهای بیوکتهدرال
[ویرایش]جفتهای هشتوجهی را میتوان به گونهای با هم ترکیب کرد که هندسه هماهنگی هشتوجهی را با جایگزینی لیگاندهای انتهایی با لیگاندهای پل زدن حفظ کند. دو دستهبندی برای ادغام هشتوجهی رایج است: اشتراک لبه و اشتراک چهره. بیوکتاهدرهای لبه و صورت مشترک به ترتیب فرمول [M2L8(μ-L)] 2 و M2L6(μ-L) 3 را دارند. نسخههای پلیمری الگوی پیوندی یکسان به ترتیب استوکیومتریهای [ML2(μ-L)2]∞ و [M(μ-L)3]∞ را میدهند.
اشتراک لبه یا وجه یک هشتوجهی ساختاری به نام بیوکتاهدرال میدهد. بسیاری از ترکیبات پنتا هالید و پنتا آلکوکسید فلزی در محلول و جامد با ساختارهای بیوکتادرال وجود دارند. یک مثال پنتاکلراید نیوبیم است. تتراهالیدهای فلزی اغلب به صورت پلیمرهایی با هشتوجهی مشترک لبه وجود دارند. تتراکلرید زیرکونیوم یک مثال است. ترکیبات با زنجیرههای هشتوجهی اشتراکی شامل MoBr3 ،RuBr3 و TlBr3 هستند.
-
مدل توپ و چوب پنتاکلرید نیوبیم ، یک ترکیب هماهنگکننده بیوکتادرال.
-
مدل توپ و چوب تتراکلرید زیرکونیوم ، یک پلیمر معدنی مبتنی بر هشتوجهی مشترک لبه.
-
مدل توپ و چوب برمید مولیبدن (III) ، یک پلیمر معدنی مبتنی بر هشتوجهی اشتراکگذاری صورت.
-
تقریباً زنجیره یدید تیتانیوم (III) را مشاهده کنید که کسوف لیگاندهای هالید را در چنین هشتوجهی مشترک چهره برجسته میکند.
هندسه منشوری مثلثی
[ویرایش]برای ترکیبات با فرمول MX6، جایگزین اصلی برای هندسه هشتوجهی، هندسه منشوری مثلثی است که دارای تقارن D3h است. در این هندسه، شش لیگاند نیز معادل هم هستند. همچنین منشورهای مثلثی تحریف شده، با تقارن C3v وجود دارند. پیشنهاد میشود که تبدیل کمپلکسهای Δ- و Λ-، که معمولاً کند است، از طریق یک واسطه منشوری مثلثی، فرآیندی به نام " پیچش Bailar " انجام شود. یک مسیر جایگزین برای راسمی شدن همین کمپلکسها، پیچش ری-دات است.
تقسیم انرژیهای d-orbital
[ویرایش]
برای یک یون آزاد، به عنوان مثال گازی Ni 2+ یا Mo0، انرژی اوربیتالهای d برابر است؛ یعنی «منحط» هستند. در یک مجموعه هشتوجهی، این انحطاط برداشته میشود. انرژی dz2 و dx2−y2، به اصطلاح مجموعه eg، که مستقیماً به سمت لیگاندها هدف قرار میگیرند، بیثبات میشود. از سوی دیگر، انرژی اوربیتالهای dxz، dxy و dyz، که به اصطلاح مجموعه t2g نامیده میشوند، تثبیت میشود. برچسبهای t2g و eg به نمایشهای تقلیلناپذیر اشاره دارند که ویژگیهای تقارن این اوربیتالها را توصیف میکند. شکاف انرژی که این دو مجموعه را از هم جدا میکند، اساس نظریه میدان کریستالی و نظریه میدان لیگاند است. از بین رفتن انحطاط با تشکیل یک کمپلکس هشتوجهی از یک یون آزاد ، شکافتن میدان کریستالی یا تقسیم میدان لیگاندی نامیده میشود. شکاف انرژی دارای Δo است که با توجه به تعداد و ماهیت لیگاندها متفاوت است. اگر تقارن کمپلکس کمتر از هشتوجهی باشد، سطوح eg و t2g میتوانند بیشتر تقسیم شوند. برای مثال، مجموعههای t2g و eg در b
2trans-MLa
4L بیشتر تقسیم میشوند.
قدرت لیگاند برای این اهداکنندگان الکترون دارای ترتیب زیر است:
به اصطلاح «لیگاندهای میدان ضعیف»، Δo کوچکتری ایجاد میکنند و نور را در طول موجهای بلندتر جذب میکنند.
واکنشها
[ویرایش]با توجه به اینکه مجموعههای هشتوجهی تقریباً بهطور غیرقابل شمارش وجود دارند، تعجب آور نیست که طیف گستردهای از واکنشها توصیف شدهاند. این واکنشها را میتوان به صورت زیر طبقهبندی کرد:
- واکنشهای جایگزینی لیگاند (از طریق مکانیسمهای مختلف)
- واکنشهای افزودن لیگاند، از جمله در میان بسیاری، پروتوناسیون
- واکنشهای ردوکس (جایی که الکترونها به دست میآیند یا از دست میروند)
- بازآراییهایی که در آن استریوشیمی نسبی لیگاند در حوزه هماهنگی تغییر میکند.
بسیاری از واکنشهای کمپلکسهای فلزات واسطه هشتوجهی در آب رخ میدهد. هنگامی که یک لیگاند آنیونی جایگزین یک مولکول آب هماهنگ میشود، واکنش آناسیون نامیده میشود. واکنش معکوس، آب جایگزین لیگاند آنیونی، aquation نامیده میشود. به عنوان مثال[CoCl(NH
3)
5]2+ به آرامی [Co(NH
3)
5(H
2O)]3+ در آب آزاد میکند، به ویژه در حضور اسید یا باز. افزودن HCl غلیظ، کمپلکس آبی را از طریق فرایند آناسیون به کلرید تبدیل میکند.

![cis-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/120px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/120px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)
![Λ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Δ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)