اوسیمرتینیب
 | |
| دادههای بالینی | |
|---|---|
| نامهای تجاری | تاگریسو، تاگریکس |
| نامهای دیگر | AZD9291 |
| AHFS/Drugs.com | entry |
| دادهها | |
| روش مصرف دارو | دهانی قرص |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| دادههای فارماکوکینتیک | |
| پیوند پروتئینی | احتمالاً زیاد[۱] |
| متابولیسم | اکسیداسیون (CYP3A) |
| نیمهعمر حذف | ۴۸ ساعت |
| دفع | مدفوع (۶۸٪)، ادرار (۱۴٪) |
| شناسهها | |
| |
| شمارهٔ سیایاس | |
| پابکم CID | |
| دراگبنک | |
| کماسپایدر | |
| UNII | |
| KEGG | |
| ChEBI | |
| لیگاند بانک داده پروتئین | |
| دادههای فیزیکی و شیمیایی | |
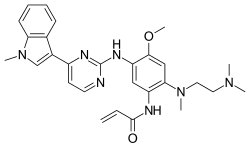
| فرمول شیمیایی | C28H33N7O2 |
| جرم مولی | ۴۹۹٫۶۱۹ g·mol−1 |
| مدل سه بعدی (جیمول) | |
| |
| |
اوسیمرتینیب (انگلیسی: Osimertinib) با نام تجاری تاگریسو (Tagrisso)[۲][۳] دارویی است که برای درمان «سرطان ریه از نوع سلول غیر کوچک» با جهشهای خاص ژنتیکی استفاده میشود.[۴][۵] این دارو، یک بازدارنده تیروزین-کیناز نسل سوم گیرنده فاکتور رشد اپیدرمی است که توسط شرکت آسترازنکا ساخته شد و در سال ۲۰۱۷ توسط سازمان غذا و داروی آمریکا و کمیسیون اروپا تأیید شد.
موارد مصرف[ویرایش]
اوسیمرتینیب برای درمان «سرطان ریه از نوع سلول غیر کوچک» (NSCLC) با متاستاز موضعی یا دوردست به کار میرود مشروط بر آنکه جهش ژنتیکی T790M در کُدگذاری برای گیرنده فاکتور رشد اپیدرمی یا فعالسازی آن موجود باشد.[۱] این جهش یا ژنتیکی است، یا آنکه اکتسابی است و در اثر مصرف سایر انواع بازدارندههای تیروزین-کیناز همچون جفیتینیب و آفاتینیب است.[۶]
در ایالات متحده آمریکا، پیش از تجویز اوسیمرتینیب، میبایست حذف اگزون ۱۹ گیرنده فاکتور رشد اپیدرمی، جهش L858R اگزون ۲۱، یا وضعیت T790M توسط یکی از روشهای تشخیصی آزمایشگاهی تأییدشدهٔ کشوری، به اثبات رسیده باشد.[۱]
در کسانی که با اوسیمرتینیب درمان میشوند، ظرف حدود ۱۰ ماه، مقاومت دارویی ایجاد میشود[۷] که علتش عموماً جهش C797S اگزون ۲۰ است.[۸]
این دارو برای جنین مضر است و نباید در بانوان باردار استفاده شود و خانمهایی که میخواهند از این دارو استفاده کنند، باید از روشهای جلوگیری مؤثر از بارداری بهره گیرند تا باردار نشوند.[۱][۹]
جهت تجویز اوسیمرتینیب به کسانی که سابقه «بیماری بینابینی ریه» (ILD) دارند، جانب احتیاط باید رعایت شود؛ چرا که چنین افرادی از کارآزماییهای بالینی به سبب بروز بیماری بینابینی ریه شدید و پنومونیت، حذف شده بودند. در تجویز اوسیمرتینیب به کسانی که در معرض خطر سندرم کیوتی هستند نیز باید احتیاط شود، چرا که این دارو سبب بروز این سندرم میشود.[۱]
عوارض جانبی[ویرایش]
عوارض بسیار شایع این دارو (بیش از ۱۰٪ افراد در کارآزماییهای بالینی) شامل اسهال، استوماتیت، راش پوستی، خشکی و خارش پوست، عقربک، افتِ پلاکتهای خون، افتِ گلبولهای سفید و کاهش نوتروفیلها است.[۱۰]
عارضه شایع دارو (بین ۱٪ تا ۱۰٪ افراد در کارآزماییهای بالینی) احتمال بروز «بیماری بینابینی ریه» (ILD) است.[۱۰]
تداخلات دارویی[ویرایش]
اوسیمرتینیب توسط آنزیمهای کبدی CYP3A4 و CYP3A5 تجزیه میشود. در نتیجه، هر دارویی که این دو آنزیم را مهار کند، میتواند سطح اوسیمرتینیب را در خون بالا ببرد که از میان این داروها، میتوان به آنتیبیوتیکهای ماکرولیدی، داروهای ضد قارچ و برخی داروهای ضد ویروس اشاره کرد. از طرف دیگر، داروهایی نظیر ریفامپین که سبب تشدید فعالیت دو آنزیم کبدیِ یادشده میشوند، موجب کاهش سطح و اثربخشی اوسیمرتینیب میگردند.[۱][۱۰]
پژوهش[ویرایش]
در حال حاضر (آوریل ۲۰۲۰)، چندین کارآزمایی بالینی جهت استفاده از این دارو در درمان سرطان در حالِ انجام است.[۱۱]
جامعه و فرهنگ[ویرایش]
هنگام عرضهٔ این دارو برای نخستین بار، قیمت تعیینشده برای آن توسط شرکت دارویی آسترازنکا، $۱۲٬۷۵۰ دلار آمریکا در ماه بود.[۱۲]: 59
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ ۱٫۵ "TAGRISSO FDA Label". nctr-crs.fda.gov. FDA. December 2019. Retrieved 2020-04-27.
- ↑ "Osimertinib" (به انگلیسی). AdisInsight. Archived from the original on 23 August 2018. Retrieved 27 February 2017.
- ↑ "Proposed INN: List 113" (PDF). International Nonproprietary Names for Pharmaceutical Substances (INN). 29 (2): 285. 2015. Archived (PDF) from the original on 28 April 2017. Retrieved 16 November 2015.
- ↑ Ayeni D, Politi K, Goldberg SB (September 2015). "Emerging Agents and New Mutations in EGFR-Mutant Lung Cancer". Clinical Cancer Research. 21 (17): 3818–20. doi:10.1158/1078-0432.CCR-15-1211. PMC 4720502. PMID 26169963.
- ↑ Tan CS, Gilligan D, Pacey S (September 2015). "Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer". The Lancet. Oncology. 16 (9): e447–e459. doi:10.1016/S1470-2045(15)00246-6. PMID 26370354.
- ↑ Xu M, Xie Y, Ni S, Liu H (May 2015). "The latest therapeutic strategies after resistance to first generation epidermal growth factor receptor tyrosine kinase inhibitors (EGFR TKIs) in patients with non-small cell lung cancer (NSCLC)". Annals of Translational Medicine. 3 (7): 96. doi:10.3978/j.issn.2305-5839.2015.03.60. PMC 4430733. PMID 26015938.
- ↑ Patel H, Pawara R, Ansari A, Surana S (December 2017). "Recent updates on third generation EGFR inhibitors and emergence of fourth generation EGFR inhibitors to combat C797S resistance". European Journal of Medicinal Chemistry. 142: 32–47. doi:10.1016/j.ejmech.2017.05.027. PMID 28526474.
- ↑ Wang S, Song Y, Liu D (January 2017). "EAI045: The fourth-generation EGFR inhibitor overcoming T790M and C797S resistance". Cancer Letters. 385: 51–54. doi:10.1016/j.canlet.2016.11.008. PMID 27840244.
- ↑ Bollinger, Meredith K; Agnew, Amanda S; Mascara, Gerard P (July 2018). "Osimertinib: A third-generation tyrosine kinase inhibitor for treatment of epidermal growth factor receptor-mutated non-small cell lung cancer with the acquired Thr790Met mutation". Journal of Oncology Pharmacy Practice (به انگلیسی). 24 (5): 379–388. doi:10.1177/1078155217712401. ISSN 1078-1552.
- ↑ ۱۰٫۰ ۱۰٫۱ ۱۰٫۲ "UK label" (به انگلیسی). UK Electronic Medicines Compendium. 26 January 2017. Archived from the original on 27 February 2017. Retrieved 27 February 2017.
- ↑ "Search of: Osimertinib - List Results - ClinicalTrials.gov". clinicaltrials.gov (به انگلیسی). Retrieved 2020-04-27.
- ↑ "AHRQ Healthcare Horizon Scanning System – Potential High-Impact Interventions Report Priority Area 02: Cancer" (PDF). AHRQ. December 2015. Archived from the original (PDF) on 2017-04-30. Retrieved 2017-02-27.
- مشارکتکنندگان ویکیپدیا. «Osimertinib». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۳۰ مه ۲۰۲۰.
