هستهزایی (شیمی)
هستهزایی[۱] (به انگلیسی: Nucleation) یا جوانهزنی به تشکیل هستهٔ بلوری جدید در محلول فوق اشباعشده در طی فرایند تبلور میگویند.
اولین مرحلهٔ دگرش فازی مرتبه اول است. این مرحله شامل تشکیل خودبهخودی هستهٔ بلوری فاز ثانویه است که توسط مرز فازی از فاز مادر جدا شدهاست به بیان دیگر جوانه زنی اولین مرحله در شکلگیری یک مرحله ترمودینامیکی جدید یا یک ساختار جدید از طریق خودسازی یا خودسازمان دهی است. هستهگیری به طور معمول فرآیندی تعریف میشود که تعیین میکند یک ناظر چه مدت باید منتظر بماند تا مرحله جدید یا ساختار خود سازمان یافته ظاهر شود. به عنوان مثال، اگر حجمی از آب (در فشار اتمسفر) زیر ۰ درجه سانتیگراد سرد شود، تمایل به یخ زدن دارد، اما حجم آب سرد فقط چند درجه زیر ۰ درجه سانتیگراد اغلب برای مدت طولانی بدون یخ باقی میماند. در این شرایط هسته یخ یا کند است یا اصلاً اتفاق نمیافتد. با این حال، در دماهای پایینتر، بلورهای یخ پس از تأخیر کمی یا بدون تاخیر ظاهر میشوند. در این شرایط جوانه زنی یخ سریع است.[۲][۳] هسته سازی معمولاً نحوه شروع انتقال فاز مرتبه اول است و سپس شروع فرآیند تشکیل یک فاز ترمودینامیکی جدید است.
ویژگیها
[ویرایش]جوانه زنی معمولاً یک فرآیند تصادفی است، بنابراین حتی در دو سیستم یکسان جوانه زنی در زمانهای مختلف رخ میدهد.[۲][۳][۴] یک مکانیسم متداول در انیمیشن سمت چپ نشان داده شدهاست. این جوانه زنی یک فاز جدید (نشان داده شده با رنگ قرمز) در یک فاز موجود (سفید) را نشان میدهد. در فاز موجود نوسانات میکروسکوپی فاز قرمز به طور مداوم ظاهر میشود و فروپاشی میشود، تا زمانی که نوسان غیرعادی فاز قرمز جدید آنقدر زیاد باشد که رشد آن مطلوب تر از کوچک شدن و از بین رفتن، باشد. سپس این جوانه فاز قرمز رشد کرده و سیستم را به این فاز تبدیل میکند. نظریه استاندارد که این رفتار را برای جوانه زنی یک مرحله ترمودینامیکی جدید توصیف میکند، تئوری جوانه زنی کلاسیک نامیده میشود. با این حال، CNT در توصیف نتایج تجربی بخار به جوانه مایع حتی برای مواد مدل مانند آرگون با چند مرتبه اندازه شکست میخورد.[۵]
برای جوانه زنی یک فاز ترمودینامیکی جدید، مانند تشکیل یخ در آب زیر ۰ درجه سانتیگراد، اگر سیستم با گذشت زمان تکامل پیدا نکند و جوانه زنی در یک مرحله رخ دهد، در این صورت احتمال جوانه زنی به شکل نمایی کاهش مییابد. این پدیده به عنوان یک نمونه در جوانه زنی یخ در قطرات کوچک آب فوق خنک دیده میشود.[۶] میزان واپاشی نمایی میزان جوانه زنی را نشان میدهد. تئوری جوانه زنی کلاسیک یک تئوری تقریبی برای تخمین این نرخها و چگونگی تغییر آنها با متغیرهایی مانند دما است. این تئوری به درستی پیش بینی میکند، زمانی که باید منتظر جوانه زنی باشید، وقتی محلول فوق اشباع شده باشد، به سرعت کاهش مییابد.[۲][۳]
این فقط مراحل جدیدی مانند مایعات و کریستالها نیستند که از طریق هسته و به دنبال آن رشد میکنند. روند خودسازی که اشیا را مانند سنگدانههای آمیلوئید مرتبط با بیماری آلزایمر را تشکیل میدهد نیز با جوانه زنی شروع میشود.[۷] سیستمهای خود سازماندهی کننده انرژی مانند ریزلولههای موجود در سلولها نیز جوانه زنی و رشد را نشان میدهند.
انرژی آزاد گیبس
[ویرایش]
انرژی بینسطحی همواره در راستای ناپایدار سازی هستهٔ بلوری عمل میکند؛ بنابراین مقداری فوقسرمایش برای آغاز استحاله مورد نیاز است. اما با رشد هستهٔ بلوری انرژی آزاد گیبس واکنش به دلیل فاز ثانویه کاهش مییابد. هستهزایی فاز جامد از فاز جامد مادر معمولاً با مقداری انرژی کرنش الاستیک همراه است که با اختلاف حجمویژهٔ فاز مادر و فاز ثانویه مرتبط است. تغییرات انرژی آزاد جوانهزنی فاز از فاز مادر در حالت کلی به صورت زیر بیان میشود:
که در آن تغییرات انرژی آزاد گیبس کل، حجم فاز جدید، تغییرات انرژی آزاد تشکیل واحد حجم فاز ثانویه، سطح مشترک جوانه و فاز مادر، انرژی ویژه سطح مشترک جوانه و فاز مادر و افزایش انرژی کرنشی در واحد حجم رسوب است.
جوانه زنی ناهمگن اغلب بر جوانه زنی همگن غلبه دارد
[ویرایش]جوانه زنی اغلب به ناخالصیهای موجود در سیستم بسیار حساس است. این ناخالصیها ممکن است خیلی کوچک باشند که با چشم غیر مسلح دیده شوند، اما هنوز هم میتوانند سرعت جوانه زنی را کنترل کنند. به همین دلیل، تشخیص بین هسته ناهمگن و هسته همگن غالباً مهم است. هسته ناهمگن در مکانهای جوانه زنی در سطوح موجود در سیستم رخ میدهد.[۲] هسته همگن دورتر از سطح تشکیل میشود.
جوانه زنی ناهمگن، جوانه زنی با جوانه در یک سطح، بسیار شایع تر از جوانه زنی همگن است.[۲][۴] به عنوان مثال، در جوانه زنی یخ از قطرات آب فوق سرد، تصفیه آب برای از بین بردن تمام یا تقریبا تمام ناخالصیها باعث قطرههای آب میشود که در زیر ۳۵ درجه سانتیگراد منجمد میشوند.[۲][۴][۶]در حالی که آب حاوی ناخالصیها ممکن است در ۵ درجه سانتیگراد یا گرمتر منجمد شود.[۲]
این مشاهدات که جوانه زنی ناهمگن زمانی میتواند رخ دهد که سرعت جوانه زنی همگن اساساً صفر باشد، اغلب با استفاده از تئوری جوانه زنی کلاسیک قابل درک است. این پیش بینی میکند که جوانه زنی با ارتفاع یک مانع انرژی آزاد ΔG به صورت نمایی، کند میشود. این سد از انرژی آزاد از تشکیل سطح جوانه در حال رشد ناشی میشود. برای جوانه زنی همگن، جوانه با یک کره تقریب مییابد، اما همانطور که در شماتیک قطرات ماکروسکوپی به سمت راست میبینیم، قطرات روی سطوح کره کامل نیستند و بنابراین رابطه بین قطره و مایع اطراف آن کمتر از مساحت یک کره است. این کاهش در سطح جوانه باعث کاهش ارتفاع مانع جوانه زنی میشود و بنابراین سرعت جوانه زنی را به صورت تصاعدی افزایش میدهد.[۳]
جوانه زنی همچنین میتواند از سطح مایع شروع شود. به عنوان مثال، شبیه سازی رایانه ای نانوذرات طلا نشان میدهد که فاز بلور در سطح طلای مایع جوانه میزند.[۸]
مطالعات شبیه سازی رایانه ای مدلهای ساده
[ویرایش]نظریه جوانه زنی کلاسیک فرضیات زیادی را مطرح میکند، به عنوان مثال با یک هسته میکروسکوپی به گونه ای برخورد میکند که گویی یک قطره ماکروسکوپی با یک سطح کاملاً مشخص است که انرژی آزاد آن با استفاده از یک ویژگی تعادل یعنی کشش سطحی σ، تخمین زده میشود. برای جوانه ای که فقط ده مولکول مرتب در آن وجود دارد، همیشه مشخص نیست که ما میتوانیم با چیزی بسیار کوچک به عنوان یک حجم بعلاوه یک سطح رفتارکنیم. همچنین جوانه زنی ذاتا خارج از یک پدیده تعادل ترمودینامیکی است، بنابراین همیشه بدیهی نیست که میتوان نرخ آن را با استفاده از خصوصیات تعادل تخمین زد یا نه.
با این حال، رایانههای مدرن از قدرت کافی برای محاسبه میزان جوانه زنی دقیق مدلهای ساده برخوردارند. این موارد با نظریه کلاسیک مقایسه شدهاست، به عنوان مثال برای مورد جوانه زنی فاز بلور در مدل کرههای سخت. یک مدل از کرههای کاملاً سخت در حرکت حرارتی است و یک مدل ساده از برخی کلوئیدها است. برای تبلور کرههای سخت، تئوری کلاسیک یک نظریه تقریبا منطقی است.[۹] بنابراین برای مدلهای ساده ای که میتوانیم مطالعه کنیم، تئوری جوانه زنی کلاسیک کاملاً خوب کار میکند، اما ما نمیدانیم که آیا برای مولکولهای پیچیدهٔ تبلور، به همان اندازه خوب کار میکند یا خیر.
ناحیه اسپینودال
[ویرایش]فرآیندهای انتقال فاز را میتوان از نظر تجزیه اسپینودال نیز توضیح داد، جایی که جدایی فاز تا زمانی که سیستم وارد منطقه ناپایدار شود که یک اغتشاش کوچک در ترکیب منجر به کاهش انرژی و در نتیجه رشد خود به خود آشفتگی میشود، به تأخیر میافتد.[۱۰] این ناحیه از یک نمودار فازی به عنوان ناحیه اسپینودال شناخته میشود و فرایند جداسازی فاز به عنوان تجزیه اسپینودال شناخته میشود و ممکن است توسط معادله کان-هلیارد محاسبه شود.
جوانهزنی در بلورها
[ویرایش]در بسیاری از موارد، مایعات و محلولها میتوانند در شرایطی که مایع یا محلول از نظر ترمودینامیکی به طور قابل توجهی پایداری کمتری از کریستال دارد، خنک یا متمرکز شوند، اما در طی چند دقیقه، ساعت، هفته یا بیشتر هیچ کریستالی تشکیل نمیشود. جوانه زنی کریستال توسط مانع قابل توجهی جلوگیری میشود. این اتفاق پیامدهایی در پی دارد، به عنوان مثال ابرهای دارای ارتفاع زیاد ممکن است حاوی تعداد زیادی قطره آب مایع کوچک باشند که بسیار کمتر از ۰ درجه سانتیگراد هستند.[۲]
در حجم کم، مانند قطرات کوچک، فقط ممکن است یک جوانه زنی برای تبلور لازم باشد. در این حجمهای کم، معمولاً زمان ظهور اولین کریستال زمان جوانه زنی تعریف میشود.[۴] تجسم مرحله اولیه جوانه زنی کریستال سدیم کلرید از طریق تصویربرداری فیلم در زمان واقعی با وضوح اتمی حاصل شد.[۱۱] هسته کریستال کربنات کلسیم نه تنها به درجه فوق اشباع بلکه به نسبت یونهای کلسیم به کربنات در محلولهای آبی نیز بستگی دارد.[۱۲] در حجم بیشتر، بسیاری از وقایع جوانه زنی رخ میدهد. در این حالت یک مدل ساده برای تبلور، ترکیبی از جوانه زنی و رشد، مدل KJMA یا Avrami است.
جوانه زنی اولیه و ثانویه
[ویرایش]زمان لازم تا پیدایش اولین بلور را زمان جوانه زنی اولیه نیز مینامند تا آن را از زمانهای جوانه زنی ثانویه متمایز کنیم. اولیه در اینجا به اولین جوانه تشکیل شده اشاره دارد، در حالی که جوانههای ثانویه جوانههای بلوری هستند که از یک کریستال موجود تولید میشوند. هسته اولیه انتقال به یک مرحله جدید را توصیف میکند که به مرحله جدیدی که قبلاً وجود دارد اتکا نمیکند، یا به این دلیل که اولین هسته تشکیل شده از آن مرحله است یا به دلیل اینکه جوانه دور از هر عضو فاز جدیدی از قبل تشکیل شدهاست. به ویژه در مطالعه تبلور، جوانه ثانویه میتواند مهم باشد. این تشکیل جوانه یک کریستال جدید است که به طور مستقیم توسط بلورهای قبلی ایجاد میشود.[۱۳]
به عنوان مثال، اگر بلورها در یک محلول قرار بگیرند و سیستم در معرض نیروهای برشی باشد، میتوان هستههای کریستال کوچکی را از یک بلور در حال رشد برید، بنابراین تعداد کریستالهای سیستم افزایش مییابد؛ بنابراین هر دو جوانه اولیه و ثانویه تعداد بلورهای موجود در سیستم را افزایش میدهند اما مکانیزم آنها بسیار متفاوت است و جوانه ثانویه به بلورهایی که قبلاً وجود داشتهاند متکی است.
مشاهدات تجربی در مورد زمان جوانه زنی برای تبلور در حجم کم
[ویرایش]به طور معمول مطالعه تجربی جوانه زنی بلورها دشوار است. جوانه میکروسکوپی است و بنابراین خیلی کوچک است و نمیتوان مستقیماً آن را مشاهده کرد. در حجم زیاد مایع به طور معمول چندین رویداد جوانه زنی وجود دارد و جدا کردن اثرات جوانه زنی از اثرات رشد فاز جوانه زده شده دشوار است. با کار با قطرات کوچک میتوان این مشکلات را برطرف کرد. از آنجا که جوانه زنی تصادفی است، تعدا زیادی قطره مورد نیاز است تا بتوان جوانه زنی را از نظر آماری بررسی کرد.

در سمت چپ، نمونه ای از دادههای جوانه زنی نشان داده شدهاست. این برای جوانه زنی در دمای ثابت و از این رو اشباع بیش از حد فاز بلور در قطرات کوچک مایع فوق سرد قلع است. این کار پوند و لا مر است.[۱۴]
جوانه زنی در قطرات مختلف در زمانهای مختلف اتفاق میافتد، از این رو این بخش، جزئی ساده ازتابع نیست که در یک زمان خاص به شدت از یک به صفر کاهش یابد. منحنی قرمز متناسب یک تابع Gompertz با دادهها است. این یک نسخه ساده از مدل Pound و La Mer است که برای مدل سازی دادههای خود استفاده میکنند.[۱۴] این مدل فرض میکند که جوانه زنی به دلیل ذرات ناخالصی در قطرات قلع مایع رخ میدهد و این فرض ساده را ایجاد میکند که تمام ذرات ناخالصی با همان سرعت جوانه زنی میکنند. همچنین فرض میشود که این ذرات با توزیع پواسون در میان قطرات قلع مایع توزیع شدهاند. مقادیر مناسب که سرعت جوانه زنی ناشی از یک ذره ناخالصی واحد ۰٫۰۲ در ثانیه است و متوسط تعداد ذرات ناخالصی در هر قطره ۱٫۲ است. توجه داشته باشید که حدود ۳۰٪ از قطرات قلع هرگز یخ نمیزنند. کف داده در حدود ۰٫۳ است. در مدل فرض بر این است که به طور تصادفی، این قطرات حتی یک ذره ناخالصی ندارند و بنابراین هیچ جوانه زنی ناهمگنی وجود ندارد. جوانه زنی همگن در مقیاس زمانی این آزمایش قابل اغماض است. قطرات باقیمانده به صورت تصادفی منجمد میشوند، اگر دارای یک ذره ناخالصی باشند با سرعت ۰٫۰۲ بر ثانیه، در صورت داشتن دو ذره ۰٫۰۴ بر ثانیه و به همین شکل ائامه مییابد.
این دادهها فقط یک نمونه هستند، اما آنها ویژگیهای مشترک هسته بلورها را به این دلیل نشان میدهند که شواهد روشنی برای جوانه زنی ناهمگن وجود دارد و این جوانه زنی به وضوح تصادفی است.
یخ
[ویرایش]تبدیل قطرات کوچک آب به یخ یک فرایند مهم است، خصوصاً در شکلگیری و حرکت ابرها. [۲] آب (در فشار اتمسفر) در ۰ درجه سانتیگراد یخ نمیزند، بلکه در درجه حرارت است که با کاهش حجم آب و افزایش ناخالصی آب تمایل به کاهش دارد.[۲]

بنابراین قطرات کوچک آب، همانطور که در ابرها یافت میشوند، ممکن است بسیار کمتر از ۰ درجه سانتیگراد مایع باقی بمانند.
نمونه ای از دادههای تجربی در مورد انجماد قطرات کوچک آب در سمت چپ نشان داده شدهاست. طرح نشان میدهد بخشی زیادی از قطرات آب، هنوز هم آب مایع هستند، یعنی به عنوان تابعی از دما هنوز منجمد نشدهاند. توجه داشته باشید که بالاترین دمایی که هر قطره در آن یخ میزند نزدیک به ۱۹- درجه سانتی گراد است، در حالی که آخرین قطره منجمد این کار را تقریباً در ۳۵- درجه سانتیگراد انجام میدهد.[۱۵]
مثالها
[ویرایش]نمونههایی از جوانه زنی سیالات (گازها و مایعات)
[ویرایش]- ابرها با خنک شدن هوای مرطوب تشکیل میشوند (غالباً به دلیل بالا رفتن هوا) و قطرات کوچک آب از هوای فوق اشباع شده جوانه میزنند.[۲] مقدار بخار آبی که هوا میتواند حمل کند با کاهش دما، کاهش مییابد. بخار اضافی شروع به جوانه زنی و تشکیل قطرات کوچک آب میکند که ابر را تشکیل میدهند. جوانه زنی قطرات آب مایع، ناهمگن است و روی ذراتی وجود دارد که به آنها هسته میعان ابر گفته میشود. بارورسازی ابرها، فرآیند افزودن هستههای چگالش مصنوعی برای سرعت بخشیدن به تشکیل ابرها است.
- حبابهای دی اکسید کربن اندکی پس از آزاد شدن فشار از یک ظرف مایع گازدار، جوانه میزنند.
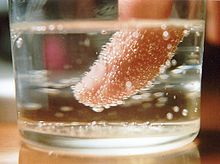
- در صورت کاهش فشار، میتوان جوانه زنی در حجم مایع در حال ایجاد کرد تا مایع با توجه به نقطه جوش وابسته به فشار بیش از حد گرم (فوق گرم) شود. اکثر اوقات جوانه در سطح گرم شدن، در سایتهای جوانه زنی رخ میدهد. به طورمعمول، محلهای جوانه زنی شکافهای ریزی هستند که در آن سطح آزاد گاز یا مایع در سطح گرم کننده با خواص ترشوندگی کمتر حفظ میشود. پس از گاز زدایی مایع، اگر سطوح گرم کننده تمیز، صاف و ساخته شده از موادی که به خوبی توسط مایع تر شدهاند، باشد میتوان فوق گرم شدن مایع را به دست آورد.
- برخی از همزنهای شامپاین با تهیه مکانهای جوانه زنی بسیاری از طریق گوشههای سطح بالا و تیز با تسریع در آزاد شدن حبابها و حذف کربناسیون از شراب کار میکنند.
- فوران رژیم غذایی و فوران قرصهای منتوس مثال دیگری را ارائه میدهد. سطح آب نبات منتوس مکانهای جوانه زنی برای تشکیل حبابهای دی اکسید کربن از نوشابه گازدار را فراهم میکند.
- هر دو اتاقک حباب و اتاقک ابر به ترتیب به جوانه زنی حباب و قطره وابسته هستند.
نمونههایی از جوانه زنی در بلورها
[ویرایش]متداولترین روند بلوری شدن روی زمین، تشکیل یخ است. آب مایع در ۰ درجه سانتیگراد یخ نمیزند مگر اینکه در در آن زمان یخ وجود داشته باشد، برای جوانه زنی یخ و به همین ترتیب برای یخ زدن آب به طور قابل توجهی خنک شدن لازم است. به عنوان مثال، قطرات کوچک آب بسیار خالص میتوانند تا زیر ۳۰- درجه سانتیگراد مایع باقی بمانند اگرچه یخ حالت پایدار زیر ۰ درجه سانتیگراد است.
بسیاری از موادی که ساخت و استفاده میکنیم کریستالی هستند اما از مایعات ساخته میشوند. به عنوان مثال آهن کریستالی ساخته شده از آهن مایع به قالب ریخته میشود، بنابراین هسته مواد بلوری به طور گستردهای در صنعت مورد مطالعه قرار میگیرد.[۱۶] در صنایع شیمیایی برای مواردی مانند تهیه پودرهای فوق پراکنده فلزی که میتوانند به عنوان کاتالیزور عمل کنند، به شدت مورد استفاده قرار میگیرد. به عنوان مثال، پلاتین رسوب یافته روی نانوذرات TiO2، آزادسازی هیدروژن از آب را کاتالیز میکند.[۱۷] این یک عامل مهم در صنعت نیمه هادی است، زیرا انرژی شکاف باند در نیمه هادیها تحت تأثیر اندازه نانو خوشهها است.[۱۸]
جوانه زنی در مواد جامد
[ویرایش]علاوه برجوانه زنی و رشد کریستالها به عنوان مثال در شیشههای غیر بلوری، هسته و رشد ناخالصی در بلورها و بین مرزدانهها رسوب میکنند، از نظر صنعتی بسیارمهم است. به عنوان مثال در فلزات حالت جامد جوانه زنی و رشد رسوب نقش مهمی دارد، در اصلاح خواص مکانیکی مانند شکل پذیری، و همچنین در نیمه هادیها، در به دام انداختن ناخالصیها در طول ساخت مدار مجتمع نقش مهمی دارد.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ «هستهزایی» [شیمی] همارزِ «nucleation»؛ منبع: گروه واژهگزینی. جواد میرشکاری، ویراستار. دفتر پنجم. فرهنگ واژههای مصوب فرهنگستان. تهران: انتشارات فرهنگستان زبان و ادب فارسی. شابک ۹۷۸-۹۶۴-۷۵۳۱-۷۶-۴ (ذیل سرواژهٔ هستهزایی2)
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997)
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ ۳٫۳ Sear, Richard P (2007-01-03). "Nucleation: theory and applications to protein solutions and colloidal suspensions". Journal of Physics: Condensed Matter. 19 (3): 033101. doi:10.1088/0953-8984/19/3/033101. ISSN 0953-8984.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ Sear, Richard P. (2014). "Quantitative studies of crystal nucleation at constant supersaturation: experimental data and models". CrystEngComm. 16 (29): 6506–6522. doi:10.1039/c4ce00344f. ISSN 1466-8033.
- ↑ Fladerer, Alexander; Strey, Reinhard (2006-04-28). "Homogeneous nucleation and droplet growth in supersaturated argon vapor: The cryogenic nucleation pulse chamber". The Journal of Chemical Physics. 124 (16): 164710. doi:10.1063/1.2186327. ISSN 0021-9606.
- ↑ ۶٫۰ ۶٫۱ Duft، D.؛ Leisner، T. (۲۰۰۴-۰۶-۰۷). «Laboratory evidence for volume-dominated nucleation of ice in supercooled water microdroplets». dx.doi.org. دریافتشده در ۲۰۲۱-۰۵-۰۷.
- ↑ Gillam, J E; MacPhee, C E (2013-08-14). "Modelling amyloid fibril formation kinetics: mechanisms of nucleation and growth". Journal of Physics: Condensed Matter. 25 (37): 373101. doi:10.1088/0953-8984/25/37/373101. ISSN 0953-8984.
- ↑ Mendez-Villuendas, Eduardo; Bowles, Richard K. (2007-05-03). "Surface Nucleation in the Freezing of Gold Nanoparticles". Physical Review Letters. 98 (18). doi:10.1103/physrevlett.98.185503. ISSN 0031-9007.
- ↑ Auer, S.; Frenkel, D. (2004-02-08). "Numerical prediction of absolute crystallization rates in hard-sphere colloids". The Journal of Chemical Physics. 120 (6): 3015–3029. doi:10.1063/1.1638740. ISSN 0021-9606.
- ↑ Mendez-Villuendas, Eduardo; Saika-Voivod, Ivan; Bowles, Richard K. (2007-10-21). "A limit of stability in supercooled liquid clusters". The Journal of Chemical Physics. 127 (15): 154703. doi:10.1063/1.2779875. ISSN 0021-9606.
- ↑ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021-01-21). "Capturing the Moment of Emergence of Crystal Nucleus from Disorder". Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. ISSN 0002-7863.
- ↑ Seepma, Sergěj Y. M. H.; Ruiz-Hernandez, Sergio E.; Nehrke, Gernot; Soetaert, Karline; Philipse, Albert P.; Kuipers, Bonny W. M.; Wolthers, Mariette (2021-01-28). "Controlling CaCO3 Particle Size with {Ca2+}:{CO32–} Ratios in Aqueous Environments". Crystal Growth & Design. 21 (3): 1576–1590. doi:10.1021/acs.cgd.0c01403. ISSN 1528-7483.
- ↑ Botsaris, GD (1976). "Secondary Nucleation — A Review". In Mullin, J (ed.).
- ↑ ۱۴٫۰ ۱۴٫۱ Pound, Guy M.; V. K. La Mer (1952). "Kinetics of Crystalline Nucleus Formation in Supercooled Liquid Tin". Journal of the American Chemical Society. 74 (9): 2323.
- ↑ Itoo, K.; Hama, K. (1956). "Freezing of Supercooled Water-droplets (I)". Papers in Meteorology and Geophysics. 6 (3–4): 247–254. doi:10.2467/mripapers1950.6.3-4_247. ISSN 0031-126X.
- ↑ .Kelton, Ken; Greer, Alan Lindsay (2010)
- ↑ Palmans, Roger; Frank, Arthur J. (1991). "A molecular water-reduction catalyst: Surface derivatization of titania colloids and suspensions with a platinum complex". The Journal of Physical Chemistry. 95 (23): 9438. doi:10.1021/j100176a075
- ↑ Rajh, Tijana; Micic, Olga I.; Nozik, Arthur J. (1993). "Synthesis and characterization of surface-modified colloidal cadmium telluride quantum dots". The Journal of Physical Chemistry. 97 (46): 11999










