پیشنویس:میکسوماتوز، استحاله میگزومی
| ERROR: parameter(s) specifying taxon are incorrect; see documentation | |
|---|---|
| |
| Myxoma virus (transmission electron microscope) | |
| طبقهبندی ویروسها |
میکسوماتوز یک بیماری است که توسط ویروس میکسوما، نوعی ویروس آبله از جنس Leporipoxvirus ایجاد میشود. میزبانهای طبیعی این ویروس، تاپتی یا خرگوش برزیلی ( Sylvilagus brasiliensis ) در آمریکای جنوبی و مرکزی، و خرگوش فرچهای ( Sylvilagus bachmani ) در آمریکای شمالی هستند. ویروس میکسوما در این گونهها فقط یک بیماری خفیف ایجاد میکند، اما در خرگوشهای اروپایی یک بیماری شدید و معمولاً کشنده ( Oryctolagus cuniculus ) ایجاد میکند. میکسوماتوز یک مثال عالی از آن چیزی است که هنگام پرش یک ویروس از گونهای سازگار با آن به یک میزبان ساده رخ میدهد و به همین دلیل به طور گسترده مورد مطالعه قرار گرفته است. این ویروس عمدا در استرالیا، فرانسه و شیلی در دهه 1950 برای کنترل جمعیت خرگوشهای وحشی اروپایی معرفی شد.
علت[ویرایش]

ویروس میکسوما از جنس Leporipoxvirus (خانواده Poxviridae ؛ زیرخانواده Chordopoxvirinae ) است. مانند سایر ویروسهای پوکس، ویروسهای میکسوما ویروسهای DNA بزرگ با DNA دو رشتهای خطی هستند. تکثیر ویروس در سیتوپلاسم سلول اتفاق میافتد. میزبانهای طبیعی تاپتی، خرگوش برزیلی ( Sylvilagus brasiliensis ) در آمریکای جنوبی و مرکزی، و خرگوش فرچهای ( Sylvilagus bachmani ) در آمریکای شمالی هستند. ویروس میکسوما در این گونهها فقط یک بیماری خفیف ایجاد می کند که علائم آن محدود به تشکیل ندولهای پوستی است. [۱]
میکسوماتوز نام بیماری شدید و اغلب کشنده در خرگوشهای اروپایی است که توسط ویروس میکسوما ایجاد میشود. سویههای مختلفی وجود دارند که از نظر حدت آنها متفاوت است. سویه کالیفرنیا، که در سواحل غربی ایالات متحده و باجا در مکزیک بومی است، خطرناکترین است، با میزان مرگ و میر گزارش شده 100٪. سویه آمریکای جنوبی، موجود در آمریکای جنوبی و آمریکای مرکزی، کمی بدخیمتر است و میزان مرگومیر گزارششده 99.8٪ است. سویههای موجود در اروپا و استرالیا ضعیف شدهاند و میزان مرگ و میر گزارششده 50 تا 95 درصد است. در حالی که خرگوشهای وحشی در اروپا و استرالیا نسبت به ویروس مصونیت پیدا کردهاند، این امر به طور کلی در مورد خرگوشهای خانگی صادق نیست. [۲]
انتقال[ویرایش]
میکسوماتوز عمدتاً توسط حشرات منتقل میشود. انتقال بیماری معمولا از طریق پشه اتفاق میافتد یا نیش کک، اما میتواند از طریق نیش مگس و شپش و همچنین کنه عنکبوتی رخ دهد. ویروس میکسوما در این میزبانهای بندپایان تکثیر نمیشود، اما به طور فیزیکی با گاز گرفتن بندپایان از یک خرگوش به خرگوش دیگر منتقل میشود. فصلی بودن به دلیل در دسترس بودن ناقلهای بندپایان و همچنین همجواری خرگوشهای وحشی آلوده، است. [۳]
ویروس میکسوما میتواند از طریق تماس مستقیم نیز منتقل شود. خرگوشهای آلوده ویروس را در ترشحات چشمی و بینی و از مناطقی از پوست فرسایش یافته دفع میکنند. این ویروس ممکن است در مایع منی و ترشحات تناسلی نیز وجود داشته باشد. ویروسهای پوکس در محیط نسبتاً پایدار هستند و میتوانند توسط اشیاء آلوده مانند بطریهای آب، فیدرها، قفسها یا دست افراد منتقل شوند. [۳] آنها در برابر خشک شدن مقاوم هستند اما به برخی از مواد ضدعفونی کننده حساس هستند. [۴]
پاتوفیزیولوژی[ویرایش]
یک مطالعه آزمایشگاهی که در آن خرگوشهای اروپایی تزریق داخل جلدی سویهای از ویروس میکسومای آمریکای جنوبی را دریافت کردند، پیشرفت بیماری را به صورت زیر نشان داد. در ابتدا ویروس در محل تلقیح در پوست تکثیر شد. تقریباً 2 روز پس از تلقیح ویروس در غدد لنفاوی مجاور پیدا شد و در 3 روز در جریان خون و اندامهای شکمی یافت شد. تقریباً در 4 روز ویروس از پوست غیر تلقیح شده و همچنین از بیضه ها جدا شد. ضخیم شدن جزئی پلکها و وجود ویروس در مایع ملتحمه در روز پنجم قابل تشخیص بود. گرفتگی بیضه در روز 6 مشاهده شد [۵]
تظاهرات بالینی در خرگوشهای اروپایی[ویرایش]


علائم بالینی میکسوماتوز به سویه ویروس، مسیر تلقیح و وضعیت ایمنی میزبان بستگی دارد. علائم شکل کلاسیک ندولر بیماری شامل توده زیر جلدی در محل تلقیح، تورم و ادم پلکها و اندام تناسلی، ترشحات شیری یا چرکی چشمی، تب، بیحالی، افسردگی و بیاشتهایی است.[نیازمند منبع]
طبق نظر مردیت (2013)، دوره زمانی معمول بیماری به شرح زیر است: [۱]
| روزها پس از عفونت | علائم بالینی |
|---|---|
| 2-4 | تورم در محل عفونت |
| 4 | تب |
| 6 | تورم پلکها، صورت، قاعده گوش و ناحیه تناسلی |
| 6 | ضایعات پوستی ثانویه، از جمله ضایعات قرمز رنگ بر روی پلکها و تودههای برجسته روی بدن |
| 6-8 | ترشحات چشمی و بینی شفاف که مخاط چرکی و پوسته پوسته میشود |
| 7-8 | دیسترس تنفسی |
| 8-9 | هیپوترمی |
| 10 | بستهشدن کامل پلکها به دلیل تورم |
| 10-12 | مرگ |
در بیماری فرا حاد با سویه بسیار بدخیم، مرگ ممکن است طی 5 تا 6 روز پس از عفونت با حداقل علائم بالینی غیر از ورم ملتحمه رخ دهد. مرگ معمولا بین روزهای 10 تا 12 اتفاق میافتد. سویههای بسیار خطرناک، مانند آنهایی که در آمریکای شمالی و جنوبی وجود دارند، اساساً 100٪ نرخ مرگ و میر دارند.
در خرگوشهای آلوده به سویههای ضعیفشده و کمخطر ویروس، ضایعات مشاهدهشده متغیرتر و عموماً خفیفتر هستند و دوره زمانی به تأخیر میافتد و طولانیتر میشود. بسیاری از خرگوشها زنده میمانند و ضایعات پوستی به تدریج پوسته پوسته میشوند و میافتند و جای زخم باقی میماند. شکل خفیفتری از این بیماری در خرگوشهای خانگی که قبلاً واکسینه شدهاند و دارای ایمنی نسبی هستند نیز دیده میشود. خرگوشهای واکسینه شده اغلب با ضایعات پوستهدار موضعی، اغلب روی پل بینی و اطراف چشمها یا تودههای پوستی متعدد روی بدن ظاهر میشوند. آنها اغلب هنوز سرحال و هوشیار هستند و با مراقبتهای پرستاری زنده میمانند. [۱]
علائم تنفسی یک یافته رایج در خرگوشهایی است که در مراحل اولیه میکسوماتوز زنده میمانند. ترشحات مخاطی چرکی بینی رخ میدهد که منجر به نفس کشیدن و تنفس استرتوروس همراه با امتداد سر و گردن میشود. پنومونی باکتریایی ثانویه در بسیاری از موارد رخ میدهد. بیماری مزمن تنفسی، مانند ترشحات بینی، در خرگوشهای زنده مانده شایع است. حتی در خرگوشهایی که ظاهراً بهبود یافتهاند، یافتن لوبهای ریه پر از مایع به جای هوا در هنگام کالبدگشایی غیرعادی نیست. [۳]
از دهه 1970 یک شکل "آمیکسوماتوز" از این بیماری در اروپا گزارش شده است که فاقد گرههای پوستی معمولی میکسوماتوز است. این شکل از نظر بالینی خفیفتر و به طور کلی غیر کشنده است. علائم تنفسی، از جمله ترشحات شفاف یا چرکی بینی، غالب است. ادم پرینه، تورم پلکها و بلفاروکانژونکتیویت چرکی، به طور کلی هنوز وجود دارد. این شکل در خرگوشهای وحشی مشاهده شده است، اما عمدتاً در خرگوشهای پرورشی قابل توجه است. [۱]
تشخیص[ویرایش]
تشخیص میکسوماتوز در خرگوشهای اروپایی اغلب بر اساس ظاهر بالینی مشخص انجام میشود. اگر خرگوش بدون نشان دادن علائم کلاسیک میکسوماتوز بمیرد، یا در صورت نیاز به تایید بیشتر، تعدادی آزمایش آزمایشگاهی در دسترس است. از نظر تاریخی این موارد شامل هیستوپاتولوژی، میکروسکوپ الکترونی و جداسازی ویروس است. بررسی هیستوپاتولوژیک پوست آسیب دیده معمولاً سلولهای مزانشیمی تمایز نیافته را در ماتریکسی از موسین، سلولهای التهابی و ادم نشان میدهد. انکلوزیونهای داخل سیتوپلاسمی ممکن است در اپیدرم و در اپیتلیوم ملتحمه دیده شود. به دلیل اندازه بزرگ و ساختار متمایز ویروسهای آبله، میتوان از معاینه میکروسکوپی الکترونی رنگ منفی نیز برای تشخیص استفاده کرد. این روش امکان تجسم سریع ویروسهای آبله را فراهم میکند، اما اجازه تأیید خاص گونهها یا گونههای ویروس را نمیدهد. جداسازی ویروس همچنان «استاندارد طلایی» است که سایر روشهای تشخیص ویروس با آن مقایسه میشوند. حداقل از نظر تئوری، یک ویروس زنده موجود در یک نمونه را میتوان در سلولهای کشت داده شده رشد داد، در نتیجه آن را گسترش داد تا مواد کافی برای اجازه دادن به خصوصیات دقیق بیشتر تولید شود.
توسعه اخیر روشهای مولکولی مانند واکنش زنجیرهای پلیمراز (PCR) و سنجش واکنش زنجیرهای پلیمراز در زمان واقعی، روشهای سریعتر و دقیقتری برای شناسایی ویروس میکسوما ایجاد کرده است. Real Time PCR تشخیص میکسوماتوز را با امکان آزمایش سریع سوابهای بینی، چشمی یا تناسلی ساده میکند. همچنین میتوان از آن بر روی نمونههای بافت پارافینی برای تایید وجود ویروس میکسوما و شناسایی سویه ویروسی استفاده کرد. [۶]
درمان[ویرایش]
در حال حاضر درمان خاصی برای میکسوماتوز وجود ندارد. اگر تصمیم به اقدام برای درمان گرفته شود، نظارت دقیق برای جلوگیری از طولانی شدن رنج ضروری است. خرگوشهایی که قبلاً واکسینه شدهاند یا آنهایی که با سویه ضعیفشده آلوده شدهاند، ممکن است با مراقبتهای حمایتی با مایعات، غذا و داروهای ضدویروسی با طیف وسیع بهبود پیدا کنند. قطع مصرف آب و غذا، کاهش وزن شدید مداوم، یا دمای مقعدی زیر 37 درجه سانتیگراد (98.6 فارنهایت) دلایلی هستند که باید اتانازی را در نظر بگیرید. [۳]
جلوگیری[ویرایش]
واکسیناسیون[ویرایش]
واکسنهای ضد میکسوماتوز در برخی کشورها موجود است. همه واکسنهای زنده اصلاحشده هستند که بر اساس سویههای ضعیفشده ویروس میکسوما یا ویروس فیبروم Shope مرتبط هستند که مصونیت متقابل ایجاد میکند. توصیه میشود که همه خرگوشها در مناطقی از جهان که میکسوماتوز بومی است واکسینه شوند، حتی اگر در داخل خانه نگهداری شوند، زیرا توانایی انتقال ویروس به داخل توسط ناقلین یا فومیتها وجود دارد. در موقعیتهای گروهی که خرگوشها به طور معمول واکسینه نمیشوند، واکسیناسیون در مواجهه با شیوع بیماری در محدود کردن عوارض و مرگومیر مفید است. [۱] این واکسن 100% محافظت نمیکند، [۳] بنابراین هنوز مهم است که از تماس با خرگوش های وحشی و ناقلان حشرات جلوگیری شود. واکسنهای میکسوماتوز باید به طور منظم تقویت شوند تا موثر باقی بمانند و معمولاً واکسیناسیون سالانه توصیه میشود. [۱]
در اروپا و بریتانیا یک واکسن ناقل دو ظرفیتی به نام Nobivac Myxo-RHD [۷] موجود است که هم در برابر میکسوماتوز و هم بیماری خونریزی دهنده خرگوش محافظت میکند. این واکسن برای ایمن سازی خرگوشهای 5 هفتهای یا بالاتر مجوز دارد و شروع ایمنی تقریباً 3 هفته طول می کشد. محافظت در برابر میکسوماتوز و بیماری هموراژیک خرگوش به مدت 12 ماه مصونیت دارد و واکسیناسیون سالانه برای اطمینان از حفاظت مداوم توصیه می شود. نشان داده شده است که این واکسن مرگ و میر و علائم بالینی میکسوماتوز را کاهش میدهد. [۸]
واکسیناسیون علیه میکسوماتوز در حال حاضر در استرالیا به دلیل نگرانی از انتشار ویروس واکسن به خرگوشهای وحشی و افزایش ایمنی آنها در برابر میکسوماتوز ممنوع است. از آنجایی که خرگوشهای وحشی در استرالیا در حال حاضر آسیب زیادی به محیط زیست وارد می کنند، این نگرانی توسط دولت جدی گرفته میشود. [۹] بسیاری از خرگوشهای خانگی در استرالیا به دلیل عدم ایمنی خود به دلیل میکسوماتوز میمیرند. [۱۰] حداقل یک کمپین برای اجازه دادن به واکسن برای حیوانات خانگی خانگی وجود دارد. [۱۱] انجمن دامپزشکی استرالیا از معرفی یک واکسن ایمن و موثر میکسوماتوز برای خرگوشهای خانگی حمایت میکند، [۱۲] و RSPCA استرالیا مکرراً خواستار بررسی واکسنهای ویروس میکسومای موجود و ارزیابی علمی تأثیرات احتمالی آنها در محیط استرالیا شده است. [۱۳]
اگرچه میکسوماتوز در بخشهایی از مکزیک و ایالات متحده بومی است، با این وجود هیچ واکسنی تجاری در هیچ یک از این کشورها وجود ندارد. اطلاعات مربوط به موارد اخیر گزارش شده در ایالات متحده از انجمن خرگوش خانگی موجود است. [۱۴] در ایالات متحده واردات واکسنها توسط خدمات بازرسی سلامت حیوانات و گیاهان، بخشی از وزارت کشاورزی، نظارت میشود. [۱۵]
سایر اقدامات پیشگیرانه[ویرایش]
در مکانهایی که میکسوماتوز بومی است اما واکسنی در دسترس نیست، جلوگیری از قرار گرفتن در معرض ویروس میکسوما از اهمیت حیاتی برخوردار است. حتی خرگوشهای واکسینه شده نیز نیاز به محافظت دارند، زیرا واکسنها 100٪ موثر نیستند. خطر ابتلا به میکسوماتوز حیوان خانگی را میتوان با جلوگیری از تماس با خرگوشهای وحشی، نگه داشتن خرگوش در داخل خانه (ترجیحا) یا پشت صفحه برای جلوگیری از قرار گرفتن در معرض پشه و استفاده از داروهای ایمن برای خرگوش برای درمان و پیشگیری از کک، شپش و کنه کاهش داد. هر خرگوش جدیدی که ممکن است در معرض قرار گرفته باشد باید قرنطینه شود و خرگوشهایی که مشکوک به میکسوماتوز هستند باید فوراً جدا شوند تا تشخیص رد شود. در صورت تایید بیماری، تمام قفسها، ظروف یا سایر اشیاء آلوده باید با 10% سفید کننده، 10% هیدروکسید سدیم یا 1% تا 1.4% فرمالین ضدعفونی شوند.
استفاده به عنوان عامل کنترل جمعیت[ویرایش]

ویروس میکسوما اولین ویروسی بود که به طور عمدی با هدف از بین بردن یک آفت مهرهداران، یعنی خرگوش اروپایی در استرالیا و اروپا وارد طبیعت شد. شکست طولانی مدت این استراتژی به دلیل فشارهای انتخابی طبیعی بر روی هر دو جمعیت خرگوش و ویروس بوده است که منجر به ظهور حیوانات مقاوم به میکسوماتوز و انواع ویروس ضعیفشده است. این فرآیند به عنوان یک مثال کلاسیک از تکامل مشترک میزبان-بیماری پس از انتقال بین گونه ای یک پاتوژن در نظر گرفته میشود.
استرالیا[ویرایش]


خرگوشهای اروپایی در سال 1788 توسط مهاجران اولیه انگلیسی به استرالیا آورده شدند (به صفحه خرگوشها در استرالیا مراجعه کنید). در ابتدا به عنوان منبع غذایی مورد استفاده قرار گرفتند، اما بعداً وحشی شدند و تعداد آنها افزایش یافت. در نوامبر 1937، شورای استرالیا برای تحقیقات علمی و صنعتی از جزیره واردانگ برای انجام اولین آزمایشات میدانی میکسوماتوز استفاده کرد که روشی را برای انتشار موفقیت آمیز ویروس میکسوم در سراسر کشور ایجاد کرد. [۱۶] در سال 1950، سویه SLS از ویروس میکسوما از تاپتی آمریکای جنوبی ( Sylvilagus brasiliensis ) به عنوان یک عامل کنترل بیولوژیکی علیه خرگوشهای وحشی در استرالیا منتشر شد. این ویروس در ابتدا بسیار کشنده بود، با نرخ مرگ و میر مورد تخمینی نزدیک به 99.8٪. با این حال، طی چند سال، این سویه با انواع کمخطر جایگزین شد، که امکان بقای طولانیتر خرگوشهای آلوده و افزایش انتقال بیماری را فراهم کرد. این ویروس فشار انتخاب قوی برای تکامل خرگوشهای مقاوم به میکسوماتوز ایجاد کرد. همانطور که خرگوشها مقاومتر شدند، سویههای ویروسی با کمتر شدن بیماری واکنش نشان دادند. [۲] ویروس بیماری هموراژیک خرگوش نیز از سال 1995 برای کنترل جمعیت خرگوش وحشی در استرالیا استفاده شده است. [۱۷]
اروپا[ویرایش]
در ژوئن 1952 پل فلیکس آرماند دلیل ، صاحب ملکی در شمال غربی فرانسه، دو خرگوش وحشی را با سویه لوزان ویروس میکسوم تلقیح کرد. [۱۸] قصد او فقط از بین بردن خرگوشهای موجود در ملکش بود، اما این بیماری به سرعت در اروپای غربی، ایرلند و بریتانیا گسترش یافت. [۱۹] برخی از انتشار ویروس به وضوح عمدی به نظر میرسید، مانند ورود به بریتانیا در سال 1953 و معرفی به ایرلند در سال 1954. با این حال، بر خلاف استرالیا، تلاشهای شدیدی برای جلوگیری از گسترش در اروپا انجام شد. این تلاشها بینتیجه ماند. بر اساس برآوردها، جمعیت خرگوش وحشی در بریتانیا 99 درصد، در فرانسه 90 درصد تا 95 درصد و در اسپانیا 95 درصد کاهش یافته است. این به نوبه خود باعث شد که شکارچیان تخصصی خرگوش مانند سیاهگوش ایبری و عقاب امپراتوری اسپانیایی در آستانه انقراض قرار گیرند. [۲۰] [۲۱] علاوه بر کاهش جمعیت خرگوش وحشی و جمعیت شکارچیان طبیعی آن، میکسوماتوز اثرات قابل توجهی بر صنعت بزرگ پرورش خرگوش داشت که خرگوشهای خانگی را برای گوشت و خز تولید میکرد. [۲۲] سویه لوزان ویروس میکسوما باعث تشکیل ندولهای بزرگ بنفش پوستی میشود که در سایر سویهها دیده نمیشود. همانطور که در استرالیا اتفاق افتاد، ویروس عموماً بدخیمتر شده و جمعیت خرگوشهای وحشی متعاقباً مقاومتر شدهاست. [۱۹]
نیوزلند[ویرایش]
معرفی میکسوماتوز به نیوزلند در سال 1952 برای کنترل مشکل در حال رشد خرگوش به دلیل عدم وجود ناقل شکست خورد. [۲۳]
آمریکای جنوبی[ویرایش]
دو جفت خرگوش اروپایی در سال 1936 در پونتا سانتا ماریا آزاد شدند و منجر به هجومی شد که در نیمه شمالی Tierra del Fuego گسترش یافت. خرگوشهای بیشتری در سال 1950 در نزدیکی Ushuaia توسط نیروی دریایی آرژانتین و یک پرورشدهنده خصوصی خرگوش معرفی شدند. خرگوشها به سرعت تبدیل به آفت شدند و زمین را با سوراخهایی پر کردند و آن را خالی از علف گذاشتند. تا سال 1953 جمعیت خرگوش به حدود 30 میلیون نفر رسید. در سال 1954 مقامات شیلیایی یک سویه برزیلی از ویروس میکسوما را به Tierra del Fuego معرفی کردند که موفق شد خرگوشها را به سطح بسیار پایینی از جمعیت برساند. [۲۴]
استفاده به عنوان یک مدل تکاملی[ویرایش]
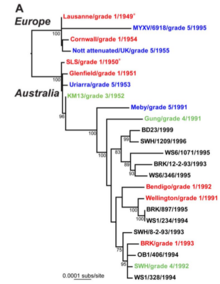
با توجه به اهمیت تکامل ویروسی برای ظهور بیماری، پاتوژنز ، مقاومت دارویی و اثربخشی واکسن، نظریه پردازان و تجربیگرایان به خوبی آن را مطالعه کردهاند. معرفی ویروس میکسوما به جمعیت خرگوشهای اروپایی در استرالیا و فرانسه، آزمایشهای طبیعی را در تکامل حدت ایجاد کرد. [۲۵] در حالی که سویههای اولیه ویروسی بسیار بدخیم بودند، سویههای ضعیفشده به زودی از مزرعه بازیابی شدند. این سویههای ضعیفشده، که به خرگوشها امکان زنده ماندن طولانیتر را میداد، به دلیل انتقال آسانتر آنها غالب شدند. از آنجایی که توالی ژنوم کامل سویههای میکسومای متعدد منتشر شده است، دانشمندان توانستهاند دقیقاً مشخص کنند که کدام ژنها مسئول تغییرات در حدت و رفتار ویروس میکسوم هستند. [۲۶]
با این حال، ثابت شده است که تکامل این بیماری هم در میان گونههای مختلف میزبان و هم در میان گونههای ویروس پیچیدهتر و غیرقابل پیشبینیتر است. هم در حالتهای مقاومت و هم از نظر بیماریزایی، و هم در همه کشورهایی که ویروس برای کنترل خرگوشهای وحشی معرفی شده است، میزبان و عوامل بیماریزا بهطور مداوم به روشهای مختلف با چالشهای تکاملی سازگار شدهاند. اگرچه سویههای کنونی میکسوماتوز به تنهایی کنترل کافی را ارائه نمیکنند، این بیماری همچنان یک عامل اکولوژیکی مهم در کنترل خرگوش، هم در استرالیا و هم در سایر کشورها، باقی میماند. برای مثال، علیرغم نگرانی طولانیمدت در استرالیا، بهویژه، جایی که حدت اولیه میکسوماتوز پس از چند دهه در این زمینه کاهش یافت، تکامل خرگوشها در مقاومت به این بیماری بدون چالش نمانده است. برای برخی از سویههای اخیر ویروس، به عنوان مثال، انتخاب برای کاهش التهاب، تکثیر ویروس را طولانی میکند، که انتقال را افزایش میدهد و سرکوب ویروس توسط تب میزبان را کاهش میدهد. همچنین ممکن است باعث سرکوب سیستم ایمنی شود که به نفع حدت بالا است. [۲۷] مطالعات هم در زمینه کنترل خرگوش و هم در زمینه اصول تکاملی مربوطه ادامه دارد.
در داستان[ویرایش]
شخصیتهای خرگوش رمان Watership Down (1972) نوشته ریچارد آدامز از میکسوماتوز به عنوان "کوری سفید" یاد میکنند و در داستان یک رئیس خرگوش همه خرگوشهایی را که به نظر میرسید مبتلا شده بودند رانده بود. در یکی از داستانهای عامیانه رمان درباره قهرمان خرگوش الاحرایره، انتقال بیماری توسط ارباب دنیای زیرین خرگوش، خرگوش سیاه اینله، برای او توضیح داده میشود («این بیماری توسط ککها در گوش خرگوشها حمل میشود. آنها از گوش یک خرگوش بیمار به گوش همراهانش میرسند.»
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ ۱٫۵ Meredith, A (2013). "Viral skin diseases of the rabbit". Veterinary Clinics of North America: Exotic Animal Practice. 16 (3): 705–714. doi:10.1016/j.cvex.2013.05.010. PMID 24018033.
- ↑ ۲٫۰ ۲٫۱ Kerr, P (2017). "Genomic and phenotypic characterization of myxoma virus from Great Britain reveals multiple evolutionary pathways distinct from those in Australia". PLOS Pathogens. 13 (3): e1006252. doi:10.1371/journal.ppat.1006252. PMC 5349684. PMID 28253375.
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ ۳٫۳ ۳٫۴ Kerr, P (2013). "Viral Infections of Rabbits". Veterinary Clinics of North America: Exotic Animal Practice. 16 (2): 437–468. doi:10.1016/j.cvex.2013.02.002. PMC 7110462. PMID 23642871.
- ↑ "Disinfection". The Center for Food Security and Public Health. Retrieved 21 July 2019.
- ↑ Fenner, F; Woodroofe, GM (1953). "The pathogenesis of infectious myxomatosis: the mechanism of infection and the immunological response in the European rabbit (Oryctolagus cuniculus)". The British Journal of Experimental Pathology. 34 (4): 400–411. PMC 2073564. PMID 13093911.
- ↑ Albini, S; Sigrist, B; Güttinger, R; Schelling, C; Hoop, RK; Vögtlin, A (6 December 2011). "Development and validation of a real-time polymerase chain reaction assay" (PDF). Journal of Veterinary Diagnostic Investigation. 24 (1): 135–137. doi:10.1177/1040638711425946. PMID 22362943.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ "Nobivac Myxo RHD". MSD Animal Health. Retrieved 20 July 2019.
- ↑ "Nobivac Myxo RHD Data Sheet". European Medicine Agency. Retrieved 20 July 2019.
- ↑ "A Statement from the Chief Veterinary Officer (Australia) on myxomatosis vaccine availability in Australia". Australian Government Department of Agriculture. Retrieved 20 July 2019.
- ↑ "The Rabbit Sanctuary Myxomatosis Hotline". Myxomatosis. Retrieved 20 July 2019.
- ↑ "Myxo Campaign". Myxomatosis. Retrieved 20 July 2019.
- ↑ "Myxomatosis vaccination of pet rabbits". Australian Veterinary Association. Retrieved 20 July 2019.
- ↑ "Why can't I vaccinate my rabbit against Myxomatosis?". Royal Society for the Prevention of Cruelty to Animals. Retrieved 20 July 2019.
- ↑ "Myxomatosis in the US". House Rabbit Society. Retrieved 23 August 2019.
- ↑ "Veterinary Biologics". United States Department of Agriculture, Animal and Plant Health Inspection Service. Retrieved 23 July 2019.
- ↑ "Rabbits around a waterhole at the enclosed trial site at Wardang Island, 1938". National Archives of Australia. Retrieved 28 July 2019.
- ↑ Mahar JE, Read AJ, Gu X, Urakova N, Mourant R, Piper M, Haboury S, Holmes EC, Strive T, Hall RN (January 2018). "Detection and Circulation of a Novel Rabbit Hemorrhagic Disease Virus in Australia". Emerg Infect Dis. 24 (1): 22–31. doi:10.3201/eid2401.170412. PMC 5749467. PMID 29260677.
- ↑ Davis, J. "Darwin's rabbit is revealing how the animals became immune to myxomatosis". Natural History Museum. Retrieved 14 August 2019.
- ↑ ۱۹٫۰ ۱۹٫۱ Kerr, P; Liu, J; Cattadori, I; Ghedin, E; Read, A; Holmes, E (6 March 2015). "Myxoma Virus and the Leporipoxviruses: An Evolutionary Paradigm". Viruses. 7 (3): 1020–1061. doi:10.3390/v7031020. PMC 4379559. PMID 25757062.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ↑ Gil-Sánchez, JM; McCain, EB (14 October 2011). "Former range and decline of the Iberian lynx (Lynx pardinus) reconstructed using verified records". Journal of Mammalogy. 92 (5): 1081–1090. doi:10.1644/10-MAMM-A-381.1.
- ↑ Sánchez, B. "Action plan for the Spanish imperial eagle (Aquila adalberti) in the European Union" (PDF). European Commission. Retrieved 14 August 2019.
- ↑ Cadogan, S (23 March 2017). "How a thriving food industry faded away to nothing in the 1960s". The Irish Examiner. Cork. Retrieved 15 October 2017.
- ↑
Peden, Robert (24 November 2008). "Rabbits - Biological control". Te Ara - the Encyclopedia of New Zealand. Retrieved 9 March 2021.
Myxomatosis (a viral disease of rabbits, caused by the myxoma virus) had been introduced to New Zealand in 1952, but failed to become established as there was no vector to spread it through the rabbit population.
- ↑ Jaksic, F (1983). "Rabbit and Fox Introductions in Tierra del Fuego: History and Assessment of the Attempts at Biological Control of the Rabbit Infestation". Biological Conservation. 26 (4): 369–370. doi:10.1016/0006-3207(83)90097-6.
- ↑ Bull, JJ; Lauring, AS; Condit, RC (2014). "Theory and Empiricism in Virulence Evolution". PLOS Pathogens. 10 (10): e1004387. doi:10.1371/journal.ppat.1004387. PMC 4207818. PMID 25340792.
- ↑ Burgess, HM; Mohr, I (2016). "Evolutionary clash between myxoma virus and rabbit PKR in Australia". Proceedings of the National Academy of Sciences. 113 (15): 3912–3914. Bibcode:2016PNAS..113.3912B. doi:10.1073/pnas.1602063113. PMC 4839419. PMID 27035991.
- ↑ Peter J Kerr, Isabella M Cattadori, Derek Sim, June Liu, Edward C. Holmes, Andrew F.Read. "Divergent Evolutionary Pathways of Myxoma Virus in Australia" bioRxiv preprint doi: https://doi.org/10.1101/2022.06.02.494607 June 2, 2022.
بیشتر خواندن[ویرایش]
- Deane, C.D. (1955). "Note on myxomatosis in hares". Bulletin of the Mammal Society of the British Isles. 3: 20. OCLC 1224626693.
-
{{cite book}}: Empty citation (help)
لینک های خارجی[ویرایش]
| در ویکیانبار پروندههایی دربارهٔ میکسوماتوز، استحاله میگزومی موجود است. |
 </img> پورتال ویروس ها
</img> پورتال ویروس ها
