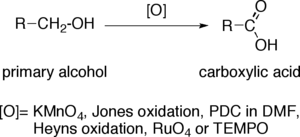
اکسایش الکلهای اولیه به کربوکسیلیک اسیدها
اکسایش الکلهای اولیه (نوع اول) به کربوکسیلیک اسیدها یک واکنش اکسایش مهم در شیمی آلی است.
هنگامی که یک الکل اولیه به کربوکسیلیک اسید تبدیل میشود، اتم کربن انتهایی حالت اکسایش خود را چهار واحد افزایش میدهد. اکسندههایی که قادر به انجام این عملیات در مولکولهای آلی پیچیده هستند، باید گزینشپذیری قابل توجهی داشته باشند؛ به ویژه مولکولهایی که دارای سایر گروههای عاملی حساس به اکسایش هستند. رایجترین اکسندهها پتاسیم پرمنگنات قلیایی (KMnO4) یا پتاسیم دیکرومات اسیدی شده هستند. از معرف جونز، PCC در DMF، اکسایش هینز، روتنیم تتراکسید (RuO4) و TEMPO نیز استفاده میشود.
پتاسیم پرمنگنات[ویرایش]
پتاسیم پرمنگنات (KMnO4) یک اکسیدکننده بسیار قوی است که قادر به واکنش با بسیاری از گروههای عاملی مانند الکلهای ثانویه، ۲٬۱-دیالها، آلدهیدها، آلکنها، اکسیمها، سولفیدها و تیولها است. تحت شرایط کنترل شده، KMnO4 الکلهای اولیه را به شکلی بسیار کارآمد به کربوکسیلیک اسیدها، اکسید میکند. این واکنش که اولین بار توسط فورنیه به تفصیل شرح داده شد،[۱][۲] معمولاً با افزودن KMnO4 به محلول یا سوسپانسیون الکل در محلول آبی قلیایی انجام میشود. مخلوط به دست آمده همزده میشود تا اکسایش کامل شود. برای انجام واکنش مؤثر، الکل باید حداقل تا حدی در محلول آبی حل شود. در صورت کم محلول بودن الکل مورد نظر میتوان با افزودن یک حلال کمکی آلی مانند دی اکسان، پیریدین، استون یا t -BuOH حلالیت را تسهیل کرد. KMnO4 به آسانی با یک پیوند دوگانه کربن-کربن قبل از اکسید شدن یک الکل اولیه واکنش میدهد.
به طور معمول، این اکسایشها تحت شرایط بازی قوی انجام میشوند، زیرا این امر باعث افزایش سرعت اکسایش و انتخاب پذیری میشود. در بسترهای حساس به باز قوی، واکنش را میتوان با pH پایینتر یا حتی در شرایط اسیدی انجام داد. البته این شرایط میتواند موجب کاهش شدید سرعت واکنش شود.

KMnO4 در آب تجزیه میشود و در نتیجه منگنز دیاکسید (MnO2) و اکسیژن گازی تشکیل میشود. این تجزیه توسط اسید، باز و MnO2 کاتالیز میشود. از آنجایی که تخمین میزان این تجزیه در طول اکسایش الکلهای اولیه دشوار است، مقدار KMnO4 باید در طول اکسایش با افزودن متوالی آن تا زمانی که اکسایش کامل شود، تنظیم شود.
اکسایش جونز[ویرایش]
واکنشگر جونز با حل کردن کروم تریاکسید (CrO3) در محلول آبی سولفوریک اسید تهیه میشود که منجر به تشکیل محلول قرمز رنگ حاوی کرومیک اسید (H2CrO4) و الیگومرهای آن میشود. افزودن معرف جونز به محلول یک الکل اولیه در استون (همانطور که برای اولین بار توسط جونز[۴][۵] توضیح داده شد) منجر به اکسایش الکل به کربوکسیلیک اسید میشود. این پروتکلِ کلاسیک، که شامل یک افزودن مستقیم است، اغلب بدون توجه به این واقعیت استفاده میشود که اغلب منجر به تشکیل مقادیر قابل توجهی از استرها (دارای ساختار R-CO-O-CH2-R) میشود که ناشی از دیمریشدن اکسایشی الکلهای اولیه است. هالند و گیلمن[۶] ثابت کردند که این واکنش جانبی را میتوان تا حد زیادی با پیروی از پروتکلِ افزودن معکوس سرکوب کرد که به موجب آن محلولی از الکل اولیه در استون به آرامی تحت شرایط رقیق شده به واکنشگر جونز اضافه میشود.
واکنشگر جونز با الکلهای ثانویه برهمکنش میکند و منجر به اکسایش به کتون میشود.[۷] از واکنش ترکیباتی که حاوی هم الکلهای اولیه و هم ثانویه هستند با واکنشگر جونز، کتواسیدها تشکیل میشوند.
به دلیل مشکلات استفاده از مقادیر زیاد کروم تریاکسید که ماده ای سمی و خطرناک برای محیط زیست است، روشی کاتالیزوری توسط ژائو[۸] ابداع شد که شامل واکنش با پریودیک اسید اضافی (H5IO6) در حضور حدود ۱٫۲ درصد مولی CrO3 بود. روش ژائو برای استفاده از کاتالیزور CrO3 در واکنشهای مقیاسِ بزرگ بسیار مناسب است.[۹]

PDC در DMF (کوری و اشمیت)[ویرایش]
پیریدینیم دیکرومات (PDC) یک جامد نارنجی روشن با فرمول شیمیایی (C5H5NH)2Cr2O7 است که اغلب برای اکسایش الکلهای اولیه و ثانویه به آلدهیدها و کتونها استفاده میشود. از سوی دیگر، در سال ۱۹۷۹، کوری و اشمیت[۱۱] گزارش کردند که واکنش الکلهای اولیه اشباع شده با PDC، با استفاده از دیمتیلفرمامید (Me2NCHO, DMF) به عنوان حلال، منجر به اکسایش به کربوکسیلیک اسیدها به جای آلدهیدها میشود. هیچ اکسایشی به کربوکسیلیک اسید روی الکلهای اولیه آلیلی و بنزیلی رخ نمیدهد. روش کوری و اشمیت برای اکسایش الکلهای اولیه اشباع شده به کربوکسیلیک اسیدها در شرایط خنثی انجام میشود.
اکسایش هینز[ویرایش]
در اکسایش هینز، واکنشگر اکسیدکننده ترکیبی از اکسیژن و پلاتین است.
روتنیم تتراکسید[ویرایش]
روتنیم تتراکسید در شیمی آلی به عنوان یک عامل اکسیدکننده کاربردهای زیادی دارد. این ماده یک عامل تهاجمی است که شرایط واکنش خفیف را فراهم میکند.
اکسایش دو مرحلهای الکلها به اسیدها از طریق آلدهیدهای جدا شده[ویرایش]
از آنجایی که بسیاری از شرایط ذکر شده برای اکسایش الکلهای اولیه به اسیدها خشن هستند و با گروههای حفاظتی رایج سازگار نیستند، شیمیدانهای آلی اغلب از یک روش دو مرحله ای برای اکسایش به اسیدها استفاده میکنند. الکل اولیه با استفاده از یکی از روشهای موجود (مثلاً اکسایش IBX، پریدینان دس–مارتین) به آلدهید تبدیل میشود. سپس آلدهید را میتوان تحت شرایط اکسایش پینیک با استفاده از سدیم کلریت قرار داد.[۱۲] این توالی اغلب در سنتز محصولات طبیعی استفاده میشود، نیکولائو و همکاران این روش را در سنتز پلاتنسین به کار بردند.[۱۳]
منابع[ویرایش]
- ↑ Fournier, H.M. (1907). "Transformation des alcools primaires saturès en acides monobasiques correspondants". Comptes Rendus Acad. Sci.: 331.
- ↑ Fournier, H.M. (20 July 1909). "Sur la préparation des acides gras et de leurs anhydres". Bull. Soc. Chim. Fr.: 920.
- ↑ Ciufolini, M.A.; Swaminathan, S. (1989). "Synthesis of a model depsipeptide segment of Luzopeptins (BBM 928), potent antitumor and antiretroviral antibiotics". Tetrahedron Lett. 30 (23): 3027. doi:10.1016/S0040-4039(00)99393-6.
- ↑ Heilbron, I.; Jones, E.R.H.; Sondheimer, F. (1947). "315. Researches on acetylenic compounds. Part XIV. A study of the reactions of the readily available ethynyl-ethylenic alcohol, pent-2-en-4-yn-1-ol". J. Chem. Soc.: 1586. doi:10.1039/jr9470001586.
- ↑ Heilbron, I.; Jones, E.R.H. (1949). "129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols". J. Chem. Soc.: 604. doi:10.1039/jr9490000604.
- ↑ Holland, B.C.; Gilman, N.W. (1974). "An Improved Procedure for the Oxidation of Alkynols to Alkynoic Acids". Synth. Commun. 4 (4): 203. doi:10.1080/00397917408062073.
- ↑ See Oxidation of alcohols to aldehydes and ketones.
- ↑ Zhao, M.; Li, J.; Song, Z.; Desmond, R.; Tschaen, D.M.; Grabowski, E.J.J.; Reider, P.J. (1998). "A novel chromium trioxide catalyzed oxidation of primary alcohols to the carboxylic acids". Tetrahedron Lett. 39 (30): 5323. doi:10.1016/S0040-4039(98)00987-3.
- ↑ Song, Z.J.; Zhao, M.; Desmond, R.; Devine, P.; Tschaen, D.M.; Tillyer, R.; Frey, L.; Heid, R.; Xu, F. (1999). "Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist". J. Org. Chem. 64 (26): 9658. doi:10.1021/jo991292t.
- ↑ Crimmins, M.T.; DeBaillie, A.C. (2006). "Enantioselective Total Synthesis of Bistramide A". J. Am. Chem. Soc. 128 (15): 4936–7. doi:10.1021/ja057686l. PMC 2546575. PMID 16608311.
- ↑ Corey, E.J.; Schmidt, G. (1979). "Useful procedures for the oxidation of alcohols involving pyridinium dichromate in approtic media". Tetrahedron Lett. 20 (52): 399. doi:10.1016/S0040-4039(01)93515-4.
- ↑ Bal B.S.; Childers, Jr. W.E.; Pinnick H.W. (1981). "Oxidation of α,β-unsaturated aldehydes". Tetrahedron (abstract). 37 (11): 2091. doi:10.1016/S0040-4020(01)97963-3.
- ↑ Nicolaou K.C.; Scott Tria G.; Edmonds D. J. (2008). "Total Synthesis of Platencin". Angew. Chem. 120 (9): 1804. doi:10.1002/ange.200800066.
جهت مطالعه[ویرایش]
- Marcos Fernández; Gabriel Tojo (2006). Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis). Berlin: Springer. ISBN 0-387-35431-X.
