زیستسازگاری تیتانیم
تیتانیم اولین بار در دههٔ ۱۹۵۰ میلادی برای جراحی بهکار برده شد؛ درحالیکه یک دهه قبلتر برای ساخت ایمپلنت بهکار رفته بود. امروزه از این فلز به عنوان پروتز، ایمپلنتهای ثابتکنندهٔ داخلی، دستگاههای داخل بدن و ابزار دقیق استفاده میشود. از تیتانیم در سراسر بدن انسان به عنوان ایمپلنت استفاده میشود. از جمله کاربردهای این فلز میتوان به استفاده در جراحیهای مغز و اعصاب، ایمپلنتهای چشم، قفس فیوژن ستون مهرهها، ضربانسازها، ایمپلنتهای پا و جایگزینهای شانه، آرنج، مفصل ران، زانو و چندین کاربرد دیگر اشاره کرد. علت اصلی استفاده از تیتانیم در بدن، زیستسازگاری فلز و دارا بودن سطوح زیست فعال در صورت اعمال فرایندهای بهبود سطح است. از جمله پارامترهای سطحی که بر زیستسازگاری ماده اثرگذار هستند، میتوان به بافت سطحی، steric hindrance, binding sites و آبدوستی اشاره کرد. برای ایجاد پاسخ سلولی مطلوب، بایستی این پارامترها بهینه شوند. برخی از ایمپلنتهای پزشکی و همچنان ابزارهای جراحی با تیتانیم نیترید پوشش داده میشوند.

زیستسازگاری[ویرایش]
تیتانیم به علت مقاومت به خوردگی مطلوب در مقابل سیالات بدن، زیستنفوذناپذیری، گیرش مطلوب ایمپلنت توسط استخوان و حد خستگی بالا به عنوان زیستسازگارترین ماده شناخته میشود.[نیازمند منبع] مقاومت تیتانیم در برابر محیط سخت بدنی به علت فیلم اکسید محافظی است که به صورت طبیعی در صورت وجود اکسیژن شکل میگیرد. این فیلم اکسید که به شدت پایدار، غیرقابل حل، و غیرقابل نفوذ شیمیایی است، از واکنشها بین فلز و محیط احاطهکننده جلوگیری میکند.
واکنش گیرش و تکثیر[ویرایش]
تحریک رگزایی حین گیرش توسط سطوح پُر انرژی[ویرایش]
پیشنهاد داده شدهاست که ظرفیت تیتانیم برای گیرش توسط استخوان از ثابت دیالکتریک بالای اکسید سطح نشأت میگیرد که در پروتئینها تأثیری نمیگذارد.[۱] یکی از عمده مزیتهای تیتانیم نسبت به جایگزینهای این ماده-که برای متصل شدن نیاز به پوشش چسبنده دارند-توانایی این ماده در ایجاد اتصال فیزیکی با استخوان است.[۲]
خواص سطحی تأثیرگذار بر گیرش[ویرایش]
خواص سطحی یک زیستماده نقش بهسزایی در مشخص کردن پاسخ سلولی (چسبندگی سلولی و تکثیر) به ماده دارد. ریزساختار تیتانیم و انرژی سطحی بالا، آن را قادر به تحریک رگزایی (رشد رگهای خونی جدید) میکند که بر فرایند گیرش ماده کمک میکند.[۳]
انرژی سطحی[ویرایش]
پتانسیل بازآوری[ویرایش]
تیتانیم میتواند با توجه به شرایط اکسیداسیون موجود، پتانسیلهای الکتریکی استاندارد متفاوتی را نشان دهد. تیتانیم جامد پتانسیل الکترود استانداردی برابر -1.63V دارد. موادی با پتانسیل الکترود استاندارد بالاتر راحتتر اکسید میشوند. در جدول زیر پتانسیلهای الکترون استاندارد در شرایط مختلف برای تیتانیم آورده شدهاست.[۴]
پوششدهی سطحی[ویرایش]
در انفعال سطحی تیتانیم فیلم اکسید به صورت طبیعی تشکیل میشود. این فیلم اکسید تحت تابعی از زمان حضور در محیط بدنی ناهمگن و قطبی خواهد شد.[۵] همچنین مورد اشاره شده سبب جذب سطحی گروه هیدروکسیلها، لیپوپروتئینها و گلیکولیپیدها در این زمان خواهد شد. جذب این ترکیبات سبب تغییر در برهمکنش ایمپلنت با بدن و بهبود زیستسازگاری آن میشود. در آلیاژهای تیتانیم از جمله آلومینیم-زیرکونیم و آلومینیم-نیوبیم، یونهای زیرکونیم و نیوبیم که به علت خوردگی آزاد میشوند، در بدن بیمار آزاد نمیشود، بلکه به لایهٔ غیرفعال اکسیدی اضافه میشود.[۶] عناصر آلیاژی در لایهٔ غیرفعال اکسیدی میتواند سبب زیستسازگاری بیشتر و مقاومت به خوردگی شود که درجهٔ تأثیر آن به اصلیترین عنصر آلیاژی مقاوم به خوردگی وابسته است.
تجمع سطحی پروتئین (Γ) توسط معادلهٔ زیر تعریف میشود:
که در آن QADS چگالی شارژ سطحی، M جرم مولی پروتئین مورد نظر، n تعداد الکترونهای مبادله شده و F ثابت فارادی است.
معادلهٔ فرکانس برخورد به صورت زیر است:
که در فرمول اشاره شده، D ضریب انتشار مولکول BSA در دمای ۳۱۰ کلوین، d قطر پروتئین مد نظر -که دو برابر شعاع استوکس است-، NA عدد آووگادرو و c ضریب تمرکز فوق اشباع حجمی بحرانی هستند.
خیسشوندگی و سطح جامد[ویرایش]
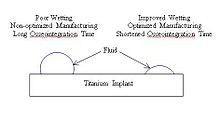
خیسشوندگی تابعی از زبری سطحی و ترکهای سطحی است.[۸] با افزایش خیسشوندگی، به سلولها اجازه داده میشود تا به آسانی به سطح ایمپلنت بپیوندند و در نتیجه زمان لازم برای گیرش ایمپلنت توسط بدن کاهش مییابد. خیسشوندگی تیتانیم میتواند با بهینه کردن پارامترهای واکنش نظیر دما، زمان و فشار اصلاح شود. قابلیت خیسشوندگی ایمپلنتهای تیتانیمی با لایهٔ اکسید سطحی پایدار که عمدتاً شامل TiO2 باشد، در تماس با مایعات فیزیولوژیکال بهبود مییابد.[۹]
جذب[ویرایش]
خوردگی[ویرایش]
جذب مکانیکی فیلم اکسید تیتانیم منجر به افزایش نرخ خوردگی میشود. تیتانیم و آلیاژهای آن در صورتی که در بدن باشند، مصون از خوردگی نیستند. در آلیاژهای تیتانیوم نسبت به جذب هیدروژن حساس هستند، رسوب هیدریدها در فلز میتواند منجر به تردتر شدن ماده شده و سبب شکست ماده شود.[۱۰] تردی هیدروژنی در آزمایشهای درونتنی تحت شرایط خوردگی fretting-crevice که منجر به تشکیل TiH میشود، مشاهده شدهاست. مطالعه و تست رفتار تیتانیم در محیط بدن، به ما اجازه میدهد تا از رفتارهای ماده باخبر شویم و از اتفاقات نامطلوب ممکن جلوگیری کنیم. برای مثال استفاده از محصولات دندانی با میزان فلوراید بالا یا دیگر مواد با قابلیت کاهش پیاچ محیط ایمپلنت را اسیدی خواهند کرد.[۱۱]
الحاق[ویرایش]
سلولهای اطراف ایمپلنت به شدت به اشیاء خارجی حساس هستند. وقتی ایمپلنت در بدن انسان کاشت میشود، سلولهای اطراف، رفتاری التهابی از خود بروز میدهند که منجر به کپسولهسازی میشود و سبب اختلال در اندامی میشود که ایمپلنت کاشته شدهاست.[۱۲]
جستارهای وابسته[ویرایش]
پیوند به بیرون[ویرایش]
- ژورنال کاربردهای مواد زیستی
- انجمن تیتانیوم ایران
- انجمن مهندسی متالورژی و مواد ایران
- انجمن مهندسی پزشکی ایران
منابع[ویرایش]
- ↑ Black J (1994) Biological performance of tantalum. Clin Mater 16: 167–173.
- ↑ Raines, Andrew L.; Olivares-Navarrete, Rene; Wieland, Marco; Cochran, David L.; Schwartz, Zvi; Boyan, Barbara D. (Spring 2010). "Regulation of angiogenesis during osseointegration by titanium surface microstructure and energy". Biomaterials. 31 (18): 4909–4917. doi:10.1016/j.biomaterials.2010.02.071. ISSN 1878-5905. PMC 2896824. PMID 20356623.
- ↑ http://titaniumthemetal.org/Resources/DataSheetMedical.pdf
- ↑ «نسخه آرشیو شده». بایگانیشده از اصلی در ۱۸ ژوئن ۲۰۱۳. دریافتشده در ۹ دسامبر ۲۰۱۷.
- ↑ Healy, K. E.; Ducheyne, P. (1991). "A physical model for the titanium-tissue interface". ASAIO transactions. 37 (3): M150–151. ISSN 0889-7190. PMID 1751087.
- ↑ Long, Marc; Rack, H. J (1998-09-01). "Titanium alloys in total joint replacement—a materials science perspective". Biomaterials. 19 (18): 1621–1639. doi:10.1016/S0142-9612(97)00146-4. ISSN 0142-9612.
- ↑ ۷٫۰ ۷٫۱ Jackson, Douglas R.; Omanović, Saša; Roscoe, Sharon G. (2000). "Electrochemical Studies of the Adsorption Behavior of Serum Proteins on Titanium". Langmuir. 16 (12): 5449–57. doi:10.1021/la991497x.
- ↑ Bico, José; Thiele, Uwe; Quéré, David (Summer 2002). "Wetting of textured surfaces". Colloids and Surfaces A: Physicochemical and Engineering Aspects (به انگلیسی). 206 (1–3): 41–46. doi:10.1016/S0927-7757(02)00061-4.
- ↑ Silva, M. a. M.; Martinelli, A. E.; Alves, Clodomiro; Nascimento, R. M.; Távora, Michele Portela; Vilar, Caroline Dantas (2006). "Surface modification of Ti implants by plasma oxidation in hollow cathode discharge". Surface and Coatings Technology (به انگلیسی). 200 (8). doi:10.1016/j.surfcoat.2004.12.027.
- ↑ Rodrigues, Danieli C.; Urban, Robert M.; Jacobs, Joshua J.; Gilbert, Jeremy L. (Winter 2009). "In vivo severe corrosion and hydrogen embrittlement of retrieved modular body titanium alloy hip-implants". Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 88 (1): 206–219. doi:10.1002/jbm.b.31171. ISSN 1552-4981. PMC 2667129. PMID 18683224.
- ↑ «نسخه آرشیو شده» (PDF). بایگانیشده از اصلی (PDF) در ۴ مارس ۲۰۱۶. دریافتشده در ۹ دسامبر ۲۰۱۷.
- ↑ Franz, Sandra; Rammelt, Stefan; Scharnweber, Dieter; Simon, Jan C. (Fall 2011). "Immune responses to implants - a review of the implications for the design of immunomodulatory biomaterials". Biomaterials. 32 (28): 6692–6709. doi:10.1016/j.biomaterials.2011.05.078. ISSN 1878-5905. PMID 21715002.


