تیتراسیون پتانسیل سنجی
تیتراسیون پتانسیل سنجی به تیتراسیونهایی که با دستگاه پتانسیومتر انجام میگیرد گفته میشود. در تیتراسیونهای پتانسیومتری تغییرات پتانسیل الکترود شناساگر نسبت به الکترود مرجع، به ازای افزایش حجمهای معینی از تیتر کننده، سنجیده میشود. الکترود مرجع در تمام تیتراسیونها معمولاً یکی از الکترودهای مرجع آزمایشگاهی مانند الکترود کالومل اشباع یا نقره – نقره کلرید اشباع است. اما نوع الکترود شناساگر بستگی به نوع تیتراسیون دارد. برای مثال در تیتراسیونهای اسید – باز معمولاً از الکترود شیشه، در تیتراسیونهای اکسایش – کاهش از الکترود پلاتین، در تیتراسیونهای کمپلکسومتری از الکترود جیوه و در تیتراسیونهای رسوبی از الکترود نقره استفاده میشود.
پتانسیل سنجی
[ویرایش]پتانسیل سنجی یک روش الکتروشیمیایی است که در آن مقدار ماده در محلول به طریق اندازهگیری مستقیم یا غیرمستقیم نیروی محرکه الکتریکی (emf) بین دو الکترود قرار داده شده در محلول اندازهگیری میشود. نیروی محرکه الکتریکی (emf) بین الکترود شناساگر و مرجع، پتانسیل یا اخلاف پتانسیل نامیده میشود.
روشها
[ویرایش]پتانسیل سنجی مستقیم
[ویرایش]پتانسیل سنجی مستقیم که در آن سنجش به کمک اندازهگیری پتانسیل الکترود انجام میگیرد. معمولاً پتانسیل سنجی مستقیم با استفاده از الکترود یون گزین به عنوان الکترود شناساگر انجام میشود و آن را میتوان برای گونههایی به کار برد که یک الکترود شناساگر برای آنها در دسترس میباشد.
تیتراسیون پتانسیل سنجی
[ویرایش]در این روش منحنی تغییرات پتانسیل بر حسب حجم واکنشگر رسم میشود. پتانسیل سنجی میتواند بر اساس هر کدام از تعادلهای اسید-باز، اکسایشی -کاهشی، تشکیل کمپلکس و رسوب انجام گیرد. تیتراسیون پتانسیل سنجی نسبت به تیتراسیون حجم سنجی در حضور شناساگرهای رنگی، مزیتهایی دارد که عبارتند از:
- نقطهٔ پایانی حتی در محلولهای رقیق، دقیقاً قابل تعیین است.
- اندازهگیری در محلولهای رنگی که در آنها، تغییر شناساگرها محسوس نیست، ممکن میباشد.
- این روش در مورد تعیین غلظتهایی که برای تعیین خاتمه واکنش، شناساگری وجود ندارد، بسیار ارزشمند است.
تعیین نقطه پایانی
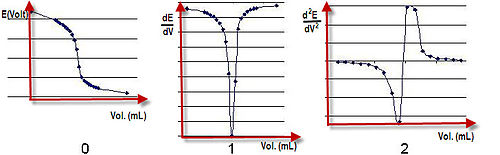
[ویرایش]رسم نمودار تغییرات (E=F(V
[ویرایش]نمودار تغییرات پتانسیل (E) بر حسب حجم تیترکننده رسم میشود. نقطه عطف نمودار نقطه پایانی را نشان میدهد. البته در این روش نقطه همارزی فقط در مورد واکنشهای متقارن مانند تیتر کردن یون Fe+2 با یون Ce+2 که تعداد الکترونهای مبادله شده در دو نیم واکنش مساوی است یا واکنش بین اسیدها و بازهای هم ظرفیت بر نقطه پایانی منطیق است.
رسم نمودار تغییرات (dE/dV = F(V
[ویرایش]در نمودار تغییرات به جای E مشتق اول ان یعنی dE/dV نسبت به حجم واکنشگر اضافه شده رسم میشود. نقطه Max منحنی نقطه پایانی را نشان میدهد.
رسم نمودار تغییرات (d2E/dV2 = F(V
[ویرایش]در این روش نمودار تغییرات مشتق دوم E یعنی d2E/dV2 نسبت به حجم استاندار اضافه شده رسم میشود و نقطه پایانی، محل تلاقی مماس بر دو قسمت نمودار با محور حجم است. مزیت روشهای مشتق گیری جهت تعیین نقطه همارزی کاربرد آنها برای واکنشهای متقارن و نامتقارن است.
