میکروسکوپ ایمونوالکترونی
مقدمه[ویرایش]
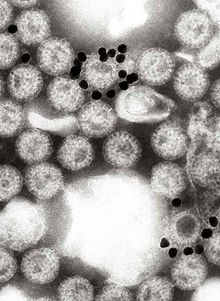
میکروسکوپ ایمونوالکترونی معادل ایمونوفلورسانس است که از میکروسکوپ الکترونی به جای میکروسکوپ نوری استفاده می کند[۱]. میکروسکوپ ایمونوالکترونی با کمک اتصال به یک آنتی بادی خاص، یک مولکول مورد نظر، به ویژه یک پروتئین مورد نظر را شناسایی می کند. این پیوند می تواند قبل یا بعد از جاسازی سلول ها ایجاد شود. واکنشی بین آنتی ژن و آنتی بادی رخ می دهد که باعث می شود این برچسب در زیر میکروسکوپ قابل مشاهده باشد. اگر آنتی ژن روی سطح سلول باشد، میکروسکوپ الکترونی روبشی یک گزینه مناسب است، اما اگر آنتی ژن در داخل سلول باشد، ممکن است میکروسکوپ الکترونی عبوری برای دیدن برچسب مورد نیاز باشد.[۲]
فرایند[ویرایش]
آنتی ژن ها و آنتی بادی های مربوط به آنها (معمولاً هر دو) با هم تعامل دارند. سپس میکروسکوپ الکترونی، عبوری آنتی بادی و در نتیجه پروتئین را تشخیص می دهد. آنتی بادی دوم معمولاً به طلا متصل است زیرا طلا دارای عدد اتمی بالایی است که آن را بسیار متراکم می کند. ذرات طلای کلوئیدی با کونژوگه شدن پادتن ها قابل مشاهده میشوند، زیرا قطر دقیق آنها مشخص است. وقتی الکترون ها از میکروسکوپ عبور می کنند، به این ذره طلا برخورد می کنند. اتم طلای متراکم، نشان دهنده الکترونهایی است که از میکروسکوپ الکترونی ساطع می شوند و باعث ظهور ذره هدف در نمونه می شوند.[۳]
فرآیند احتمالی دیگر، شامل پروتئین A است که از یک باکتری به دست می آید. کاملا اتم طلا را می پوشاند و به ناحیه ثابت آنتی بادی ها متصل می شود. این فرآیند از پروتئین A به عنوان جایگزینی برای ثانویه استفاده می کند و در نتیجه فقط به یک آنتی بادی نیاز دارد. پروتئین A باعث می شود که پروتئین مورد نظر قابل مشاهده باشد. بنابراین، کل فرآیند منجر به محلی سازی و تجسم پروتئین هدف می شود.
در حین استفاده از میکروسکوپ ایمونوالکترونی، نمونه میتواند در بخشهای نازک باشد تا الکترونها بتوانند در آن نفوذ کنند یا به صورت منفی رنگآمیزی شوند. رنگآمیزی منفی وضوح بالاتری دارد اما فقط میتواند مولکولهایی را شناسایی کند که اگر به صورت تکی باشند قابل تشخیص هستند. هنگامی که در میکروسکوپ اایمونوالکترونی استفاده می شود، رنگ آمیزی منفی یک ذره کوچک را در نمونه میکارد و ساختارهای درون آن را بهتر حل می کند. مزیت میکروسکوپ ایمونوالکترونی این است که امکان تشخیص ذرات بدون توجه به زمینه را فراهم می کند.[۴]
نتایج و عوارض[ویرایش]
نتایج[ویرایش]
نتایج حاصل از میکروسکوپ ایمونوالکترونی معمولاً به صورت بصری اندازهگیری میشوند. نمونه باید ویژگی های خاصی داشته باشد تا تجزیه و تحلیل کمی موثر باشد و تعداد دفعات استفاده از آن را محدود کند. در طی آزمایشهای موفق، میکروسکوپ ایمونوالکترونی میتواند پروتئینها را دقیقاً تعیین کند و درک رابطه بین ساختار و عملکرد را تقویت کند. این فرآیندها در برچسبگذاری و محلیسازی به محققان کمک میکنند تا بتوانند مسیرها و فرآیندهای سلولی مختلف را درک کنند.
عوارض بالقوه[ویرایش]
بخش های زیر میکروسکوپ باید بسیار نازک باشند تا الکترون ها از آن عبور کنند. احتمال دارد بغضی از عوارض در طی مراحل آماده سازی لازم برای ایجاد مقاطع نازک، از جمله تثبیت شیمیایی و جاسازی (معمولاً در پلاستیک) ایجاد شوند. این آمادهسازیهای خشن میتوانند آنتیژنها را دناتوره کنند و پیوند ضروری آنها را با آنتیبادیها قطع کنند. محققان فرآیندهای خاصی را برای دور زدن این مسائل و حفظ تعامل بین آنتی ژن و آنتی بادی ها اختراع و استفاده کرده اند. این روش ها شامل تثبیت نور به جای تثبیت شیمیایی، انجماد نمونه قبل از برش دادن آن، و جوجه کشی آن در دمای اتاق به جای دماهای بالا است[۵].
پیوند بین آنتیبادیها و آنتیژن مرتبط با آنها و یا بین آنتیبادیها و برچسبهای طلایی آنها ممکن است. به دلیل تأثیر غلظتهای پایین یا مانع فضایی در اتصال، تا حدی ایمن شوند. گروههای کنترلی برای محاسبه مقدار برچسبگذاری که به طور طبیعی بدون ویروس رخ میدهد، ضروری هستند.
تاریخچه[ویرایش]
در سال 1931، ارنست روسکا (برنده جایزه نوبل 1986) و ماکس نول اولین میکروسکوپ الکترونی را ساختند. این اختراع منجر به میکروسکوپ الکترونی روبشی و میکروسکوپ الکترونی عبوری شد که بعداً به میکروسکوپ ایمونوالکترونی کمک کرد. در ابتدا، تکنولوژی فقط اجازه تصاویر دو بعدی را می داد، اما اکنون با تکنولوژی مدرن، تصاویر سه بعدی نیز در دسترس هستند.

میکروسکوپ ایمونوالکترونی زمانی به وجود آمد که دو گروه مستقل در دهه 1940، ویروس موزاییک تنباکو و آنتی سرم آن را ترکیب کردند. سپس آن را زیر میکروسکوپ الکترونی بررسی کردند. در این زمان، به دلیل عدم وجود کنتراست اضافی و میکروسکوپ های بی کیفیت، وضوح بسیار ضعیف تر بود. هر دو گروه از محققان دریافتند که این میله ها در یک گروه تقریباً دو برابر اندازه اصلی آنها جمع شده اند. بیش از یک و نیم دهه بعد، محققان شروع به استفاده از آنتی بادی های منفرد متصل به ویروس ها کردند. سرانجام، در سال 1962، آنتی بادی های رنگ آمیزی منفی بیرون آمدند.
کاربرد ها[ویرایش]
ویروس ها[ویرایش]
میکروسکوپ الکترونی عبوری با موفقیت اطلاعات کلی ای در مورد ساختار ارائه می دهد، اما در تلاش است تا قسمت های دقیق تر یک ویروس یا سلول را متمایز کند. میکروسکوپ ایمونوالکترونی به توانایی تشخیص عفونت های ویروسی و مکان یابی آنتی ژن های ویروسی در واکسن ها کمک می کند.
میکروسکوپ ایمونوالکترونی می تواند بیماری ها را تشخیص دهد و عوامل بیماری زا را شناسایی کند. یک مثال توانایی آن در به تصویر کشیدن تخریب میلین در غشای پایه است. این آسیب می تواند با تکانه های عصبی کندتر همراه باشد و در نتیجه طیف وسیعی از مسائل شناختی و فیزیکی ایجاد شود. در این مورد، دانشمندان فیبرهای لنگر ناکافی را در غشای پایه کشف کردند که باعث شکنندهتر شدن پوست میشد. در هر دو مورد، دانشمندان آنتی ژن خاصی را برای هدف قرار دادن به منظور استفاده از میکروسکوپ الکترونی ایمنی برای کشف و کسب اطلاعات بیشتر در مورد این بیماری ها شناسایی کردند.
بیوپسی کلیه[ویرایش]
در ابتدا، بیوپسی های کلیه از میکروسکوپ ایمونوفلورسانس استفاده می کردند که وضوح کمتری نسبت به میکروسکوپ ایمونوالکترونی ارائه می کرد. قبل از تعویض میکروسکوپ نوری با میکروسکوپ الکترونی، نتایج نشان داد که نمونهبرداریهای متعددی نیاز به میکروسکوپ الکترونی اضافی برای اطمینان از تشخیص دقیقتر دارند. استفاده اضافی از میکروسکوپ ایمونوالکترونی هم برای تشخیص اولیه و هم برای تایید یافته های میکروسکوپ نوری رخ داد. دانشمندان تصمیم گرفتند یک مطالعه تحقیقاتی را در مورد اثربخشی هر نوع میکروسکوپ کامل کنند. در بسیاری از موارد تنها با استفاده از میکروسکوپ نوری، پزشکان نمیتوانستند تشخیص اولیه را انجام دهند. حتی تعدادی از آنها تشخیص نادرست داشتند. نوع تشخیص نیز نقش مهمی در آزمایش داشت. میکروسکوپ نوری فلورسانس برخی از تشخیص ها را بدون نیاز به توجه به دقت شناسایی میکرد اما تمایز سایرین بسیار دشوارتر بود و به میکروسکوپ الکترونی نیاز داشتند. حتی در بیمارانی که میکروسکوپ ایمونوفلورسانس نتایج صحیحی را به همراه داشت، محققان هنوز بر این باور بودند که تایید لازم است. نتایج این مطالعه نیاز به تغییر از میکروسکوپ نوری به میکروسکوپ الکترونی برای تشخیص بیوپسی کلیه را نشان داد.[۶]
منابع[ویرایش]
- ↑ "ISBN". Wikipedia (به انگلیسی). 2023-12-18.
- ↑ "Immuno-Electron Microscopy Services at the Core Electron Microscopy Facility". UMass Chan Medical School (به انگلیسی). 2013-11-02. Retrieved 2024-01-09.
- ↑ «Learn: immunoelectron microscopy - The Human Protein Atlas». www.proteinatlas.org. دریافتشده در ۲۰۲۴-۰۱-۰۹.
- ↑ "ISBN". Wikipedia (به انگلیسی). 2023-12-18.
- ↑ Gulati, Neetu M.; Torian, Udana; Gallagher, John R.; Harris, Audray K. (2019-6). "Immunoelectron Microscopy of Viral Antigens". Current Protocols in Microbiology. 53 (1): e86. doi:10.1002/cpmc.86. ISSN 1934-8525. PMC 6588173. PMID 31219685.
{{cite journal}}: Check date values in:|date=(help) - ↑ Haas, M. (1997-01). "A reevaluation of routine electron microscopy in the examination of native renal biopsies". Journal of the American Society of Nephrology (به انگلیسی). 8 (1): 70. doi:10.1681/ASN.V8170. ISSN 1046-6673.
{{cite journal}}: Check date values in:|date=(help)
