ذوب روی
ذوب روی فرایند تبدیل کنسانتره روی (سنگ معدنی حاوی روی) به روی خالص است. ذوب روی از نظر تاریخی دشوارتر از ذوب فلزات دیگر مانند آهن بودهاست، زیرا در مقایسه با آنها، روی نقطه جوش پایینتری دارد. در دماهایی که معمولاً برای ذوب فلزات استفاده میشود، روی به شکل گازی است که با گاز دودکش از کوره خارج میشود و از میان میرود، مگر اینکه اقدامات خاصی برای جلوگیری از آن انجام شود.
متداولترین کنسانتره روی فرآوری شده سولفید روی[۱] اسفالریت با استفاده از روش فلوتاسیون کف به دست میآید. روی ثانویه (بازیافت شده) مانند اکسید روی نیز با سولفید روی پردازش میشود.[۲] تقریباً ۳۰ درصد از کل روی تولید شده از منابع بازیافتی است.[۳]
روشها
[ویرایش]دو روش برای ذوب روی وجود دارد: فرایند پیرومتالورژیکی و فرایند الکترولیز.[۲] هر دو روش هماکنون در صنعت استفاده میشوند و[۲][۴] هر دوی این فرایندها در مرحله اول که (برشته کردن) میباشد مشترک هستند.
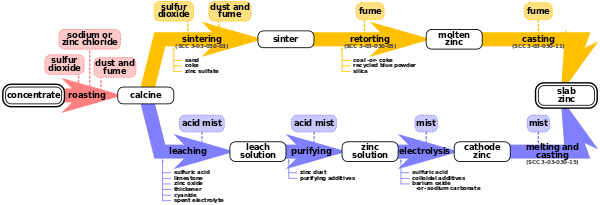
برشته کردن
[ویرایش]برشته کردن فرآیندی است برای اکسید کردن کنسانتره سولفید روی در دمای بالا و تبدیل آن به اکسید روی ناخالص به نام "Zinc Calcine". واکنشهای شیمیایی که انجام میشود به شرح زیر است:
تقریباً ۹۰ درصد روی موجود در کنسانتره در مرحله اکسیداسیون به اکسید روی تبدیل میشود. با این حال، در دمای برشته کردن، حدود ۱۰ درصد روی با ناخالصیهای آهن موجود در کنسانتره سولفید روی واکنش میدهد و فریت روی تشکیل میدهد. یک محصول جانبی این واکنش بوی دیاکسید گوگرد که بیشتر به اسید سولفوریک تبدیل میشود که یک کالای تجاری.[۲] صفحه جریان پالایشگاه پیوست شده در لینک شماتیکی از عملیات برشته کردن روی در شرق کانادا در نوراندا را نشان میدهد[۵]
فرایند برشته کردن بسته به نوع برشته کن مورد استفاده متفاوت است. سه نوع برشته کن وجود دارد: چند اجاقی، تعلیقی و بستر سیال.[۱]
برشته کن چند اجاقی
[ویرایش]در یک برشته کننده چند اجاقی، کنسانتره از طریق یک سری تشکیل شده از ۹ کوره یا بیشتر، که در داخل یک ستون استوانه ای با اندود آجری روی هم قرار گرفتهاند، میریزد. هنگامی که کنسانتره خوراک به داخل کوره ریخته میشود، ابتدا توسط گازهای داغی که از کورهها عبور میکنند، خشک میشود و سپس برای تولید کلسین، اکسید میشود. واکنشها آهسته است و فقط با افزودن سوخت قابل تداوم است. برشته کنهای چندگانه بدون فشار هستند و در حدود ۶۹۰ درجه سلسیوس (۱٬۲۷۰ درجه فارنهایت) فعالیت میکنند. زمان عملیات به ترکیب کنسانتره و میزان حذف گوگرد مورد نیاز بستگی دارد. برشته کنهای چند اجاقی قابلیت تولید کلسین با خلوص بالا را نیز دارند.[۱]
برشته کن تعلیقی
[ویرایش]در یک برشته کن معلق، کنسانترهها در یک محفظه احتراق بسیار شبیه به کوره ذغال سنگ پودر شده دمیده میشوند. برشته کن از یک پوسته فولادی استوانه ای با روکش نسوز ساخته شدهاست که مشابه کورههای چند اجاقی، فضای احتراق بزرگ در بالا و ۲ تا ۴ عدد اجاق در قسمت پایینی دارد. معمولاً برای اطمینان از اینکه انتقال حرارت به مواد به اندازه کافی سریع است تا واکنشهای گوگردزدایی و اکسیداسیون در محفظه کوره اتفاق بیفتد، لازم است تا سنگزنی اضافی، فراتر از آنچه برای یک کوره چند اجاقی لازم است، صورت بگیرد. برشته کنهای تعلیقی بدون فشار هستند و در حدود ۹۸۰ درجه سلسیوس (۱٬۸۰۰ درجه فارنهایت) کار میکنند.[۱]
برشته کن با بستر سیال
[ویرایش]در یک برشته کن با بستر سیال، کنسانترههای سولفید آسیاب شده به حالت تعلیق در میآیند و در بستر مواد اولیه که روی ستون هوا قرار دارد، اکسید میشوند. همانطور که در برشته کن تعلیقی، سرعت واکنش برای گوگردزدایی سریعتر از فرآیندهای چندگانه قدیمی است. برشته کنهای بستر سیال تحت فشار کمی کمتر از فشار اتمسفر و در دمای متوسط ۱٬۰۰۰ درجه سلسیوس (۱٬۸۳۰ درجه فارنهایت) کار میکنند. در فرایند بستر سیال، پس از احتراق به سوخت اضافی نیاز نیست. از مزایای اصلی این برشته کن میتوان به ظرفیت بیشتر، قابلیت حذف گوگرد بیشتر و نگهداری کمتر اشاره کرد.[۱]
فرایند الکترولیز
[ویرایش]فرایند الکترولیز که به نامهای فرایند هیدرومتالورژیکی، فرایند Roast-Leach-Electrowin (RLE) یا فرایند الکترولیتی نیز شناخته میشود، بیشتر از فرآیندهای پیرومتالورژی استفاده میشود.[۲]
فرایند الکترولیز شامل ۴ مرحله است: شستشو، خالص سازی، الکترولیز و ذوب و ریختهگری.
لیچینگ (تصفیه به وسیله شست و شو)
[ویرایش]فرمول اولیه شیمیایی لیچینگ که این فرایند را هدایت میکند:
این امر در عمل از طریق فرآیندی به نام شستشوی مضاعف به دست میآید. کلسین ابتدا در محلول خنثی یا کمی اسیدی (سولفوریک اسید) شسته میشود تا روی از اکسید روی خارج شود. سپس کلسین باقی مانده در اسید سولفوریک قوی شسته میشود تا بقیه روی از اکسید روی و فریت روی خارج شود. نتیجه این فرایند موادی به شکل جامد و مایع است. مایع حاوی روی است و اغلب به آن محصول شستشو میگویند. جامد باقیمانده لیچ نامیده میشود و حاوی فلزات گرانبها (معمولاً سرب و نقره) است که به عنوان محصول جانبی فروخته میشود. همچنین آهن در محصول لیچ که از لیچ اسید قوی تشکیل شد، وجود دارد که در مرحله میانی به شکل گوتیت، ژاروزیت و هماتیت. هنوز هم کادمیوم، مس، آرسنیک، آنتیموان، کبالت، ژرمانیوم، نیکل و تالیم در محصول شستشو وجود دارد؛ بنابراین نیاز به تطهیر و خالص سازی دارد.[۱][۲]
خالص سازی
[ویرایش]فرایند خالص سازی از فرایند سیمان سازی برای خالص سازی بیشتر روی استفاده میکند. از گرد و غبار و بخار روی برای حذف مس، کادمیوم، کبالت و نیکل استفاده میکند که در فرایند الکترولیز اختلال ایجاد میکند. پس از خالص سازی، غلظت این ناخالصیها به کمتر از ۰٫۰۵ میلیگرم در لیتر (۴× 10-7 پوند در هر گالن) محدود میشود. تصفیه معمولاً در مخازن همزن بزرگ انجام میگیرد. این فرایند در دماهای بین ۴۰ تا ۸۵ درجه سلسیوس (۱۰۴ تا ۱۸۵ درجه فارنهایت) و فشارهای مختلف از ۱ اتمسفر تا ۲٫۴ اتمسفر استاندارد (۲۴۰ کیلوپاسکال) (مقیاس مطلق) انجام میگیرد. همچنین محصولات جانبی برای پالایش بیشتر فروخته میشوند.[۱][۲]
محلول سولفات روی باید بسیار خالص باشد تا الکترووینینگ (electrowinning) کاملاً کارآمد باشد. ناخالصیها میتوانند ولتاژ تجزیه را به اندازه ای تغییر دهند که سلول الکترولیز عمدتاً به جای فلز روی، گاز هیدروژن تولید کند.[۶]
الکترولیز
[ویرایش]روی از محلول سولفات روی خالص شده توسط الکترووینینگ استخراج میشود که شکل تخصصی الکترولیز است. این فرایند با عبور جریان الکتریکی از محلول در یک سری سلول کار میکند. این باعث میشود روی بر سطح کاتدها (ورقهای آلومینیومی) رسوب کند و اکسیژن در آندها تشکیل شود. اسید سولفوریک نیز در این فرایند تشکیل شده و در فرایند لیچینگ مورد استفاده مجدد قرار میگیرد. هر ۲۴ تا ۴۸ ساعت، هر سلول خاموش میشود، کاتدهای پوشش داده شده با روی برداشته شده و شسته میشوند و روی به صورت مکانیکی از صفحات آلومینیومی جدا میشود.[۱][۲]
ذوب الکترولیتی روی حاوی چند صد سلول است. بخشی از انرژی الکتریکی به گرما تبدیل میشود که باعث افزایش دمای الکترولیت میشود. سلولهای الکترولیتی در محدوده دمایی ۳۰ تا ۳۵ درجه سلسیوس (۸۶ تا ۹۵ درجه فارنهایت) و در فشار اتمسفر کار میکنند. بخشی از الکترولیت بهطور مداوم در برجهای خنککننده به گردش در میآید تا الکترولیت را از طریق تبخیر آب خنک و متمرکز کند. سپس الکترولیت خنک شده و غلیظ شده به سلولها بازیافت میشود.[۱] این فرایند تقریباً یک سوم کل انرژی مصرفی در هنگام ذوب روی را به خود اختصاص میدهد.[۲]
دو فرایند متداول برای الکترووینینگ فلز وجود دارد: فرایند چگالی جریان پایین و فرایند چگالی جریان بالا Tainton. اولی از محلول اسید سولفوریک ۱۰ درصد به عنوان الکترولیت با چگالی جریان ۲۷۰–۳۲۵ آمپر بر متر مربع استفاده میکند. دومی از محلول اسید سولفوریک ۲۲ تا ۲۸ درصد به عنوان الکترولیت با چگالی جریان حدود ۱۰۰۰ آمپر بر متر مربع استفاده میکند. دومی خلوص بهتری میدهد و ظرفیت تولید بالاتری در هر حجم الکترولیت دارد، اما این عیب را دارد که داغ تر میشود و برای ظرفی که در آن انجام میشود خورنده تر است. در هر یک از فرآیندهای الکترولیتی، برای تولید هر تن مربع روی حدود ۳٬۹۰۰ کیلووات-ساعت (۱۴ گیگاژول) توان الکتریکی مصرف میشود.[۶]
ذوب و ریختهگری
[ویرایش]بسته به نوع محصولات نهایی تولید شده، کاتدهای روی که از کارخانه الکترووینینگ بیرون میآیند میتوانند یک مرحله تبدیل اضافی را در ریختهگری انجام دهند. کاتدهای روی در کورههای القایی ذوب میشوند و به محصولات قابل فروش مانند شمش تبدیل میشوند. سایر فلزات و اجزای آلیاژی ممکن است برای تولید آلیاژهای حاوی روی که در ریختهگری قالبی یا کاربردهای گالوانیزه عمومی استفاده میشوند، اضافه شوند. در نهایت، روی مذاب ممکن است با استفاده از ظروف عایق شده با طراحی خاص به کارخانههای تبدیل نزدیک یا اشخاص ثالث منتقل شود.
فرآیندهای پیرومتالورژیکی
[ویرایش]همچنین چندین فرایند پیرومتالورژیکی وجود دارد که اکسید روی را با استفاده از کربن کاهش میدهد، سپس روی فلزی را از مخلوط حاصل در فضایی از مونوکسید کربن تقطیر میکند. نقص عمده هر یک از فرآیندهای پیرومتالورژی این است که تنها ۹۸٪ خالص است. یک ترکیب استاندارد ۱٫۳٪ سرب، ۰٫۲٪ کادمیوم، ۰٫۰۳٪ آهن، و ۹۸٫۵٪ روی است.[۷] این ممکن است برای گالوانیزه کردن به اندازه کافی خالص باشد، اما برای آلیاژهای ریختهگری که نیاز به روی با عیار بالا (۹۹٫۹۹۵٪ خالص) دارد، کافی نیست.[۷] برای رسیدن به این خلوص، روی باید تصفیه شود
چهار نوع فرایند پیرومتالورژیکی تجاری عبارت اند از: فرایند شرکت معدنی سنت جوزف (الکتروترمیک)، فرایند کوره بلند، فرایند مستمر قائمآهنگ نیوجرسی روی، و فرایند توده افقی نوع بلژیکی.
فرایند شرکت معدنی سنت جوزف (الکتروترمیک).
[ویرایش]این فرایند توسط شرکت معدنی سنت جوزف در سال ۱۹۳۰ توسعه یافت و تنها فرایند پیرومتالورژیکی است که هنوز در ایالات متحده برای ذوب روی استفاده میشود. مزیت این سیستم این است که میتواند طیف گستردهای از مواد حاوی روی از جمله گرد و غبار کوره قوس الکتریکی را ذوب کند.[۱] عیب این فرایند این است که کارایی کمتری نسبت به فرایند الکترولیز دارد.[۲]
این فرایند با عملیات تف جوشی پایین جریان آغاز میشود. زینتر که مخلوطی از کلسین روستر و کلسین EAF (کوره قوس الکتریکی) است، بر روی یک نوار نقاله از نوع دروازه بارگذاری میشود و سپس گازهای احتراق از طریق زینتر پمپ میشود. کربن موجود در گازهای احتراق با برخی ناخالصیها مانند سرب، کادمیوم و هالیدها واکنش نشان میدهد. این ناخالصیها به کیسههای فیلتراسیون منتقل میشوند. زینتر پس از این فرایند که زینتر محصول نامیده میشود، معمولاً دارای ترکیبی از ۴۸٪ روی، ۸٪ آهن، ۵٪ آلومینیوم، ۴٪ سیلیکون، ۲٫۵٪ کلسیم و مقادیر کمتری منیزیم، سرب و سایر فلزات است. سپس محصول زینتر با کک در یک کوره برقی شارژ میشود. یک جفت الکترود گرافیتی از بالا و پایین کوره جریانی را در مخلوط ایجاد میکند. کک مقاومت الکتریکی را برای مخلوط ایجاد میکند تا مخلوط را تا ۱٬۴۰۰ درجه سلسیوس (۲٬۵۵۰ درجه فارنهایت) و مونوکسید کربن تولید میکند. این شرایط اجازه میدهد تا واکنش شیمیایی زیر رخ دهد:
بخار روی و دیاکسید کربن به یک کندانسور خلاء منتقل میشود، جایی که روی با حباب زدن از طریق حمام روی مذاب بازیابی میشود. بیش از ۹۵ درصد از بخار روی که از مخزن خارج میشود به روی مایع متراکم میشود. دیاکسید کربن با کربن احیا میشود و مونوکسید کربن دوباره به کوره توده بازگردانده میشود.[۱]
فرایند کوره بلند (فرایند ذوب سلطنتی)
[ویرایش]این فرایند توسط شرکت ملی ذوب در Avonmouth Docks انگلستان به منظور افزایش تولید، افزایش کارایی و کاهش هزینههای نیروی کار و نگهداری توسعه داده شد. LJ Derham پیشنهاد استفاده از اسپری قطرات مذاب سرب را برای خنک کردن و جذب سریع بخار روی، با وجود غلظت بالای دیاکسید کربن، ارائه کرد. سپس مخلوط سرد میشود، جایی که روی از سرب جدا میشود. اولین کارخانه با استفاده از این طرح در سال ۱۹۵۰ افتتاح شد. یکی از مزایای این فرایند این است که میتواند شمش سرب و تفاله مس را به صورت مشترک تولید کند. در سال ۱۹۹۰، ۱۲ درصد از تولید روی جهان را به خود اختصاص داد.
این فرایند با شارژ زینتر جامد و کک گرم شده در بالای کوره بلند شروع میشود. هوای پیش گرم شده در ۱۹۰ تا ۱٬۰۵۰ درجه سلسیوس (۳۷۰ تا ۱٬۹۲۰ درجه فارنهایت) به پایین کوره دمیده میشود. بخار روی و سولفیدها از قسمت بالایی خارج شده و وارد کندانسور میشوند. سرباره و سرب در انتهای کوره جمع میشوند و مرتباً از آن جدا میشوند. روی از بخار موجود در کندانسور از طریق سرب مایع پاک میشود. روی مایع از سرب در مدار خنککننده جدا میشود. تقریباً ۵٬۰۰۰ تن متری (۵٬۵۰۰ تن کوچک) سرب در هر سال برای این فرایند مورد نیاز است، با این حال این فرایند ۲۵ درصد سرب بیشتری را از سنگ معدنهای شروع کننده نسبت به سایر فرایندها بازیابی میکند.
قاب عمودی پیوسته روی نیوجرسی
[ویرایش]
فرایند روی نیوجرسی[۸] دیگر برای تولید روی اولیه در ایالات متحده، اروپا و ژاپن استفاده نمیشود، با این حال هنوز برای تقویت عملیات ثانویه استفاده میشود. این فرایند در سال ۱۹۶۰ به اوج خود رسید، زمانی که ۵ درصد از تولید روی جهان را به خود اختصاص داد. نسخه اصلاح شده این فرایند هنوز در Huludao چین استفاده میشود که ۶۵۰۰۰ تن در سال تولید میکرد.[۷]
این فرایند با برشته کردن کنسانترههایی که با زغال سنگ مخلوط شده و در دو مرحله بریکت میشوند، آغاز میشود. سپس بریکتها در یک کوکر اتوژن در دمای ۷۰۰ درجه سلسیوس (۱٬۲۹۲ درجه فارنهایت) و سپس به داخل مخزن شارژ میشود. سه دلیل برای بریکت کردن کلسین وجود دارد: اطمینان از حرکت آزادانه شارژ به سمت پایین. برای اجازه دادن به انتقال حرارت در یک مقطع اندازه عملی؛ برای ایجاد تخلخل کافی برای عبور بخار روی کاهش یافته به بالای مخزن. بخار روی کاهش یافته که در بالای مخزن جمعآوری میشود سپس به مایع متراکم میشود.[۷]
Overpelt این طرح را با استفاده از تنها یک محفظه بزرگ تراکم، به جای بسیاری از محفظههای کوچک، همانطور که در ابتدا طراحی شده بود، بهبود بخشید. این محفظه اجازه میدهد تا مونوکسید کربن به داخل کورهها برای گرم کردن مخازن بازگردانده شود.[۷]
این فرایند به شرکت ذوب امپریال (ISC)، مستقر در آوونموث، انگلستان، که یک کارخانه بزرگ قفل عمودی (VR) را برای سالها در حال تولید بود، دریافت کرد. تا اواسط دهه ۱۹۷۰ مورد استفاده قرار گرفت تا زمانی که کارخانه کوره ذوب سلطنتی (ISF) این شرکت جایگزین آن شد. کارخانه VR در سال ۱۹۷۵ تخریب شد.
فرایند پاسخگویی افقی از نوع بلژیکی
[ویرایش]این فرایند اصلیترین فرآیندی بود که از اواسط قرن نوزدهم تا سال ۱۹۵۱ در بریتانیا مورد استفاده قرار گرفت.[۷][۹] این فرایند بسیار ناکارآمد بود زیرا به عنوان یک عملیات دسته ای در مقیاس کوچک طراحی شده بود. در هر بار انجام فرایند پاسخگویی تنها ۴۰ کیلوگرم (۸۸ پوند) تولید میشود؛ بنابراین شرکتها آنها را در انبارها قرار میدهند و از یک مشعل گازی بزرگ برای گرم کردن همه آنها استفاده میکنند.[۹] فرایند بلژیکی نیازمند تقطیر مجدد برای حذف ناخالصیهای سرب، کادمیوم، آهن، مس و آرسنیک است.[۶]
تاریخ
[ویرایش]به نظر میرسد اولین تولید روی در هند از قرن ۱۲ و بعداً در چین از قرن ۱۶ انجام صورت گرفتهاست.[۱۰] در هند، روی از قرن ۱۲ تا ۱۸ در زوار تولید میشد، اگرچه برخی از مصنوعات روی به نظر میرسد در دوران باستان کلاسیک در اروپا ساخته شده باشند.[۱۱] سنگ معدن اسفالریت یافت شده در اینجا احتمالاً از طریق بو دادن به اکسید روی تبدیل شدهاست، اگرچه هیچ مدرک باستانشناسی در این مورد یافت نشدهاست. گمان میرود که ذوب در مخازن سفالی استوانه ای مهر و موم شدهای انجام شدهاست که با مخلوطی از سنگ معدن بو داده، دولومیت و مواد آلی، شاید سرگین گاو، بستهبندی شده و سپس به صورت عمودی در یک کوره قرار داده شده و تا حدود ۱۱۰۰ گرم شدهاست. درجه سانتی گراد مونوکسید کربن تولید شده توسط زغالکردن مواد آلی، اکسید روی را به بخار روی کاهش میدهد، که سپس در یک کندانسور رسی مخروطی در انتهای مخزن مایع میشود و در ظرف جمعآوری میچکد. در طول دوره ۱۴۰۰–۱۸۰۰، تولید حدود ۲۰۰ کیلوگرم در روز تخمین زده میشود.[۱۲] روی نیز از اواسط قرن شانزدهم در چین ذوب شد.[۱۳]
تولید روی در مقیاس بزرگ در اروپا با شروع ویلیام قهرمان، که فرایند تقطیر روی را در ۱۷۳۸ اختراع کرد.[۱۴] در فرایند Champion، سنگ معدن روی (در این مورد، کربنات، ZnCO 3) در دیگهای احیای بزرگ با زغال چوب بسته شد و در کوره حرارت داده شد. سپس بخار روی از طریق یک لوله متراکم آهنی فرود میآمد تا به یک ظرف پر از آب در پایین برسد.[۱۵] چمپیون اولین آثار روی خود را در بریستول، انگلستان راه اندازی کرد، اما به زودی به Warmley گسترش یافت و تا سال ۱۷۵۴ چهار کوره روی را در آنجا ساخت.[۱۶] اگرچه چمپیون موفق به تولید حدود ۲۰۰ تن روی شد،[۱۶] برنامههای تجاری او موفقیتآمیز نبود و در سال ۱۷۶۹ ورشکست شد.[۱۵] با این حال، ذوب روی در این منطقه تا سال ۱۸۸۰ ادامه یافت.[۱۶]
| سال | افقی {{سخ}} پاسخ دادن |
عمودی {{سخ}} پاسخ دادن |
الکتروترمیک | انفجار {{سخ}} کوره |
الکترولیتی |
|---|---|---|---|---|---|
| <۱۹۱۶ | > ۹۰ | ||||
| ۱۹۲۹ | ۲۸ | ||||
| ۱۹۳۷ | ج ۳۳ | ||||
| ۱۹۶۰ | ۳۴٫۵ | ۱۱ | ۷٫۵ | ۲ | ۴۵ |
| ۱۹۷۰ | ۱۵ | ۱۰ | ۶٫۵ | ۱۲٫۵ | ۵۶ |
| ۱۹۸۰ | ۳ | ۷ | ۶ | ۱۰ | ۷۴ |
تولید اولیه روی اروپایی نیز در سیلسیا، در کارنتیا، و در لیژ، بلژیک انجام شد. در فرایند کارینت، که در کارهایی که در سال ۱۷۹۸ توسط Bergrath Dillinger تأسیس شد، استفاده شد، یک کوره با سوخت چوب، تعداد زیادی قاب عمودی کوچک را گرم کرد،[۱۹] و سپس بخار روی از طریق یک لوله سرامیکی به یک محفظه تراکم معمولی در زیر ریخت. این فرایند در سال ۱۸۴۰ از کار افتاد. فرآیندهای بلژیکی و سیلزیایی هر دو از پاسخگوییهای افقی استفاده میکردند.[۲۰] در سیلزی، یوهان روهبرگ در سال ۱۷۹۹ کورهای برای تقطیر روی ساخت، در ابتدا از گلدانها استفاده کرد، اما بعداً به لولههایی با ته صاف به نام «مافل» تغییر داد، که به لولههای افقی خم شده به سمت پایین متصل میشد که در آن روی متراکم میشد. روند سیلزی در نهایت با فرایند بلژیک ادغام شد. این فرایند که توسط ژان ژاک دانیل دونی توسعه یافت، در سالهای ۱۸۰۵ تا ۱۸۱۰ معرفی شد و از قفسههایی با مقطع استوانه ای استفاده شد.[۱۹][۲۰] کندانسورها لولههای سفالی افقی بودند که از انتهای مخازن امتداد یافته بودند.[۲۱] فرایند پاسخ افقی ادغام شده «بلگو-سیلزی» بهطور گسترده در ربع سوم قرن نوزدهم در اروپا و بعداً در ایالات متحده پذیرفته شد.[۲۰]
تلاشهای تجربی برای استخراج روی از طریق الکترولیز در قرن نوزدهم آغاز شد، اما تنها کاربرد تجاری موفق قبل از سال ۱۹۱۳، فرآیندی بود که در بریتانیا و اتریش استفاده میشد، جایی که روی و کلر با الکترولیز یک محلول آبی کلرید روی تولید میشدند.[۲۲] شرکت مس آناکوندا، در آناکوندا، مونتانا، و شرکت معدنی و ذوب تلفیقی، در تریل، بریتیش کلمبیا، هر دو کارخانههای الکترولیتی موفقی را در سال ۱۹۱۵ با استفاده از فرایند فعلی سولفات روی ساختند.[۲۳] اهمیت این روش همچنان رو به رشد بوده و در سال ۱۹۷۵ ۶۸ درصد از تولید روی جهان را به خود اختصاص دادهاست.[۲۴]
فرایند توده عمودی پیوسته در سال ۱۹۲۹ توسط شرکت نیوجرسی روی معرفی شد. در این فرایند از یک توده با دیوارههای کاربید سیلیکون، حدود ۹ متر ارتفاع و با مقطع ۲ در ۰٫۳ متر استفاده شد. دیوارههای مخزن تا ۱۳۰۰ درجه سلسیوس گرم شد و بریکتهای متشکل از سنگ معدن روی متخلخل، کک، زغال سنگ و مواد بازیافتی به بالای مخزن وارد شدند. روی گازی از بالای ستون بیرون کشیده شد و پس از طی یک سفر ۲۰ ساعته در داخل مخزن، بریکتهای مصرف شده از پایین خارج شدند.[۲۵] برای متراکم کردن روی گازی، این شرکت ابتدا از یک محفظه آجری ساده با بافلهای کربوراندومی استفاده کرد، اما بازده ضعیفی داشت. در طول دهه ۱۹۴۰ یک کندانسور ساخته شد که بخار روی را بر روی یک اسپری از قطرات روی مایع، که توسط یک پروانه الکتریکی به بالا پرتاب میشد، متراکم میکرد.[۲۶]
فرایند الکتروترمیک که توسط شرکت سرب سنت جوزف توسعه داده شد، تا حدودی مشابه بود.[۲۵][۲۷] اولین کارخانه تجاری با استفاده از این فرایند در سال ۱۹۳۰ در محل فعلی جوزف تاون، پنسیلوانیا ساخته شد. کوره الکتروترمیک یک استوانه فولادی به ارتفاع حدود ۱۵ متر و قطر ۲ متر بود که با آجر نسوز روکش شده بود. مخلوطی از سنگ معدن پخته شده و کک به بالای کوره وارد شد و جریانی بین ۱۰۰۰۰–۲۰۰۰۰ آمپر با اختلاف پتانسیل ۲۴۰ ولت بین الکترودهای کربنی در کوره اعمال شد و دما را به ۱۲۰۰–۱۴۰۰ افزایش داد. درجه سانتی گراد[۲۵][۲۷] یک کندانسور کارآمد برای این فرایند از ۱۹۳۱–۱۹۳۶ ابداع شد. شامل یک حمام روی مایع بود که گازهای خروجی از آن توسط مکش کشیده میشدند. محتوای روی جریان گاز به داخل حمام مایع جذب شد.[۲۶]
فرایند سرباره از سال ۱۹۴۳ در Avonmouth، انگلستان توسط امپریال ذوب شرکت توسعه داده شد، که در سال ۱۹۶۸ بخشی از ریو تینتو روی شد.[۲۸] که از اسپری قطرات سرب مذاب برای متراکم کردن بخار روی استفاده میکند.[۲۹]
جستارهای وابسته
[ویرایش]- فرایند Waelz
منابع
[ویرایش]- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ Compilation of Air Pollutant Emission Factors (PDF), vol. 1, U.S. Environmental Protection Agency, 1995, archived from the original (PDF) on 2010-02-25.
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ Zinc Smelting Process, archived from the original on 2008-04-14, retrieved 2008-04-13.
- ↑ Zinc Casting: A Systems Approach (PDF), Interzinc, 1992, archived from the original (PDF) on 3 March 2016, retrieved 29 November 2021.
- ↑ Our Facilities - Monaca, retrieved 2008-04-13.
- ↑ Noranda's zinc roasting operation illustrated http://www.norandaincomefund.com/pdfs/refinery_flowsheet.pdf
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ Samans, Carl H. (1949), Engineering Metals and their Alloys, New York: MacMillan.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ ۷٫۳ ۷٫۴ ۷٫۵ Porter, Frank (1991), Zinc Handbook: Properties, Processing, and Use in Design, CRC Press, pp. 16–17, ISBN 0-8247-8340-9.
- ↑ U.S. Patent ۲٬۴۵۷٬۵۵۲
- ↑ ۹٫۰ ۹٫۱ Zinc processing, Encyclopædia Britannica Inc., retrieved 2008-04-18.
- ↑ "zinc processing", Encyclopædia Britannica Online, 2009. Accessed on line October 8, 2009.
- ↑ pp. 1–3, Zinc in classical antiquity, P. T. Craddock, pp. 1–6 in 2000 years of zinc and brass, edited by P.T. Craddock, London: British Museum, 1998, rev. ed. , شابک ۰−۸۶۱۵۹−۱۲۴−۰.
- ↑ pp. 35–46, Zinc in India, P. T. Craddock, I. C. Freestone, L. K. Gurjar, A. P. Middleton and L. Willies, pp. 27–72 in Craddock 1998.
- ↑ p. 23, Zinc Sculpture in America: 1850-1950, Carol A. Grissom, Associated University Presses, 2009, شابک ۰−۸۷۴۱۳−۰۳۱-X.
- ↑ pp. 24–26, Grissom 2009.
- ↑ ۱۵٫۰ ۱۵٫۱ pp. 147–148, Brass and zinc in Europe from the Middle Ages until the mid-nineteenth century, Joan Day, pp. 133–158 in Craddock 1998.
- ↑ ۱۶٫۰ ۱۶٫۱ ۱۶٫۲ p. 26, Grissom 2009.
- ↑ pp. 162, 213, 214, Zinc-production technology 1801–1950: a review, J. K. Almond, pp. 159–228 in 2000 years of zinc and brass, edited by P.T. Craddock, London: British Museum, 1998, rev. ed. , شابک ۰−۸۶۱۵۹−۱۲۴−۰.
- ↑ p. 15, Porter 1991.
- ↑ ۱۹٫۰ ۱۹٫۱ pp. 151–152, Day in Craddock 1998.
- ↑ ۲۰٫۰ ۲۰٫۱ ۲۰٫۲ pp. 179–181, Zinc-production technology 1801–1950: a review, J. K. Almond, pp. 159–228 in Craddock 1998.
- ↑ pp. 198–199, Almond in Craddock 1998.
- ↑ pp. 210–213, Almond in Craddock 1998.
- ↑ p. 21, Electrolytic deposition and hydrometallurgy of zinc, Oliver Caldwell Ralston, McGraw-Hill Book Company, Inc. , 1921.
- ↑ p. 214, Almond in Craddock 1998.
- ↑ ۲۵٫۰ ۲۵٫۱ ۲۵٫۲ p. 184, Almond in Craddock 1998.
- ↑ ۲۶٫۰ ۲۶٫۱ pp. 201–202, Almond in Craddock 1998.
- ↑ ۲۷٫۰ ۲۷٫۱ pp. 196–197, Almond in Craddock 1998.
- ↑ "Rio Tinto Co". Grace's Guide. Retrieved 2014-10-27.
- ↑ p. 229, 233, 234, Development of the zinc-lead blast-furnace as a research project, S. W. K. Morgan, pp. 229–241 in Craddock 1998.






