نانوپوسته
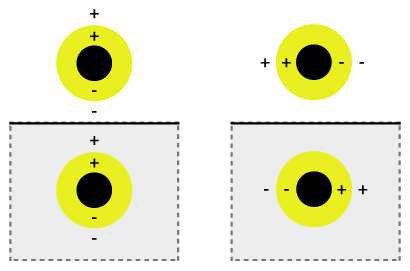
نانوپوسته یا بهتر بگوییم پلاسمون نانوپوسته، نوعی نانوذره های کروی است که از یک هسته دی الکتریک تشکیل شده است که توسط یک پوسته فلزی نازک (معمولاً طلا ) پوشانده شده است. [۱] این نانوپوسته ها شامل شبه ذره ای به نام پلاسمون است که یک تحریک جمعی یا نوسان پلاسمای کوانتومی است که در آن الکترون ها به طور همزمان نسبت به همه یون ها نوسان می کنند.
نوسان همزمان را می توان هیبریداسیون پلاسمون نامید که در آن قابلیت تنظیم نوسان با مخلوطی از پوسته داخلی و خارجی که در آن هیبرید می شوند و انرژی کمتر یا انرژی بالاتری به دست می آورند، مرتبط است. این انرژی کمتر به شدت با نور فرودی جفت می شود، در حالی که انرژی بالاتر یک ضد پیوند است و ضعیفی با نور فرودی ترکیب می شود. برهمکنش هیبریداسیون برای لایه های پوسته نازک تر قوی تر است، از این رو، ضخامت پوسته و شعاع کلی ذرات تعیین می کند که با کدام طول موج نور جفت شود. [۲] نانوپوستهها را میتوان در طیف وسیعی از طیف نوری که نواحی مرئی و نزدیک مادون قرمز(فروسرخ) را در بر میگیرد، تغییر داد. برهمکنش نور و نانوذره ها بر قرارگیری بارها تأثیر می گذارد که بر استحکام جفت تأثیر می گذارد. نور فرودی که به صورت موازی زیرلایه سو داده شده است، یک قطبش s ایجاد می کند (شکل 1b)، بنابراین بار ها از سطح بستر دورتر هستند که تعامل قوی تری بین پوسته و هسته ایجاد می کند. در غیر این صورت، یک قطبش p تشکیل می شود که انرژی پلاسمونی با جابجایی قوی تری ایجاد می کند که باعث برهمکنش و جفت شدن ضعیف تر می شود.
کشف[ویرایش]
کشف این نانوپوسته توسط پروفسور نائومی جی هالاس و تیمش در دانشگاه رایس در سال 2003 انجام شد. زمانی که او و تیمش نانوپوستهها را کشف کردند، در ابتدا مطمئن نبودند که چنین نانوپوستههایی دارای چه پتانسیلی هستند. هالاس به سی.ان.ان گفت"ما گفتیم، برای چه چیزی می تواند خوب باشد؟" . پس از پیشنهادهای فراوان، درمان سرطان از همکاری های مداوم با مهندسان زیستی که به دنبال انواع مختلف کاربردهای زیست پزشکی بودند، بیرون آمد. [۳] هالاس گفت: "یکی از چشم اندازهای ما، تشخیص و درمان سرطان کمتر از یک ویزیت نیست". [۴] در سال 2003 هالاس جایزه بهترین کشف سال 2003 توسط Nanotechnology Now را دریافت کرد . [۴]
تولید[ویرایش]
یکی از جدیدترین روشهای سنتز نانوپوستههای طلا، استفاده از فومهای کامپوزیت میکروفلوئیدی است. این روش پتانسیل جایگزینی روش استاندارد لیتوگرافی سنتز نانوپوسته های پلاسمونیک را دارد. فرآیند تولیدی که در زیر شرح داده شده، آزمایشی بود که توسط سوهانیا دورایسوامی و سیف ا. خان از دپارتمان مهندسی شیمی و بیومولکولی در سنگاپور انجام شد. اگرچه این روش یک آزمایش بود، اما آینده سنتز نانوپوسته ها را نشان می دهد.
مواد مورد نیاز برای تولید نانوپوسته ها به شرح زیر است: تترا اتیل ارتوسیلیکات، هیدروکسید آمونیوم، هیدروکسیل آمین هیدروکلراید، 3-آمینوپروپیل تریس، هیدروژن تتراکلرآئورات (III) تری هیدرات، تتراکیس (هیدروکسی متیل) کلرید فسفونیوم، هیدروکسید سدیم، کربنات پتاسیم، اتانول، آب فوق خالص و ظروف شیشه ای شسته شده در آب آشامیدنی و شستشوی کامل در آب. [۵]
اولین گام در سنتز نانوپوسته ها در این روش، ایجاد دستگاهی برای انجام واکنش در داخل آن است. الگوهای دستگاه میکروسیال با فوتو لیتوگرافی استاندارد با استفاده از مقاوم نوری منفی SU-8 2050 بر روی ویفرهای سیلیکونی ساخته شد. دستگاهها سپس در پلی (دی متیل سیلوکسان) (PDMS) با استفاده از تکنیک لیتوگرافی نرم به طورخلاصه، PDMS بر روی SU-8 قالب گیری شد. در دمای 70 درجه سانتی گراد به مدت 4 ساعت، پوست کنده، برش داده و تمیز می شود. سوراخ های ورودی و خروجی (in. o.d.1/16) در دستگاه سوراخ شد. میکروکانالها بهطور برگشتناپذیر به یک اسلاید شیشهای که از قبل با لایه نازکی از PDMS پوشانده شده بود، پس از یک درمان مختصر پلاسمای هوا 35 ثانیه، متصل شدند. ریزکانال ها دارای مقطع مستطیلی و عرض 300 میکرومتر، عمق 155 میکرومتر و طول 0.45 متر هستند. [۵]
تولید واقعی این نانوذره ها شامل پمپاژ «روغن سیلیکون، مخلوطی از ذرات سیلیکا با دانههای طلا و محلول آبکاری طلا و محلول کاهنده به دستگاه میکروسیال در حالی است که گاز نیتروژن از یک سیلندر تحویل داده میشود». [۵] سپس محلول آبکاری در یک محیط کنترل شده به مدت بیش از 24 ساعت باقی ماند تا پیر شود. پس از فرآیند پیری، مایع از دستگاه میکروسیال جمع آوری شده و در یک سانتریفیوژ قرار می گیرد. مایع به دست آمده دارای یک لایه روغن روی سطح است که محلولی در زیر آن حاوی نانوپوسته ها است.
دلیل انقلابی بودن این روش این است که اندازه و ضخامت نسبی نانوپوسته طلا را می توان با تغییر مدت زمان اجازه انجام واکنش و همچنین غلظت محلول آبکاری کنترل کرد. بدین ترتیب به محققان اجازه میدهد تا ذرات را متناسب با نیازهای خود تنظیم کنند. البته برای درمان اپتیک یا سرطان.
درمان سرطان[ویرایش]
نانوذرات با پوسته طلا، که نانوذرات کروی با هستههای سیلیس و/یا لیپوزوم [۶] و پوستههای طلا هستند، در درمان سرطان و بهبود تصویربرداری زیستی استفاده میشوند. کاوشگرهای ترانوستیک - قادر به تشخیص و درمان سرطان در یک درمان واحد هستند - نانوذراتی هستند که محلهای اتصالی روی پوسته خود دارند که به آنها اجازه میدهد به مکان مورد نظر (معمولاً سلولهای سرطانی) بچسبند و سپس میتوان از طریق تصویربرداری با روش دوگانه (یک استراتژی تصویربرداری) تصویربرداری کرد. که از اشعه ایکس و تصویربرداری رادیونوکلئیدی و از طریق فلورسانس نزدیک مادون قرمز استفاده می کند. [۷] دلیل استفاده از نانوذرات طلا به دلیل خواص نوری واضح آنها است که توسط اندازه، هندسه و پلاسمون های سطح آنها کنترل می شود. نانوذرات طلا (مانند AuNP ها) از مزیت زیست سازگار بودن و انعطاف پذیری داشتن چندین مولکول مختلف و مواد بنیادی متصل به پوسته آنها برخوردار هستند (تقریباً هر چیزی که به طور معمول به طلا متصل شود می تواند به نانو پوسته طلا متصل شود. که می تواند در کمک به شناسایی و درمان سرطان استفاده شود). درمان سرطان تنها به دلیل پراکندگی و جذبی است که برای پلاسمونیک ها اتفاق می افتد. تحت پراکندگی، نانو ذرات با روکش طلا برای فرآیندهای تصویربرداری قابل مشاهده می شوند که به طول موج صحیح تنظیم می شوند که به اندازه و هندسه ذرات بستگی دارد. تحت جذب، فرسایش فتوترمال اتفاق میافتد که نانوذرات و محیط اطراف آنها را تا دمایی گرم میکند که قادر به کشتن سلولهای سرطانی باشد. این با حداقل آسیب به سلول های بدن به دلیل استفاده از "پنجره آب" (محدوده طیفی بین 800 و 1300 نانومتر) انجام می شود. [۱] از آنجایی که بدن انسان بیشتر از آب تشکیل شده است، این امر نور مورد استفاده را در مقابل اثرات ارائه شده بهینه می کند.
این نانوپوستههای طلا با استفاده از فاگوسیتوز به داخل تومورها منتقل میشوند، جایی که فاگوسیتها نانوپوستهها را از طریق غشای سلولی فرو میبرند و یک فاگوزوم داخلی یا ماکروفاژ تشکیل میدهند . پس از این، به داخل سلول منتقل میشود و معمولاً از آنزیمها برای متابولیزه کردن آن و بازگرداندن آن به خارج از سلول استفاده میشود. این نانوپوستهها متابولیزه نمیشوند، بنابراین برای مؤثر بودن آنها فقط باید در داخل سلولهای تومور باشند و از مرگ سلولی ناشی از عکس (همانطور که در بالا توضیح داده شد) برای پایان دادن به سلولهای تومور استفاده میشود. این طرح در شکل 2 نشان داده شده است.
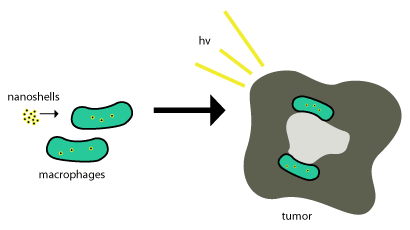
درمانهای مبتنی بر نانوذرات با بهرهبرداری از نفوذپذیری و اثر ماندگاری افزایشیافته، ویژگیای که اجازه میدهد ساختارهای نانومقیاس به طور غیرفعال و بدون کمک آنتیبادیها به تومورها جذب شوند، با موفقیت وارد تومورها شدهاند.[4] تحویل نانوپوسته ها به مناطق مهم تومور می تواند بسیار دشوار باشد. اینجاست که اکثر نانوپوستهها سعی میکنند از جذب طبیعی مونوسیتهای تومور برای تحویل استفاده کنند، همانطور که در شکل بالا مشاهده میشود. این سیستم تحویل "اسب تروا" نامیده می شود. [۸]
این فرآیند بسیار خوب عمل می کند زیرا تومورها حدود ¾ ماکروفاژ هستند و هنگامی که مونوسیت ها به تومور وارد می شوند، به ماکروفاژها تمایز می یابند که برای حفظ نانوذرات محموله نیز نیاز دارند. هنگامی که نانوپوسته ها در مرکز نکروز قرار گرفتند، از نور مادون قرمز نزدیک برای از بین بردن ماکروفاژهای مرتبط با تومور استفاده می شود.
علاوه بر این، این نانوذرات را میتوان برای آزادسازی الیگونوکلئوتیدهای DNA ضد حس در هنگام فعالسازی عکس، ساخت. این الیگونوکلئوتیدها همراه با درمانهای فتوتراپی برای انجام ژندرمانی استفاده میشوند. این امر به این دلیل محقق میشود که مجتمعهای نانوذراتی در داخل سلولها تحویل داده میشوند و سپس تحت آزادسازی نور ناشی از DNA از سطح خود قرار میگیرند. این امکان دستکاری داخلی یک سلول را فراهم می کند و وسیله ای برای نظارت بر بازگشت سلول های گروهی به تعادل فراهم می کند. [۹]
نمونه دیگری از پلاسمونیکهای نانوپوسته در درمان سرطان شامل قرار دادن دارو در داخل نانوذره و استفاده از آن به عنوان وسیلهای برای رساندن داروهای سمی تنها به مکانهای سرطانی است. [۱۰] این امر با پوشش خارجی نانوذره با اکسید آهن انجام می شود (که امکان ردیابی آسان با دستگاه MRI را فراهم می کند )، سپس هنگامی که ناحیه تومور با نانوذرات پر از دارو پوشانده شد، نانوذرات می توانند با استفاده از امواج نور تشدید کننده فعال شوند. دارو را آزاد کنید
همچنین ببینید[ویرایش]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ Loo, C; Lin, A; Hirsch, L; Lee, Mh; Barton, J; Halas, N; West, J; Drezek, R (Feb 2004). "Nanoshell-enabled photonics-based imaging and therapy of cancer". Technology in Cancer Research & Treatment. 3 (1): 33–40. doi:10.1177/153303460400300104. PMID 14750891. Archived from the original (Free full text) on 23 October 2007. Retrieved 6 August 2009. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «loo» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Brinson, Be; Lassiter, Jb; Levin, Cs; Bardhan, R; Mirin, N; Halas, Nj (Nov 2008). "Nanoshells Made Easy: Improving Au Layer Growth on Nanoparticle Surfaces". Langmuir. 24 (24): 14166–14171. doi:10.1021/la802049p. PMC 5922771. PMID 19360963.
- ↑ CNN. "Biography: Naomi Halas." CNN. Cable News Network, 11 Mar. 2008. Web. 7 May 2012. <http://edition.cnn.com/2007/TECH/science/06/11/halas.biog/>.
- ↑ ۴٫۰ ۴٫۱ "Best Discoveries." - Best of Nanotechnology. Nanotechnology Now, 29 Mar. 2008. Web. 7 May 2012. <http://www.nanotech-now.com/2003-Awards/Best-Discoveries-2003.htm>.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ Duraiswamy, Suhanya; Khan, Saif (23 August 2010). "Plasmonic Nanoshell Synthesis in Microfluidic Composite Foams". Nano Letters. 9. 10 (9): 3757–3763. Bibcode:2010NanoL..10.3757D. doi:10.1021/nl102478q. PMID 20731386. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «Duraiswamy» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Abbasi, Akram; Park, Keunhan; Bose, Arijit; Bothun, Geoffrey D. (2017-05-30). "Near-Infrared Responsive Gold–Layersome Nanoshells". Langmuir. 33 (21): 5321–5327. doi:10.1021/acs.langmuir.7b01273. ISSN 0743-7463. PMID 28486807.
- ↑ Bardhan, R; Grady, Nk; Halas, Nj (Sep 2008). "Nanoscale Control of Near-Infrared Fluorescence Enhancement Using Au Nanoshells". Nano Micro Small. 4 (10): 1716–1722. doi:10.1002/smll.200800405. PMID 18819167.
- ↑ Choi, Mr; Stanton-Maxey, Kj; Stanley, Jk; Levin, Cs; Bardhan, R; Akin, D; Badve, S; Sturgis, J; Robinson, Jp (Dec 2007). "A cellular Trojan Horse for delivery of therapeutic nanoparticles into tumors". Nano Letters. 7 (12): 3759–65. Bibcode:2007NanoL...7.3759C. doi:10.1021/nl072209h. PMID 17979310.
- ↑ Bardan, R; Lal, S; Joshi, A; Halas, Nj (May 2011). "Theranostic Nanoshells: From Probe Design to Imaging and Treatment of Cancer". Accounts of Chemical Research. 44 (10): 936–946. doi:10.1021/ar200023x. PMC 3888233. PMID 21612199.
- ↑ https://www.sciencedaily.com/releases/2006/11/061115085736.htm
