کشت سهبعدی سلول با شناوری مغناطیسی

کشت سلولی 3D توسط روش شناوری مغناطیسی (MLM) استفاده از رشد بافتهای 3D با القای سلولهای آغشته به مجموعههای مغناطیسی نانو در فضاهای مختلف مغناطیسی با استفاده از رشتههای مغناطیسی نئودیمیم و ایجاد برهمکنشهای بین سلولی با شناور کردن سلولها در محیط هوا / مایع در یک ظرف پتری استاندارد است. مجموعه نانو ذرات مغناطیسی شامل نانوذرات اکسید آهن، نانوذرات طلا و پلیمرپلیلیسین است. اندازهٔ کشت سلولی 3D، از کشت ۵۰۰ سلول در یک ظرف تا میلیونها سلول در سامانههای که حجم با عملکرد بالا متغیر است.[۱][۲][۳] هنگامی که کشتهای مغناطیسی ایجاد میشوند، میتوان آنها را به عنوان واحدهای ساختمانی یا «جوهر» برای فرایند بیوپرینتینگ سهبعدی مغناطیسی استفاده کرد.
بررسی اجمالی[ویرایش]
کشت سلولی تکلایه بر روی محیط کشت پلاستیکی بهطور قابل توجهی درک ما از زیستشناسی سلولی پایه را بهبود میبخشد، اما معماری پیچیده 3D بافت in vivo را شبیهسازی نمیکند و میتواند خواص سلولی را بهطور قابل توجهی تغییر دهد. این اغلب آزمایشات علمی در علوم پایه را تغییر میدهد و منجر به گمراه شدن نتایج آزمایشات دارویی از نظر کارایی و سمیت میشود و ممکن است سلولهایی تولید کند که ویژگیهای مورد نیاز را برای توسعهٔ درمانهای بازساختی بافت نداشته باشند.[۱][۲][۴][۵][۶][۷][۸][۹]
آینده کشت سلولی برای مطالعات پایهای و کاربردهای زیست_پزشکی در گرو تولید ساختار چند سلولی و سازماندهی در سه بعد است.[۴][۵][۷][۸][۱۰][۱۱][۱۲] بسیاری از طرحهای کشت سه بعدی در حال توسعه هستند یا به بازار عرضه میشوند، مانند راکتور زیستی[۱۳] یا محیط ژل بر پایه پروتئین.[۷][۱۴]
یک سیستم کشت سلولی ۳ بعدی معروف به Bio-Assembler ™ از واکنشگرهای[۱] مبتنی بر پلیمر زیست سازگار برای انتقال نانوذرات مغناطیسی به هر سلول استفاده میکند لذا یک راننده مغناطیسی اعمالشده میتواند سلولها را از انتهای ظرف کشت سلول شناور کند و سلولها را به سرعت در نزدیکی رابط هوا_مایع کنار هم میآورد. این امر، تعاملات سلول-سلولی را در غیاب هر سطح مصنوعی یا ماتریکس شروع میکند. میدانهای مغناطیسی برای ساخت سریع ساختارهای چندسلولی سهبعدی من جمله بیان پروتئینهای ماتریکس خارجسلولی، طراحی میشوند. مورفولوژی، بیان پروتئین، و پاسخ به عوامل اگزوژن در بافت کشت داده شده شباهت زیادی به شرایط داخل بدن نشان میدهد.[۱]
تاریخچه[ویرایش]
کشت سلولی 3D توسط روش شناوری مغناطیسی (MLM) از طریق همکاری بین دانشمندان دانشگاه ریس و مرکز سرطان ام.دی. اندرسون دانشگاه تگزاس مرکز سرطان ام.دی. اندرسون دانشگاه تگزاس در سال ۲۰۰۸ صورت گرفت.[۱] از آن زمان، این فناوری توسط Nano3D Biosciences مجوز گرفته و تجاری شدهاست.[۱۵]
روند شناوری مغناطیسی[ویرایش]

در بالا تصویری است که کشت سلولی 3D را از طریق شناوری مغناطیسی با سیستم کشت سلولی Bio-Assembler نشان میدهد. (A) اجتماعی از نانوذرات اکسید آهن مغناطیسی به نام Nanoshuttle اضافه شده و روی سلولها پراکنده میشود و مخلوط انکوبه میشود. (B) پس از انکوباسیون با Nanoshuttle، سلولها جدا شده و به ظرف پتری منتقل میشوند. (C) یک درایو مغناطیسی سپس روی یک ظرف پتری قرار میگیرد. (D) میدان مغناطیسی باعث میشود که سلولها به سطح تماس هوا_محیط نزدیک شوند. (E) سلولهای اندوتلیالی ورید بند ناف انسانی (HUVEC) به مدت ۶۰ دقیقه (تصویر سمت چپ) و ۴ ساعت (تصاویر راست) (نوار مقیاس، ۵۰ میکرومتر) شناور شدهاند. آغاز برهمکنش سلول-سلول به محض این که سلولها شناور شوند رخ میدهد و ساختارهای 3D تشکیل میشوند. در عرض ۱ ساعت، سلولها هنوز نسبتاً پراکنده هستند، اما در حال حاضر برخی نشانههای کشش را نشان میدهند. شکلگیری ساختارهای 3D بعد از ۴ ساعت شناوری (فلش) قابل مشاهده است.[۱][۲]
بیان پروتئین[ویرایش]
بیان پروتئین در کشتهای شناورشباهتی قابل توجهی به الگوهای in vivo نشان میدهد. بیان N-cadherin در سلولهای شناور گلیوبلاستومای انسانی، همانند بیان مشاهده شده در زنوگرافتهای تومور انسانی رشد کرده در موشهای مبتلا به ضعف ایمنی بودند. در حالی که کشت استاندارد 2D بیان بسیار ضعیف نشان داد که با بیان زنوگرافت مطابقت نداشت، همانطور که در تصویر زیر نشان داده شدهاست.[۱] پروتئین غشایی N-cadherin اغلب به عنوان یک شاخص برای اجتماع بافت in-vivo در کشت 3D استفاده میشود.[۱]
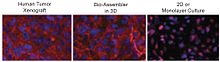
در تصویر بالا، توزیع N-cadherin (قرمز) و هستهها (آبی) در زنوگرافت موشی سرطان مغز انسان (چپ، سلولهای سرطانی مغز انسان رشد کرده در مغز موش) نشان داده شده، سلولهای سرطانی مغز به مدت ۴۸ ساعت توسط شناوری مغناطیسی 3D کشت داده میشوند. (وسط)، و سلولهایکشت داده شده بر روی اسلاید شیشهای لبه را میپوشانند(2D، راست). سیستم دوبعدی N-cadherin را در سیتوپلاسم و هسته نشان میدهد و به طورقابل توجهی در غشا وجود ندارد، در حالیکه در کشت شناور و موش، N-cadherin به وضوح در غشا متمرکز شده و همچنین در سیتوپلاسم و اتصالات سلولی وجود دارد.[۱]
کاربردها[ویرایش]
هم کشتی، دستکاری مغناطیسی و تهاجم[ویرایش]
یکی از چالشهایی که در تولید in vivo مانند کشت یا بافت در ب in vitro وجود دارد، مشکل درهم کشای انواع سلولهای مختلف است. با توجه به توانایی کشت سلولهای 3D توسط شناوری مغناطیسی برای جمعآوری سلولها، هم کشتی سلولهای مختلف ممکن میشود. هم کشتی سلولهای مختلف را میتوان در شروع شناوری، با مخلوط کردن انواع سلولهای مختلف قبل از شناوری یا هدایت مغناطیسی کشتهای 3D در فرایند تهاجم ایجاد کرد.[۱]
توانایی منحصر به فرد برای دستکاری سلولها و شکلدادن به بافت به صورت مغناطیسی، فرصتهای جدیدی را برای کنترل هم کشتی و تهاجم فراهم میکند. هم کشتی در یک معماری بافت واقع بینانه برای مدلسازی دقیق شرایط in vivo، مانند افزایش دقت آزمایشهای سلولی، همانطور که در شکل زیر نشان داده شده، حیاتی است.[۱]

آنچه در تصویر بالا نشان داده شدهاست یک تهاجم از اسفروئیدهای چند سلولی شناور شدهٔ مغناطیسی است.[۱] تصاویر فلورسانس سلولهای گلیوبلاستومای انسانی (GBM)(سبز، سلولهای بیان کننده GFP) و آستروسیتهای طبیعی انسانی(NHA) (قرمز؛ mCherry-برچسب) بهطور جداگانه کشت و سپس به صورت مغناطیسی نزدیک هم هدایت شدهاند (سمت چپ، زمان ۰). تهاجم GBM به کشت NHAin 3D، یک آزمایش قدرتمند جدید برای زیستشناسی سرطان و آزمایش دارو (درست، ۱۲ ساعت تا ۲۵۲ ساعت) را فراهم میکند.[۱][۲]
شبیهسازی عروق با سلولهای بنیادی[ویرایش]
با تسهیل ساخت جمعیتهای مختلف سلولها با استفاده از MLM، قادر به دسیابی به نسلهای پایدار شبهارگانها هستیم که تحت عنوان adiposferes شناخته میشوند و قادر به شبیهسازی تعاملات بین سلولهای پیچیده از بافت چربی سفید اندوژن (WAT) هستند.[۱۶]
همکشتی پره_آدیپوسیتهای 3T3-L1 در 3D با سلولهای bEND.3 اندوتلیالی موش یک شبکهٔ شبه عروقی با توانایی تولید چربی در سلولهای اطراف رگ میسازد.
شکل زیر را ببینید.[۱۶]
علاوه بر خطوط سلولی، ارگانوژنز WAT را میتوان از سلولهای اولیه شبیهسازی کرد.[۱۶]
شکست رگی استرومایی تخلیه شده آدیپوسیتی (SVF) حاوی سلولهای استرومایی چربی (ASC)، سلولهای اندوتلیال و لکوسیتهای نفوذی گرفتهشده از بافت چربی سفید موش (WAT) در محیط سه بعدی کشت داده شدند. این ارگانوئیدها علالخصوص در ساختار سلسله مراتبی با کپسولهای متمایز و ساختارهای رگ مانند بزگ به همراه سلولهای اندوتلیال و همچنین مکانیزم perivascular ASC را نشان میدهد.[۱۶]
در رابطه با القای آدیپوژنزیس از آدیپوسفرهای 3T3-L1 یا آدیپوسفرهای مشتق شده از SVF، سلولها بهطور مؤثر قطرات چربی عظیمی از آدیپوسیتهای سفید را درون in vivo ایجاد کردند، در حالی که تنها قطرات چربی کوچک در 2D قابل ساخت هستند. این سیگنالهای درونسلولی را نشان میدهد که بهتر ارگانژنز WAT را تکرار میکند.[۱۶]
این MLM برای همکشتی سه بعدی آدیپوسفرهای مناسب برای مدلسازی WAT ex vivo را ایجاد میکند و یک پلتفرم جدید برای شناسایی کاربردی فراهم میکند تا مولکولهای فعال شده را در پاسخ به جمعیتهای سلولی چربی مشخص کند. همچنین میتواند برای برنامههای پیوند WAT و سایر روشهای درمان سلولهای مبتنی بر WAT نیز مورد استفاده قرار گیرد.[۱۶]
همکشتی سازمان یافته برای ساخت بافت مشابه in vivo[ویرایش]
با استفاده از MagPen ™ (یک محصول Nano3D Biosciences, Inc.)، هم کشتی سه بعدی سازما نیافته شبیه به معماری بافت اصلی میتواند به سرعت ایجاد شود. سلولهای اندوتلیال (PEC)، سلولهای عضلانی صاف (SMC)، فیبروبلاستها (PF) و سلولهای اپیتلیال (EpiC) که با Bio-Assembler ™ کشت شدهاند میتوانند به ترتیب گرفته و رها شوند تا لایهها شکل بگیرند و برونشیولهایی را که فنوتیپ را حفظ میکنند و ساختمان ماتریکس خارج سلولی را القا میکنند، تشکیل دهند. القاء تشکیل ماتریکس خارج سلولی.[۱۷]


انواع سلولهای کشت شده[ویرایش]
در لیست زیر انواع سلولهایی (خطهای اولیه و سلولی) هستند که با روش القای مغناطیسی به خوبی کشت شدهاند. جدول دوم همان است اما با تصاویر موجود است. تصاویر بیشتر در Nano3D Biosciences, Inc. در دسترس هستند.
| سلولها | خط تلفن | ارگانیسم | بافت ارگانیزم |
|---|---|---|---|
| اندوتلیال موش[۱۶] | خط سلولی | موش | رگ |
| آدیپوسیت موش[۱۶] | خط سلولی | موش | چربی |
| هپاتوم Rattus norvegicus | خط سلولی | موش | کبد |
| فیبروبلاستهای ریه (HPF)[۱۷] | اولیه | انسان | ریه |
| اندوتلیال ریوی (HPMEC)[۱۷] | اولیه | انسان | ریه |
| اپیتلیال مجاری کوچک (HSAEpiC)[۱۷] | اولیه | انسان | ریه |
| اپیتلیال برونش[۱۷] | اولیه | انسان | ریه |
| آدنوکارسینوم آلوئولار انسان[۱۷] | A549 | انسان | ریه |
| آلوئولار تیپ دو[۱۷] | اولیه | انسان | ریه |
| عضله صافی تراشه (HTSMC)[۱۷] | اولیه | انسان | ریه |
| سلولهای بنیادی مزانشیمی (HMSC) | اولیه | انسان | مغز استخوان |
| سلولهای اندوتلیال مغز استخوان (HBMEC) | اولیه | انسان | مغز استخوان |
| سلولهای بنیادی پالپ دندان | اولیه | انسان | |
| سلولهای اندوتلیالی ورید بند ناف انسانی (HUVEC) | اولیه | انسان | |
| کاندروسیتهای موش | اولیه | موش | استخوان |
| بافت چربی موش[۱۶] | اولیه | موش | |
| اندوتلیال دیچه قلب | اولیه | خوک | |
| فیبروبلاستهای پره_آدیپوسیت[۱۶] | 3T3 | موش | |
| سلولهای بنیادی عصبی | C17.2 | موش | مغز |
| سلولهای کلیوی جنینی انسان | HEK293 | انسان | کلیه |
| ملانوما | B16 | موش | پوست |
| آستروسیتها[۱] | NHA | انسان | مغز |
| گلیوبلاستوما[۱] | LN229 | انسان | مغز |
| سلولهای T و سلولهای ارائه دهنده آنتیژن | انسان | ||
| اپیتلیال پستان | MCF10A | انسان | پستان |
| سرطان پستان | MDA231 | انسان | پستان |
| استئوسارکوم | MG63 | انسان | استخوان |
منابع[ویرایش]
- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ ۱٫۱۲ ۱٫۱۳ ۱٫۱۴ Souza, GR و همکاران. فرهنگ سه بعدی کیفی بر اساس سلول مغناطیسی. Nature Nanotechnol.5، 291-296، doi: 10.1038 / nnano.2010.23 (2010).
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ Molina, J. ، Hayashi, Y. ، Stephens, C. & Georgescu, M. -M. سلولهای گلوبوبلاستوم invasive، سلولهای بنیادی را جذب میکنند و سبب افزایش فعال شدن Akt میشوند. Neoplasia12، 453-463 (2010).
- ↑ "بیو مونتاژ در 3 D با سقوط مغناطیسی - نقد و بررسی فناوری." نقد فنی Np, nd وب. 20 آگوست 2012. < http://www.technologyreview.com/view/426363/bio-assembling-in-3-d-with-magnetic-levitation/ >.
- ↑ ۴٫۰ ۴٫۱ Pampaloni, F. , Reynaud, E. G. & Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biol.8, 839-845 (2007).
- ↑ ۵٫۰ ۵٫۱ Cukierman, E. , Pankov, R. , Stevens, D. R. & Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science294, 1708-1712 (2001).
- ↑ Abbott, A. Biology's new dimension. Nature424, 870-872 (2003).
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ Prestwich, G. D. Simplifying the extracellular matrix for 3-D cell culture and tissue engineering: A pragmatic approach. J. Cell. Biochem.101, 1370-1383, doi:10.1002/jcb.21386 (2007).
- ↑ ۸٫۰ ۸٫۱ Boudreau, N. & Weaver, V. Forcing the Third Dimension. Cell125, 429-431 (2006).
- ↑ Griffith, L. G. & Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat. Rev. Mol. Cell Biol.7, 211-224 (2006).
- ↑ Birgersdotter, A. , Sandberg, R. & Ernberg, I. Gene expression perturbation in vitro--a growing case for three-dimensional (3D) culture systems. Semin. Cancer Biol.15, 405- 412 (2005).
- ↑ Yamada, K. M. & Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell130, 601-610 (2007).
- ↑ Atala, A. Engineering tissues, organs and cells. J. Tissue Eng. Regen. Med.1, 83-96 (2007).
- ↑ Bilodeau, K. & Mantovani, D. Bioreactors for Tissue Engineering: Focus on Mechanical Constraints. A Comparative Review. Tissue Eng.12, 2367-2383 (2006).
- ↑ Prestwich, G. D. , Liu, Y. , Yu, B. , Shu, X. Z. & Scott, A. 3-D culture in synthetic extracellular matrices: new tissue models for drug toxicology and cancer drug discovery. Adv. Enzyme Regul. 47, 196-207 (2007).
- ↑ "N3D Biosciences, Inc. " ABOUT US." N3D Biosciences, Inc. " ABOUT US. N.p. , n.d. Web. 20 Aug. 2012. <http://www.n3dbio.com/about/ بایگانیشده در ۱۴ دسامبر ۲۰۱۳ توسط Wayback Machine>.
- ↑ ۱۶٫۰۰ ۱۶٫۰۱ ۱۶٫۰۲ ۱۶٫۰۳ ۱۶٫۰۴ ۱۶٫۰۵ ۱۶٫۰۶ ۱۶٫۰۷ ۱۶٫۰۸ ۱۶٫۰۹ Daquinag, A. C. , Souza, G. R. , Kolonin, M. G. Adipose Tissue Engineering in Three-Dimensional Levitation Tissue Culture System Based on Magnetic Nanoparticles. Tissue Eng. Part C. -Not available-, ahead of print. doi:10.1089/ten.tec.2012.0198 (2012).
- ↑ ۱۷٫۰ ۱۷٫۱ ۱۷٫۲ ۱۷٫۳ ۱۷٫۴ ۱۷٫۵ ۱۷٫۶ ۱۷٫۷ Tseng, H. , Gage, J. A. , Raphael, R. , Moore, R. H. , Killian, T. C. , Grande-Allen, K. J., Souza, G. R. Assembly of a three-dimensional multitype bronchiole co-culture model using magnetic levitation. Tissue Eng. Part C. -Not available-, ahead of print. doi:10.1089/ten.TEC.2012.0157 (2013)
