مواد فراسخت

مواد فوق سخت (superhard materials) موادی با سختی ویکرز بیشتر از 40GPa هستند. این جامدات تراکم ناپذیر، دارای تراکم الکترونی بالا و مقادیر زیاد پیوند کوالانسی هستند و به علت سختی بالای خود در صنایع مختلف ساینده، برش، دیسکترمز و پوششهای محافظ و مقاوم دربرابر سایش بسیار مورد توجه قرار گرفتهاند. الماس سختترین ماده موجود با سختی GPa 70 -150 است که به دلیل هدایت حرارتی بالا و نارسانایی الکتریکی بسیار مورد توجه قرار گرفتهاست ولی محدودیتهایی مثل هزینه بالا و اکسیداسیون در دمای بالای ۸۰۰ درجه سانتی گراد دارد.[۱][۲]علاوه بر این الماس قابلیت انحلال در آهن و تشکیل کاربید آهن در دمای بالا را نیز دارد که موجب ناکارآمدی الماس در برش مواد آهنی مثل فولاد میشود؛ بنابراین تحقیقات اخیر در حوزه مواد فوق سخت برروی ترکیباتی متمرکز شدهاست که از نظر حرارتی و شیمیایی پایدارتر از الماس خالص باشند.[۳] تحقیقات در حوزه تولید مواد فوق سخت جدید بهطور کلی به ۲ نگرش تقسیم میشود: ۱) بررسی پیوندهای کوالانسی کوتاه و جهتدار کربن در الماس با عناصر سبک مانند B,C،O,N. این نگرش در اواخر دهه ۱۹۸۰ با کشف C3N4 و ترکیبات سه تایی B-C-N شهرت یافت. ۲) ترکیب عناصر سبک B,C،O,N با فلزات انتقالی دارای دانسیته الکترئنهای ظرفیت بالا که منجر به تهیه مادهای با تراکم ناپذیری زیاد میشود. در این روش فلزات دارای مدول بالک زیاد و سختی کم با اتمهای دارای کوالانت کوچک همراه میشوند. به عنوان مثال کاربید تنگستن هرچند که ماده فوق سخت محسوب نمیشود ولی یک نمونه صنعتی از این روش است. از طرفی بوریدهای ترکیب شده با فلزات انتقالی به زمینه مهمی در تحقیقات مواد فوق سخت تبدیل شدهاند، که منجر به کشف موادی مثل WB4, ReB2, OsB2 شدهاست. مواد فوق سخت را میتوان به دو گروه کلی ذاتی و غیر ذاتی تقسیم کرد: مواد ذاتی مثل الماس، نیترید بور مکعبی، نیترید کربن و ترکیبات سهگانه B-C-N که سختی ذاتی دارند. (سختی ناشی از ترکیب شیمیایی است) مواد غیرذاتی مثل الماس نانوکریستالین که به عنوان اگریگیت نانومیلههای الماس شناخته میشود. در این دسته از مواد فوق سختی و سایر خواص مکانیکی بیشتر وابسته به ریزساختار است.[۴][۵][۶]
تعریف و مکانیک سختی[ویرایش]
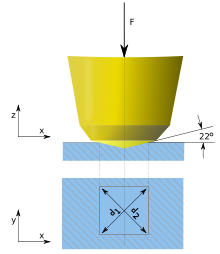

سختی یک ماده با تراکم ناپذیری، الاستیسیته و مقاومت در برابر تغییر شکل رابطه مستقیم دارد. ماده فوق سخت دارای مدول برش و مدول بالک بالا است و تغییر شکل پلاستیم نمیدهد. در حالت ایدهآل، مواد فوق سخت باید دارای شبکه ایزوتروپ بدون نقص باشند که تا حد زیادی مانع از کاهش استحکام در اثر تغییر شکا ساختاری شود. با این حال، نواقص میتوانند موجب تقویت برخی ساختارهای کوالانسی شوند. در روشهای قدیمی سنتز مواد فوقسخت از شرایط دما بالا و فشار بالا (HPHT) استفاده میکردند، اما روشهای جدید مدعی کاهش انرژی مصرفی و در نتیجه کاهش هزینه هستند.[۶][۵] از نظر تاریخی، ابتدا سختی به عنوان توانایی یک ماده برای ایجاد خراش روی ماده دیگر تعریف شد و توسط عدد صحیح و گاه نیمه صحیح بین ۰–۱۰ در مقیاس موهس کمی شد. اما خیلی زود به غیرخطی و ناپیوسته بودن این مقیاس پییرده شد و اندازهگیری سختی مکانیکی مواد با استفاده از نانوایندنتور (معمولاً از جنس الماس) و مقیاسهای ویکرز، برینل، راکول و نوپ توسعه یافت.[۶]در حالی که مقیاس ویکرز به عنوان متداولترین آزمایش اندازهگیری سختی پذیرفته شدهاست، به دلیل وابستگی مقادیر حاصل از این روش به بار اعمالی، در مورد بار وزنی که باید در طول آزمون اعمال شود اختلاف نظرهایی وجود دارد. یک فرورفتگی ایجاد شده در اثر بار ۰٫۵ نیوتونی مقدار سختی بالاتری در مقایسه با فرورفتگی ناشی از ۵۰ نیوتون از خود نشان میدهد. این پدیده به عنوان اثر اندازه فرورفتگی (indentation size effect (ISE شناخته میشود؛ بنابراین مقادیر سختی با گزارش بار معنادار هستند. برخی معتقدند که مقادیر سختی باید با اعمال بار زیاد گزارش شوند چون در این حالت یک نمایش استانداردتر از سختی ماده به دست میآید.[۷] سختی ویکرز چند ماده در جدول زیر ذکر شدهاست:[۸][۹]
| نام ماده | سختی ویکرز (GPa) |
|---|---|
| الماس | ۱۱۵ |
| c-BC2N | ۷۶ |
| Boron | ۵۸ |
| c-BN | ۴۸ |
| OsB4 | ۳۷ |
| B4C | ۳۵ |
| WB4 | ۳۰ |
| AlMgB4 | ۲۶/۷ |
| ReB2 | ۲۰ |
مدول بالک، مدول الاستیسیته و مدول برشی فاکتورهای کلیدی در فرایند طبقهبندی مواد سخت هستند. انعطافناپذیری و تراکمناپذیری یک ماده توسط مدول بالک (B)، که مقاومت یک جامد دربرابر فشردهسازی حجمی تحت فشار هیدرواستاتیک را به عنوان B=-VdP/dV اندازهگیری میکند، کمی میشود. در این رابطه V حجم، P فشار و dP/dV مشتق جزئی فشار به حجم است. آزمون مدول بالک از یک ابزار فرورونده برای ایجاد تغییر شکل دائمی در ماده استفاده میکند. اندازه تغییر شکل ایجاد شده به مقاومت ماده در برابر فشار حجمی ایجاد شده توسط ایندنتور بستگی دارد. عناصر با حجم مولار کوچک و نیروهای بین اتمی قوی معمولاً دارای مدول بالک بالایی هستند. مدول بالک، اولین تست اصلی برای اندازهگیری سختی، به حجم مولار(V) و انرژی همدوسی وابسته است. (B ~ Ec/Vm). در گذشته اعتقاد بر این بود که اندازهگیری مدول بالک، اندازهگیری مستقیم سختی یک ماده است اما امروزه اثری از این تفکر باقی نماندهاست؛ زیرا مشاهده کردند که برخی از فلزات قلیایی و نجیب (Pd, Ag) دارای مدول بالک غیر معمول زیادی نسبت به سختی ویکرز و برینل هستند. در اوایل ۲۰۰۰، رابطه مستقیمی بین مدول بالک و دانسیته الکترونهای ظرفیت یافت شد، به این صورت که هرچه تعداد الکترونها بیشتر باشد، دافعه درون ساختاری نیز بیشتر است. هنوز هم از مدول بالک برای اندازهگیری اولیه سختی مواد فوق سخت استفاده میشود، اما متوجه شدهاند که باید سایر خصوصیات را نیز در نظر گرفت.[۶][۵] برخلاف مدول بالک، مدول برشی با در نظر گرفتن صفحه بلوری و جهت برش، مقاومت در برابر تغییر شکل را در یک حجم ثابت اندازهگیری میکند. مدول برشی G به صورت نسبت تنش برشی به کرنش برشی تعریف میشود: G=F.L/A.dX=stress/strain که F نیرواعمالی، A سطحی که نیرو به آن اعمال میشود، dx جابجایی و L طول اولیه هستند. هرچه مدول برشی بزرگتر باشد، توانایی ماده برای مقاومت در برابر نیروهای برشی بیشتر است؛ بنابراین، مدول برشی یک معیار از سختی است. مدول برشی براساس رابطه زیر به مدول بالک وابسته است: 2B(1-2V)(1+V)=3/G که V نسبت پواسون (برای مواد کوالانت تقریباً برابر ۰/۱ است) است. اگر مادهای شامل پیوندهای جهت دار زیادی باشد، مدول برشی افزایش مییابد و نسبت پواسون کم میشود. اگر مادهای در برابر تغییر فرم پلاستیک مقاومت کند سخت در نظر گرفته میشود. یک ماده با پیوندهای کوالانت کوتاه در مقایسه با مادهای با پیوندهای کوالانت بلند و غیرموضعی (جدا)، تعداد کمتری نابجاییهای اتمی منجر به تغییر فرم پلاستیک دارد. اگر مادهای حاوی تعداد زیادی پیوندهای جدا و غیرموضعی باشد، نرم است.[۵] چقرمگی شکست، خاصیت مکانیکی دیگری است که تا حدودی به سختی مربوط است و نشان دهنده توانایی مقاومت ماده در برابر شکستن در اثر ضربه شدید است. یک ماده فوق سخت الزاماً یک ماده فوق چقرمه نیست. به عنوان مثال، چقرمگی شکست الماس حدود 7–10 MPa·m1/2 است،[۱۰][۱۱]که در مقایسه با سنگهای قیمتی دیگر و مواد سرامیکی زیاد است، اما در مقایسه با بسیاری از فلزات و آلیاژها و فولادهای معمولی و آلیاژهای آلومینیوم که چقرمگی آنها حداقل ۵ مرتبه بزرگتر است، ضعیف است.[۱۲] هنگام ارزیابی ماده به عنوان ماده فوق سخت باید چندین ویژگی در نظر گرفته شود. در حالی که مواد سخت دارای مدول بالک بالا هستند، اما داشتن مدول بالک بالا به معنای سخت بودن ماده نیست و خصوصیات غیرالاستیک نیز باید در نظر گرفته شود و حتی ممکن است که مدول برشی ارتباط بهتری با سختی در مقایسه با مدول بالک داشته باشد. مواد کوالانسی عموماً پیوند خمشی و مدول برشی بالایی دارند که موجب ساختار فوق سخت آنها در مقایسه با جامدات یونی میشود.
الماس[ویرایش]
الماس یک آلوتروپ کربن با ساختار اصلاح شده مکعب مرکز وجوه پر(fcc) است که به نام «مکعب الماس» شناخته میشود. الماس به سختی، انعطافناپذیری و تراکم ناپذیری شهرت دارد. الماس سنتزی به دلیل ویژگیهای ذاتی الماس یا کربونادو از اهمیت ویژهای در تحقیقات و صنعت و کاربردهای نوری و الکتریکی برخوردار است.

الماس سنتز شده[ویرایش]
سنتز فشار بالا الماس در سال ۱۹۵۳ در سوئد[۱۳][۱۴]و در سال ۱۹۵۴ در ایالات متحده،[۱۵]با توسعه دستگاهها و تکنیکهای جدید منجر به نقطه عطفی در سنتز مواد فوقسخت مصنوعی یا سنتزی شد. سنتز الماس، پتانسیل این ماده در کاربردهای فشار بالای صنعتی را نشان داد و باعث افزایش علاقه به این زمینه شد. چهار سال پس از اولین سنتز الماس مصنوعی، نیترید بور مکعبی c-BN، دومین ماده جامد سخت، سنتز شد.[۱۶] الماس مصنوعی به دو صورت: ۱)تک کریستال منفرد و پیوسته ۲) پلی کریستالهای کوچکی که از طریق مرزدانه به هم متصل شدهاند وجود دارد. تفکیک ذاتی سه بعدی این زیرواحدها به دلیل خاصیت جذب و پراکندگی نور، منجر به تشکیل دانههای قابل مشاهده با چشم غیر مسلح میشود. سختی الماس مصنوعی (70–150 GPa) به خلوص نسبی بلور بسیار وابسته است. هرچه ساختار بلوری کاملتر باشد، الماس سختتر خواهد بود. تحقیقات و گزارشهای مختلف نشان میدهند که تک بلورهای HPHT و اگریگیتهای نانوبلوری الماس (نانومیلههای الماس جمع شده) میتوانند سختتر از الماس طبیعی باشند.[۱۷] در گذشته، به دلیل اینکه الماس بیشتر در کاربردهای زینتی مورد استفاده قرار میگرفت و کوچکترین نقصی در ساختار با چشم غیرمسلح نیز قابل مشاهده بود، تصور بر این بود که الماس مصنوعی باید از نظر ساختاری کامل باشد تا مفید واقع شود. اگرچه این تا حدی درست است، اما خواص ایجاد شده به دلیل این تغییرات کوچک، منجر به کاربردهای جالب توجه جدید الماس مصنوعی شدهاست. به عنوان مثال، دوپ کردن نیتروژن میتواند مقاومت مکانیکی الماس را افزایش دهد،[۱۸] و دوپ کردن بور (در حد چند درصد اتمی) آن را به یک ابررسانا تبدیل میکند.[۱۹] در سال ۲۰۱۴، محققان سنتز الماس نانو دوقلو با مقادیر سختی ویکرز تا 200 GPa را گزارش دادند.[۲۰] محققان این سختی بیسابقه را به اثر Hall-Petch نسبت دادند، یعنی ریزساختار ریزتر منجر به افزایش دانسیته مرزدانه که عامل متوقف کننده نابجایی است شده و در نتیجه سختی افزایش یافته بود. آنها با استفاده از نانوذرات کربن به عنوان پیش سازنده تحت دما و فشار بالا به دوقلویی با ضخامت متوسط ۵ نانومتر و به دمای اکسیداسیون ۲۰۰ درجه سانتیگراد بالاتر از الماس طبیعی دست یافتند. پایداری حرارتی بالاتر به دست آمده در کاربردهای صنعتی مانند ابزارهای برش یعنی جایی که دمای بالا میتواند منجر به تخریب سریع الماس شود بسیار حائز اهمیت است.
نیترید بور مکعبی[ویرایش]
تاریخچه

نیترید بور مکعبی یا c-BN اولین بار در سال ۱۹۵۷ توسط رابرت اچ. ونتورف در جنرال الکتریک، اندکی پس از سنتز الماس، سنتز شد.[۱۶]فرایند کلی برای سنتز c-BN شامل انحلال نیترید بور هگزاگونال (h-BN) در یک کاتالیزور حلال، معمولاً فلزات قلیایی یا قلیایی خاکی یا نیتریدهای آنها، و به دنبال آن جوانه زنی خود به خودی c-BN تحت شرایط فشار بالا، دما بالا (HPHT) است.[۶]تولید c-BN در مقایسه با سنتز الماس به دلیل گامهای میانی پیچیدهتر کمتر و کندتر است. به دلیل عدم انحلال در آهن و سایر آلیاژهای فلزی برای برخی از کاربردهای صنعتی مفیدتر از الماس است.[۲۱]نیترید بور مکعبی خالص شفاف یا کمی کهربا است و میتوان رنگهای مختلفی را بسته به نقایص یا مقدار اضافی بور (کمتر از ۱ درصد) تولید کرد.[۶] نقایص را میتوان با دوپ کردن کاتالیستهای حلال (لیتیم، کلسیم یا منیزیم نیترید) با Al, B, Ti, Si ایجاد کرد؛ که تغییر در مورفولوژی و رنگ کریستالهای C-BN ایجاد میکند.[۲۲] و نتیجه آن بلورهای تیره و بزرگتر (۵۰۰ میکرومتر) با اشکال بهتر و عملکرد بالاتر است.
ساختار و ویژگیها[ویرایش]
نیترید بور مکعبی دارای ساختار بلوری اسفالریت است، که با جایگزینی هر دو اتم کربن در الماس با یک اتم بور و یک اتم نیتروژن ساخته میشود. پیوند کوتاه (آنگستروم B-N (1.57 نزدیک به طول پیوند C-C الماس (آنگستروم ۱٫۵۴) است، که منجر به پیوند کووالانسی قوی بین اتمها به همان شیوه الماس میشود. کاهش جزئی در میزان کوالانسی پیوندهای B-N در مقایسه با باندهای C-C موجب کاهش سختی از 100 GPa برای الماس به 48 GPa برای c-BN میشود. همانطور که الماس پایدارتر از گرافیت است، c-BN پایدارتر از h-BN است، اما نرخ تبدیل آنها در دمای اتاق ناچیز است.[۲۱]نیترید بور مکعبی در آهن، نیکل و آلیاژهای دیگر در دمای بالا نامحلول است، اما به دلیل تشکیل لایههای میانی نیتریدی و بوریدی فلزی، به خوبی به فلزات متصل میشود. این ماده همچنین در اکثر اسیدها نامحلول است، اما در نمکهای مذاب قلیایی و نیتریدها مانند LiOH , KOH , NaOH / Na2CO3، NaNO3 که برای اچ کردن c-BN استفاده میشوند، حل میشود.[۲۳] c-BN به دلیل ثبات در برابر گرما و فلزات، در کاربردهای مکانیکی از الماس پیشی گرفتهاست. هدایت حرارتی BN در میان بالاترین عایقهای الکتریکی است. علاوه بر این، c-BN فقط از عناصر سبک تشکیل شده و قدرت جذب اشعه ایکس کمی دارد، که میتواند زمینه جذب اشعه X را کاهش دهد.[۲۴]
تحقیق و توسعه
c-BN به دلیل مقاومت شیمیایی و مکانیکی بسیار زیاد، کاربرد گستردهای به عنوان ساینده دارد، مانند ابزارهای برش و سطوح مقاوم در برابر خراش. نیترید بور مکعبی جذب اشعه X بسیار کمی دارد. این ویژگی، همراه با استحکام بالا، داشتن پوششهای بسیار نازک از c-BN بر روی سازههایی که با استفاده از اشعه X مورد بازرسی قرار میگیرند را امکانپذیر میکند. هر ساله چند صد تن c-BN در سراسر جهان تولید میشود.[۲۵] Borazon، یک نام تجاری c-BN در ایالات متحده، در کاربردهای صنعتی در ابزارهای شکلدهی استفاده میشود، زیرا میتواند دمای بالاتر از ۲۰۰۰ درجه سانتیگراد را تحمل کند. چرخهای ساینده با روکش نیترید بور مکعبی، که به آنها چرخ Borazon گفته میشود، بهطور معمول در ماشینکاری فلزات سخت آهنی، چدنها و فوق آلیاژهای پایه نیکل و پایه کبالت استفاده میشود. نامهای تجاری دیگری مانند Elbor و Cubonite توسط فروشندگان روسی به بازار عرضه میشوند.[۲۱] رویکرد جدید در تحقیقات بر بهبود توانایی فشار c-BN در دستگاههای مورد استفاده برای سنتز c-BN متمرکز است.[۶]در حال حاضر، توانایی تولید c-BN به فشارهای حدود 6 GPa محدود شدهاست. افزایش حد فشار باعث سنتز تک بلورهای بزرگتر از سنتز کاتالیزوری موجود میشود. با این حال، استفاده از حلالها در شرایط فوق بحرانی برای سنتز c-BN موجب کاهش فشار مورد نیاز شدهاست.[۶]هزینه بالای c-BN هنوز کاربرد آن را محدود میکند، که انگیزه جستجو برای سایر مواد فوق سخت است.
نیترید کربن[ویرایش]
ساختار نیترید کربن بتا (β-C3N4) برای اولین بار توسط امی لیو و ماروین کوهن در سال ۱۹۸۹ ارائه شد. این ساختار با Si3N4 هم ساختار و سختتر از الماس میباشد.[۲۶] طول پیوند در این ساختار ۱٫۴۷ آنگستروم است که ۵ درصد کوچکتر از طول پیوند c-c ساختار الماس است. مدول برشی نیترید کربن ۶۰ درصد الماس است و نسبت به c-BN از سختی کمتری برخوردار است. با وجود دو دهه تلاش برای این ترکیب، هیچ نمونه سنتزی C3N4 سختی پیشبینی شده را تأیید نکردهاست که این امر به سختی سنتز و بیثباتی C3N4 نسبت داده شدهاست. نیترید کربن فقط در فشار بالاتر از فشار تحول گرافیت به الماس پایدار است در نتیجه شرایط سنتز نیاز به فشارهای بسیار زیاد دارد زیرا کربن چهار بار منفی دارد و چهار پیوند میتواند ایجاد کند ولی در این ساختار عدد همسایگی شش دارد.[۶]به علاوه C3N4 اگر در ماشینکاری فلزات آهنی استفاده شود، خطر ایجاد کاربید را به همراه دارد. اگرچه نشریات تهیه C3N4 را در فشارهای کمتر از آنچه گفته شده گزارش کردهاند اما فوق سخت بودن آن هنوز اثبات نشدهاست.[۲۷]
نیترید کربن بور[ویرایش]
اندازههای اتمی مشابه بور، کربن و نیتروژن و همچنین ساختارهای مشابه پلیمرفهای نیترید کربن و بور، امکان سنتز فاز شبه الماس حاوی هر سه عنصر را نشان میدهد. همچنین میتوان ترکیبات حاوی B-C-O , B-O-N یا B-C-O-N را تحت فشار بالا ایجاد کرد، اما سنتز آنها یک فرایند شیمیایی پیچیده دارد و علاوه بر این، خواص الاستیک آنها کمتر از الماس میباشد. از سال ۱۹۹۰، علاقه زیادی به مطالعه امکان سنتز فازهای متراکم B-C-N که از نظر حرارتی و شیمیایی پایدارتر از الماس و سختتر از c-BN میباشند و مواد عالی برای برشهای با سرعت بالا و پرداخت آلیاژهای آهنی هستند، ایجاد شد. این ویژگیها به دلیل ساختار شبه الماس همراه با پیوندهای sp3 σ موجود در بین کربن و اتم دیگر است. پوششهای نازک BCxNy با استفاده از رسوب بخارات شیمیایی در سال ۱۹۷۲ سنتز شد.[۲۸] با این حال، دادههای گزارش شده در مورد تلاش برای سنتز فاز متراکم B-C-N توسط نویسندگان مختلف متناقض بودهاست. مشخص نیست که محصولات سنتز به صورت محلول جامد شبه الماس بین کربن و نیترید بور هستند یا فقط مخلوط مکانیکی از الماس پراکنده و c-BN. در سال ۲۰۱۱ ساختار شبه الماسی c-BC2N در فشار بالاتر از ۱۸ گیگاپاسکال و دمای بالاتر از ۲۲۰۰ درجه کلوین به روش انتقال فاز مستقیم حالت جامد از شبه گرافیت BN)0.48C0.52) سنتز شد. سختی ویکرز و نوپ گزارش شده مابین الماس و c-BN بود که موجب شد که ماده جدید، دومین ماده سخت شناخته شود.[۲۹] فازهای سه تایی B-C-N را میتوان به روش
SHOCK-COMRESSION نیز سنتز کرد. همچنین پیشنهاد شدهاست که سیستمهای سه تایی B-C-N را با اضافه کردن سیلیکون به ترکیبات چهارتایی میتوان گسترش داد.
بوریدهای فلزی[ویرایش]
یک مزیت مهم بوریدهای فلزی در مقایسه با سیستمهای مبتنی بر کربن این است که بوریدهای فلزی را میتوان به راحتی در مقادیر زیاد در شرایط محیط سنتز کرد.[۵]بیشتر بوریدهای فلزی سخت هستند؛[۳۰]با این وجود، تعداد کمی از آنها به دلیل سختی بالا ویژه خود برجستهتر هستند، به عنوان مثال WB4، RuB2، OsB2 و ReB2.[۳۱][۳۲] بوریدهای فلزی به دلیل تراکم الکترونی بالای خود جز فلزات قرار میگیرند و نیمه هادی یا عایق نیستند. به علاوه، پیوندهای کووالانسی اضافی B-B و M-B (M = فلز) منجر به سختی بالا میشود. فلزات سنگین متراکم، مانند اوسمیم، رنیوم، تنگستن و غیره به دلیل تراکم الکترون زیاد، شعاع اتمی کوچک، مدول بالک زیاد و توانایی پیوند شدید با بور، برای تشکیل بوریدهای سخت مناسب هستند.[۳۳][۳۴]
اسمیم دیبورید

دارای مدول بالک بالا در حدود 395 GPa است که موجب میشود به عنوان یک گزینه برای مواد فوق سخت در نظر گرفته شود، اما بیشترین سختی ویکرز بدست آمده حدود 37 GPa است که کمی پایینتر از محدوده مواد فوق سخت یعنی 40 GPa است. یک روش معمول برای سنتز OsB2 استفاده از واکنش حالت جامد مخلوط حاوی OsCl3: MgB2 به نسبت ۲:۳ است. پس از شستشوی محصول MgCl2 شسته میشود و الگوی پراش اشعه ایکس فازهای OsB2، OsB و Os را نشان میدهد. سپس به مدت سه روز در دمای ۱۰۰۰ درجه سانتیگراد حرارت داده میشود و محصول بلوری OsB2 خالص تولید میشود. OsB2 دارای یک ساختار اورتورومبیک (گروه فضایی Pmmn) با دو صفحه دارای اتمهای اسمیم است که توسط یک لایه هگزاگونالی غیر مسطح از اتمهای بور احاطه شدهاست. پارامترهای شبکه a = ۴٫۶۸۴ Å b = ۲٫۸۷۲ Å و c = ۴٫۰۹۶ Å هستند.[۵]جهت b کریستال بیشترین فشردگی و جهت c کمترین فشردگی را دارد.[۳۵] اتمهای بور و اوسمیم در جهات a و b، به گونهای قرار گرفتهاند که کاملاً از هم جدا هستند؛ بنابراین، هنگامی که فشرده میشوند، مقابل یکدیگر قرار نمیگیرند و ار چون که دافعه الکترواستاتیک نیرویی است که تراکمناپذیری مواد را به حداکثر مقدار ممکن میرساند، بنابراین در این حالت دافعه الکترواستاتیک بهطور کامل استفاده نمیشود و به همین دلیل کمترین میزان فشردگی در جهت c است. در صورت توزیع یکنواخت بور در شبکه تراکم ناپذیری میتواند بیشتر باشد. پراش الکترون برگشتی همراه با اندازهگیری سختی نشان میدهد که در صفحه (۰۱۰)، کریستال در جهت <۱۰۰> نسبت به <۰۰۱> ۵۴٪ سختتر است. این امر با بررسی طول تورفتگی در امتداد یک جهت مشخص (مربوط به تورفتگیهای ناشی از تست سختی ویکرز) مشاهده میشود. از نگاه دیگر به دلیل پیوندهای کووالانسی کوتاه (B-B (1.80 Å در جهت <۱۰۰> که در جهت <۰۰۱> وجود ندارد، در جهت <۱۰۰> سختتر است.[۵]
بوریدهای رنیوم[ویرایش]
رنیوم به دلیل خصوصیات فیزیکی و شیمیایی مطلوب مثل تراکم الکترون زیاد، شعاع اتمی کوچک و مدول بالک زیاد به عنوان گزینهای برای ساخت بوریدهای فلزی فوقسخت بررسی شد. ترکیب رنیوم با بور منجر به تشکیل کریستالی با پیوند بسیار کووالانسی و دارای سختی بالقوه و فشرده ناپذیری میشود. مجموعه گستردهای از بوریدهای رنیوم از جمله Re3B , Re7B3، Re2B , ReB , Re2B3، Re3B7، Re2B5، ReB3 و ReB2 بررسی شدهاست. هر یک از این مواد مجموعهای از خواص و ویژگیهای خاص خود را دارند. برخی خواص ابررسانایی و برخی دیگر خاصیت الاستیک و الکترونیکی منحصر به فردی دارند، اما مهمترین خواص مربوط به مواد فوق سخت ReB2 است.[۳۶] Rhenium diboride)ReB2) یک ترکیب نسوز است که برای اولین بار در دهه ۱۹۶۰ با استفاده از کورههای ذوب قوس، zone melting یا optical floating zone سنتز شد. یکی از روشهای سنتر این ماده روش فلاکس است که با قرار دادن فلز رنیوم و بور آمورف در یک بوته آلومینایی به همراه آلومینیوم اضافی به عنوان محیط رشد با نسبت ۱: ۲: ۵۰ برای Re: B: Al انجام میشود. بوته در تیوب آلومینایی قرار داده میشود و در یک کوره دارای جریان گاز آرگون قرار میگیرد و به مدت چند ساعت در ۱۴۰۰ درجه سانتیگراد زینتر میشود. پس از خنک شدن، آلومینیوم در NaOH حل میشود. هر روش سنتز ReB2 اشکالات خاص خود را دارد و این روش نیز شامل اجزا کوچکی از آلومینیوم که در شبکه بلوری حل شدهاند میباشد. دیبورید رنیوم دارای نقطه ذوب بسیار بالای حدود ۲۴۰۰ درجه سانتیگراد و ساختار بلوری لایهای بسیار ناهمسانگرد است.[۳۷] دارای تقارن هگزاگونال (گروه فضایی P63mc) یا ارتورومبیک (Cmcm) است و همانطور که در مثال بالا مشاهده میشود لایههای فشرده Re با لایههای مثلثی جمع شده بور در امتداد صفحه (۰۰۱) جایگزین میشوند. ReB2 یکی از کمترین مقادیر چگالی را در بین بوریدهای فلزی دارد که نشان دهنده پیوند کووالانسی قوی و سختی زیاد است.[۳۶] سختی در بورید رنیوم به دلیل ناهمسانگرد بودن ساختار آن به جهت بلوری بستگی دارد. صفحه (۰۰۲) حاوی کووالانسیترین حالت است و حداکثر مقدار سختی ویکرز 40.5 GPa را نشان میدهد، در حالی که صفحات عمود سختی ویکرز 38.1 GPa یعنی ۶ درصد کمتر را دارند. این مقادیر با افزایش بار اعمالی به حدود 28 GPa کاهش مییابند. مقادیر nanoindentation برای صفحات (۰۰۲) و عمود به ترتیب برابر 36.4 GPa و 34.0 GPa است. مقادیر سختی به خلوص و ترکیب مواد بستگی دارد، هرچه بور بیشتر بورید سختتر میباشد، مقادیر فوق برای نسبت
Re:B تقریباً ۱: ۱٫۸۵ است. رنیوم دی بورید همچنین دارای مدول بالک 383 GPa و مدول برشی 273 GPa است.[۳۸][۳۷] سختی به بار اعمالی هنگام آزمایش بستگی دارد. مقادیر فوق که حدود 40 GPa اند، همگی با نیروی مؤثر 0.5-1 N اندازهگیری شدند. با چنین بار کمی، مقادیر سختی برای سایر مواد نیز بیش از حد تخمین زده میشود، به عنوان مثال برای c-BN بیش از 100 GPa میشود.[۳۹] مقادیر سختی گزارش شده ReB2 در بار معمولی 3-49 N حدود 17-19 GPa است که نشان میدهد ReB2 یک ماده سخت، نه فوق سخت میباشد.[۹][۳۹][۴۰] دی بورید رنیوم دارای رسانایی فلزی است که با کاهش دما به علت همپوشانی اسپینهای d و p رنیوم و بور افزایش مییابد. دی بورید رنیوم تنها ماده فوقسخت دارای رفتار فلزی است. این ماده همچنین از ثبات حرارتی نسبتاً بالایی برخوردار است و بسته به روش گرمایش، جرم خود را تا دمای ۶۰۰–۸۰۰ درجه سانتیگراد حفظ خواهد کرد و در دمای نزدیک به ۱۰۰۰ درجه سانتیگراد، کاهش جرم مشاهده میشود. در صورت اعمال شیب حرارتی کندتر عملکرد بهتری خواهد داشت. بخشی از این افت کوچک در حدود ۱۰۰۰ درجه سانتیگراد به علت تشکیل یک پوشش B2O3 کمرنگ روی سطح، به علت خروج بور از ماده جامد و تشکیل یک پوشش محافظ است که باعث کاهش تلفات اضافی بور میشود. این پوشش میتواند به راحتی توسط متانول حل شده و مواد به حالت براق اولیه خود بازمیگردند.[۴۱][۳۸][۳۷]
تنگستن بورید[ویرایش]
کشف تترابورید تنگستن فوقسخت گواهی دیگر به امیدوارکننده بودن طراحی پیوند کووالانسی فلزات انتقالی تراکمناپذیر با بور است. در حالی که WB4 برای اولین بار در سال ۱۹۶۶ سنتز و شناسایی شد،[۴۲] در سال ۲۰۱۱ به عنوان یک ماده فوق سنگین ارزان قیمت شناخته شد. جالب اینجاست که ترکیبات بورید تنگستن دیگر که بور کمتری دارند مانند دی بورید تنگستن فوق سخت نیستند. مقادیر بالاتر بور به دلیل افزایش چگالی پیوندهای کوتاه کووالانسی بور-بور و بور - فلز منجر به سختی بالاتر میشود. با این حال، محققان توانستهاند WB2 را از طریق افزودن مقادیر کم دیگر فلزات انتقالی مانند نایوبیوم و تانتالوم در ساختار بلور، به سمت فوقسخت سوق دهند. این مکانیزم افزایش سختی را استحکام بخشی از طریق محلول جامد مینامند و مکانیزم این استحکام بخشی به این شکل است که اتمهایی با اندازههای مختلف در شبکه اصلی قرار میگیرند و مانع از حرکت نابجاییها میشوند.[۴۳]
بورید آلومینیوم منیزیم[ویرایش]
BAM یک ترکیب شیمیایی از آلومینیوم، منیزیم و بور است؛ که فرمول آن AlMgB14 است و ترکیب شیمیایی آن به Al0.75Mg0.75B14 نزدیکتر است. این آلیاژ سرامیکی مقاومت سایش بالا و ضریب اصطکاک کم دارد.
سایر مواد فوق سخت غنی از بور[ویرایش]


از دیگر ترکیبات سخت غنی از بور میتوان به B4C و B6O اشاره کرد. a-B4C آمورف دارای سختی حدود 50 GPa است که در محدوده فوق سختی قرار دارد. میتوان به این صورت نگاه کرد که از کریستالهای شبه ایکوزاهدرال بور که در زمینه آمورف قرار گرفتهاند ساخته شدهاست. فرم بلوری B4C، دارای سختی حدود 30 GPa است. فرم کریستالی (استوکیومتری B13C3) از ایکوزاهدرالهای بور متصل شده توسط اتمهای بور و کربن تشکیل شدهاست.[۴۴]
اکسید بور (B6O) دارای سختی حدود 35 GPa است. ساختار آن شامل هشت واحد ایکوزاهدرال B12 است که در رأس یک سلول واحد رومبوهدرال نشستهاند و دو اتم اکسیژن در امتداد جهت رومبوهدرال (۱۱۱) قرار دارند.[۴۵]
مواد فوقسخت نانوساختار[ویرایش]
مواد نانوساختار فوقسخت یک گروه جدا از مواد فوقسخت هستند. تمرکز در سنتز مواد فوقسخت نانو بر به حداقل رساندن ریزترکهای رخ داده در ساختار از طریق سخت شدن مرز دانهای است. از بین بردن ریزترکها میتواند مواد را ۳ تا ۷ برابر مقاومت اصلی خود تقویت کند. استحکام بخشی از طریق مرز دانه توسط معادله هال-پچ توصیف شدهاست.[۴۶] متوسط سختی ماده با کاهش d (اندازه کریستالیت) به زیر ۱۰ نانومتر، کاهش مییابد. مکانیسمهای زیادی برای لغزش مرزدانه و در نتیجه نرم شدن مواد ارائه شدهاست، اما هنوز جزئیات آن درک نشدهاست. علاوه بر استحکام بخشی از طریق مرزدانه، توجه زیادی به ایجاد ساختار microheterostructure یا ایجاد نانوساختار دو ماده با اختلاف خیلی زیاد در مدول الاستیک شدهاست. ساختار microheterostructure برای اولین بار در سال ۱۹۷۰ ارائه شد و دارای لایههای نازک بسیار مرتب که از نظر تئوری نمیتوان آنها را با استفاده از ابزار مکانیکی جدا کرد، بود؛ و باور بر این بود که این ساختارها مستحکمتر از مخلوطهای ساده هستند. این نظریه با ساختارهای Al / Cu و Al / Ag تأیید شد. پس از تشکیل Al / Cu و Al / Ag، تحقیقات به سمت سیستمهای چند لایه شامل Cu / Ni , TiN / VN , W / WN , Hf / HfN و غیره گسترش یافت. در همه موارد، کاهش پارامتر شبکه باعث افزایش سختی میشود.[۴] یکی از مواد متداول نانوساختار، نانومیلههای الماس اگریگیت (جمع شده) است که سختتر از الماس بالک است و در حال حاضر سختترین ماده (150 a GPa) شناخته شدهاست.[۴۷]
منابع[ویرایش]
- ↑ ^ John, P; Polwart, N. ; Troupe, C.E. ; Wilson, J.I.B. (2002). "The oxidation of (100) textured diamond". Diamond and Related [Materials. 11 (3–6): 861.
- ↑ Nassau, K; Nassau, J. (1979). "The history and present status of synthetic diamond". Journal of Crystal Growth. 46 (2): 157.
- ↑ Tolbert, Sarah H. ; Gilman, John J. ; Kaner, Richard B. (2005-05-27). "Designing Superhard Materials". Science. 308 (5726): 1268–1269.
- ↑ ۴٫۰ ۴٫۱ Haines, J; Leger, JM; Bocquillon, G (2001). "Synthesis and design of superhard materials". Annual Review of Materials Research. 31: 1–23.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ ۵٫۳ ۵٫۴ ۵٫۵ ۵٫۶ Levine, Jonathan B. ; Tolbert, Sarah H. ; Kaner, Richard B. (2009). "Advancements in the Search for Superhard Ultra-Incompressible Metal Borides". Advanced Functional Materials. 19 (22): 3519.
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ ۶٫۳ ۶٫۴ ۶٫۵ ۶٫۶ ۶٫۷ ۶٫۸ Vepřek, Stan (1999). "The search for novel, superhard materials" Journal of Vacuum Science and Technology A. 17 (5): 2401–2420
- ↑ Zhao, Y. ; Solozhenko, V. ; Riedel, R. ; Novikov, N. ; Nicol, M. ; Dubrovinskaia, N. ; Brazhkin, V. (2004). "What does 'harder than diamond' mean?". Nature Materials. 3 (9): 576–577
- ↑ Qin, Jiaqian; He, Duanwei; Wang, Jianghua; Fang, Leiming; Lei, Li; Li, Yongjun; Hu, Juan; Kou, Zili; Bi, Yan (2008). "Is Rhenium Diboride a Superhard Material?". Advanced Materials. 20 (24): 4780.
- ↑ ۹٫۰ ۹٫۱ Solozhenko, V. L. ; Kurakevych, Oleksandr O. ; Andrault, Denis; Le Godec, Yann; Mezouar, Mohamed (2009). "Ultimate Metastable Solubility of Boron in Diamond: Synthesis of Superhard Diamondlike BC5" Phys. Rev. Lett. 102 (1): 015506.
- ↑ Marinescu, I. D. ; Tönshoff, H. K. & Inasaki, I. (2000). Handbook of ceramic grinding and polishing. William Andrew. p. 21
- ↑ ^ Lee, J. & Novikov N. V. (2005). Innovative superhard materials and sustainable coatings for advanced manufacturing. Springer. p. 102
- ↑ 1. ^ Kutz, Myer (2002). Handbook of materials selection. John Wiley and Sons. p. 384
- ↑ Barnard, A. S. (2000) The diamond formula: diamond synthesis—a gemmological perspective. Butterworth-Heinemann
- ↑ Liander, H. (1955). "Artificial diamonds". ASEA Journal. 28: 97.
- ↑ "Man-Made Diamonds". Chemical & Engineering News. 33 (8): 718. 1955
- ↑ ۱۶٫۰ ۱۶٫۱ Wentorf, R. H. (1957). "Cubic Form of Boron Nitride". The Journal of Chemical Physics. 26 (4): 956.
- ↑ Lonsdale, Kathleen (1962). "Further Comments on Attempts by H. Moissan, J. B. Hannay and Sir Charles Parsons to Make Diamonds in the Laboratory". Nature. 196 (4850): 104–106.
- ↑ Catledge, Shane A. ; Vohra, Yogesh K. (1999). "Effect of nitrogen addition on the microstructure and mechanical properties of diamond films grown using high-methane concentrations". Journal of Applied Physics. 86 (1): 698.
- ↑ Ekimov, E. A. ; Sidorov, V. A. ; Bauer, E. D. ; Mel'nik, N. N. ; Curro, N. J. ; Thompson, J. D. ; Stishov, S. M. (2004). "Superconductivity in diamond". Nature. 428 (6982): 542–5
- ↑ Tian, Yongjun; Liu, Zhongyuan; He, Julong; Wen, Bin; Zhao, Zhisheng; Wang, Yanbin; Ma, Yanming; Hu, Wentao; Xu, Bo (2014). "Nanotwinned diamond with unprecedented hardness and stability". Nature. 510 (7504): 250–253.
- ↑ ۲۱٫۰ ۲۱٫۱ ۲۱٫۲ Greim, Jochen; Schwetz, Karl A. (2005). "Boron Carbide, Boron Nitride, and Metal Borides". Boron Carbide, Boron Nitride, and Metal Borides, in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH: Weinheim.
- ↑ Bocquillon, G. ; Loriers-Susse, C. ; Loriers, J. (1993). "Synthesis of cubic boron nitride using Mg and pure or M'-doped Li3N, Ca3N2 and Mg3N2 with M'=Al, B, Si, Ti". Journal of Materials Science. 28 (13): 3547.
- ↑ Leichtfried, G. ; et al. (2002). "13.5 Properties of diamond and cubic boron nitride". In Beiss, P. (ed.). Landolt-Börnstein – Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials. Landolt-Börnstein - Group VIII Advanced Materials and Technologies. 2A2. Berlin: Springer. pp. 118–139.
- ↑ El Khakani, M. A. ; Chaker, M. (1993). "Physical properties of the x-ray membrane materials". Journal of Vacuum Science and Technology B. 11 (6): 2930
- ↑ 1. Wilke, K.T. and Bohm, J. (1988) Kristallzüchtung, Verlag Harri Deutsch, Frankfurt.
- ↑ ^ Liu, A. Y. ; Cohen, M. L. (1989). "Prediction of New Low Compressibility Solids". Science. 245 (4920): 841–2.
- ↑ Yin, Long-Wei; Li, Mu-Sen; Liu, Yu-Xian; Sui, Jin-Ling; Wang, Jing-Min (2003). "Synthesis of beta carbon nitride nanosized crystal through mechanochemical reaction". Journal of Physics: Condensed Matter. 15 (2): 309.
- ↑ 1. ^ Badzian, R. ; Niemyski, T. and Olkusnik, E. (1972) in Proceedings of the 3rd International Conference on Chemical Vapor Deposition, Salt Lake City, April 1972, F. A. Galski (ed.), p. 747
- ↑ Solozhenko, Vladimir L. ; Andrault, Denis; Fiquet, Guillaume; Mezouar, Mohamed; Rubie, David C. (2001). "Synthesis of superhard cubic BC2N". Applied Physics Letters. 78 (10): 1385
- ↑ ^ Akopov, Georgiy; Yeung, Michael T. ; Kaner, Richard B. (June 2017). "Rediscovering the Crystal Chemistry of Borides". Advanced Materials. 29 (21): 1604506
- ↑ Mohammadi, R. ; Xie, M. ; Lech, A. T. ; Turner, C. L. ; Kavner, A. ; Tolbert, S. H. ; Kaner, R. B. (2012). "Toward Inexpensive Superhard Materials: Tungsten Tetraboride-Based Solid Solutions". Journal of the American Chemical Society. 134 (51): 20660–8.
- ↑ Mohammadi, R. ; Lech, A. T. ; Xie, M. ; Weaver, B. E. ; Yeung, M. T. ; Tolbert, S. H. ; Kaner, R. B. (2011). "Tungsten tetraboride, an inexpensive superhard material". Proceedings of the National Academy of Sciences. 108 (27): 10958–62.
- ↑ Robinson, Paul J. ; Liu, Gaoxiang; Ciborowski, Sandra; Martinez-Martinez, Chalynette; Chamorro, Juan R. ; Zhang, Xinxing; McQueen, Tyrel M. ; Bowen, Kit H. ; Alexandrova, Anastassia N. (16 November 2017). "Mystery of Three Borides: Differential Metal–Boron Bonding Governing Superhard Structures". Chemistry of Materials. 29 (23): 9892–9896.
- ↑ Cumberland, Robert W. ; Weinberger, Michelle B. ; Gilman, John J. ; Clark, Simon M. ; Tolbert, Sarah H. ; Kaner, Richard B. (2005). "Osmium Diboride, An Ultra-Incompressible, Hard Material". Journal of the American Chemical Society. 127 (20): 7264–5.
- ↑ Chen, Z. ; Xiang, H. ; Yang, Jinlong; Hou, J. ; Zhu, Qingshi (2006). "Structural and electronic properties of OsB2: A hard metallic material". Physical Review B. 74 (1): 12102
- ↑ ۳۶٫۰ ۳۶٫۱ Gou, Huiyang; Wang, Zhibin; Zhang, Jingwu; Yan, Shuting; Gao, Faming (2009). "Structural Stability and Elastic and Electronic Properties of Rhenium Borides: First Principle Investigations". Inorganic Chemistry. 48 (2): 581–7
- ↑ ۳۷٫۰ ۳۷٫۱ ۳۷٫۲ Levine, Jonathan B. ; Nguyen, Sandy L. ; Rasool, Haider I. ; Wright, Jeffrey A. ; Brown, Stuart E. ; Kaner, Richard B. (2008). "Preparation and Properties of Metallic, Superhard Rhenium Diboride Crystals". Journal of the American Chemical Society. 130(50): 16953–8.
- ↑ ۳۸٫۰ ۳۸٫۱ Levine, J.B. ; Betts, J.B. ; Garrett, J.D. ; Guo, S.Q. ; Eng, J.T. ; Migliori, A. ; Kaner, R.B. (2010). "Full elastic tensor of a crystal of the superhard compound ReB2". Acta Materialia. 58 (5): 1530
- ↑ ۳۹٫۰ ۳۹٫۱ Dubrovinskaia, N. ; Dubrovinsky, L. ; Solozhenko, V. L. (2007). "Comment on "Synthesis of Ultra-Incompressible Superhard Rhenium Diboride at Ambient Pressure"". Science. 318 (5856): 1550c.
- ↑ ^ Gu, Qinfen; Krauss, Guenter; Steurer, Walter (2008). "ChemInform Abstract: Transition Metal Borides: Superhard versus Ultra-Incompressible". ChemInform. 39 (50).
- ↑ Šimůnek, A (2009). "Anisotropy of hardness from first principles: The cases of ReB2 and OsB2". Physical Review B. 80 (6): 60103.
- ↑ Krug, M. P. ; Romans, P. A. (1966-02-10). "Composition and crystallographic data for the highest boride of tungsten". Acta Crystallographica. 20 (2): 313–315.
- ↑ ^ Kaner, Richard B. ; Tolbert, Sarah H. ; Yeung, Michael T. ; Weaver, Beth E. ; Xie, Miao; Lech, Andrew T. ; Mohammadi, Reza (2011-07-05). "Tungsten tetraboride, an inexpensive superhard material". Proceedings of the National Academy of Sciences. 108 (27): 10958–10962.
- ↑ Ulrich, S; Ehrhardt, H. ; Schwan, J. ; Samlenski, R. ; Brenn, R. (1998). "Subplantation effect in magnetron sputtered superhard boron carbide thin films". Diamond and Related Materials. 7 (6): 835
- ↑ Hubert, Hervé; Garvie, Laurence A. J. ; Devouard, Bertrand; Buseck, Peter R. ; Petuskey, William T. ; McMillan, Paul F. (1998). "High-Pressure, High-Temperature Synthesis and Characterization of Boron Suboxide (B6O)". Chemistry of Materials. 10 (6): 1530.
- ↑ Bouchaud, Elisabeth; Jeulin, Dominique and Prioul, Claude (2001) Physical aspects of fracture. Springer
- ↑ ^ Blank, V; Popov, M. ; Pivovarov, G. ; Lvova, N. ; Gogolinsky, K. ; Reshetov, V. (1998). "Ultrahard and superhard phases of fullerite C60: Comparison with diamond on hardness and wear" (PDF). Diamond and Related Materials. 7 (2–5): 427.
