پیشنویس:اثر ایزوتوپ جنبشی
In the reaction of methyl bromide with cyanide,
the kinetic isotope effect of the carbon in the methyl group was found to be 1.082 ± 0.008.[۱][۲]
در شیمی آلی فیزیکی، اثر ایزوتوپی سرعتدهنده (KIE) به تغییر در سرعت واکنش یک واکنش شیمیایی اشاره دارد که زمانی رخ میدهد که یکی از اتمهای حاضر در واکنشدهندهها با یکی از ایزوتوپهای آن جایگزین شود.[۱] به طور رسمی، KIE برابر با نسبت ثابتهای سرعت برای واکنشهایی است که شامل واکنشدهندههای ایزوتوپی جایگزینشده سبک (kL) و سنگین (kH) (ایزوتوپولوگها) هستند:
این تغییر در سرعت واکنش، نتیجهی یک اثر مکانیکی کوانتومی است که عمدتاً به خاطر فرکانسهای ارتعاشی پایینتر ایزوتوپهای سنگینتر نسبت به همتایان سبکتر آنها رخ میدهد. در اغلب موارد، این امر نیاز به انرژی ورودی بیشتری برای ایزوتوپهای سنگینتر جهت رسیدن به حالت گذار (یا، در موارد نادر، حد تفکیک) را نشان میدهد و در نتیجه، منجر به سرعت واکنش کندتر میشود. مطالعه اثرات ایزوتوپی کاتالیتیکی میتواند به روشن شدن مکانیسم واکنش برخی واکنشهای شیمیایی کمک کند و گاهی اوقات در توسعه دارو برای بهبود فارماکوکینتیک نامطلوب با محافظت از پیوندهای C-H مستعد به متابولیسم مورد استفاده قرار میگیرد.
اثر ایزوتوپی کاتالیتیکی به عنوان یکی از ضروریترین و حساسترین ابزار برای مطالعه مکانیسمهای واکنش شناخته میشود. دانستن این مکانیسم ها، بهبود ویژگیهای مطلوب واکنشهای مربوطه را ممکن میسازد. برای مثال، اثرات ایزوتوپی کاتالیتیکی میتوانند نشان دهند که آیا یک واکنش جایگزینی هستهدوستی، مسیر تکمولکولی (SN1) یا دو-مولکولی (SN2) را دنبال میکند.
در واکنش متیل بروماید و سیانید (که در مقدمه نشان داده شد)، اثر ایزوتوپی کاتالیتیکی مشاهده شده روی کربن متیل، نشاندهنده مکانیسم SN2 است.[2] بسته به مسیر واکنش، میتوان از استراتژیهای مختلفی برای تثبیت حالت گذار مرحله سرعتدهنده واکنش و بهبود سرعت و انتخابپذیری واکنش استفاده کرد که برای کاربردهای صنعتی اهمیت دارند.

تغییرات نرخی ناشی از ایزوتوپ زمانی مشهود تر هستند که تغییر جرم نسبی بیشتر باشد، زیرا این اثر به فرکانس های ارتعاشی پیوند های تحت تأثیر مرتبط است. به عنوان مثال، تغییر یک اتم هیدروژن (H) به ایزوتوپ آن، دوتریم (D)، نشان دهنده افزایش ۱۰۰ درصدی جرم است، در حالی که در جایگزینی کربن-۱۲ با کربن-۱۳، جرم فقط ۸ درصد افزایش مییابد. سرعت واکنشی که شامل یک پیوند C-H است، معمولاً ۶ تا ۱۰ برابر سریعتر از پیوند C-D مربوطه است، در حالی که واکنش ۱۲C فقط ۴ درصد سریع تر از واکنش ۱۳C مربوطه است[۳]:۴۴۵ (حتی اگر در هر دو مورد، ایزوتوپ یک واحد جرم اتمی سنگین تر است).
جایگزینی ایزوتوپی میتواند به طرق مختلفی بر سرعت واکنش تأثیر بگذارد. در بسیاری موارد، تفاوت سرعت را میتوان با این نکته توضیح داد که جرم یک اتم بر فرکانس ارتعاشی پیوند شیمیایی که تشکیل میدهد تأثیر میگذارد، حتی اگر سطح انرژی پتانسیل برای واکنش تقریباً یکسان باشد. ایزوتوپهای سنگینتر (از نظر کلاسیک) منجر به فرکانسهای ارتعاشی پایینتر میشوند یا از نظر مکانیک کوانتومی، انرژی نقطه صفر پایینتری خواهند داشت. با انرژی نقطه صفر پایینتر، برای شکستن پیوند باید انرژی بیشتری تأمین شود، که منجر به انرژی فعالسازی بالاتری برای شکستن پیوند میشود و در نتیجه سرعت اندازهگیری شده را کاهش میدهد (برای مثال، به معادله آرنیوس مراجعه کنید).[۱][۳]:۴۲۷
طبقه بندی[ویرایش]
اثرات ایزوتوپ جنبشی اولیه[ویرایش]
اثر ایزوتوپی کاتالیتیکی اولیه ممکن است زمانی مشاهده شود که پیوندی به اتم نشاندار ایزوتوپی در حال تشکیل یا شکستن باشد.[۱][۲]:۴۲۷ بسته به نحوه بررسی اثر ایزوتوپی کاتالیتیکی (اندازهگیری موازی نرخها در مقابل رقابت بینمولکولی در مقابل رقابت درونمولکولی)، مشاهده یک اثر ایزوتوپی کاتالیتیکی اولیه، نشاندهنده شکستن/تشکیل پیوندی به ایزوتوپ در مرحله سرعتدهنده یا مراحل بعدی تعیینکننده محصول است. (این تصور غلط که یک اثر ایزوتوپی کاتالیتیکی اولیه باید نشاندهنده شکستن/تشکیل پیوند به ایزوتوپ در مرحله سرعتدهنده باشد، اغلب در کتابهای درسی و ادبیات اولیه تکرار میشود: بخش مربوط به آزمایشهای زیر را ببینید.)[4]
برای واکنشهای جایگزینی هستهدوستی که قبلاً ذکر شد، اثرات ایزوتوپی کاتالیتیکی اولیه برای گروههای خارجشونده، هستهدوستها و کربن α که در آن جایگزینی اتفاق میافتد، بررسی شده است. تفسیر اثرات ایزوتوپی کاتالیتیکی گروههای خارجشونده در ابتدا به دلیل نقش قابل توجه عوامل مستقل از دما، دشوار بود. اثرات ایزوتوپی کاتالیتیکی در کربن α میتوانند برای درک بهتری از تقارن حالت گذار در واکنشهای SN2 مورد استفاده قرار گیرند، اگرچه این اثر ایزوتوپی کاتالیتیکی به دلیل دخالت عوامل غیر ارتعاشی، از حساسیت ایدهآل کمتری برخوردار است.[2]
اثرات ایزوتوپ جنبشی ثانویه[ویرایش]
اثر ایزوتوپی کاتالیتیکی ثانویه زمانی مشاهده میشود که هیچ پیوندی به اتم نشاندار ایزوتوپی در واکنشدهنده شکسته یا تشکیل نشده باشد.[1][3]:۴۲۷ اثرات ایزوتوپی کاتالیتیکی ثانویه معمولاً بسیار کوچکتر از اثرات اولیه هستند؛ با این حال، اثرات ایزوتوپی ثانویه دوتریمی میتوانند تا ۱.۴ به ازای هر اتم دوتریم بزرگ باشند و تکنیکهایی برای اندازهگیری اثرات ایزوتوپی عناصر سنگین با دقت بسیار بالا توسعه یافتهاند، بنابراین اثرات ایزوتوپی کاتالیتیکی ثانویه همچنان برای روشن کردن مکانیسمهای واکنش بسیار مفید هستند.
برای واکنشهای جایگزینی هستهدوستی ذکر شده، اثرات ایزوتوپی کاتالیتیکی ثانویه هیدروژن روی کربن α، یک روش مستقیم برای تشخیص بین واکنشهای SN1 و SN2 ارائه میدهند. مشخص شده است که واکنشهای SN1 معمولاً منجر به اثرات ایزوتوپی کاتالیتیکی ثانویه بزرگ میشوند و به حداکثر تئوری خود در حدود ۱.۲۲ نزدیک میشوند، در حالی که واکنشهای SN2 به طور معمول اثرات ایزوتوپی کاتالیتیکی ثانویه نزدیک به یا کمتر از یک ایجاد میکنند. اثرات ایزوتوپی کاتالیتیکی که بزرگتر از ۱ هستند، بهعنوان اثرات ایزوتوپی کاتالیتیکی نرمال یا عادی، و اثرات ایزوتوپی کاتالیتیکی که کمتر از یک هستند، بهعنوان اثرات ایزوتوپی کاتالیتیکی معکوس نامیده میشوند. به طور کلی، انتظار میرود ثابتهای نیروی کوچکتر در حالت گذار، یک اثر ایزوتوپی کاتالیتیکی نرمال ایجاد کنند و ثابتهای نیروی بزرگتر در حالت گذار، زمانی که سهم ارتعاش کششی بر اثر ایزوتوپی کاتالیتیکی غالب است، میتوانند یک اثر ایزوتوپی کاتالیتیکی معکوس ایجاد کنند.[2]

اندازه این اثرات ایزوتوپی ثانویه روی کربن α عمدتاً توسط ارتعاشات Cα-H(D) تعیین میشود. برای یک واکنش SN1، از آنجایی که اتم کربن در طول حالت گذار مرحله سرعتدهنده به یک یون کاربنیوم sp2 هیبریدیزه با افزایش ترتیب پیوند Cα-H(D) تبدیل میشود، اگر فقط ارتعاشات کششی مهم باشند، انتظار میرود یک اثر ایزوتوپی کاتالیتیکی معکوس مشاهده شود. اثر ایزوتوپی کاتالیتیکی نرمال بزرگ مشاهدهشده، توسط سهم قابل توجه ارتعاشات انحنا خارج از صفحه هنگام رفتن از واکنشدهندهها به حالت گذار تشکیل یون کاربنیوم ایجاد میشود. برای واکنشهای SN2، ارتعاشات انحنا همچنان نقش مهمی در اثر ایزوتوپی کاتالیتیکی ایفا میکنند، اما سهم ارتعاشات کششی از نظر بزرگی قابل مقایسهتر هستند و اثر ایزوتوپی کاتالیتیکی حاصل بسته به سهم ویژه ارتعاشات مربوطه، ممکن است نرمال یا معکوس باشد.[2][5][6]
تئوری[ویرایش]
تفسیر نظری اثرات ایزوتوپی به شدت به نظریه حالت گذار متکی است، که فرض میکند یک سطح انرژی پتانسیل واحد برای واکنش وجود دارد و همچنین بین واکنشدهندهها و محصولات، یک مانع روی این سطح قرار دارد که حالت گذار بر روی آن قرار گرفته است.[7][8] اثر ایزوتوپی کاتالیتیکی عمدتاً از تغییرات حالتهای پایه ارتعاشی ناشی میشود که توسط اختلال ایزوتوپی در امتداد مسیر حداقل انرژی سطح انرژی پتانسیل ایجاد میشود و تنها با روشهای مکانیکی کوانتومی قابل محاسبه است. بسته به جرم اتم در حال حرکت در امتداد مختصات واکنش و ماهیت (عرض و ارتفاع) مانع انرژی، تونلزنی کوانتومی مکانیکی نیز ممکن است سهم بزرگی در اثر ایزوتوپی کاتالیتیکی مشاهدهشده داشته باشد و علاوه بر مدل «نیمه کلاسیک» نظریه حالت گذار، باید جداگانه در نظر گرفته شود.[7]
اثر ایزوتوپی کاتالیتیکی دوتریوم (۲H KIE) رایج ترین، مفیدترین و قابل درکترین نوع اثر ایزوتوپی کاتالیتیکی است. پیشبینی دقیق مقدار عددی اثر ایزوتوپی کاتالیتیکی دوتریوم با استفاده از محاسبات تئوری تابع چگالی اکنون نسبتاً رایج است. علاوه بر این، چندین مدل کیفی و نیمهکمی به تخمین های تقریبی اثرات ایزوتوپی دوتریوم بدون نیاز به محاسبات اجازه می دهند و اغلب اطلاعات کافی برای توجیه دادههای تجربی یا حتی پشتیبانی یا رد امکانات مکانیسمی مختلف را ارائه میدهند. مواد اولیه حاوی دوتریوم اغلب به صورت تجاری در دسترس هستند و ساخت مواد اولیه غنی شده از نظر ایزوتوپی را نسبتاً ساده میکند. همچنین، به دلیل اختلاف نسبی زیاد در جرم دوتریوم و پروتیوم و اختلافات همراه در فرکانس های ارتعاشی، بزرگی اثر ایزوتوپی از هر جفت ایزوتوپ دیگری به جز پروتیوم و تریتیوم [9] بزرگتر است و امکان اندازه گیری و تفسیر آسان اثرات ایزوتوپی اولیه و ثانویه را فراهم میکند. در مقابل، اثرات ثانویه برای عناصر سنگینتر عموماً بسیار کوچک و از نظر بزرگی نزدیک به عدم قطعیت تجربی هستند که تفسیر آن ها را پیچیده کرده و کاربرد آن ها را محدود میکند. در زمینه اثرات ایزوتوپی، اغلب از هیدروژن برای اشاره به ایزوتوپ سبک، پروتیوم (۱H)، به طور خاص استفاده میشود. در بقیه این مقاله، اشاره به هیدروژن و دوتریوم در ساختارهای نحوی موازی یا مقایسه های مستقیم بین آنها باید به معنای پروتیوم و دوتریوم تفسیر شود.[10]
نظریه اثرات ایزوتوپی کاتالیتیکی اولین بار توسط جاکوب بیگلایزن در سال ۱۹۴۹ مطرح شد.[3][11] : ۴۲۷ فرمول کلی بیگلایزن برای اثرات ایزوتوپی کاتالیتیکی دوتریوم (که برای عناصر سنگین تر نیز قابل استفاده است) در زیر آمده است. این فرمول از نظریه حالت گذار و یک روش مکانیکی آماری برای سطوح انتقالی، چرخشی و ارتعاشی برای محاسبه ثابتهای سرعت kH و kD استفاده میکند. با این حال، این فرمول «نیمهکلاسیک» است به این معنا که سهم تونلزنی کوانتومی را نادیده میگیرد، که اغلب به عنوان یک عامل اصلاحی جداگانه وارد میشود. فرمول بیگلایزن همچنین با اختلافات در برهمکنشهای دافعه غیر پیوندی ناشی از پیوند C-D کمی کوتاهتر نسبت به پیوند C-H برخورد نمیکند. در معادله، مقادیر با زیرنویسهای H یا D به ترتیب به گونههای جایگزینشده با هیدروژن یا دوتریوم اشاره دارند، در حالی که مقادیر با یا بدون علامت دو خنجر، ‡، به ترتیب به حالت گذار یا حالت پایه واکنشدهنده اشاره دارند.[6][12]: به طور دقیق، یک ضریب KH/KD ناشی از یک اختلاف ایزوتوپی در ضرایب انتقال نیز باید در نظر گرفته شود.[13]
- ،
جایی که ما تعریف می کنیم
- و .
در معادله بالا، h ثابت پلانک، kB ثابت بولتزمن، νi فرکانس ارتعاشی، c سرعت نور، NA ثابت آووگادرو و R ثابت گازها است. مقادیر با زیرنویسهای H یا D به ترتیب به گونههای جایگزینشده با هیدروژن یا دوتریوم اشاره دارند.
معادله بالا نشان میدهد که اثر ایزوتوپی کاتالیتیکی اولیه دوتریوم (KIE) از نسبت فرکانسهای ارتعاشی گونههای هیدروژندار و دوتریومدار در حالت گذار و واکنشدهندهها تعیین میشود. اگر فرکانسهای ارتعاشی گونههای دوتریومدار در حالت گذار و واکنشدهندهها بیشتر از گونههای هیدروژندار باشد، KIE اولیه دوتریوم کوچکتر از ۱ خواهد بود. در مقابل، اگر فرکانسهای ارتعاشی گونههای دوتریومدار در حالت گذار و واکنشدهندهها کمتر از گونههای هیدروژندار باشد، KIE اولیه دوتریوم بزرگتر از ۱ خواهد بود.
در مورد واکنشهای SN1، اتم کربن در طول حالت گذار برای مرحله سرعتدهنده به یک یون کاربنیوم sp2 هیبریدیزه تبدیل میشود. این تبدیل با افزایش ترتیب پیوند Cα-H(D) همراه است. از آنجایی که جرم دوتریوم بیشتر از هیدروژن است، ارتعاشات کششی Cα-H(D) در حالت گذار یون کاربنیوم برای دوتریوم بیشتر از هیدروژن است. بنابراین، KIE اولیه دوتریوم برای واکنشهای SN1 کوچکتر از ۱ است.
در مورد واکنشهای SN2، اتم کربن در طول حالت گذار به یک یون کربنیوم sp3 هیبریدیزه تبدیل میشود. این تبدیل با کاهش ترتیب پیوند Cα-H(D) همراه است. از آنجایی که جرم دوتریوم بیشتر از هیدروژن است، ارتعاشات کششی Cα-H(D) در حالت گذار یون کاربنیوم برای دوتریوم کمتر از هیدروژن است. بنابراین، KIE اولیه دوتریوم برای واکنشهای SN2 بزرگتر از ۱ است.
- .
در مورد خاص اثرات ایزوتوپی دوتریوم، استدلال خواهیم کرد که سه اصطلاح اول را میتوان به عنوان یک یا تقریباً یک در نظر گرفت. اولین عامل S (حاوی σX) نسبت اعداد تقارن برای گونه های مختلف است. این یک عدد گویا (نسبت دو عدد صحیح) خواهد بود که به تعداد چرخش های مولکولی و پیوندی منجر به جابجایی اتم ها یا گروه های یکسان در واکنش دهنده ها و حالت گذار بستگی دارد.[12] برای سیستم های با تقارن پایین، همه σX (واکنش دهنده و حالت گذار) یک خواهند بود؛ بنابراین S اغلب قابل صرف نظر است. عامل MMI (حاوی MX و IqX) به نسبت جرم های مولکولی و ممانهای اینرسی اشاره دارد. از آنجایی که هیدروژن و دوتریوم نسبت به اکثر واکنش دهنده ها و حالات گذار بسیار سبکتر هستند، تفاوت کمی در جرم های مولکولی و ممان های اینرسی بین مولکول های حاوی H و D وجود دارد، بنابراین عامل MMI نیز معمولاً تقریباً یک است. عامل EXC (حاوی حاصل ضرب توابع پارتیشن ارتعاشی) اثر ایزوتوپی کاتالیتیکی ناشی از واکنشهای مولکول های برانگیخته ارتعاشی را اصلاح میکند. کسری از مولکولهایی که انرژی کافی برای ارتعاشات پیوند A-H/D با حالت برانگیخته دارند، برای واکنشهای در یا نزدیک دمای اتاق عموماً کم است (پیوندهای به هیدروژن معمولاً در 1000 cm−1 یا بالاتر ارتعاش میکنند، بنابراین exp(-ui) = exp(-hνi/kBT) < 0.01 در 298 K، منجر به سهم ناچیز از عوامل 1–exp(-ui) میشود). بنابراین، برای اثرات ایزوتوپی کاتالیتیکی هیدروژن/دوتریوم، مقادیر مشاهده شده معمولاً تحت سلطه آخرین عامل، ZPE (یک تابع نمایی از اختلافات انرژی نقطه صفر ارتعاشی)، هستند که شامل سهمی از اختلافات انرژی نقطه صفر ارتعاشی برای هر یک از حالتهای ارتعاشی واکنش دهنده ها و حالت گذار است که میتوان به صورت زیر نمایش داد:[6]
- ،
جایی که ما تعریف می کنیم
- و .
مجموعهای موجود در توان عبارت دوم را میتوان به عنوان مجموع تمام حالتهای ارتعاشی حالت پایه واکنشدهنده و حالت گذار تفسیر کرد. روشی دیگر برای تفسیر این است که آنها را به عنوان مجموع حالتهای ارتعاشی منحصربهفرد واکنشدهنده یا حالت گذار در نظر گرفت، یا حالتهایی که فرکانسهای ارتعاشی آنها با پیشروی در راستای مختصات واکنش به طور قابل توجهی تغییر میکند. جفتهای باقیمانده از حالتهای ارتعاشی واکنشدهنده و حالت گذار، و بسیار مشابهی دارند و هنگام محاسبه مجموعهای درون توان، خنثیسازیهایی اتفاق میافتد. بنابراین، در عمل، اثرات ایزوتوپی کاتالیتیکی دوتریوم اغلب به دلیل این خنثیسازی، تا حد زیادی به تعداد انگشتشماری از حالتهای ارتعاشی کلیدی وابسته هستند، که امکان تجزیه و تحلیل کیفی kH/kD را فراهم میکند.[12]
همانطور که ذکر شد، به خصوص برای جایگزینی هیدروژن / دوتریوم ، بیشتر اثرات ایزوتوپی کاتالیتیکی از اختلاف انرژی نقطه صفر (ZPE) بین واکنش دهنده ها و حالت گذار ایزوتوپ های مورد نظر ناشی میشود. این اختلاف را میتوان به صورت کیفی با توضیحات زیر درک کرد:[ویرایش]
در تقریب Born-Oppenheimer، سطح انرژی پتانسیل برای هر دو گونه ایزوتوپی یکسان است. با این حال، یک روش مکانیکی کوانتومی انرژی سطوح ارتعاشی گسسته را روی این منحنی معرفی میکند و پایینترین حالت انرژی ممکن یک مولکول مربوط به پایین ترین سطح انرژی ارتعاشی است که کمی بالاتر از حداقل منحنی انرژی پتانسیل قرار دارد. این اختلاف، که به عنوان ZPE نامیده میشود، تجلی اصل عدم قطعیت هایزنبرگ است که نیاز به عدم قطعیت در طول پیوند C-H یا C-D دارد.
از آنجایی که گونه سنگینتر (در این مورد دوتریوم شده) رفتار «کلاسیک» تری دارد، سطوح انرژی ارتعاشی آن به منحنی انرژی پتانسیل کلاسیک نزدیکتر است و ZPE پایین تری دارد. اختلافات ZPE بین دو گونه ایزوتوپی، حداقل در بیشتر موارد، در حالت گذار کاهش مییابد، زیرا ثابت نیروی پیوند در طول شکستن پیوند کاهش می یابد. بنابراین، ZPE پایین تر گونه دوتریوم شده به انرژی فعالسازی بزرگتری برای واکنش آن منجر میشود، همانطور که در شکل زیر نشان داده شده است، و منجر به یک اثر ایزوتوپی کاتالیتیکی معمولی میشود.[۱]
این اثر، به طور اصولی، باید در تمام 3N−6 حالت ارتعاشی برای ماده اولیه و 3N‡−7 حالت ارتعاشی در حالت گذار (یک حالت، مربوط به مختصات واکنش، در حالت گذار وجود ندارد، زیرا یک پیوند میشکند و هیچ نیروی برگرداننده ای در برابر حرکت وجود ندارد) در نظر گرفته شود.
اسیلاتور هارمونیک تقریب خوبی برای یک پیوند در حال ارتعاش است، حداقل برای حالات ارتعاشی با انرژی کم. مکانیک کوانتومی انرژی نقطه صفر ارتعاشی را به صورت میدهد. بنابراین، به راحتی می توان ضریب ½ و مجموع جملات بر حالات ارتعاشی حالت پایه و حالت گذار در توان فرمول ساده شده بالا را تفسیر کرد. برای یک اسیلاتور هارمونیک، فرکانس ارتعاشی به طور معکوس با جذر مربع جرم کاهش یافته سیستم در حال ارتعاش متناسب است:
- ،
که در آن k f ثابت نیرو است. علاوه بر این، جرم کاهش یافته با جرم اتم نور سیستم، X = H یا D تقریب می شود. از آنجا که mD تقریباً 2 m H است .
- .
در مورد جدا شدن همولیتیک پیوند C-H/D، اصطلاح مربوط به حالت گذار حذف میشود و با صرف نظر از دیگر حالت های ارتعاشی، kH/kD = exp(½Δui) میشود. بنابراین، برای یک پیوند C-H/D «سفتتر» (« قویتر») اثر ایزوتوپی بزرگتری مشاهده میشود. برای اکثر واکنش های مورد علاقه، یک اتم هیدروژن بین دو اتم با یک حالت گذار [A···H···B]‡ منتقل میشود و باید حالت های ارتعاشی در حالت گذار در نظر گرفته شود. با این وجود، به طور کلی همچنان این واقعیت صادق است که شکستن پیوندی با فرکانس ارتعاشی بالاتر منجر به اثر ایزوتوپی بزرگتری میشود.

برای محاسبه حداکثر مقدار ممکن برای اثر ایزوتوپی کاتالیتیکی دوتریوم بدون تونل زنی، موردی را در نظر می گیریم که در آن اختلاف انرژی نقطه صفر بین ارتعاشات کششی یک پیوند کربن-هیدروژن معمولی (3000 cm−1) و پیوند کربن-دوتریوم (2200 cm−1) در حالت گذار ناپدید میشود (اختلاف انرژی (1/2)(3000 – 2200 cm−1) = 400 cm−1، یا حدود 1.15 کیلو کالری بر مول)، بدون هیچ جبران از انرژی نقطه صفر در حالت گذار (مثلاً از کشش متقارن A···H···B، که منحصر به حالت گذار است). فرمول ساده شدهی ارائه شده در متن، حداکثر kH/kD را 6.9 پیش بینی می کند. اگر حذف کامل دو ارتعاش خمشی نیز در نظر گرفته شود، kH/kD تا 15-20 قابل پیش بینی است. با این حال، بعید است فرکانس های خمشی در حالت گذار ناپدید شوند و تنها موارد کمی وجود دارند که kH/kD در دمای اتاق از 7-8 تجاوز کند. علاوه بر این، اغلب مشاهده می شود که زمانی که مقادیر از 7-8 بالاتر می روند، تونل زنی عامل اصلی است.[ویرایش]
برای اثر ایزوتوپی کاتالیتیکی اولیه نیمهکلاسیک (بدون تونلزنی) برای واکنشهایی که در حدود 298 K اتفاق میافتند، kH/kD ~ 10 حداکثر مقدار در نظر گرفته میشود. (فرمول kH/kD وابسته به دما است، بنابراین اثرات ایزوتوپی بزرگتر در دماهای پایینتر امکانپذیر است).[۱]
بسته به ماهیت حالت گذار انتقال H (متقارن در مقابل "زود" یا "دیر" و خطی در مقابل خمیده)، میزان نزدیک شدن اثر ایزوتوپی اولیه دوتریوم به این حداکثر متغیر است. مدلی که توسط وستهیمر توسعه یافته است پیشبینی میکرد که حالتهای گذار خطی متقارن (گرماسنجی، با اصل هاموند پُست)، بزرگترین اثرات ایزوتوپی را دارند، در حالی که حالتهای گذار "زود" یا "دیر" (به ترتیب برای واکنشهای گرمازا یا گرماگیر) یا غیر خطی (مثلاً حلقوی) اثرات کوچکتری را نشان میدهند. این پیشبینیها از آن زمان پشتیبانی تجربی گستردهای دریافت کردهاند.[2]
برای اثرات ایزوتوپی کاتالیتیکی ثانویه، Streitwieser پیشنهاد کرد که تضعیف (یا تقویت، در مورد اثر ایزوتوپی معکوس) حالتهای خمشی از حالت پایه واکنشدهنده به حالت گذار، عمدتاً مسئول اثرات ایزوتوپی مشاهدهشده هستند. این تغییرات به تغییر محیط فضایی نسبت داده میشوند که در آن کربن متصل به H/D با تغییر هیبریداسیون از sp3 به sp2 یا بالعکس (اثر ایزوتوپی کاتالیتیکی ثانویه α) یا تضعیف پیوند به دلیل برهمکنش فوقپوندی در مواردی که یک کاتیون کربنیوم در یک فاصله کربن دورتر تولید میشود (اثر ایزوتوپی کاتالیتیکی ثانویه β) مواجه می شود. این اثرات ایزوتوپی دارای حداکثر نظری kH/kD = 20.5 ≈ 1.4 هستند.
برای یک اثر ایزوتوپی کاتالیتیکی ثانویه در موقعیت α، تغییر هیبریداسیون از sp3 به sp2 یک اثر ایزوتوپی معمولی ایجاد میکند، در حالی که تغییر هیبریداسیون از sp2 به sp3 منجر به یک اثر ایزوتوپی معکوس با حداقل نظری kH/kD = 2-0.5 ≈ 0.7 میشود. در عمل، kH/kD ~ 1.1-1.2 و kH/kD ~ 0.8-0.9 برای اثرات ایزوتوپی کاتالیتیکی ثانویه α و kH/kD ~ 1.15-1.3 برای اثر ایزوتوپی کاتالیتیکی ثانویه β معمولی هستند. برای واکنشدهندههایی که حاوی چندین اتم هیدروژن β با جایگزینی ایزوتوپی هستند، اثر ایزوتوپی مشاهدهشده اغلب نتیجه همکنش چندین H/D در موقعیت β است. در این موارد، اثر هر اتم با برچسب ایزوتوپی ضربکننده است و مواردی که kH/kD > 2 غیرمعمول نیستند.[۱]
عبارات ساده زیر مربوط به اثرات ایزوتوپ جنبشی دوتریوم و تریتیوم، که به عنوان معادله سواین (یا معادلات Swain-Schaad-Stivers) نیز شناخته می شوند، می توانند از عبارت کلی ارائه شده در بالا با استفاده از برخی ساده سازی ها استخراج شوند:[7][18]
- ;
که در آن A پارامتر آرنیوس و E ارتفاع مانع است
- .
در استخراج این عبارات، تقریب معقولی استفاده شد که بر اساس آن، جرم های کاهش یافته تقریباً برابر با جرم های هیدروژن، دوتریوم یا تریتیوم هستند. علاوه بر این، فرض بر این بود که حرکت ارتعاشی با یک اسیلاتور هارمونیک تقریب شود، به طوری که . زیرنویس "s" به این اثرات ایزوتوپی کاتالیتیکی "نیمه کلاسیک" اشاره میکند که تونل زنی کوانتومی را نادیده می گیرند. سهم تونل زنی باید جداگانه به عنوان یک عامل اصلاحی در نظر گرفته شود.
برای اثرات ایزوتوپی شامل عناصر غیر از هیدروژن، بسیاری از این ساده سازی ها معتبر نیستند و بزرگی اثر ایزوتوپی ممکن است به شدت به برخی یا تمام عوامل نادیده گرفته شده بستگی داشته باشد. بنابراین، اثرات ایزوتوپی کاتالیتیکی برای عناصر غیر از هیدروژن اغلب بسیار دشوارتر از توجیه یا تفسیر هستند. در بسیاری از موارد، به خصوص برای واکنش های انتقال هیدروژن، سهم تونل زنی (نگاه کنید به بخش زیر) در اثرات ایزوتوپی کاتالیتیکی قابل توجه است.
تونل سازی[ویرایش]
در برخی موارد، افزایش سرعت واکنش اضافی برای ایزوتوپ سبکتر مشاهده میشود که احتمالاً به دلیل تونلزنی مکانیکی کوانتومی است. این پدیده معمولاً فقط در واکنشهایی که شامل پیوندهایی با اتمهای هیدروژن هستند، مشاهده میشود. تونلزنی زمانی اتفاق میافتد که یک مولکول به جای عبور از یک سد انرژی پتانسیل، از درون آن نفوذ کند.[19]،[20] اگرچه در قوانین مکانیک کلاسیک غیرمجاز است، اما ذرات در مکانیک کوانتومی بر اساس دوگانگی موج-ذره میتوانند از نواحی فضایی ممنوع از نظر کلاسیک عبور کنند.[21]
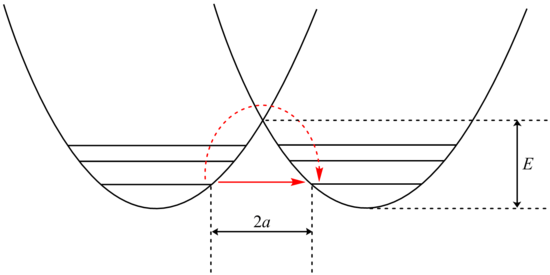
تجزیه و تحلیل تونل زنی را می توان با استفاده از اصلاح بل در معادله آرنیوس ، که شامل افزودن یک عامل تونل زنی، Q:
که در آن پارامتر A پارامتر آرنیوس است . و E هم ارتفاع مانع می باشد .
جایی که و
بررسی اصطلاح β وابستگی نمایی به جرم ذره را نشان می دهد. در نتیجه، تونل زنی برای ذرات سبکتر مانند هیدروژن بسیار محتمل تر است. تنها با دو برابر کردن جرم یک پروتون تونل زنی با جایگزینی آن با ایزوتوپ دوتریوم، سرعت چنین واکنش هایی به شدت کاهش مییابد. در نتیجه، اثرات ایزوتوپی کاتالیتیکی بسیار بزرگی مشاهده می شوند که نمی توان آن ها را با تفاوت های انرژی نقطه صفر توجیه کرد.

علاوه بر این، اصطلاح β به صورت خطی با عرض سد، ۲a، بستگی دارد. همان طور که در مورد جرم، تونل زنی برای عرض های سد کوچک تر بیشترین است. فاصله تونل زنی بهینه پروتون ها بین اتم های دهنده و پذیرنده ۰٫۴ Å است.[۱]
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامWestaway1وارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Lynn KR, Yankwich PE (5 August 1961). "Isotope Fractionation at the Methyl Carbon in the Reactions of Cyanide Ion with Methyl Chloride and Methyl Bromide". Journal of the American Chemical Society. 83 (15): 3220–3223. doi:10.1021/ja01476a012.
- ↑ وابستگی تونلزنی به دما تونلزنی یک اثر مکانیک کوانتومی است که به قوانین مکانیک موج مربوط میشود، نه سینتیک. بنابراین، با کاهش دما، اهمیت تونلزنی بیشتر میشود، جایی که حتی کوچکترین سدهای انرژی جنبشی ممکن است قابل عبور نباشند اما میتوان از طریق تونلزنی آنها را پشت سر گذاشت.[۲۰] پیتر اس. زوئف و همکاران گزارش دادند که ثابت سرعت برای انبساط حلقوی فلوئوروباربن ۱-متیلسیکلوبوتیل در نیتروژن ۴٫۰ × ۱۰^-۶ بر ثانیه و در آرگون ۴٫۰ × ۱۰^-۵ بر ثانیه در دمای ۸ کلوین است. آنها محاسبه کردند که در دمای ۸ کلوین، واکنش از طریق یک حالت کوانتومی واحد واکنشدهنده انجام میشود، به طوری که ثابت سرعت گزارششده مستقل از دما است و سهم تونلزنی در سرعت ۱۵۲ مرتبه قدر بزرگتر از سهم عبور از سد انرژی حالت گذار است.[۲۵] بنابراین، علیرغم این واقعیت که واکنشهای شیمیایی معمولی با کاهش دما به شدت کند میشوند، واکنشهای تونلزنی به ندرت تغییر میکنند. ذرات تونلزنی از سد فعالسازی نتیجهی این واقعیت هستند که تابع موج یک گونهی واسطه، واکنشدهنده یا محصول، به چاه انرژی یک گودال خاص در امتداد سطح انرژی یک واکنش محدود نمیشود، بلکه میتواند به حداقل انرژی بعدی «نفوذ» کند. با توجه به این موضوع، تونلزنی باید مستقل از دما باشد.[۲۰][۳] برای حذف هیدروژن از n-آلکان ها و سیکلوآلکان های گازی توسط اتمهای هیدروژن در محدوده دمایی ۳۶۳-۴۶۳ کلوین، دادههای اثر ایزوتوپی کاتالیتیکی H/D با ضریب پیشنمایی کوچک AH/AD بین ۰٫۴۳ تا ۰٫۵۴ و اختلافهای بزرگ انرژی فعالسازی از ۹٫۰ تا ۹٫۷ kJ/mol مشخص شدند. با استناد به استدلالهای خود بر اساس نظریه حالت گذار، ضریب عامل A کوچک همراه با اختلافهای بزرگ انرژی فعالسازی (معمولاً حدود ۴٫۵ kJ/mol برای پیوندهای C-H(D)) شواهد محکمی برای تونلزنی ارائه دادند. برای هدف این بحث، مهم است که ضریب عامل A برای پارافینهای مختلفی که استفاده کردند تقریباً در تمام محدوده دمایی ثابت بود.[۲۶] مشاهدهای که تونلزنی کاملاً مستقل از دما نیست را میتوان با این واقعیت توضیح داد که همه مولکولهای یک گونه خاص در دماهای مختلف، حالت پایه ارتعاشی خود را اشغال نمیکنند. افزودن انرژی حرارتی به چاه انرژی پتانسیل میتواند باعث شود سطوح ارتعاشی بالاتر از حالت پایه پر شوند. برای یک واکنش معمولی مبتنی بر سینتیک، این برانگیختگی تأثیر کمی بر سرعت خواهد داشت. با این حال، برای یک واکنش تونلزنی، تفاوت بین انرژی نقطه صفر و اولین سطح انرژی ارتعاشی میتواند بسیار زیاد باشد. ترم تصحیح تونلزنی Q به صورت خطی به عرض سد وابسته است و این عرض با افزایش تعداد حالتهای ارتعاشی روی پتانسیل مورس به طور قابل توجهی کاهش مییابد. کاهش عرض سد میتواند تأثیر بسیار زیادی بر سرعت تونلزنی داشته باشد، به طوری که حتی جمعیت کمی از حالتهای ارتعاشی برانگیخته بر این فرآیند حاکم خواهند بود.[۲۰][۳]
معیارهای تونلزنی اثر ایزوتوپی کاتالیتیکی[ویرایش]
برای تعیین اینکه آیا تونلزنی در اثر ایزوتوپی کاتالیتیکی (KIE) یک واکنش با H یا D نقش دارد، چند معیار در نظر گرفته میشود:
- Δ(EaH-EaD) > Δ(ZPEH-ZPED) (Ea= انرژی فعالسازی، ZPE= انرژی نقطه صفر)
- واکنش همچنان در دماهای پایینتر ادامه مییابد.
- ضریب پیشنمایی آرنیوس AD/AH برابر با ۱ نیست.
- آنتروپی فعالسازی منفی بزرگ.
- ژئومتریهای واکنشدهندهها و محصولات معمولاً بسیار شبیه به هم هستند.[۲۰]
همچنین برای واکنشهایی که شامل ایزوتوپهای H، D و T هستند، یک معیار برای تونلزنی، روابط Swain-Schaad است که ثابتهای سرعت (k) واکنشهایی را که H، D یا T در آنها تبادل میشوند، مقایسه میکند:
- kH/kT=(kD/kT)X و kH/kT=(kH/kD)Y
ارزشهای تجربی X بیشتر از ۳٫۲۶ و Y کمتر از ۱٫۴۴ نشاندهنده سهم مشخصی از مشارکت تونلزنی است.[۲۴][۴]: ۴۳۷-۸
In organic reactions, this proton tunneling effect has been observed in such reactions as the deprotonation and iodination of nitropropane with hindered pyridine base[۱] with a reported KIE of 25 at 25 °C:
and in a 1,5-sigmatropic hydrogen shift[۲] although it is observed that it is difficult to extrapolate experimental values obtained at elevated temperatures to lower temperatures:[۳][۴]
It has long been speculated that high efficiency of enzyme catalysis in proton or hydride ion transfer reactions could be due partly to the quantum mechanical tunneling effect. Environment at the active site of an enzyme positions the donor and acceptor atom close to the optimal tunneling distance, where the amino acid side chains can "force" the donor and acceptor atom closer together by electrostatic and noncovalent interactions. It is also possible that the enzyme and its unusual hydrophobic environment inside a reaction site provides tunneling-promoting vibration.[۵] Studies on ketosteroid isomerase have provided experimental evidence that the enzyme actually enhances the coupled motion/hydrogen tunneling by comparing primary and secondary kinetic isotope effects of the reaction under enzyme catalyzed and non-enzyme catalyzed conditions.[۶]
Many examples exist for proton tunneling in enzyme catalyzed reactions that were discovered by KIE. A well studied example is methylamine dehydrogenase, where large primary KIEs of 5–55 have been observed for the proton transfer step.[۷]

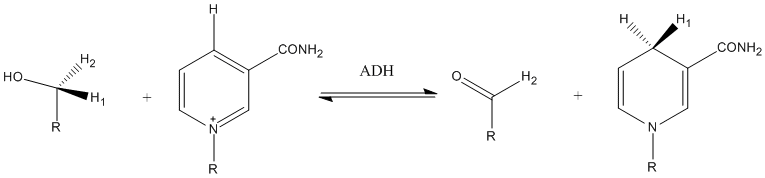
Another example of tunneling contribution to proton transfer in enzymatic reactions is the reaction carried out by alcohol dehydrogenase. Competitive KIEs for the hydrogen transfer step at 25 °C resulted in 3.6 and 10.2 for primary and secondary KIEs, respectively.[۸]
اثر ایزوتوپ جنبشی گذرا[ویرایش]
معادلات ارائه شده در بالا برای اثر ایزوتوپی فقط به واکنش هایی اشاره می کنند که می توانند با سینتیک مرتبه اول توصیف شوند. در همه مواردی که این امکان وجود ندارد، باید با استفاده از معادلات GEBIK و GEBIF، اثرات ایزوتوپی کینتیکی گذرا را در نظر گرفت.[24]
آزمایش[ویرایش]
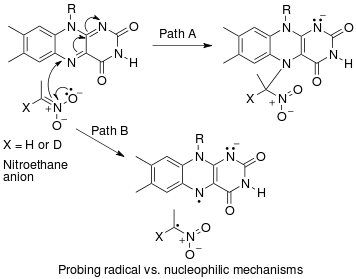
سیمونز و هارتویگ، موارد زیر را به عنوان انواع اصلی آزمایشهای اثر ایزوتوپی کینتیکی که شامل کاربردیسازی پیوند C-H میشوند، اشاره میکنند:[4]
- الف) KIE از نرخ مطلق دو واکنش موازی تعیین می شود.

در این آزمایش، ثابتهای سرعت برای بستر معمولی و ایزوتوپ نشانهدار آن به طور مستقل تعیین میشوند و اثر ایزوتوپی کاتالیتیکی (KIE) به عنوان نسبت این دو به دست میآید. دقت KIE اندازهگیری شده به شدت به دقت اندازهگیری هر یک از این ثابتهای سرعت محدود میشود. علاوه بر این، بازتولید دقیق شرایط در دو واکنش موازی میتواند بسیار چالشبرانگیز باشد. با این وجود، اندازهگیری یک اثر ایزوتوپی کاتالیتیکی بزرگ از طریق مقایسه مستقیم ثابتهای سرعت، نشاندهندهی این است که شکستن پیوند C-H در مرحلهی تعیینکنندهی سرعت رخ میدهد. (مقدار کوچکتر ممکن است نشاندهندهی اثر ایزوتوپی به دلیل پیشتعادل باشد، به طوری که شکستن پیوند C-H در جایی قبل از مرحلهی تعیینکنندهی سرعت رخ دهد.)
- ب) KIE از رقابت بین مولکولی تعیین می شود .
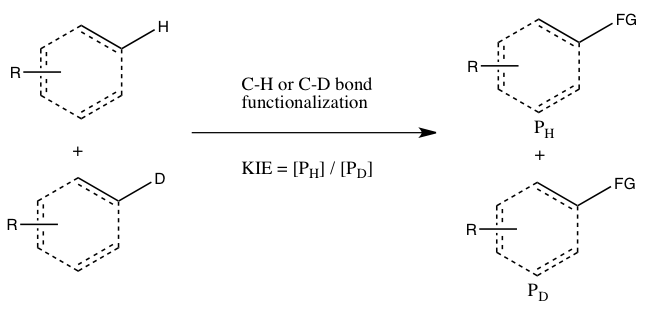
در این نوع آزمایش، از بسترهای مشابه آزمایش A استفاده میشود، اما به جای دو ظرف جداگانه، در یک ظرف مشترک با هم واکنش میدهند. اثر ایزوتوپی کاتالیتیکی (KIE) از این آزمایش با اندازهگیری مقدار نسبی محصولات تشکیلشده از عملکردیسازی C-H در مقابل C-D (یا با بررسی نسبی مواد اولیه واکنشنیافته) تعیین میشود. برای مشاهدهی اثر ایزوتوپی کاتالیتیکی، لازم است واکنش قبل از تکمیل شدن کامل متوقف شود (بخش ارزیابی را در زیر ببینید). به طور کلی، واکنش در تبدیل پایین (~ ۵ تا ۱۰ درصد تبدیل) متوقف میشود یا از مخلوط ایزوتوپی با مقدار اضافی زیاد (> ۵ برابر) استفاده میشود.[ویرایش]
این نوع آزمایش اطمینان میدهد که هر دو عملکردیسازی پیوند C-H و C-D دقیقاً تحت شرایط یکسان اتفاق میافتند و نسبت محصولات حاصل از عملکردیسازی پیوند C-H و C-D را میتوان با دقت بسیار بیشتری نسبت به ثابتهای سرعت در آزمایش A اندازهگیری کرد. علاوه بر این، تنها یک اندازهگیری از غلظت محصولات از یک نمونه واحد مورد نیاز است.
با این حال، تفسیر اثرات ایزوتوپی کاتالیتیکی مشاهده شده در این آزمایش دشوارتر است، زیرا ممکن است به این معنی باشد که شکستن پیوند C-H در طول مرحلهی تعیینکنندهی سرعت یا در مرحلهی تعیینکنندهی محصول پس از مرحلهی تعیینکنندهی سرعت رخ میدهد. به گفتهی Simmons و Hartwig، عدم وجود اثر ایزوتوپی کاتالیتیکی نشاندهندهی این است که شکستن پیوند C-H در طول مرحلهی تعیینکنندهی سرعت رخ نمیدهد.
- ج) KIE از رقابت درون مولکولی تعیین می شود .
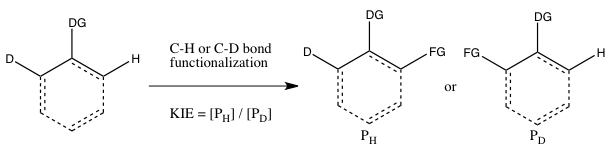
این نوع آزمایش شبیه به آزمایش B است، با این تفاوت که این بار یک رقابت درون مولکولی برای عملکردیسازی پیوند C-H یا C-D وجود دارد. در اکثر موارد، بستر دارای یک گروه هدایتکننده (DG) بین پیوندهای C-H و C-D است. محاسبه ی اثر ایزوتوپی کاتالیتیکی از این آزمایش و تفسیر آن، همان ملاحظات آزمایش B را دنبال میکند.
با این حال، نتایج آزمایش های B و C ممکن است متفاوت باشند، اگر اتصال برگشت ناپذیر بستر حاوی ایزوتوپ در آزمایش B قبل از شکستن پیوند C-H یا C-D اتفاق بیفتد. در چنین سناریویی، ممکن است در آزمایش C (جایی که انتخاب ایزوتوپ حتی پس از اتصال بستر میتواند اتفاق بیفتد) یک اثر ایزوتوپی مشاهده شود، اما در آزمایش B نه (زیرا انتخاب اینکه کدام پیوند C-H یا C-D شکسته شود، هنگامی که بستر به طور برگشت ناپذیر متصل میشود، انجام شده است).
بر خلاف آزمایش B، برای به دست آوردن یک kH/kD دقیق، نیازی به توقف واکنش در مصرف کم مواد اولیه ایزوتوپی نیست، زیرا نسبت H و D در مواد اولیه ۱:۱ است، بدون توجه به میزان تبدیل.



ارزیابی نسبت های ثابت سرعت از واکنش های رقابت بین مولکولی[ویرایش]
جایی که F 1 و F 2 به ترتیب کسر تبدیل برای گونه های ایزوتوپی A 1 و A 2 می باشند .

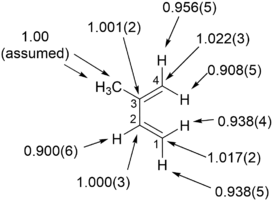
اندازه گیری اثر ایزوتوپ جنبشی در فراوانی طبیعی[ویرایش]
NMR تک پالس[ویرایش]


مثالهای توضیح مکانیسم واکنش آلی فلزی[ویرایش]





DEPT-55 NMR[ویرایش]


طیف سنجی جرمی نسبت ایزوتوپی[ویرایش]

مطالعات موردی[ویرایش]
اثرات ایزوتوپ هیدروژن اولیه[ویرایش]
اثرات ایزوتوپ جنبشی هیدروژن حلال[ویرایش]

اثرات ایزوتوپ استریک[ویرایش]
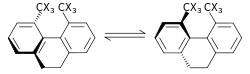
|
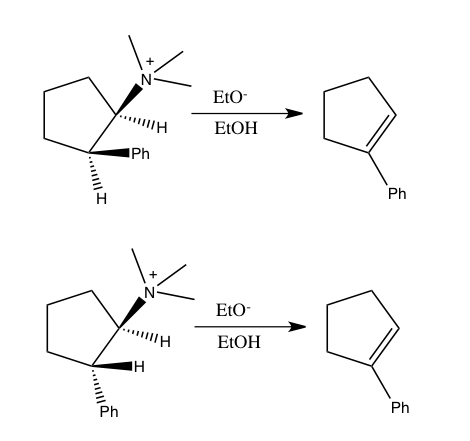
اثرات ایزوتوپ جنبشی معکوس[ویرایش]
- H 3 O + + R
 RH + + H 2 O
RH + + H 2 O - RH + + H 2 O → H 3 O + + P
اثرات ایزوتوپ کربن 13[ویرایش]
جبران تغییرات در فراوانی طبیعی 13 درجه سانتیگراد[ویرایش]
نمونه های دیگر[ویرایش]
- آزمایش متقاطع (شیمی)
- ثابت تعادل#اثر جایگزینی ایزوتوپی
- اثر ایزوتوپی بر پراکسیداسیون لیپیدی
- اثرات ایزوتوپی جنبشی RuBisCO (ریبولوز-1،5-بیس فسفات کربوکسیلاز اکسیژناز)
- اثر ایزوتوپ مغناطیسی
- مکانیسم واکنش
- شکنش ایزوتوپ جنبشی گذرا
- معادله اوری-بیگلیزن-مایر
- ↑ Lewis ES, Funderburk L (1967). "Rates and isotope effects in the proton transfers from 2-nitropropane to pyridine bases". Journal of the American Chemical Society. 89 (10): 2322–2327. doi:10.1021/ja00986a013.
- ↑ Dewar MJ, Healy EF, Ruiz JM (1988). "Mechanism of the 1,5-sigmatropic hydrogen shift in 1,3-pentadiene". Journal of the American Chemical Society. 110 (8): 2666–2667. doi:10.1021/ja00216a060.
- ↑ von Doering W, Zhao X (July 2006). "Effect on kinetics by deuterium in the 1,5-hydrogen shift of a cisoid-locked 1,3(Z)-pentadiene, 2-methyl-10-methylenebicyclo[4.4.0]dec-1-ene: evidence for tunneling?". Journal of the American Chemical Society. 128 (28): 9080–5. doi:10.1021/ja057377v. PMID 16834382.
- ↑ In this study the KIE is measured by sensitive proton NMR. The extrapolated KIE at 25 °C is 16.6 but the margin of error is high
- ↑ Kohen A, Klinman JP (July 1999). "Hydrogen tunneling in biology". Chemistry & Biology. 6 (7): R191-8. doi:10.1016/S1074-5521(99)80058-1. PMID 10381408.
- ↑ Wilde TC, Blotny G, Pollack RM (May 2008). "Experimental evidence for enzyme-enhanced coupled motion/quantum mechanical hydrogen tunneling by ketosteroid isomerase". Journal of the American Chemical Society. 130 (20): 6577–85. doi:10.1021/ja0732330. PMID 18426205.
- ↑ Truhlar DG, Gao J, Alhambra C, Garcia-Viloca M, Corchado J, Sánchez M, Villà J (2002). "The Incorporation of Quantum Effects in Enzyme Kinetics Modeling". Accounts of Chemical Research. 35 (6): 341–349. doi:10.1021/ar0100226. PMID 12069618.
- ↑ Kohen, A; Klinman, J. P (1998). "Enzyme Catalysis: Beyond Classical Paradigms". Accounts of Chemical Research. 31 (7): 397–404. doi:10.1021/ar9701225.

![{\displaystyle {\begin{matrix}\\{\ce {{CN^{-}}+{^{12}CH3-Br}->[k_{12}]{^{12}CH3-CN}+Br^{-}}}\\{\ce {{CN^{-}}+{^{13}CH3-Br}->[k_{13}]{^{13}CH3-CN}+Br^{-}}}\\{}\end{matrix}}\qquad {\text{KIE}}={\frac {k_{12}}{k_{13}}}=1.082\pm 0.008}](https://wikimedia.org/api/rest_v1/media/math/render/svg/438109ea220fd190ccc57f3e2c3726c47c24aae0)

![{\displaystyle {\frac {k_{{\ce {H}}}}{k_{{\ce {D}}}}}=\left({\frac {\sigma _{{\ce {H}}}\sigma _{{\ce {D}}}^{\ddagger }}{\sigma _{{\ce {D}}}\sigma _{{\ce {H}}}^{\ddagger }}}\right)\left({\frac {M_{{\ce {H}}}^{\ddagger }M_{{\ce {D}}}}{M_{{\ce {D}}}^{\ddagger }M_{{\ce {H}}}}}\right)^{\frac {3}{2}}\left({\frac {I_{x{\ce {H}}}^{\ddagger }I_{y{\ce {H}}}^{\ddagger }I_{z{\ce {H}}}^{\ddagger }}{I_{x{\ce {D}}}^{\ddagger }I_{y{\ce {D}}}^{\ddagger }I_{z{\ce {D}}}^{\ddagger }}}{\frac {I_{x{\ce {D}}}I_{y{\ce {D}}}I_{z{\ce {D}}}}{I_{x{\ce {H}}}I_{y{\ce {H}}}I_{z{\ce {H}}}}}\right)^{\frac {1}{2}}\left({\frac {\prod \limits _{i=1}^{3N^{\ddagger }-7}{\frac {1-e^{-u_{i{\ce {D}}}^{\ddagger }}}{1-e^{-u_{i{\ce {H}}}^{\ddagger }}}}}{\prod \limits _{i=1}^{3N-6}{\frac {1-e^{-u_{i{\ce {D}}}}}{1-e^{-u_{i{\ce {H}}}}}}}}\right)e^{-{\frac {1}{2}}\left[\sum \limits _{i=1}^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_{i{\ce {D}}}^{\ddagger })-\sum \limits _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{\ce {D}}})\right]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f26faede9d0fba35d6f675e641c716e7284c0d)



![{\displaystyle {\begin{aligned}{\frac {k_{{\ce {H}}}}{k_{{\ce {D}}}}}&\cong \exp \left\{-{\frac {1}{2}}\left[\sum \limits _{i=1}^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_{i{\ce {D}}}^{\ddagger })-\sum \limits _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{\ce {D}}})\right]\right\}\\&\cong \exp \left[\sum _{i}^{\mathrm {(react.)} }{\frac {1}{2}}\Delta u_{i}-\sum _{i}^{\mathrm {(TS)} }{\frac {1}{2}}\Delta u_{i}^{\ddagger }\right]\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20d669d624e10fcb89d116442c5543998ea4fbf8)

















![{\displaystyle {\begin{aligned}{\ce {{A1}+{B}+{C}+\cdots }}\ &{\ce {->[k_{1}]P1}}\\{\ce {{A2}+{B}+{C}+\cdots }}\ &{\ce {->[k_{2}]P2}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a3e1c66994bddc0e6b39e89f23e4e0ec7a47b5c)

![{\displaystyle {k_{1} \over k_{2}}={\frac {\ln(1-F_{1})}{\ln[1-(F_{1}R_{P}/R_{0})]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37f721659b133bfa69404286f90a8309fea92944)