الکترون هسته
الکترونهای هستهای ، الکترونهایی در یک اتم هستند که الکترونهای ظرفیت نیستند و در واکنشهای شیمیایی شرکت نمیکنند. [۱]
هسته و الکترونهای هستهای یک اتم، هسته اتم را تشکیل میدهند. الکترونهای هستهای با نیروی خیلی قوی به هسته متصل هستند. بنابراین، بر عکس الکترونهای ظرفیت، الکترونهای هستهای باجداسازی بار مثبت هسته اتم از الکترونهای ظرفیت نقش ثانویهای در پیوند و واکنشهای شیمیایی بازی میکنند. تعداد الکترونهای ظرفیتی یک عنصر میتواند با توجه به گروه جدول تناوبی آن عنصر تعیین شود (برای اطلاعات بیشتر به الکترون ظرفیتی مراجعه کنید). • برای عناصر گروه اصلی، تعداد الکترون¬های ظرفیت از 1 تا 8 (اوربیتال¬های ns و np) متغیر است. • برای فلزات واسطه، تعداد الکترون¬های ظرفیت از 3 تا 12 (اوربیتال هایns و (n-1)d) متغیر است. • برای لانتانیدها و اکتینیدها، تعداد الکترون¬های ظرفیت از 3 تا 16 (اوربیتال هایns، (n-2)f و (n-1)d) متغیر است. تمام الکترونهای غیر ظرفیتی دیگر برای اتم آن عنصر، الکترونهای هسته محسوب میشوند.[۲] نظریه مداری توضیح پیچیده تر از تفاوت میان هسته و الکترون ظرفیت را می توان با نظریه مداری بیان کرد. در اتمهایی که یک الکترون دارند، انرژی یک مدار به طور انحصاری توسط عدد کوانتوم اصلی( n) تعیین میشود. مدار n=1 کمترین انرژی ممکن را در اتم دارد. برای n بزرگ، انرژی به اندازهای افزایش مییابد که الکترون به راحتی از اتم میتواند خارج شود. در اتمهای دارای یک الکترون، تمام سطوح انرژی با همان عدد کوانتوم اصلی همگن هستند و انرژی یکسانی دارند. در اتمهایی که بیش از یک الکترون دارند ، انرژی یک الکترون به علاوه ویژگیهای مداری که در آن قرار دارد، به برهمنکش¬های آن با سایر الکترونها در مدارهای دیگر نیز بستگی دارد. این (موضوع) نیاز به در نظر گرفتن شماره کوانتومی ℓ دارد. مقادیر بالاتر ℓ با مقادیر بالاتر انرژی مرتبط هستند؛ به عنوان مثال، حالت 2p از حالت 2s بالاتر است. هنگامی که ℓ=2 باشد ، افزایش انرژی مدار به اندازهای بزرگ میشود که انرژی مدار بالاتر از انرژی مدار s در ماژول بعدی بالاتر را بزرگتر کند؛ هنگامی که ℓ=3، انرژی به ماژول دو مرحله بالاتر افزایش مییابد. پر شدن مدارهای 3d اتفاق نمیافتد مگر زمانی که مدارهای 4s پر شده باشند. افزایش انرژی زیرلایهها با افزایش تکانه زاویهای در اتمهای بزرگ به علت اثرات برهمکنش الکترون به الکترون است و به طور خاص به توانایی الکترونهای با تکانه زاویهای کمتر، برای نفوذ مؤثرتر به سمت هسته مربوط میشود، جایی که از بار الکترونهای متداخل کمتری فیلتر میشوند. بنابراین، در اتمهای با عدد اتمی بالاتر، شماره کوانتومی ℓ الکترونها به میزان بیشتری به عنوان عامل تعیینکننده در انرژی آنها اهمیت پیدا میکند و عدد کوانتومی اصلی n الکترونها به مرور زمان در تعیین مکان انرژی آنها کمتر اهمیت دارد. ترتیب انرژی ۳۵ زیرلایه اول (به عنوان مثال، 1s، 2s، 2p، 3s و غیره) در جدول زیر نشان داده میشود. هر سلول یک زیرلایه را با شماره کوانتومی اصلی n و ℓ داده شده توسط شاخصهای سطر و ستون خود نمایش میدهد. عدد در هر سلول موقعیت زیرلایه را نشان میدهد. جدول تناوبی زیر نیز بر اساس زیرلایهها سازماندهی شده است.

هسته اتمی[ویرایش]
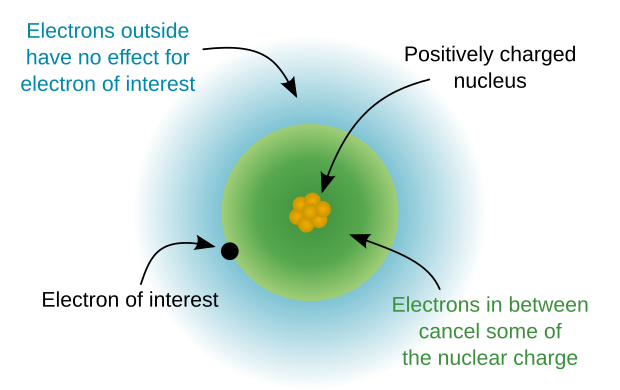
هسته اتمی به اتمی اشاره دارد که الکترونهای ظرفیتی ندارد.[۳] هسته اتم ، شامل یک بار الکتریکی مثبت به نام بار هسته می باشد که بار موثری است که توسط یک الکترون لایه خارجی تجربه می شود . به عبارت دیگر، بار هسته بیانی از نیروی جاذبه ای است که توسط الکترون های ظرفیتی به هسته یک اتم تجربه می شود که اثر محافظ الکترون های هسته را در نظر می گیرد. بار هسته میتواند با تفاضل تعداد پروتونها و تعداد الکترونهای هسته که این الکترونها به عنوان الکترون های لایه داخلی شناخته میشوند، محاسبه شود و همواره یک مقدار مثبت در اتمهای خنثی است. جرم هسته تقریباً با جرم اتم برابر است. هسته اتمی را میتوان با دقت کافی به صورت کروی شکل و متقارن در نظر گرفت. شعاع هسته حداقل سه برابر کوچکتر از شعاع اتم مربوطه است (اگر شعاع ها را با همان روش ها محاسبه کنیم). برای اتمهای سنگین، با افزایش شمار الکترون ها شعاع هسته به مقدار کمی رشد میکند. شعاع هسته سنگینترین عنصر طبیعی - اورانیوم - با شعاع یک اتم لیتیوم قابل قیاس می باشد ، درحالی که اتم لیتیوم فقط سه الکترون دارد. روش¬های شیمیایی نمی¬توانند الکترون¬های هسته را از اتم جدا کنند. هنگامی که توسط شعله یا اشعه فرابنفش یونیزه می¬شود، هسته های اتمی، به عنوان یک قاعده، نیز دست نخورده باقی می¬مانند. بار هسته یک روش مناسب برای توضیح روندها در جدول تناوبی است.[۴] از آنجاییکه بار هسته با حرکت در طول یک ردیف از جدول تناوبی افزایش مییابد، الکترونهای لایه خارجی به سمت هسته به شدت بیشتری جذب میشوند و شعاع اتم کاهش مییابد. این میتواند برای توضیح چندین روند تناوبی مانند شعاع اتم، انرژی یونش اول (IE)، الکترونگاتیویته و اکسایش استفاده شود. بار هسته را میتوان بهعنوان «عدد اتمی» منهای «همه الکترونها بهجز الکترونهای موجود در لایه بیرونی» محاسبه کرد. به عنوان مثال، کلر (عنصر 17)، با آرایش الکترونی 1s2 2s2 2p6 3s2 3p5، دارای 17 پروتون و 10 الکترون لایه داخلی است (2 در لایه اول و 8 الکترون در لایه دوم) بنابراین: بار هسته: 7=10-17 با در نظر گرفتن لایه های کامل الکترونی به عنوان "حفاظت کننده" ، بار هسته، بار خالص هسته اتم در نظر گرفته می شود. همانطور که بار هسته افزایش مییابد، الکترونهای ظرفیتی به سمت هسته با قدرت بیشتری جذب میشوند و شعاع اتم در طول دوره کاهش مییابد.
اثرات نسبیتی[ویرایش]
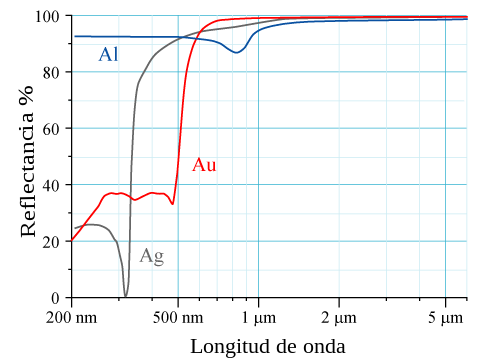
برای عناصر با عدد اتمی بالا Z، اثرات نسبیتی برای الکترونهای هسته قابل مشاهده هستند. سرعت الکترونهای هستهای s به سرعتهای نسبیتی میرسد که منجربه انقباض مدارهای 6s نسبت به مدارهای 5d میشود. ویژگیهای فیزیکی که تحت تأثیر این اثرات نسبیتی قرار میگیرند، شامل کاهش دمای ذوب جیوه و رنگ طلایی مشاهده شده در طلای طبیعی و سزیوم به دلیل تنگ شدن گستره انرژی است.[۵] طلا ظاهر زردی دارد زیرا نور آبی را بیشتر از سایر طولهای موج قابل رؤیت جذب میکند و در نتیجه نوری با رنگ زرد بازتاب میدهد.
انتقال الکترونی[ویرایش]
یک الکترون هستهای میتواند با جذب تابش الکترومغناطیسی از سطح هسته خارج شود. این فرآیند ، الکترون را به یک لایه ظرفیتی خالی تحریک میکند یا باعث می¬شود که به دلیل اثر فوتوالکتریک به صورت فوتوالکترون گسیل شود. اتم حاصل یک فضای خالی در پوسته الکترون هستهای خود خواهد داشت که به آن حفره هستهای گفته می¬شود . این در حالتی فراپایدار است و در طول 10-15 ثانیه تجزیه خواهد شد و اضافی انرژی را از طریق فلورسانس پرتو ایکس (به عنوان ایکس اختصاصی) یا از طریق اثر اوگر آزاد میکند.[۶] تشخیص انرژیی که توسط یک الکترون ظرفیتی که در یک مدار با انرژی پایینتر فرو میرود، آزاد میشود، اطلاعات مفیدی درباره ساختار الکترونی و شبکه محلی مواد ارائه میدهد. اگرچه بیشتر اوقات این انرژی به صورت فوتون آزاد میشود، اما انرژی میتواند به الکترون دیگری منتقل شود که از اتم خارج میشود. این الکترون دومی به عنوان الکترون اوگر شناخته میشود و این فرایند انتقال الکترونی با گسیل پرتو انتقالی به عنوان اثر اوگر شناخته میشود.[۷] هر اتم به استثنای هیدروژن دارای الکترونهای سطح هسته با انرژیهای پیوندی دقیق است. بنابراین امکان انتخاب یک عنصر با تنظیم انرژی ایکس-ری به لبه جذب مناسب برای بررسی وجود دارد. طیف اشعه ایجاد شده میتواند برای تعیین ترکیب عنصری یک ماده استفاده شود.
پانویس[ویرایش]
- ↑ Rassolov, Vitaly A.; Pople, John A.; Redfern, Paul C.; Curtiss, Larry A. (2001-12-28). "The definition of core electrons". Chemical Physics Letters. 350 (5–6): 573–576. Bibcode:2001CPL...350..573R. doi:10.1016/S0009-2614(01)01345-8.
- ↑ Miessler, G. L. (1999). Inorganic Chemistry. Prentice Hall.
- ↑ Harald Ibach, Hans Lüth. Solid-State Physics: An Introduction to Principles of Materials Science. Springer Science & Business Media, 2009. P.135
- ↑ Spencer, James; Bodner, George M.; Rickard, Lyman H. (2012). Chemistry : structure and dynamics (5th ed.). Hoboken, N.J: John Wiley & Sons. pp. 85–87. ISBN 978-0-470-58711-9.
- ↑ "Quantum Primer". www.chem1.com. Retrieved 2015-12-11.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "auger effect".
- ↑ "The Auger Effect and Other Radiationless Transitions". Cambridge University Press. Retrieved 2015-12-11.
