دستگاه بلوری مکعبی


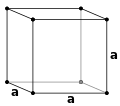
در کریستالوگرافی، دستگاه بلوری مکعبی (به انگلیسی: Cubic crystal system) به یکی از ۷ دستگاه شبکههای بلوری گفته میشود که ۳ گونه مکعبی شکل از ۱۴ شبکه براوه را دربر میگیرد؛ این دستگاه از رایجترین و ساده ترین اشکالی است که در بلورها و مواد معدنی یافت میشود.
دستگاه بلوری مکعبی در سه شکل اصلی زیر یافت میشود:
- شبکه مکعبی ساده (simple cubic) که آن را به اختصار SC یا CP مینامند.
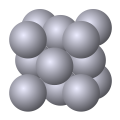
شبه فلز پولونیم تنها عنصری است که دارای این گونه مکعبی است.[3] - شبکه مکعبی مرکزپر (body-centered cubic) که آن را به اختصار BCC یا CL مینامند.
فلزات کروم، آهن (آلفا)، مولیبدن و تانتالم از جمله فلزاتی اند که دارای شبکه مکعبی BCC هستند.[1] - شبکه مکعبی وجوهپر (face-centered cubic) که آن را به اختصار FCC یا CF مینامند.
فلزات آلومینیوم، مس، طلا، سرب، نیکل، پلاتین و نقره از جمله فلزاتی اند که دارای شبکه مکعبی FCC هستند.[1]
-
مکعبی ساده SC
-
مرکزپر BCC
-
وجوهمرکزپر FCC
شبکه براوه
[ویرایش]شبکه بلوری مکعبی ساده (CP) دارای هشت نقطه شبکه در هشت گوشه سلول واحد است[1]، اتمهایی که در گوشه سلول واحد قرار دارند بهطوری مساوی بین هشت سلول واحد مجاور تقسیم میشوند بنابراین در هر سلول واحد مکعبی ساده یک (1/8*8) اتم وجود دارد. هر اتم موجود در این شبکه بلوری دارای عدد همسایگی (به انگلیسی: Coordination Number) شش است.
شبکه بلوری مکعبی مرکزپر (CL) دارای یک نقطه شبکه در مرکز و هشت نقطه شبکه در هشت گوشه سلول واحد است[1]، اتمی که در مرکز سلول واحد قرار دارد بهطور کامل متعلق به یک سلول واحد است بنابراین در هر سلول واحد مکعبی مرکز پر دو (1/8*8+1) اتم وجود دارد.[1] هر اتم در این شبکه بلوری دارای عدد همسایگی هشت است.
-
مدل فضاپرکن شبکه بلوری مکعبی مرکزپر (CL)
شبکه بلوری وجهپر (CF) دارای شش نقطه شبکه در شش وجه و هشت نقطه شبکه در هشت گوشه سلول واحد است[1]، اتمی که در وجه سلول واحد قرار گیرد بهطور مساوی بین دو سلول واحد مجاور تقسیم میشود بنابراین در هر سلول واحد مکعبی وجهپر چهار (1/8*8+1/2*6) اتم وجود دارد.[1] هر اتم در این شبکه بلوری دارای عدد همسایگی دوازده است.[1]
-
مدل فضاپرکن شبکه بلوری مکعبی وجهپر (CF)
حفرههای کریستالی
[ویرایش]حفرات در شبکه مکعبی ساده
سلول واحد مکعبی ساده دارای یک حفره (به انگلیسی: Void) مکعبی است.[2]
حفرات در شبکه مکعبی مرکز پر
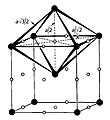
سلول واحد مکعبی مرکزپر دارای شش حفره هشت وجهی است.[2] شش حفره هشتوجهی که هر یک در مرکز یکی سطح سلول واحد قرار دارند بهطور مساوی بین دو سلول واحد تقسیم میشوند و همچنین دوازده هشتوجهی که هر یک در مرکز هر یال سلول واحد قرار گرفتهاند بهطور مساوی بین چهار سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد شش (6*1/2+12*1/4) حفره هشتوجهی در سلول واحد مکعبی مرکزپر وجود دارد. همچنین سلول واحد مکعبی مرکزپر دارای دوازده حفره چهار وجهی است.[2] چهار حفره چهار وجهی بر مرکز سطح سلول واحد قرار دارد که بهطور مساوی میان دو سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد دوازده (6*4*1/2) حفره چهار وجهی در سلول واحد مکعبی مرکز پر قرار دارد. لازم است ذکر شود که حفرات هشتوجهی و چهار وجهی ذکر شده دارای حالت عادی نیستند (یعنی طول همه یال های این حفرات با یکدیگر برابر نیست).
-
حفره کریستالی اکتاهدرال در شبکه بلوری مکعبی مرکزپر
-
حفره کریستالی تتراهدرال در شبکه بلوری مکعبی مرکزپر
حفرات در شبکه مکعبی وجهپر
سلول واحد مکعبی وجهپر دارای چهار حفره هشتوجهی است.[2] یک حفره هشتوجهی به صورت کامل در مرکز سلول واحد قرار دارد، دوازده حفره هشتوجهی نیز در مرکز هر یال سلول واحد قرار دارد که بهطور مساوی میان چهار سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد چهار (1+12*1/4) حفره هشت وجهی در سلول واحد مکعبی وجهپر وجود دارد. همچنین سلول واحد مکعبی وجهپر دارای هشت حفره چهار وجهی است.[2] حفرات هشت وجهی در این ساختار کریستالی میان هر راس و مرکز سلول قرار دارند.
-
حفره کریستالی اکتاهدرال در شبکه بلوری مکعبی وجهپر
-
حفره کریستالی تتراهدرال در شبکه بلوری مکعبی وجهپر
Atomic Packing Factor
یکی از مشخصات مهم شبکههای بلوری کسر تراکم (به انگلیسی: Atomic Packing Factor) است که برابر است با حاصل تقسیم حجم اشغال شده توسط اتمها بر حجم کل سلول واحد، این مقدار در شبکه بلوری مکعبی ساده برابر با 0.524 (که مقداری کوچک محسوب میشود[1]) است، در شبکه بلوری مکعبی مرکزپر این مقدار برابر است با 0.68 [1] و همچنین در شبکه بلوری مکعبی وجهپر این مقدار برابر است با 0.74 که از نظر ﺗﺌوری بیشترین مقدار قابل دستیابی است[1] البته ساختارهای کریستالی دیگری نیز دارای این ضریب تراکم هستند مانند ساختار شش وجهی متراکم (به انگلیسی: HCP: Hexagonal Close Packed).
جستارهای وابسته
[ویرایش]منابع
[ویرایش]1. William D. Callister, David G. Rethwisch; 2018, Materials Science And Engineering, 10th ed. pp. 50–54
2. Christopher Hammond; 2009, The Basics of Crystallography and Diffraction, 3rd ed. pp. 11–15
3. John A. Dutton e-Educational Institute Website, PennState College of Earth and Mineral Sciences; link: https://www.e-education.psu.edu/matse81/node/2131
4. Hurlbut, Cornelius S.; Klein, Cornelis, 1985، Manual of Mineralogy، 20th ed.، pp. 64 – 65, ISBN 0-471-80580-7