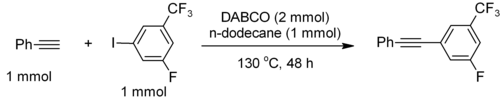DABCO
| |||
| نامها | |||
|---|---|---|---|
| نامکذاری آیوپاک
1,4-دیآزابیسایکلو[2,2,2]اکتان
| |||
| نامهای دیگر تریاتیلندیآمین، TEDA
| |||
| شناسهها | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.455 | ||
| EC Number |
| ||
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|||
| UNII | |||
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|||
| |||
| |||
| ویژگیها | |||
| C6H12N2 | |||
| جرم ملکولی | 112.176 g·mol−1 | ||
| شکل ظاهری | کریستال سفید پودرشده | ||
| نقطه ذوب | 156 to ۱۶۰ °C (313 to 320 °F; 429 to 433 K) | ||
| نقطه جوش | ۱۷۴ °C (345 °F; 447 K) | ||
| قابل انحلال، جاذب رطوبت | |||
| اسیدیته (pKa) | ۳٫۰, ۸٫۸ (در آب، برای اسید مزدوج)[۱] | ||
| خطرات | |||
| ایمنی و بهداشت شغلی (OHS/OSH): | |||
خطرات اصلی
|
زیانآور | ||
| GHS labelling: | |||
  
| |||
| Danger | |||
| H228, H302, H315, H319, H335, H412 | |||
| P210, P261, P273, P305+P351+P338 | |||
| NFPA 704
(لوزی آتش) |
|||
| نقطه اشتعال | ۶۲ °C (144 °F; 335 K) | ||
| Related compounds | |||
ترکیبات مرتبط
|
کوینوکلیدین تروپان | ||
به غیر از موارد ذکر شده، دادهها در شرایط استاندارد بدست آمدهاست (at 25 °C [77 °F], 100 kPa).
| |||
۱٬۴-دیآزابیسایکلو[۲٬۲,۲]اکتان (به اختصار DABCO) که بنام تریاتیلندیآمین (به اختصار TEDA) نیز شناخته میشود، یک ترکیب آلی دوحلقهایست با فرمول شیمیایی . این جامد بیرنگ یک آمین نوع سوم و باز قویا هسته دوست است که به عنوان کاتالیزور و معرف در پلیمریزاسیون و سنتزهای آلی کاربرد دارد.[۳]
ساختمان آن شبیه کوینوکلیدین است که کربن انتهاییاش با ازت جایگزین شده باشد.
واکنشها
[ویرایش]مقدار pKa برای [HDABCO]+ (مشتق پروتونه) برابر ۸٫۸ است که تقریباً مانند آلکیلآمینهای دیگر است. هسته دوستی آمین به این دلیل زیاد است که مراکز آمینی آن بدون ممانعت فضایی است. این ماده برای جفت شدن C-C انتهایی استیلنی، مثل فنیلاستیلن با آیودورنهای با کمبود الکترون به قدر کافی قلیایی است.
کاتالیزور
[ویرایش]DABCO به عنوان کاتالیزور قلیایی برای موارد زیر استفاده میشود:
- شکلگیری پلیاورتان از الکل و ایزوسیانات بصورت مونومر و پلیمرها.[۴]
- واکنش بیلیس-هیلمن آلدئیدها و همچنین کتون و آلدئیدهای غیر اشباع.[۵]
باز لوییس
[ویرایش]به عنوان آمینی که ممانعت فضایی ندارد، یک لیگاند و باز لوییس قوی محسوب میشود و میتواند با هیدروژنپراکساید[۶] و سولفوراکساید[۷] به نسبت ۲:۱ تشکیل بلور دهد.
سنتز مونومر یونی
[ویرایش]DABCO میتواند در سنتز مونومرهای دوبارشارژ استایرنی بکار گرفته شود. مونومرهای یونی اجازه دارند تا در سنتز پلیالکترولیت و یونومرهای با دو کاتیون آمونیوم چهارتایی حلقوی، بر روی هر گروه یونی متصل شوند.[۸]
DABCO و آمینهای مرتبط آنتیاکسیدانهای مؤثری در حذف اکسیژن تکالکترونی بوده،[۹] و به همین دلیل در بهبود طول عمر رنگها کاربرد دارند. این ویژگی DABCO، در لیزرهای رنگی و در استقرار نمونههای میکروسکوپ فلوئورسانس (زمانی که با گلیسرول و PBS بکار میروند) بسیار کاربرد دارد.[۱۰] همچنین DABCO میتواند برای دمتیله کردن (متیل زدایی) نمکهای آمین نوع چهارم با حرارت در دیمتیلفرمامید (DMF) بکار رود.[۱۱]
تولید
[ویرایش]این ماده با واکنش حرارتی ترکیبات از نوع H2NCH2CH2X (X = OH, NH2, or NHR) در حضور کاتالیزورهای زئولیتی تهیه میشود. یک روش ایدهآل تهیه، با تبدیل از اتانولآمین نشان داده شدهاست:[۱۲]
3 H2NCH2CH2OH → N(CH2CH2)3N + NH3 + 3 H2O
کاربردها
[ویرایش]در سیستمهای محافظتی، فیلتر کربن فعال ماسکهای شیمیایی و بیولوژیک و نظایر آن، DABCO بکار میرود.[۱۳]
منابع
[ویرایش]- ↑ D. H. Ripin; D. A. Evans (2002). "pKa's of Nitrogen Acids" (PDF).
- ↑ "Safety data for 1,4-diazabicyclo[2.2.2]octane (see MSDS)".
- ↑ Uppuluri V. Mallavadhani, Nicolas Fleury-Bregeot. "1,4-Diazabicyclo [2.2.2]octane".
- ↑ "Polyurethane additives guide" (PDF). Air Products & Chemicals. Archived from the original (PDF) on 2016-03-06.
- ↑ Baylis, A. B. ; Hillman, M. E. D. German Patent 2155113, 1972.
- ↑ P. Dembech, A. Ricci, G. Seconi, and M. Taddei "Bis(trimethylsilyl) Peroxide" Org.
- ↑ Ludovic Martial and Laurent Bischoff "Preparation of DABSO from Karl-Fischer Reagent" Org.
- ↑ Zhang, K.; Drummey, K. J.; Moon, N. G.; Chiang, W. D.; Long, T. E. (2016). "Styrenic DABCO salt-containing monomers for the synthesis of novel charged polymers". Polymer Chemistry. 7 (20): 3370–3374. doi:10.1039/C6PY00426A. hdl:10919/77569.
- ↑ Ouannes, C.; Wilson, T. (1968). "Quenching of singlet oxygen by tertiary aliphatic amines. Effect of DABCO (1,4-diazabicyclo[2.2.2]octane)". Journal of the American Chemical Society. 90 (23): 6527–6528. doi:10.1021/ja01025a059.
- ↑ Valnes, K.; Brandtzaeg, P. (1985). "Retardation of immunofluorescence fading during microscopy". Journal of Histochemistry and Cytochemistry. 33 (8): 755–761. doi:10.1177/33.8.3926864. PMID 3926864.
- ↑ Ho, T. L. (1972). "Dealkylation of Quaternary Ammonium Salts with 1,4-Diazabicyclo[2.2.2]octane". Synthesis. 1972 (12): 702. doi:10.1055/s-1972-21977.
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a02_001
- ↑ Mahle, J.; et al. (2010). "Role of TEDA as an Activated Carbon Impregnant for the Removal of Cyanogen Chloride from Air Streams: Synergistic Effect with Cu(II)". Journal of Physical Chemistry C. 114 (47): 20083–20090. doi:10.1021/jp106730j. Retrieved 2022-03-17.