هیبریداسیون اوربیتال


هیبریداسیون اوربیتال (به انگلیسی: Orbital hybridisation) فرآیندیست در شیمی کوانتومی که طی آن اوربیتالهای اتمها با یکدیگر ترکیب شده و اوربیتالهای مولکولی یا پیوندی را با شکل، انرژی و مشخصات متفاوت ایجاد میکنند که مسئولیت ایجاد پیوند شیمیایی را بر عهده دارند.[۱]
تاریخچه[ویرایش]
شیمیدان لینوس پاولینگ برای اولین بار در سال 1931 نظریه هیبریداسیون را برای توضیح ساختار مولکول های ساده مانند متان (CH4) با استفاده از اوربیتال های اتمی توسعه داد. پاولینگ اشاره کرد که یک اتم کربن با استفاده از یک s و سه اوربیتال p چهار پیوند تشکیل می دهد، بنابراین "ممکن است استنباط شود" که یک اتم کربن سه پیوند در زاویه قائمه (با استفاده از اوربیتال های p) و چهارمین پیوند ضعیف تر با استفاده از اوربیتال مداری s در برخی جهت دلخواه تشکیل می دهد. در واقع، متان دارای چهار پیوند C-H با قدرت معادل است. پاولینگ فرض میکرد که در حضور چهار اتم هیدروژن، اوربیتالهای s و p چهار ترکیب معادل را تشکیل میدهند که او اوربیتالهای ترکیبی نامید. هر هیبرید برای نشان دادن ترکیب آن با sp3 نشان داده می شود و در امتداد یکی از چهار پیوند C-H هدایت می شود. این مفهوم برای چنین سیستمهای شیمیایی ساده توسعه داده شد، اما این رویکرد بعداً به طور گستردهتری به کار رفت و امروزه به عنوان یک اکتشافی مؤثر برای منطقی کردن ساختارهای ترکیبات آلی در نظر گرفته میشود. این تصویر مداری ساده ای معادل ساختارهای لوئیس می دهد.
انواع هیبریداسیون[ویرایش]
برای مثال ساختار الکترونی اتم کربن به صورت زیر است:
حال انواع هیبرید اتم کربن به صورت زیر خواهد بود:
هیبریدSP[ویرایش]
هیبریداسیون sp، دارای ساختار خطی با زاویه 180درجه در مولکول آن است که در این مدل، اوربیتال 2s و یکی از اوربیتالهای 2p، برای تشکیل دو اوربیتال sp هیبرید میشوند که هرکدام، دارای 50 درصد خاصیت s و ۵۰ درصد خاصیت p هستند.
-
 ساختار الکترونی
ساختار الکترونی -
 مولکول
مولکول
هیبرید SP2[ویرایش]
برای هر اتم کربن، یک اوربیتال 2s و دو اوربیتال 2p هیبرید میشوند و سه اوربیتال sp2 و یک اوربیتال 2p ایجاد میشود. برای مولکول کربن sp2 هیبرید می شود، زیرا یک پیوند (pi) برای پیوند دوگانه بین کربن ها لازم است و تنها سه پیوند سیگما(σ)در هر اتم کربن تشکیل می شود. در هیبریداسیون sp2 اوربیتال 2s تنها با دو اوربیتال از سه اوربیتال 2p موجود مخلوط می شود که معمولاً 2px و 2py نشان داده می شوند. سومین اوربیتال 2p (2pz) بدون هیبرید باقی می ماند. ساختار هر مولکول کربن، به صورت سهضلعی مسطح خواهد بود.
-
 ساختار الکترونی
ساختار الکترونی -
 مولکول
مولکول
هیبریدSP3[ویرایش]
در هیبرید SP3 اوربیتال 2S با هر سه اوربیتال 2P هیبرید SP3 تشکیل می دهد که هر کدام از اوربیتال ها 75% خواصیت اوربیتال 2P و 25% خواصیت 2S را دارند. ساختار مولکول در این هیبرید یک چهار وجهی خواهد بود. زاویه پیوند ها 109 درجه خواهد بود.
-
 ساختار الکترونی
ساختار الکترونی -
 مولکول
مولکول
شکل هیبرید اتم های مختلف[ویرایش]
هیبریداسیون به توضیح شکل مولکول کمک می کند، زیرا زوایای بین پیوندها تقریباً برابر با زاویه بین اوربیتال های هیبریدی است. این در تضاد با نظریه دافعه جفت الکترون لایه ظرفیتی (VSEPR) است که میتواند برای پیشبینی هندسه مولکولی بر اساس قوانین تجربی به جای نظریههای پیوند ظرفیت یا مداری استفاده شود.
هیبریداسیون spx[ویرایش]
از آنجایی که اوربیتال های ظرفیت عناصر گروه اصلی اوربیتال های یک s و سه p با قانون هشتگانه مربوطه هستند، هیبریداسیون spx برای مدل سازی شکل این مولکول ها استفاده می شود.
| مثال | هیبریداسیون | هندسه | عدد همسایگی |
|---|---|---|---|
| CO2 | SP(180°) | خطی | 2 |
| BCl3 | SP2(120°) | مسطح مثلثی | 3 |
| CCl4 | SP3(109.5°) | چهاروجهی | 4 |
هیبریداسیون spxdy[ویرایش]
از آنجایی که اوربیتال های ظرفیت فلزات واسطه پنج اوربیتال d، یک s و سه p با قانون 18 الکترونی مربوطه هستند، هیبریداسیون spxdy برای مدل سازی شکل این مولکول ها استفاده می شود. این مولکولها به دلیل اوربیتالهای d مختلف درگیر، تمایل دارند شکلهای متعددی داشته باشند که مربوط به هیبریداسیون یکسان است. یک مجتمع مسطح مربع دارای یک اوربیتال p خالی است و از این رو دارای 16 الکترون ظرفیت است.
هیبریداسیون sdx[ویرایش]
در کمپلکسهای فلزات واسطهای با تعداد الکترون d کم، اوربیتالهای p خالی هستند و از هیبریداسیون sdx برای مدلسازی شکل این مولکولها استفاده میشود.

تاثیر هیبرید بر طول پیوند و ΔE در مولکول کربن[ویرایش]
ایجاد هیبرید باعث تغیر در طول پیوند بین اتم ها و دنبال آن تغیر انرژی درونی داریم. انرژی درونی با فرمول زیر بدست می آید:
ΔE= ΔEstrain+ΔEint
-
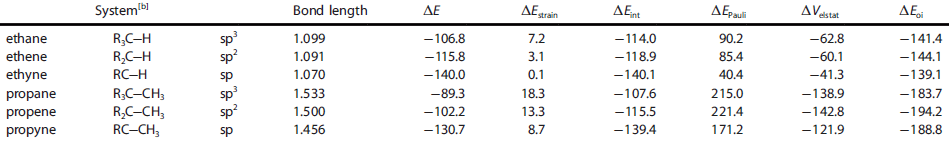 ایجاد هیبرید باعث تغیر در طول پیوند و قدرت پیوند میشود که در نتیجه آن انرژی درونی آن نیز تغیر میکند.
ایجاد هیبرید باعث تغیر در طول پیوند و قدرت پیوند میشود که در نتیجه آن انرژی درونی آن نیز تغیر میکند.
طیف فتوالکترون[ویرایش]
یک تصور اشتباه در مورد هیبریداسیون مداری این است که به اشتباه طیف فوتوالکترون فرابنفش بسیاری از مولکول ها را پیش بینی می کند. در حالی که این درست است اگر قضیه کوپمنز برای هیبریدهای موضعی به کار رود، مکانیک کوانتومی ایجاب می کند که تابع موج (در این مورد یونیزه) از تقارن مولکول که دلالت بر رزونانس در نظریه پیوند ظرفیت دارد، تبعیت کند. به عنوان مثال، در متان، حالات یونیزه شده (+CH4) را می توان از چهار ساختار رزونانس ساخت که الکترون جدا شده را به هر یک از چهار اوربیتال sp3 نسبت می دهد. تفاوت انرژی بین هر حالت یونیزه شده و حالت پایه، انرژی یونیزاسیون خواهد بود، که دو مقدار را با نتایج تجربی مطابقت دارد.
هیبریداسیون در نظریه محاسباتیVB[ویرایش]
در حالی که مدل ساده هیبریداسیون مداری معمولاً برای توضیح شکل مولکولی استفاده می شود، هیبریداسیون زمانی که در برنامه های پیوند ظرفیتی مدرن محاسبه می شود به طور متفاوتی استفاده می شود. به طور خاص، هیبریدسازی از پیش تعیین نشده است، اما در عوض به صورت متغیر برای یافتن راه حل کمترین انرژی بهینه شده و سپس گزارش می شود.این بدان معنی است که تمام محدودیت های مصنوعی، به ویژه دو محدودیت، در هیبریداسیون مداری برداشته می شوند:
- که هیبریداسیون به مقادیر صحیح محدود می شود (هیبریداسیون هم ظرفیتی)
- که اوربیتال های هیبریدی متعامد با یکدیگر هستند (نقایص هیبریداسیون)
این بدان معناست که در عمل، اوربیتالهای ترکیبی با ایدههای سادهای که معمولاً آموزش داده میشود مطابقت ندارند و بنابراین در مقالات محاسباتی علمی به سادگی به عنوان هیبریدهای spx، spxdy یا sdx برای بیان ماهیت خود بهجای مقادیر صحیحتر خاصتر نامیده میشوند.
عیوب هیبریداسیون[ویرایش]
هیبریداسیون اوربیتالهای s و p برای تشکیل هیبریدهای موثر spx مستلزم آن است که آنها دارای وسعت شعاعی قابل مقایسه باشند. در حالی که اوربیتال های 2p به طور متوسط کمتر از 10 درصد بزرگتر از 2s هستند، که بخشی از آن به فقدان گره شعاعی در اوربیتال های 2p مربوط می شود، اوربیتال های 3p که دارای یک گره شعاعی هستند، 20 تا 33 درصد از اوربیتال های 3s فراتر می روند. تفاوت در وسعت اوربیتال های s و p در یک گروه بیشتر می شود. هیبریداسیون اتم ها در پیوندهای شیمیایی را می توان با در نظر گرفتن اوربیتال های مولکولی موضعی، به عنوان مثال با استفاده از اوربیتال های مولکولی موضعی طبیعی در یک طرح اوربیتال پیوند طبیعی (NBO) تجزیه و تحلیل کرد. در متان، CH4، نسبت p/s محاسبهشده تقریباً 3 است که با هیبریداسیون «ایدهآل» sp3 مطابقت دارد، در حالی که برای سیلان، SiH4، نسبت p/s نزدیکتر به 2 است. روند مشابهی برای سایر عناصر 2p دیده می شود. جایگزینی فلوئور به جای هیدروژن باعث کاهش بیشتر نسبت p/s می شود. عناصر 2p هیبریداسیون تقریبا ایده آل را با اوربیتال های هیبریدی متعامد نشان می دهند. برای عناصر بلوک p سنگین تر، این فرض متعامد قابل توجیه نیست. این انحرافات از هیبریداسیون ایده آل توسط Kutzelnigg، نقص هیبریداسیون نامیده شد. با این حال، گروههای محاسباتی VB مانند Gerratt، Cooper و Raimondi (SCVB) و همچنین Shaik و Hiberty (VBSCF) یک قدم فراتر میروند تا استدلال کنند که حتی برای مولکولهای مدل مانند متان، اتیلن و استیلن، اوربیتالهای ترکیبی از قبل معیوب هستند. غیر متعامد، با هیبریداسیون هایی مانند sp1.76 به جای sp3 برای متان.
جستارهای وابسته[ویرایش]
منابع[ویرایش]
- ↑ Not Carbon s–p Hybridization, but Coordination Number Determines C@H and C@C Bond Length (doi.org/10.1002/chem.202004653)
)








