ترکیبات آروماتیک
ترکیبات آروماتیک ترکیبات آلی هستند که به عنوان «هیدروکربنهای آروماتیک (معطر) تک حلقهای یا چند حلقهای» نیز شناخته میشوند.[۱] عضو اصلی آنها بنزن است. هتروآرینها ارتباط نزدیکی با هم دارند، زیرا حداقل یک اتم کربن از گروه CH با یکی از ناجوراتمهای اکسیژن، نیتروژن یا گوگرد جایگزین میشود. نمونههایی از ترکیبات غیر بنزنی با خواص آروماتیک میتوان از فوران، یک ترکیب هتروسیکلیک با یک حلقه پنج عضوی که شامل یک اتم اکسیژن است، یا پیریدین، یک ترکیب هتروسیکلیک با یک حلقه شش عضوی حاوی یک اتم نیتروژن است، نام برد.
مدل حلقه بنزنی[ویرایش]

بنزن،، سادهترین هیدروکربن آروماتیک است و در بین هیدروکربنهای آروماتیک اولین هیدروکربنی است که به این نام، نامگذاری شد. ماهیت پیوند آن برای اولین بار توسط آگوست ککوله در قرن ۱۹ شناسایی شد. هر اتم کربن در چرخه شش ضلعی دارای چهار الکترون برای اشتراک گذاری است. یکی از الکترونها به اتم هیدروژن پیوند میدهد و به هر دو اتم کربن همسایه هر کدام ۱ الکترون پیوند میدهد. دیگر یک الکترون باقیمانده با یکی از دو اتم کربن همسایه به اشتراک گذاشته میشود، بنابراین در حلقه بنزن یک کربن یک پیوند دوگانه با یکی از کربنهای همسایه ایجاد کردهاست و با اتم کربن دیگر، یک پیوند یگانه ایجاد شدهاست، به همین دلیل است که در برخی موارد از نمایش دادن مولکول بنزن آن را به صورت شش ضلعی با پیوند یگانه و دوگانه به صورت یکی در میان به تصویر میکشند.
نمایشهای دیگر از این ساختار، ساختار شش ضلعی را با دایره ای در داخل آن به تصویر میکشند تا نشان دهند که شش الکترون در اطراف اوربیتالهای مولکولی غیرمحلی به اندازه خود حلقه، شناور هستند. این نشاندهنده ماهیتی معادل با شش پیوند کربن-کربن در مولکول بنزن است که همگی از مرتبه پیوند ۱٫۵ هستند. که این خاصیت توسط ساختار رزونانسی توضیح داده شدهاست. الکترونها به صورت شناور در بالا و زیر حلقه تجسم میشوند که با میدانهای الکترومغناطیسی که تولید میکنند حلقه را صاف نگه میدارند.
خواص کلی هیدروکربنهای آروماتیک:
- معطر هستند و خصلت آروماتیکی از خود نشان میدهند.
- نسبت کربن به هیدروژن در آنها بالاست.
- با شعله ای با رنگ زرد دودهای تندی میسوزند زیرا نسبت کربن به هیدروژن بالایی دارند.
- تحت واکنشهای جایگزینی الکتروفیل و جانشینیهای آروماتیک نوکلئوفیل قرار میگیرند.
نماد دایره برای آروماتیک بودن توسط سِر رابرت رابینسون و شاگردش جیمز آرمیت در سال ۱۹۲۵ معرفی شد[۲] و از سال ۱۹۵۹ توسط کتاب درسی موریسون و بوید در مورد شیمی آلی رایج شد. تعریف و استفاده صحیح از نظر علمی از این نماد مورد بحث است زیرا: برخی از نشریات از آن برای هر سیستم π چرخه ای استفاده میکنند، در حالی که برخی دیگر از نشریات فقط برای سیستمهای π ای که از قانون هوکل پیروی میکنند، استفاده میکنند که بهطور اختصاصی[۳] استدلال میکند که مطابق با پیشنهاد اصلی رابینسون، استفاده از نماد دایره باید به سیستمهای تک حلقه ای ۶ π-الکترونی محدود شود. به این ترتیب نماد دایره برای پیوند شش الکترونی شش مرکزی را میتوان با نماد Y برای پیوند دو الکترونی سه مرکزی مورد استفاده قرار میگیرد.
واکنشها[ویرایش]
سیستمهای دارای حلقه آروماتیک در بسیاری از واکنشهای آلی شرکت میکنند.
جایگزینی آروماتیک[ویرایش]

در جایگزینی آروماتیک، یک جایگزین روی حلقه آرن، معمولاً هیدروژن، با جایگزین دیگری جایگزین میشود. دو نوع اصلی جایگزینی آروماتیک الکتروفیلیک زمانی که معرف فعال، یک الکتروفیل است و جایگزینی آروماتیک هسته دوست زمانی که معرف، یک هسته دوست است وجود دارد. در جایگزینی آروماتیک رادیکال-هسته دوست، معرف فعال یک رادیکال است. نمونه ای از جایگزینی آروماتیک الکتروفیل نیتراسیون سالیسیلیک اسید است:[۴]
واکنشهای جفت شدن[ویرایش]
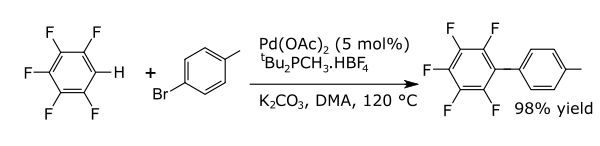
در واکنشهای جفت شدن، یک فلز، جفت بین دو قطعه رادیکال قراردادی را کاتالیز میکند. واکنشهای جفت شدن رایج با آرنها منجر به تشکیل پیوندهای کربن-کربن جدید میشود، به عنوان مثال، آلکیلآرنها، وینیلآرنها، بیریلها، پیوندهای کربن-نیتروژن جدید (آنیلینها) یا پیوندهای کربن-اکسیژن جدید (ترکیبات آریلوکسی) دارند. به عنوان مثال، آریلاسیون مستقیم پرفلوئوروبنزنها[۵] است.
هیدروژناسیون[ویرایش]

هیدروژنه کردن آرنها باعث ایجاد حلقههای اشباع شده میشود. ترکیب ۱-نفتول بهطور کامل به مخلوطی از ایزومرهای دکالین-ال احیا میشود.[۶]
ترکیب رزورسینول، هیدروژنه شده با نیکل رینی در حضور سدیم هیدروکسید آبی، باعث تشکیل یک انولات میشود که با متیل یدید به ۲-متیل-۱٬۳-سیکلوهگزاندیون آلکیله میشود:[۷]
حلقه زایی[ویرایش]
واکنشهای حلقه زایی معمول نیستند. در واکنش حرارتی غیرمعمول دیلز-آلدر، آرنها را در واکنش واگنر-ژائورگ میتوان یافت. دیگر واکنشهای حلقه زایی فتوشیمیایی با آلکنها از طریق برانگیخته پار انجام میشود.
آروماتیزاسیون[ویرایش]
در واکنشهای آروماتیزاسیون، آروماتیک بودن واکنش دهنده برای همیشه از بین میرود.
بنزن و مشتقات بنزن[ویرایش]
مشتقات بنزن دارای یک تا شش استخلاف هستند که به هسته مرکزی بنزن متصل هستند. نمونههایی از ترکیبات بنزن با تنها یک استخلاف عبارتند از : فنل، که حامل یک گروه هیدروکسیل است، و تولوئن با یک گروه متیل است. هنگامی که بیش از یک استخلاف روی حلقه وجود دارد، رابطه فضایی آنها مهم میشود که برای آن الگوهای استخلافی ارتو، متا و پارا ابداع میشوند. به عنوان مثال، سه ایزومر برای کرزول وجود دارد، زیرا گروه متیل و گروه هیدروکسیل را میتوان در کنار یکدیگر قرار داد (اورتو)، یک موقعیت را از یکدیگر جدا کرد (متا)، یا دو موقعیت را از یکدیگر جدا کرد (پارا). زایلنول علاوه بر گروه هیدروکسیل دارای دو گروه متیل است و برای این ساختار ۶ ایزومر وجود دارد.
- برخی از مشتقات بنزن
حلقه آرن قابلیت بارها تثبیت شدن را دارد. به عنوان مثال، این در فنل (C6H5 -OH)، که در هیدروکسیل (OH) اسیدی است، دیده میشود، زیرا بار روی این اکسیژن (آلکوکسید –O−) تا حدی به حلقه بنزن تبدیل میشود.
سایر هیدروکربنهای آروماتیک تک حلقه ای[ویرایش]
سایر هیدروکربنهای آروماتیک تک حلقه ای عبارتند از سیکلوتترادکاهپتاان یا سیکلواکتادکانوناان.
هیدروکربنهای آروماتیک چند حلقه[ویرایش]
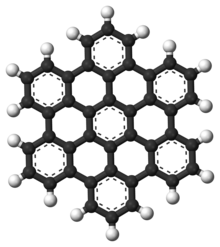
هیدروکربنهای آروماتیک چند حلقه ای (PAHs) هیدروکربنهای آروماتیک هستند که از چندین حلقه آروماتیک تشکیل شدهاند و حاوی ناجوراتم یا حامل استخلاف نیستند.[۸] نفتالین از سادهترین نمونه PAH هاست. PAHها در ذخایر نفت، زغال سنگ و قطران وجود دارند و به عنوان محصولات جانبی سوختن سوخت (چه سوخت فسیلی یا زیست توده) تولید میشوند. آنها به علت آلایندگی تولید شده هنگام سوختن نگران کننده هستند زیرا برخی از ترکیبات آلایندهها به عنوان سرطان زا، جهش زا و تراتوژن شناسایی شدهاند. PAHها همچنین در غذاهای پخته شده یافت میشوند. مطالعات نشان دادهاست که سطوح بالایی از PAHها، به عنوان مثال، در گوشت پخته شده در دمای بالا مانند فرایند پخت کباب، یا در ماهی دودی یافت میشود.[۹][۱۰][۱۱]
آنها همچنین در محیط بین ستاره ای، در دنباله دارها و در شهاب سنگها نیز یافت میشوند و یک مولکول نامزد برای درنظرگیری به عنوان مولکولهای پایه ای برای اولین شکلهای حیات هستند. در گرافن، موتیف PAH به ورقههای بزرگ ۲ بعدی گسترش یافتهاست.
جستارهای وابسته[ویرایش]
- جایگزینهای آروماتیک: آریل، آریلوکسی و آرنیدیل
- آسفالتین
- هیدرودآلکیلاسیون
- حلقههای آروماتیکی ساده
- اکسید رودیوم پلاتین، کاتالیزوری که برای هیدروژنه کردن ترکیبات آروماتیک استفاده میشود.
منابع[ویرایش]
- ↑ https://goldbook.iupac.org/terms/view/A00435.
{{cite web}}: Missing or empty|title=(help) - ↑ Armit, James Wilkins; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. 127: 1604–1618.
- ↑ Jensen, William B. (April 2009). "The circle symbol for aromaticity" (PDF). J. Chem. Educ. 86 (4): 423–424. Bibcode:2009JChEd..86..423J. doi:10.1021/ed086p423.
- ↑ Webb, K.; Seneviratne, V. (1995). "A mild oxidation of aromatic amines". Tetrahedron Letters. 36 (14): 2377–2378. doi:10.1016/0040-4039(95)00281-G.
- ↑ Lafrance, M.; Rowley, C.; Woo, T.; Fagnou, K. (2006). "Catalytic intermolecular direct arylation of perfluorobenzenes". Journal of the American Chemical Society. 128 (27): 8754–8756. CiteSeerX 10.1.1.631.607. doi:10.1021/ja062509l. PMID 16819868.
- ↑ Meyers, A. I.; Beverung, W. N.; Gault, R., "1-Naphthol", Org. Synth., 51: 103; Coll. Vol., 6
{{citation}}: Missing or empty|title=(help) - ↑ Noland, Wayland E.; Baude, Frederic J., "Ethyl Indole-2-carboxylate", Org. Synth., 41: 56; Coll. Vol., 5
{{citation}}: Missing or empty|title=(help) - ↑ Fetzer, J. C. (2000). "The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons". Polycyclic Aromatic Compounds. New York: Wiley. 27 (2): 143. doi:10.1080/10406630701268255. ISBN 0-471-36354-5.
- ↑ "Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects" (PDF). European Commission, Scientific Committee on Food. December 4, 2002.
- ↑ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA (1983). "Polycyclic aromatic hydrocarbons in grilled food". J. Agric. Food Chem. 31 (4): 867–873. doi:10.1021/jf00118a049. PMID 6352775.
- ↑ "Polycyclic Aromatic Hydrocarbons (PAHs)". Agency for Toxic Substances and Disease Registry. 1996.