محلول بافر: تفاوت میان نسخهها
FreshmanBot (بحث | مشارکتها) جز ←کاربرد بافرها: replaced: ه ی ← هٔ ، میتوان ← میتوان با ویرایشگر خودکار فارسی |
برچسبها: ویرایش همراه ویرایش از وبگاه همراه |
||
| خط ۸: | خط ۸: | ||
! نام !!ساختار !! [[ثابت تفکیک اسیدی]]<br>در ۲۵°C !! دامنه بافری !! Temp Effect<br>''d''pH/''d''T in (1/K)<ref>{{Cite web|title=Buffer Reference Center |url=http://www.sigmaaldrich.com/life-science/core-bioreagents/biological-buffers/learning-center/buffer-reference-center.html |publisher=Sigma-Aldrich | accessdate=2009-04-17}}</ref> !! جرم مولی |
! نام !!ساختار !! [[ثابت تفکیک اسیدی]]<br>در ۲۵°C !! دامنه بافری !! Temp Effect<br>''d''pH/''d''T in (1/K)<ref>{{Cite web|title=Buffer Reference Center |url=http://www.sigmaaldrich.com/life-science/core-bioreagents/biological-buffers/learning-center/buffer-reference-center.html |publisher=Sigma-Aldrich | accessdate=2009-04-17}}</ref> !! جرم مولی |
||
|- |
|- |
||
| [[تیایپیاس (بافر)]]|| [[file:TAPS.svg|200px]] || |
| [[تیایپیاس (بافر)]]|| [[file:TAPS.svg|200px]] || ۸٫58 || ۷٫۷–۹٫۱ || −۰٫۰۱۸ || ۲۴۳٫۳ |
||
|- |
|- |
||
| [[بیسین]] ||[[file:Bicine.png|150px]] || ۸٫۳۵ || ۷٫۶–۹٫۰ || −۰٫۰۱۸ || ۱۶۳٫۲ |
| [[بیسین]] ||[[file:Bicine.png|150px]] || ۸٫۳۵ || ۷٫۶–۹٫۰ || −۰٫۰۱۸ || ۱۶۳٫۲ |
||
نسخهٔ ۲۳ ژانویهٔ ۲۰۲۰، ساعت ۰۷:۳۱
| اسیدها و بازها |
|---|
 |
| انواع اسید |
| انواع باز |
محلول بافر(به انگلیسی: Buffer solution) یک محلول شیمیایی است که از یک اسید ضعیف و نمک آن یا یک باز ضعیف و نمک آن ساخته میشود. محلولهای بافر توانایی حفظ پیاچ محلول را حتی در صورت افزودن اندکی باز یا اسید دارند. خون یک نمونه مهم از این نوع محلولها است.[۱]
بافرهای مشهور در زیستشناسی
جدول زیر نام و مشخصات برخی بافرهای مشهور راربیان کردهاست:[۲]
| نام | ساختار | ثابت تفکیک اسیدی در ۲۵°C |
دامنه بافری | Temp Effect dpH/dT in (1/K)[۳] |
جرم مولی |
|---|---|---|---|---|---|
| تیایپیاس (بافر) |  |
۸٫58 | ۷٫۷–۹٫۱ | −۰٫۰۱۸ | ۲۴۳٫۳ |
| بیسین |  |
۸٫۳۵ | ۷٫۶–۹٫۰ | −۰٫۰۱۸ | ۱۶۳٫۲ |
| Tris |  |
۸٫۰۶ | ۷٫۵–۹٫۰ | −۰٫۰۲۸ | ۱۲۱٫۱۴ |
| Tricine | 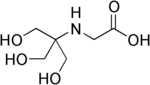 |
۸٫۰۵ | ۷٫۴–۸٫۸ | −۰٫۰۲۱ | ۱۷۹٫۲ |
| تپسو (بافر) |  |
۷٫۶۳۵ | ۷٫۰-۸٫۲ | ۲۵۹٫۳ | |
| هاشئیپیئیاس |  |
۷٫۴۸ | ۶٫۸–۸٫۲ | −۰٫۰۱۴ | ۲۳۸٫۳ |
| تیایاس (بافر) |  |
۷٫۴۰ | ۶٫۸–۸٫۲ | −۰٫۰۲۰ | ۲۲۹٫۲۰ |
| اماوپیاس |  |
۷٫۲۰ | ۶٫۵–۷٫۹ | −۰٫۰۱۵ | ۲۰۹٫۳ |
| پی آی پی ای اس |  |
۶٫۷۶ | ۶٫۱–۷٫۵ | −۰٫۰۰۸ | ۳۰۲٫۴ |
| کاکودیلیک اسید |  |
۶٫۲۷ | ۵٫۰–۷٫۴ | ۱۳۸٫۰ | |
| امایاس (بافر) |  |
۶٫۱۵ | ۵٫۵–۶٫۷ | −۰٫۰۱۱ | ۱۹۵٫۲ |
کاربرد بافرها
محلولهای بافر برای حفظ pH صحیح برای عملکرد آنزیمها در بسیاری از موجودات زنده ضروری هستند.
بسیاری از آنزیمها تنها در شرایط دقیقی کار میکنند؛اگر pH در محدوده بسیار کمی تغییرکند عملکرد آنزیمها کند ویا متوقف میشود ودچار تغییر ماهیت میشوند.در بسیاری از موارد تغییر ماهیت میتواند بطور ثابت فعالیت کاتالیزوری را از کار بیاندازد.
بافر کربنیک اسید(H2CO3) و بیکربنات (-HCO3) در پلاسمای خون موجود است که برای حفظ pH بین 7.35تا7.45 بکار میرود.
از لحاظ کاری و صنعتی محلولهای بافر در فرآیند تخمیر و درتعیین شرایط مناسب برای رنگهای موجود در رنگ آمیزی پارچه بکار می روند.
بافرها همچنین در تجزیه و تحلیلهای شیمیایی و کالیبراسیون pHسنجها بکار میروند.
از بزرگترین نمونهٔ زیستی (بیولوژیکی) استفاده از آنها میتوان به تحقیقهایی اشاره کرد که در آن مواد در بافر ساخته میشوند؛مخصوصا بافر فسفات نمکی (PBS) که در pH=7.4مورد استفاده قرار میگیرد.
منابع
- ↑ مورتیمر، چارلز (۱۳۸۳). شیمی عمومی 1. ج. دوم. تهران: نشر علوم دانشگاهی. ص. ۲۸۲. شابک ۹۶۴۶۱۸۶۳۳۵.
- ↑ "Biological buffers". REACH Devices.
- ↑ "Buffer Reference Center". Sigma-Aldrich. Retrieved 2009-04-17.
