واکنش آبگیری
در شیمی، واکنش آبگیری به واکنشی گفته میشود که طی آن خروج آب از مولکول یا یون واکنش دهنده رخ دهد. واکنشهای آبگیری، فرایندهایی متداول در شیمی محسوب میشوند و به واکنش معکوس آن واکنش آبدهی گفته میشود. عوامل متداولی که بهعنوان عامل آبگیری یا جاذب رطوبت بهخصوص در سنتز آلی به کار میروند، عبارتاند از سولفوریک اسید و آلومینیوم اکسید. نیاز به گرم کردن مخلوط واکنش، از مشخصههای اغلب واکنشهای آبگیری است.
انواع واکنشهای آبگیری[ویرایش]
نمونه کلاسیک یک واکنش آبگیری، واکنش استری شدن فیشر است که شامل واکنش یک اسید کربوکسیلیک با یک الکل در حضور یک عامل آبگیر است:
RCO2H + R′OH ![]() RCO2R′ + H2O
RCO2R′ + H2O
| واکنش | معادله عمومی | مثالها |
|---|---|---|
| تبدیل دو الکل به یک اتر (تعویض) | 2R–OH → R–O–R + H2O | |
| تبدیل یک اسید و یک الکل به یک استر (استری شدن فیشر-اسپیر) | R−COOH + R'−OH → R−COO−R '+ H2O | |
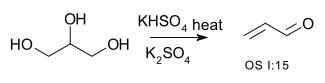
| تبدیل یک الکل به یک آلکن ( حذف) | R –CH2-CHOH–R → R–CH=CH–R + H2O | تبدیل گلیسرول به آکرولئین:[۱]
یا واکنش آبگیری از یک ۲-متیل-۱-سیکلوهگزانول و تبدیل آن به یک ۱-متیل سیکلو هگزن [۲]، با استفاده از یک سولفوران مارتین به عنوان عامل آبگیر:[۳] CH3CH2OH → H2C=CH2 + H2O |
| تبدیل دو اسید کربوکسیلیک به یک اسید انیدرید | 2RCOOH → (RCO)2O + H2O | تولید یک دیفنیک انیدرید، یک انیدرید حلقوی با کمک آبگیری درون مولکولی:
 |
| تبدیل یک آمید به یک نیتریل | RCONH2 → R–CN + H2O | تولید ۲-کلرونیکوتینونیتریل از طریق آبگیری گروه آمید با کمک فسفریل کلرید از ماده اولیه نیکوتینآمید:
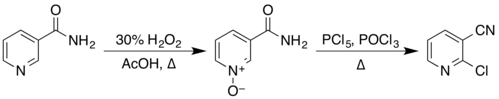 |
| بازآرایی دیانول - بنزن | بازآرایی دیانون-بنزن:[۵] [۶]
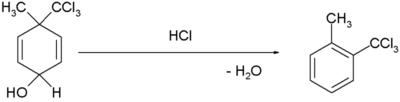 |
منابع[ویرایش]
- ↑ "Acrolein", Org. Synth.
- ↑ J. Brent Friesen; Robert Schretzman (2011). "Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment". J. Chem. Educ. 88 (8): 1141–1147. Bibcode:2011JChEd..88.1141F. doi:10.1021/ed900049b.
- ↑ Roden, Brian A. (2001). "Diphenylbis(1,1,1,3,3,3-hexafluoro-2-phenyl-2-propoxy)sulfurane". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd409.
- ↑ Zimmermann, Heinz; Walz, Roland (2008). "Ethylene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_045.pub3. ISBN 978-3527306732.
- ↑ H. Plieninger; Gunda Keilich (1956). "Die Dienol-Benzol-Umlagerung" [The dienol-benzene rearrangement]. Angew. Chem. (به آلمانی). 68 (19): 618. doi:10.1002/ange.19560681914.
- ↑ Margaret Jevnik Gentles; Jane B. Moss; Hershel L. Herzog; E. B. Hershberg (1958). "The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione". J. Am. Chem. Soc. 80 (14): 3702–3705. doi:10.1021/ja01547a058.