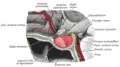
هیپوفیز پیشین
| هیپوفیز پیشین | |
|---|---|
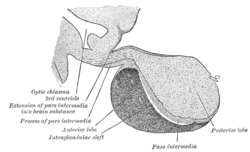 برش عرضی هیپوفیز میمون بالغ | |
| جزئیات | |
| ساخته از | oral mucosa (Rathke's pouch) |
| سرخرگها | superior hypophyseal |
| سیاهرگها | hypophyseal |
| شناسهها | |
| لاتین | lobus anterior hypophysis |
| MeSH | D010903 |
| نورونیمز | 407 |
| شناسه نورولکس | birnlex_1581 |
| TA98 | A11.1.00.002 |
| TA2 | 3855 |
| FMA | 74627 |
اندام اصلی دستگاه درونریز، هیپوفیز پیشین یا هیپوفیز قدامی که آدنوهیپوفیز نیز نامیده میشود، لوب غددی و قدامی است که همراه با لوب خلفی (هیپوفیز خلفی یا پسین یا نوروهیپوفیز)، غده هیپوفیز را تشکیل میدهد. هیپوفیز پیشین چندین فرایند فیزیولوژیکی از جمله استرس، رشد، تولیدمثل و شیردهی را تنظیم میکند. عملکرد صحیح هیپوفیز پیشین و اندامهای هدف و تحت تأثیر آن، اغلب از طریق آزمایشهای خونی که سطح هورمونها را اندازهگیری میکند مشخص میشود.
ساختار[ویرایش]

غده هیپوفیز در یک محفظهٔ استخوانی محافظ به نام زین ترکی قرار دارد. از سه لوب تشکیل شدهاست: لوب قدامی، میانی و خلفی. در بسیاری از جانوران، این لوبها متمایز هستند. با اینحال، در انسان، لوب میانی فقط چند لایهٔ سلولی ضخیم و نامشخص است. در نتیجه، اغلب، بخشی از هیپوفیز پیشین در نظر گرفته میشود. در همهٔ جانوران، هیپوفیز پیشین گوشتی و غدهای بوده و از ترکیب عصبی هیپوفیز پسین متمایز است.[نیازمند منبع]
عملکرد[ویرایش]
هیپوفیز پیشین شامل پنج نوع سلول غدد درونریز است و آنها توسط هورمونهایی که ترشح میکنند نامگذاری شدهاند: سوماتوتروپ (هورمون رشد). لاکتوتروپ (پرولاکتین)؛ گنادوتروپ (هورمون لوتئینی و هورمون محرکه فولیکولی)؛ کورتیکوتروپ (آدرنوکورتیکوتروپین) و تیروتروپ (هورمون محرکه تیروئید).[۱] همچنین حاوی سلولهای فولیکولوستلیت غیر غدد درونریز است که تصور میشود جمعیت سلولهای غدد درونریز را تحریک و پشتیبانی میکنند.
هورمونهایی که از هیپوفیز پیشین ترشح میشوند، یا مستقیماً رشد را تحت تأثیر قرار میدهند یا بهصورت هیپرپلازی یا هایپرتروفی در بافت هدف و مورد تحریک. مکانیسم این هورمونها برای اثر مستقیم بر روی بافتهای هدف یا سایر غدد درونریز برای آزادسازی هورمونها، ایجاد پاسخهای فیزیولوژیکی آبشاری متعدد است.[۲]
| هورمون | نامهای دیگر | نماد(ها) | ساختار | سلولهای ترشحی | رنگآمیزی | هدف | اثر |
|---|---|---|---|---|---|---|---|
| هورمون آدرنوکورتیکوتروپیک | کورتیکوتروپین | ACTH | پلیپپتیدی | کورتیکوتروپها | بازوفیل | غده فوق کلیوی | ترشح گلوکوکورتیکوئید، مینرالوکورتیکوئید و آندروژن |
| هورمون محرک تیروئید | تیروتروپین | TSH | گلیکوپروتئینی | تیروتروپها | بازوفیل | غده تیروئید | ترشح هورمونهای تیروئید |
| هورمون محرک فولیکول | - | FSH | گلیکوپروتئینی | گنادوتروپها | بازوفیل | غدد جنسی | دستگاه تناسلی |
| هورمون لوتئینی | لوتروپین | LH, ICSH | گلیکوپروتئینی | گنادوتروپها | بازوفیل | غدد جنسی | تولید هورمون جنسی |
| هورمون رشد | سوماتوتروپین | GH, STH | پلیپپتیدی | سوماتوتروپها | اسیدوفیل | کبد، بافت چربی | باعث رشد میشود؛ متابولیسم لیپید و کربوهیدرات |
| پرولاکتین | لاکتوتروپین | PRL | پلیپپتیدی | لاکتوتروپها | اسیدوفیل | تخمدانها، غدد پستانی، بیضهها، پروستات | ترشح استروژن / پروژسترون، شیردهی؛ اسپرمزایی، هایپرپلازی خوشخیم پروستات، ترشح TSH و ACTH |
اهمیت بالینی[ویرایش]
افزایش فعالیت[ویرایش]
پرکاری هیپوفیز است که در آن هیپوفیز مقادیر زیادی هورمون ترشح میکند. این ترشح بیش از حد اغلب منجر به تشکیل آدنوم هیپوفیز (تومور) میشود. بهطور عمده سه نوع تومور هیپوفیز پیشین و اختلالات مرتبط با آنها وجود دارد. به عنوان مثال، آکرومگالی ناشی از ترشح بیش از حد هورمون رشد (GH) است که اغلب توسط آدنوم هیپوفیز آزاد میشود. این اختلال میتواند باعث تغییر شکل و احتمالاً مرگ شود[۵] و میتواند منجر به غولپیکری شود، یک اختلال هورمونی که در «غولها» مانند آندره غول بروز یافتهاست که پیش از بسته شدن صفحات رشد استخوانها در بلوغ اتفاق میافتد.[۶] شایعترین نوع تومور هیپوفیز پرولاکتینوما است که پرولاکتین را بیش از حد ترشح میکند.[۷] نوع سوم آدنوم هیپوفیز ACTH اضافی ترشح میکند که به نوبهٔ خود باعث ترشح بیش از حد کورتیزول میشود و عامل بیماری کوشینگ است.[۶]
کاهش فعالیت[ویرایش]
کمکاری هیپوفیز با کاهش ترشح هورمونهای آزاد شده توسط هیپوفیز پیشین تعریف میشود. برای مثال، کاهش ترشح هورمون رشد پیش از بلوغ میتواند علت کوتولگی باشد. علاوه بر این، نارسایی ثانویه آدرنال میتواند ناشی از کمبود ترشح ACTH باشد که به نوبهٔ خود به قشر آدرنال سیگنالی برای تولید مقدار کافی کورتیزول نمیدهد که یک وضعیت تهدیدکنندهٔ زندگی است. کمکاری هیپوفیز میتواند در اثر تخریب یا برداشتن بافت قدامی هیپوفیز از طریق آسیبهای مغزی، تومور، سل یا سیفلیس و سایر علل ایجاد شود. این اختلال در گذشته با نام بیماری سیموندز شناخته میشد، اما امروزه بر پایهٔ دستهبندی پایگاه داده بیماریها به آن سندرم شیهان میگویند.[۸] اگر کمکاری هیپوفیز ناشی از از دست دادن خون همراه با زایمان باشد، این اختلال به عنوان سندرم شیهان شناخته میشود.
تصاویر بیشتر[ویرایش]
جستارهای وابسته[ویرایش]
- آدنوم هیپوفیز
- هیپوفیز خلفی
- هیپوفیتاریسم
منابع[ویرایش]
- ↑ Le Tissier, P.R; Hodson, D.J; Lafont C; Fontanaud P; Schaeffer, M; Mollard, P. (2012) Anterior pituitary cell networks. Front Neuroendocrinol. Aug; 33(3):252-66
- ↑ Nelson, R. J. (2011) An Introduction to Behavioral Endocrinology, 4th Edition. Sunderland, MA: Sinauer Associates, Inc.شابک ۹۷۸−۰۸۷۸۹۳۶۲۰۵
- ↑ Malendowicz, L.K; Rucinski, M; Belloni, A.S; Ziolkowska, A; and Nussdorfer, G.C. (2007) Leptin and the regulation of the hypothalamic-pituitary-adrenal axis. Int Rev Cytol. 263: 63-102.
- ↑ Sone, M. and Osamura, R.Y. (2001) Leptin and the pituitary. Pituitary. Jan-Apr; 4(1-2): 15-23.
- ↑ Scacchi, Massimo; Francesco Cavagnini (2006). "Acromegaly". Pituitary. 9 (4): 297–303. doi:10.1007/s11102-006-0409-4. ISSN 1573-7403. PMID 17077948.
- ↑ ۶٫۰ ۶٫۱ Nelson, Randy J. (2011). An introduction to behavioral endocrinology (4th ed.). Sunderland, Massachusetts: Sinauer Associates. ISBN 978-0-87893-620-5.
- ↑ Ciccarelli, E; F Camanni (June 1996). "Diagnosis and drug therapy of prolactinoma". Drugs. 51 (6): 954–965. doi:10.2165/00003495-199651060-00004. ISSN 0012-6667. PMID 8736617.
- ↑ Summers, V. K. (September 1947). "Diagnosis and Treatment of Simmonds' Disease". Postgraduate Medical Journal. 23 (263): 441–443. doi:10.1136/pgmj.23.263.441. ISSN 0032-5473. PMC 2529616. PMID 20258051.